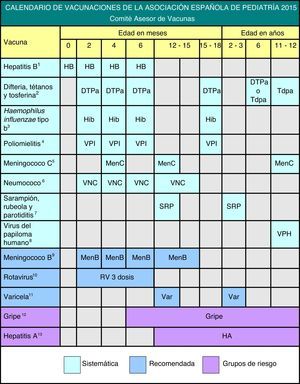
El Comité Asesor de Vacunas de la Asociación Española de Pediatría actualiza anualmente su calendario de vacunaciones, tras un análisis tanto epidemiológico como de la seguridad, efectividad y eficiencia de las vacunas actuales, incluyendo grados de recomendación. Es el calendario que se estima idóneo actualmente para los niños residentes en España.
En cuanto a las vacunas oficiales incluidas en el calendario común, se recalca la posibilidad de vacunar indistintamente frente a hepatitis B desde el nacimiento o desde los 2 meses; la recomendación de la primera dosis de triple vírica y de varicela a los 12 meses y la segunda a los 2-3 años; la administración de la vacuna DTPa o Tdpa a los 6 años, con refuerzo en la adolescencia; estrategias con Tdpa en embarazadas y convivientes del recién nacido, y la inmunización frente al papilomavirus en niñas a los 11-12 años con pauta de 2 dosis (0, 6 meses).
Este comité insiste en la vacunación antineumocócica universal, tal y como se está llevando a cabo en todos los países de Europa Occidental.
La vacuna frente al meningococo B, autorizada pero bloqueada actualmente en España, presenta un perfil de vacuna sistemática y se reivindica que, al menos, esté disponible en las farmacias comunitarias.
Se propone, igualmente, la disponibilidad pública de las vacunas frente a la varicela, ya que han demostrado ser efectivas y seguras a partir del segundo año de vida. La vacunación frente al rotavirus es recomendable en todos los lactantes. La vacunación antigripal anual y la inmunización frente a la hepatitis A están indicadas en grupos de riesgo.
The Advisory Committee on Vaccines of the Spanish Association of Paediatrics updates the immunisation schedule every year, taking into account epidemiological data as well as evidence on the safety, effectiveness and efficiency of current vaccines, including levels of recommendation. In our opinion, this is the optimal vaccination calendar for all children resident in Spain.
Regarding the vaccines included in the official unified immunization schedule, the Committee emphasizes the administration of the first dose of hepatitis B either at birth or at 2 months of life; the recommendation of the first dose of MMR and varicella vaccine at the age of 12 months, with the second dose at the age of 2-3 years; DTaP or Tdap vaccine at the age of 6 years, followed by another Tdap booster dose at 11-12 years old; Tdap strategies for pregnant women and household contacts of the newborn, and immunization against human papillomavirus in girls aged 11-12 years old with a 2 dose scheme (0, 6 months).
The Committee reasserts its recommendation to include vaccination against pneumococcal disease in the routine immunisation schedule, the same as it is being conducted in Western European countries.
The recently authorised meningococcal B vaccine, currently blocked in Spain, exhibits the profile of a universal vaccine. The Committe insists on the need of having the vaccine available in communitary pharmacies.
It has also proposed the free availability of varicella vaccines. Their efectiveness and safety have been confirmed when they are administred from the second year of life. Vaccination against rotavirus is recommended in all infants. The Committee stresses the need to vaccinate population groups considered at risk against influenza and hepatitis A.
El Comité Asesor de Vacunas de la Asociación Española de Pediatría (CAV-AEP) actualiza anualmente su calendario de vacunaciones teniendo en cuenta la evidencia disponible, para ofrecer la propuesta sobre vacunas que se considera más adecuada para los niños residentes en España.
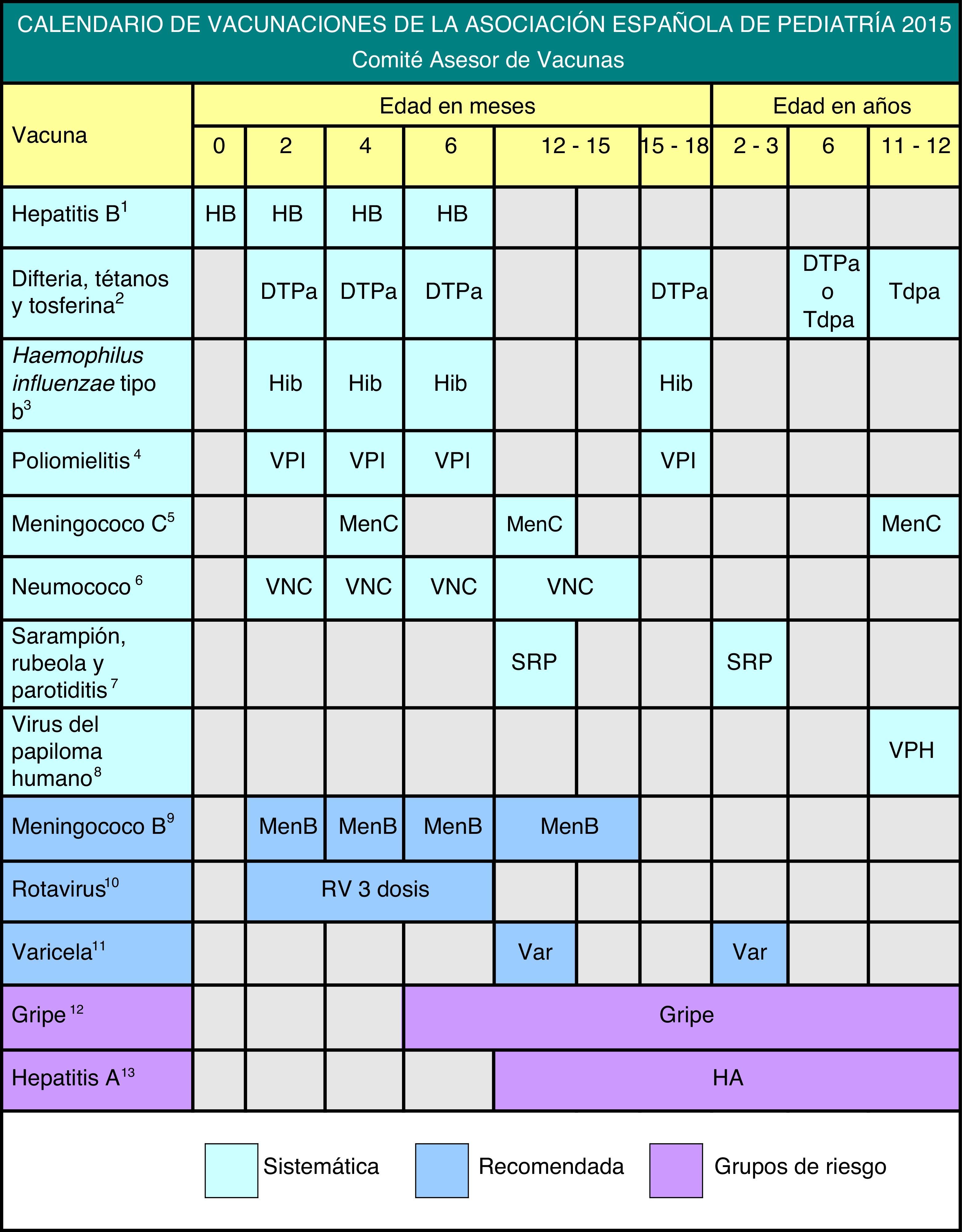
Se presentan distintos grados de recomendación para las diferentes vacunas, con el objeto de establecer niveles de prioridad, que se explican en la figura 1, donde se muestra el calendario propuesto por este comité para 2015.
El Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI) ha propuesto un calendario de vacunaciones común, de mínimos, que en bastantes puntos está más basado en criterios economicistas que en la evidencia científica publicada o en las indicaciones de sus propios técnicos de salud. Es un calendario que no convence a los profesionales y que está teniendo problemas para su implantación en todas las comunidades autónomas (CC. AA.). No se siguen las recomendaciones actuales de múltiples organismos oficiales y sociedades científicas (SS. CC.), como las de la AEP, de vacunar frente al neumococo a menores de 5 años o de varicela a niños pequeños, de inmunizar frente al virus del papiloma humano (VPH) a los 11-12 años ni de permitir vacunar frente a la hepatitis B desde el nacimiento o desde los 2 meses indistintamente, o la de vacunar frente a la tos ferina en la adolescencia y promover estrategias de inmunoprevención en embarazadas y convivientes del recién nacido (RN).
Sería deseable que las SS. CC. fueran tenidas en cuenta en la toma de decisiones, así como un mayor esfuerzo económico colectivo, por parte de las CC. AA. y del MSSSI, que permitiera la financiación de un calendario sistemático más completo, y no de mínimos, para los niños españoles.
Otro problema acuciante está siendo la progresiva instauración del bloqueo administrativo, por parte de la Agencia Española de Medicamentos y Productos Sanitarios, de algunas vacunas como la del rotavirus (RV) (Rotarix®), las 2 vacunas de la varicela (Varilrix® y Varivax®) y, recientemente, la del meningococo B (Bexsero®). Todas estas vacunas han sido bloqueadas de forma injustificada (las de la varicela y del meningococo B han pasado a ser de «uso hospitalario»), siendo el único país del mundo en el que no se pueden adquirir de forma libre en las farmacias comunitarias. Este Comité reivindica la libre disponibilidad de estas vacunas, autorizadas por la Agencia Europea de Medicamentos, para todo aquel que quiera administrarlas tras prescripción médica.
Debido a las limitaciones de extensión de este documento, se recomienda la revisión del Manual de Vacunas en línea de la AEP, que está en permanente actualización, accediendo a él desde nuestra página web, www.vacunasaep.org, para ampliar la información sobre todas las vacunas infantiles y las situaciones especiales de su administración, incluidas las adaptaciones de los calendarios de vacunación, que presentan cambios con respecto a las de 2014 (sobre todo en la vacunación del meningococo B y del VPH).
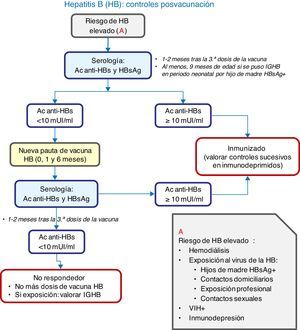
Vacunación frente a hepatitis BRecomendación 2015: Se recomienda vacunar en el primer año de vida con 3 o 4 dosis, en forma de vacuna monocomponente y hexavalente o solo hexavalente. En niños mayores se aplicarán 3 dosis de vacuna monocomponente, o bien combinada con hepatitis A.
En España, la tasa de incidencia anual de hepatitis B mantiene el descenso iniciado en 2010, siendo de 1,49/100.000 habitantes en 20131. Actualmente, en todas las CC. AA. se vacuna en el primer año de vida, y en más de la mitad se administra la dosis inicial al nacimiento.
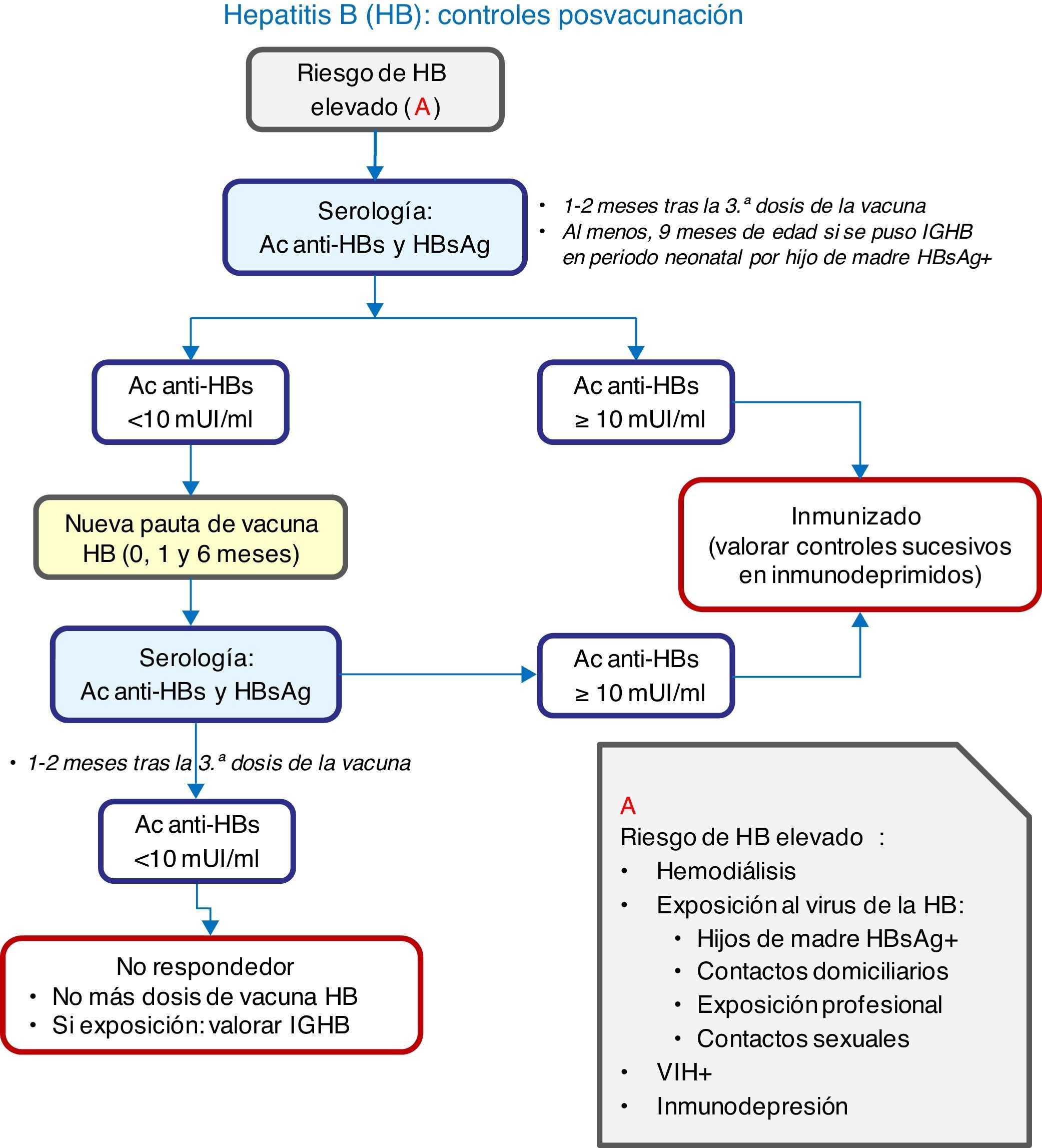
Si se vacuna en el primer año puede seguirse cualquiera de las siguientes pautas: RN, 1 y 6 meses; RN, 2 y 6 meses; RN, 2, 4 y 6 meses; y 2, 4 y 6 meses de edad. Los 4 esquemas son adecuados para hijos de madres HBsAg negativas. Las 3 primeras pautas son también correctas para hijos de madres HBsAg positivas, que deben recibir, además, 0,5ml de inmunoglobulina específica antihepatitis B, preferiblemente en las primeras 12h de vida.
En el caso de la vacunación sistemática neonatal, se recomienda la administración de la vacuna hexavalente a los 2 y 6 meses, intercalando la pentavalente a los 4 meses de edad2.
La vacunación frente a hepatitis B en niños mayores y adolescentes no vacunados seguirá la pauta de 0, 1 y 6 meses.
En la figura 2 se expone un algoritmo con la actuación ante situaciones de riesgo.
Vacunación frente a difteria, tétanos, tosferina, poliomielitis y Haemophilus influenzae tipo bRecomendación 2015: Se recomienda la primovacunación de DTPa-VPI-Hib a los 2, 4 y 6 meses, siendo aceptable el empleo de la vacuna hexavalente (que incluye hepatitis B) o de la pentavalente más la vacuna monocomponente de hepatitis B. Se puede adelantar la primera dosis a las 6 semanas de vida. El refuerzo con DTPa-VPI-Hib debe realizarse a los 15-18 meses, con un refuerzo posterior con DTPa o Tdpa a los 6 años y con Tdpa a los 11-12 años. Se recomienda vacunar con Tdpa a la embarazada, entre la semana 27 y la 36 de gestación, y a los miembros del entorno familiar de los RN (especialmente a la madre en el puerperio inmediato, si previamente no se vacunó en el tercer trimestre del embarazo).
La incidencia de tosferina en España se incrementó en los años 2010 a 2012, con aumento en todos los grupos etarios, si bien las complicaciones se concentraron en lactantes (8 fallecimientos relacionados con tosferina en niños menores de 3 meses en 2012)3. Las acciones preventivas deben dirigirse prioritariamente a proteger a este grupo y a disminuir la incidencia en adolescentes y adultos4. Se recomiendan dosis de refuerzo en adolescentes y adultos, en especial cuando se utilizan preparados de baja carga antigénica (Tdpa) debido a la evidencia de rápida pérdida de inmunidad. La vacunación de la embarazada en el tercer trimestre es segura y eficaz, siendo la forma más efectiva y eficiente de controlar la tosferina en el lactante, por el paso transplancentario de anticuerpos5.
Vacunación frente a meningococo CRecomendación 2015: Se recomiendan 3 o 4 dosis de vacuna conjugada monovalente (esquema 1 [o 2]+1+1), con la siguiente pauta: primera dosis a los 4 meses (o dos dosis a los 2 y 4 meses, según la vacuna utilizada), otra a los 12 meses de edad y otra final a los 12 años.
La efectividad de esta vacuna ha sido ampliamente demostrada6.
La tasa de enfermedad meningocócica invasiva (EMI) por serogrupo C se mantiene muy baja (0,15/100.000 en 2011) en España. Desde 2014 existe una nueva pauta vacunal recomendada por el MSSSI y aceptada por las CC. AA., con una dosis en la adolescencia como cambio más destacable, que el CAV-AEP apoya desde 2013.
La presencia de otros serogrupos (W135, Y y A) se mantiene muy baja (3%) en España. La disponibilidad de vacunas conjugadas tetravalentes (Menveo® y Nimenrix®), reservadas para la vacunación de viajeros a zonas endémicas de esos serogrupos, puede constituir una alternativa idónea para la dosis de refuerzo en la adolescencia, dado el aumento de viajes a países endémicos a partir de esta edad7.
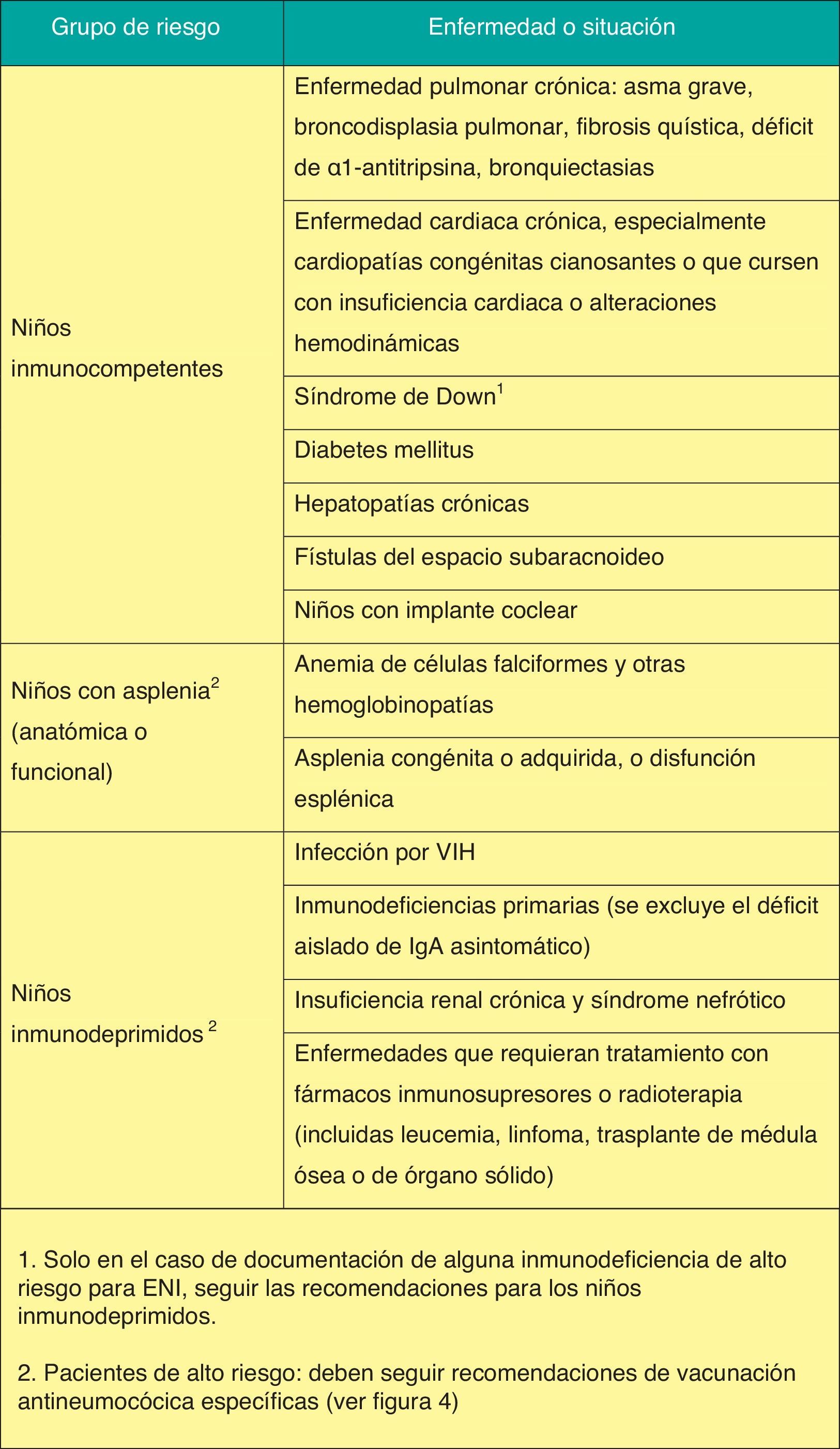
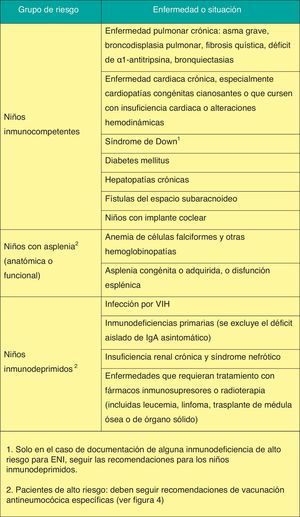
Vacunación frente a neumococoRecomendación 2015: Se recomienda vacunar frente a neumococo a todos los niños menores de 5 años, así como a todos los que padecen inmunodepresión u otras situaciones de riesgo a cualquier edad. En ausencia de vacunación sistemática, la pauta vacunal debe ser 3+1. La vacuna recomendada, según los datos epidemiológicos de España, es la vacuna neumocócica conjugada tridecavalente (VNC13).
La evidencia de la capacidad de las vacunas antineumocócicas conjugadas (decavalente [VNC10] y VNC13) para producir un marcado descenso de la enfermedad neumocócica invasiva (ENI) continúa acumulándose8–10. El impacto sobre la colonización nasofaríngea, inductor de un marcado efecto de inmunidad de grupo al reducirse también la ENI en personas no vacunadas, se produce cuando la cobertura vacunal es como mínimo del 65-75%. Por otro lado, hasta ahora no hay reemplazo con incremento de ENI por serotipos no vacunales.
Ambas vacunas tienen también un impacto significativo en la enfermedad neumocócica no invasiva, produciendo una disminución de las hospitalizaciones por neumonía, tanto neumocócica como por todas las causas, incluyendo también a los no vacunados9,11.
Los grupos de riesgo y las recomendaciones de vacunación antineumocócica aparecen en las figuras 3 y 4.
Recomendación 2015: Se recomienda que la primera dosis de triple vírica se administre a los 12 meses de vida, y la segunda, a los 2-3 años, preferentemente a los 2, para la corrección precoz de posibles fallos primarios de la vacuna.
Entre julio de 2013 y junio de 2014, los casos de sarampión comunicados en la Región Europea de la OMS seguían altos, han aumentado los de rubeola y persisten brotes de parotiditis12. España es uno de los países con menor incidencia de estas enfermedades, pero participa de estas tendencias12. Se recomienda un esfuerzo para mantener coberturas elevadas y aspirar a la eliminación de estas enfermedades.
Las 2 presentaciones de triple vírica disponibles, Priorix® y MMRVaxpro®, están indicadas a partir del año de vida, pero autorizadas a partir de los 9 meses si se requiere una protección más temprana en situaciones epidemiológicas especiales. Tras la administración de una dosis a los 12 meses se alcanzan tasas de seroconversión≥95% para los 3 virus13. No se dispone de vacunas monocomponentes ni bicomponentes frente a estas enfermedades: su inmunoprotección activa deberá realizarse con la triple vírica.
Vacunación frente al virus del papiloma humanoRecomendación 2015: Se recomienda la vacunación sistemática frente al VPH de todas las niñas de 11-12 años, como forma de prevención del cáncer cervical y de lesiones precancerosas del tracto genital femenino.
El CAV-AEP estima que la edad óptima para vacunar es a los 11-12 años de edad, con el fin de mejorar la aceptación de la vacunación y adelantarse al inicio de la actividad sexual14. Las mujeres de 13 a 26 años no vacunadas son un grupo de alta prioridad de vacunación y pueden beneficiarse de ella sin necesidad de cribado citológico o viral previo. La posología aprobada actualmente para las 2 vacunas se refleja en la figura 115.
Ya se dispone de datos de efectividad para evitar la infección persistente por VPH, así como para las lesiones preneoplásicas asociadas a los VPH más prevalentes, incluidos los de alto riesgo16. Es muy probable que en los próximos años se obtengan datos de prevención del cáncer de cérvix y otros tipos de cánceres asociados al VPH.
Ambas vacunas presentan un adecuado perfil de seguridad y balance beneficio/riesgo favorable17, a pesar de lo cual, la cobertura media en España no pasa del 75%18, siendo superior en las CC. AA. con vacunación escolar. Es preciso un mayor esfuerzo de todos los profesionales sanitarios para aumentar esta cobertura.
La vacuna tetravalente está aprobada para varones15 e incluida en el calendario de algunos países. En espera de más datos, el CAV-AEP no se pronuncia al respecto, pero se aconseja que se informe a los varones adolescentes de esta medida preventiva.
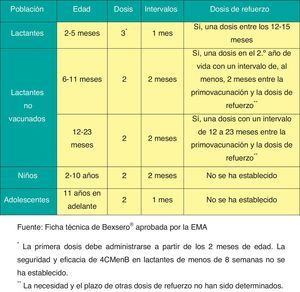
Vacuna frente a meningococo BRecomendación 2015: La vacuna frente al meningococo B presenta un perfil para ser incluida en los calendarios de todas las CC. AA. y debería estar disponible libremente para su administración a todos los niños desde los 2 meses de edad.
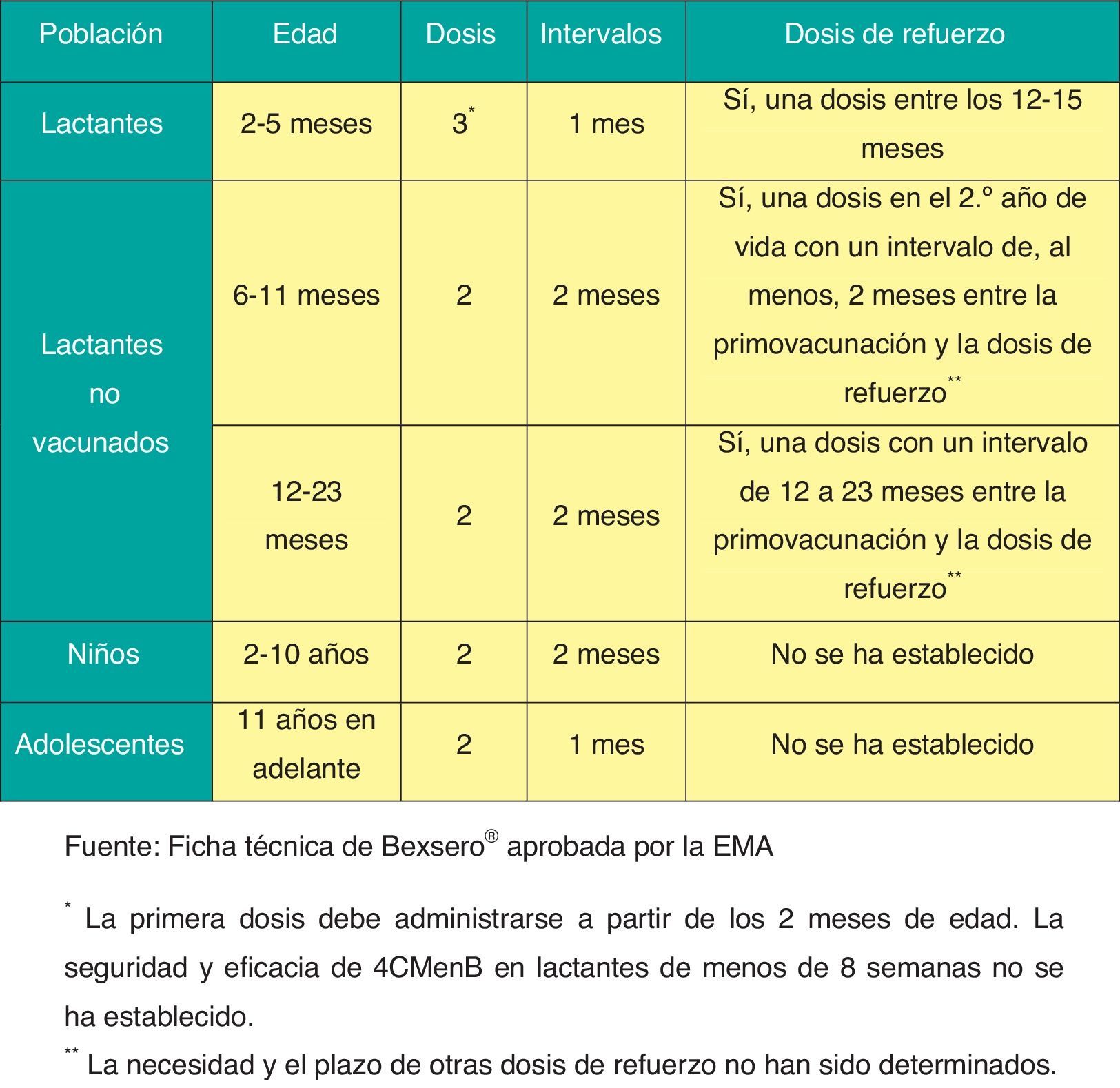
La única vacuna actualmente disponible para la prevención de la EMI por serogrupo B (Bexsero®)19 ha demostrado en los ensayos clínicos realizados que es inmunógena y segura en lactantes, niños, adolescentes y adultos, e induce memoria inmunológica20.
Este preparado ha sido aprobado por la Agencia Europea de Medicamentos19 para su empleo a partir de los 2 meses de edad, lo que permite su libre distribución tanto en las farmacias comunitarias como en las hospitalarias de toda la Unión Europea. En algunos países, la vacuna se ha introducido ya en el calendario sistemático de vacunaciones. De especial relevancia ha sido la decisión de Reino Unido de incluirla en el calendario oficial, comenzando con los lactantes con un esquema 2+1 (2, 4 y 12 meses)21.
En España, en agosto de 2014, el MSSSI autorizó esta vacuna para la inmunización frente al meningococo B, pero catalogándola de «uso hospitalario», para un grupo muy reducido de pacientes, como aquellos con asplenia anatómica o funcional grave, déficit de complemento, tratamiento con eculizumab, antecedente personal de más de una EMI o personal de laboratorio que manipule muestras con meningococos. También se emplearía para el control de brotes de EMI22. Estas indicaciones suponen menos del 5% de los casos de EMI globalmente, por lo que consideramos que es insuficiente; más del 95% de los casos de EMI se dan en personas sanas sin factores de riesgo, sobre todo niños pequeños y adolescentes.
La posología de esta vacuna se refleja en la figura 5.
Por tanto, en España existe una situación administrativa muy peculiar, que impide a los profesionales la libre prescripción de una vacuna aprobada por la Agencia Europea de Medicamentos. En el resto de Europa, en cambio, la vacuna sí será de libre dispensación, e incluso formará parte del calendario sistemático de algunos países o regiones.
Vacunación frente a rotavirusRecomendación 2015: Se considera que vacunar frente al RV es una medida de salud recomendable y segura para todos los lactantes.
Desde la introducción de las vacunas frente al RV en 2006, se ha reducido notablemente la morbimortalidad por gastroenteritis por RV en lactantes y niños pequeños23, tanto en países en vías de desarrollo como en industrializados.
En países con vacunación sistemática se ha observado un descenso también en niños mayores y adultos no vacunados24. En estos se está realizando una estricta vigilancia poscomercialización, centrada sobre todo en la invaginación intestinal, observándose un riesgo bajo (aproximadamente 1-5 casos por cada 100.000 niños vacunados)25. Los beneficios que se obtienen con esta vacunación siguen siendo muy superiores al hipotético riesgo de invaginación, como lo demuestran los datos procedentes de países con vacunación sistemática, como Reino Unido26. Así, se mantiene la recomendación de vacunación universal frente al RV por parte de las SS. CC. y de la OMS27.
La vacuna pentavalente, RotaTeq®, sigue siendo la única disponible en España. Se aplica por vía oral y puede administrarse al mismo tiempo que las otras vacunas del calendario. La posología aparece en la figura 1.
Vacunación frente a varicelaRecomendación 2015: Se recomienda la vacunación frente a la varicela de todos los niños con 2 dosis: una a los 12 meses y otra a los 2-3 años de edad, preferentemente a los 2 años. Se recomienda, además, realizar vacunación de rescate, con 2 dosis, a niños mayores de esta edad que no hayan padecido la enfermedad o no hayan sido vacunados (completando la pauta en los que hubieran recibido una sola dosis previamente).
En España, actualmente, las 2 vacunas disponibles (Varilrix® y Varivax®) están clasificadas como de «uso hospitalario» por la Agencia Española de Medicamentos y Productos Sanitarios15. Esta decisión, única en el mundo, no está justificada, dada la elevada efectividad de esta vacuna para reducir la incidencia de la enfermedad y sus complicaciones, tanto en la población vacunada como en la no vacunada28,29, incluso con coberturas subóptimas30.
Estas vacunas son, en general, muy bien toleradas31. La mayor preocupación con relación a la extensión de la vacunación infantil es su posible impacto epidemiológico, desplazando la varicela a edades superiores o causando un incremento de herpes zóster en la población general. Tras casi 20 años de vacunación, en EE. UU. no se ha constatado ningún desplazamiento de la edad de presentación de la varicela29. La incidencia del herpes zóster muestra un incremento ya antes de la introducción de la vacunación infantil frente a varicela, sin que esta haya mostrado ninguna influencia sobre ello32,33. Tanto la OMS como el ECDC recomiendan llevar a cabo medidas eficaces de vigilancia epidemiológica para poder realizar estudios de coste-efectividad de la vacunación infantil frente a varicela31,34.
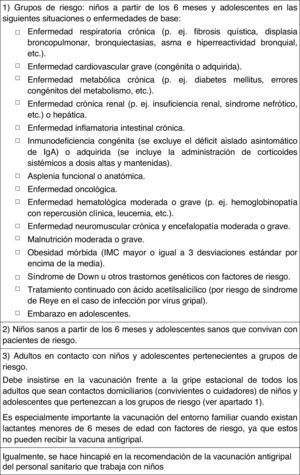
Vacunación antigripalRecomendación 2015: Se recomienda la vacunación antigripal en la infancia y adolescencia en: a) grupos de riesgo, es decir, niños a partir de los 6 meses de edad y adolescentes en determinadas situaciones o enfermedades de base; b) niños sanos a partir de los 6 meses de edad y adolescentes sanos que convivan con pacientes de riesgo, y c) adultos en contacto con niños y adolescentes incluidos en los grupos de riesgo.
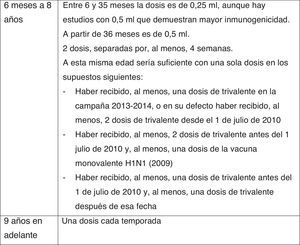
En la figura 6 se resumen las recomendaciones de vacunación antigripal de este Comité, y en la figura 7 su posología35,36.
La vacunación antigripal universal de todos los niños, en el momento actual, en nuestro medio y con las vacunas disponibles, plantea algunas dudas e inconvenientes37: 1) la necesidad de añadir anualmente una inyección al calendario de vacunaciones, con los consecuentes problemas de implementación y aceptabilidad; 2) la baja efectividad de las vacunas antigripales trivalentes inactivadas en niños menores de 2 años, y 3) el coste sería elevado y no existen en nuestro medio suficientes datos de eficiencia en niños. La llegada y mayor disponibilidad de vacunas atenuadas intranasales y de preparados tetravalentes a nuestro medio podrían cambiar este panorama.
La información ampliada para esta vacunación puede ser consultada en el documento que este Comité elabora anualmente, antes del inicio de cada temporada epidémica35.
Vacunación frente a hepatitis ARecomendación 2015: Se recomienda la vacunación frente a la hepatitis A en ciertas situaciones de riesgo con 2 dosis, con un intervalo de, al menos, 6 meses entre ellas. Debe valorarse su administración en niños mayores de 12 meses que acuden a guarderías.
Los preparados, la posología y las indicaciones de esta vacunación en niños y adolescentes de grupos de riesgo se recogen en la figura 838.
La eficacia es del 95% y se estima que los anticuerpos persisten, al menos, de 14 a 20 años en niños39.
Las guarderías que atienden a niños incontinentes tienen más probabilidad de experimentar brotes de esta enfermedad. Por esta razón, los niños mayores de 12 meses que acuden a guarderías podrían beneficiarse de la administración de esta vacuna.
Otro grupo de especial riesgo son los hijos de inmigrantes nacidos en nuestro país, cuyos padres proceden de áreas endémicas, pues tienen especial riesgo de contraer y luego transmitir la enfermedad, tras visitar a sus familias en sus países de origen40.
Conflicto de interesesConflicto de intereses de los autores con relación al documento (en los últimos 5 años):
David Moreno-Pérez ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de Novartis y como consultor en un Advisory Board de AstraZeneca, Novartis y Pfizer.
Francisco José Álvarez García ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, y como consultor en un Advisory Board de Novartis.
Javier Arístegui Fernández ha colaborado en actividades docentes y como investigador en ensayos clínicos subvencionados por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, y como consultor en un Advisory Board de Novartis.
María José Cilleruelo Ortega ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, como investigadora en ensayos clínicos de Pfizer y como consultora en un Advisory Board de Novartis.
José María Corretger Rauet ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis y Sanofi Pasteur MSD.
Nuria García Sánchez ha colaborado en actividades docentes subvencionadas por Sanofi Pasteur MSD y ha asistido a actividades docentes subvencionadas por Novartis y Pfizer.
Ángel Hernández Merino ha recibido ayuda económica para asistir a actividades docentes nacionales.
Teresa Hernández-Sampelayo Matos ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, y como investigadora en ensayos clínicos subvencionados por GlaxoSmithKline y Pfizer.
Manuel Merino Moína ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, como investigador en ensayos clínicos de GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD y como consultor en un Advisory Board de Novartis.
Luis Ortigosa del Castillo ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Novartis, Pfizer y Sanofi Pasteur MSD, y como investigador en ensayos clínicos de GlaxoSmithKline.
Jesús Ruiz-Contreras ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline, Pfizer y Sanofi Pasteur MSD, y como investigador en ensayos clínicos de GlaxoSmithKline y Pfizer.
- -
David Moreno-Pérez. Infectología Pediátrica e Inmunodeficiencias. Unidad de Gestión Clínica de Pediatría. Hospital Materno-Infantil. Hospital Regional Universitario de Málaga. Grupo de Investigación IBIMA. Departamento de Pediatría y Farmacología. Facultad de Medicina de la Universidad de Málaga.
- -
Francisco José Álvarez García. Pediatra. Centro de Salud de Llanera. Asturias. Profesor Asociado en Ciencias de la Salud. Departamento de Medicina. Universidad de Oviedo.
- -
Javier Arístegui Fernández. Unidad de Infectología Pediátrica. Hospital Universitario de Basurto. Bilbao. Departamento de Pediatría. Facultad de Medicina de la Universidad del País Vasco (UPV/EHU).
- -
M. José Cilleruelo Ortega. Servicio de Pediatría. Hospital Universitario Puerta de Hierro-Majadahonda, Madrid. Departamento de Pediatría. Facultad de Medicina de la Universidad Autónoma de Madrid.
- -
José María Corretger Rauet. Consell Assessor de Vacunacions. Departament de Salut. Generalitat de Catalunya. Barcelona.
- -
Nuria García Sánchez. Pediatra. Centro de Salud Delicias Sur. Zaragoza. Profesora Asociada en Ciencias de la Salud. Departamento de Pediatría. Facultad de Medicina de la Universidad de Zaragoza.
- -
Ángel Hernández Merino. Pediatra. Centro de Salud La Rivota. Alcorcón. Madrid.
- -
Teresa Hernández-Sampelayo Matos. Servicio de Pediatría. Hospital General Universitario Gregorio Marañón. Departamento de Pediatría. Facultad de Medicina de la Universidad Complutense de Madrid.
- -
Manuel Merino Moína. Pediatra. Centro de Salud El Greco. Getafe. Madrid. Profesor Colaborador de la Facultad de Medicina. Universidad Europea. Madrid.
- -
Luis Ortigosa del Castillo. Servicio de Pediatría. Hospital Universitario Ntra. Sra. de Candelaria. Departamento de Pediatría. Facultad de Medicina. Universidad de La Laguna. Santa Cruz de Tenerife.
- -
Jesús Ruiz-Contreras. Servicio de Pediatría. Hospital Universitario 12 de octubre. Madrid. Departamento de Pediatría. Facultad de Medicina de la Universidad Complutense de Madrid.