Estudiar la influencia del estrés oxidativo (EO) en la adolescencia, dado que éste se produce por un desequilibrio entre sustancias oxidantes y mecanismos de defensa antioxidante y se ha descrito como uno de los factores que más influye en la disminución progresiva de las funciones biológicas con el avance de la edad.
Material y métodosSe han seleccionado 38 varones prepúberes con estadio de Tanner G1-P1 y 32 varones púberes sanos con estadio de Tanner G3−4-P3−4 de 10 a 14 años, que presentaban peso, talla, índice de masa corporal, frecuencia cardíaca y presión arterial en el percentil 50 de su edad (desviación estándar ±1). Se midieron en saliva las concentraciones basales de los productos de lipoperoxidación, glutatión reducido y catalasa, ya que se ha demostrado una buena correlación entre las concentraciones plasmáticas y salivares de los biomarcadores del EO.
ResultadosLos varones puberales presentaron concentraciones superiores significativas de los productos de lipoperoxidación (p<0,001), no se obtuvieron diferencias significativas en los demás biomarcadores estudiados. Se encontró una correlación significativa positiva entre los productos de lipoperoxidación y el glutatión reducido (p<0,001).
ConclusiónSe describe por primera vez que en la pubertad hay un aumento de los productos de lipoperoxidación y que podrían estar influyendo en la aparición de EO en esta etapa de la vida.
Evaluate the influence of puberty in oxidative stress.
Subjects and methodsThe study included 38 prepubescent males with Tanner G1-P1 and 32 healthy pubescent boys with Tanner G3−4-P3−4. Weight, height and body mass index, heart rate, blood pressure values were within the 50 percentile 50±1SD for their age. The biomarkers were measured in saliva, as a good correlation between saliva and plasma levels has been reported in lipoperoxidation products, reduced glutathione and catalase.
ResultsPubescent boys had significantly higher levels of lipoperoxidation products (P<0.001) compared with the prepubertal group, with no significant differences in the other parameters measured. There was a significant positive correlation between lipoperoxides and reduced glutathione in these children.
ConclusionIt is the first time that an increase of lipoperoxidation products has been reported in pubertal boys and this biomarker could play a role in the development of oxidative stress in this stage of life.
El estrés oxidativo (EO) se caracteriza por un desequilibrio entre las moléculas de acción oxidante (especies reactivas del oxígeno [ERO]) y los mecanismos de defensa antioxidante que se transforman en un daño a las macromoléculas, lo que desencadena el deterioro y la muerte celular1. Este fenómeno se ha asociado a la disminución progresiva de las funciones fisiológicas que ocurren con el avance de la edad2,3. En el sistema de defensa antioxidante tiene una función preponderante el glutatión reducido (GSH), que es una de las principales moléculas antioxidantes presentes en el organismo4.
La bibliografía publicada hasta el momento actual sobre el EO en la infancia y en la adolescencia está fundamentalmente dirigida a establecer la posible relación y nexo de unión entre el EO y diferentes procesos patológicos, como asma, diabetes u obesidad5–7. Adicionalmente, el artículo de Elhadd et al valora la influencia de la pubertad en el EO en adolescentes con diabetes de tipo 18.
No obstante, según los conocimientos de los autores de este artículo, los estudios realizados en niños y en adolescentes sanos son escasos. Así, el trabajo de Souki et al evalúa el malonildialdehído (MDA) y el óxido nítrico como marcadores biológicos de EO en niños y adolescentes sanos en diferentes grupos de edad9. Asimismo, Erden-Inal et al10 describen los cambios producidos acontecidos en las concentraciones del GSH en relación con la edad, así como su repercusión sobre los productos de peroxidación lipídica (LPO)11–13. Estos estudios identifican valores significativamente más elevados de MDA en sujetos sanos de 10 a 13 años y de 14 a 18 años comparados con grupos de edad de 6 a 9 años y de 2 a 5 años. En relación con la actividad de la enzima catalasa, también se han encontrado cambios en su actividad relacionados con la edad14, incluso en grupos etarios que incluyen niños y adolescentes15.
A pesar de estas pruebas, no parece estar estudiada la influencia que puede ejercer el desarrollo puberal sobre marcadores del EO en una población sana.
Dado que en diferentes etapas madurativas se producen cambios biológicos, que podrían condicionar, al menos en parte, cambios en los biomarcadores del EO16,17, sería de interés valorar si en la etapa de cambio de la infancia a la adolescencia, en las que el crecimiento y desarrollo son más acentuados, acontecen cambios en el EO caracterizados por variaciones en sus biomarcadores. Sobre la base de esto, el objetivo de este estudio es evaluar el efecto de la pubertad sobre biomarcadores del EO en muestras salivares basales en varones prepúberes y púberes.
Material y métodosPacientes y diseño experimentalEl comité de Investigación y Bioética del Hospital Universitario Reina Sofía de Córdoba aprobó el protocolo de estudio. Se seleccionaron un total de 70 varones sanos desde el Servicio de Pediatría, distribuidos en 2 grupos según el estadio de Tanner18: prepuberales estadio de Tanner G1-P1 (n=38) y puberales estadio de Tanner G3−4-P3−4 (n=32). Los criterios de inclusión fueron niños sanos, medidas de peso, talla, índice de masa corporal (IMC), presión arterial sistólica (PAS) y presión arterial diastólica (PAD) en el percentil 50 (desviación estándar [DE] de ±1)19,20. Los niños se incorporaron al estudio tras el consentimiento informado del responsable legal de cada menor y del propio sujeto.
Se recogieron muestras de saliva en situación basal, ya que Lukash et al21 han demostrado que en los biomarcadores del EO hay una correlación significativa entre las concentraciones plasmáticas y salivares. Las muestras se alicuotaron y se congelaron a −70°C hasta la realización de las diferentes determinaciones bioquímicas.
Medidas somatométricas y hemodinámicasLas medidas antropométricas y de presión arterial se realizaron en situación de reposo. Para la medición del peso y la talla se utilizaron una báscula y un tallímetro (SECA, Hamburg, Germany). La frecuencia cardíaca en latidos/min y la PAS y la PAD en mmHg se midieron con un monitor de signos vitales 8100T Critikon-Dinamap Vital.
Productos de lipoperoxidaciónSe cuantificó la formación de LPO como la concentración de MDA y de 4-hidroxialquenales. Para esto se utilizó el equipo suministrado por el Oxis Internacional (Portland, OR, EE. UU.; LPO-586).
Concentraciones de glutatión reducidoLas concentraciones de GSH se determinaron mediante ensayo comercial adquirido de Oxis Internacional (Portland, OR, EE. UU.; GSH-400).
Actividad catalasaLa actividad catalasa se determinó a través de la descomposición del peróxido de hidrógeno o de la liberación de oxígeno mediante la técnica basada en el método de rayos ultravioleta de Aebi22.
Análisis estadísticoTras realizar del test de Kolgomorov-Smirnov y comprobar que la muestra no seguía una distribución normal, se utilizaron pruebas no paramétricas para el análisis de los datos. La significación estadística de los cambios entre grupos se analizó por el test de la U de Mann-Whitney. Se valoró el coeficiente de correlación mediante la prueba de Pearson. Los datos se presentan como media (DE ±) y se consideran diferencias significativas cuando se alcanzó una p<0,05. Para el análisis estadístico se utilizó el paquete SPSS (SPSS-15, Chicago, III, EE. UU.).
ResultadosVariables antropométricas y hemodinámicasLos sujetos puberales presentaron valores significativamente superiores de peso, talla e IMC que los sujetos prepuberales. La PAS fue significativamente menor en los varones prepuberales mientras que la PAD fue significativamente menor en los varones púberes (tabla 1).
Características demográficas y antropométricas de los sujetos prepúberes y púberes
| Prepuberales | Puberales | |
| n | 38 | 32 |
| Edad (años) | 10,74±0,07 | 13,88±0,05++ |
| Peso (kg) | 36,08±0,89 | 38,50±1,58++ |
| Talla (cm) | 142,60±0,95 | 163,70±1,28++ |
| IMC (kg/m2) | 17,64±0,37 | 19,90±0,39++ |
| FC (latidos/min) | 92,32±3,03 | 87,93±2,14 |
| PAS (mmHg) | 115,1±1,86 | 121,7±1,70+ |
| PAD (mmHg) | 66,05±1,86 | 59,56±1,76+ |
IMC: índice de masa corporal; FC: frecuencia cardíaca; PAS: presión arterial sistólica; PAD: presión arterial diastólica.
Los valores se expresan como media (desviación estándar ±).
+p<0,05 frente a varones puberales; ++p<0,001 frente a varones puberales.
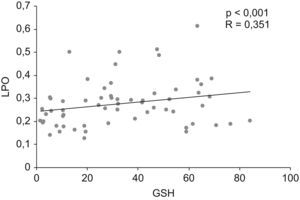
Las concentraciones de LPO fueron significativamente inferiores en el grupo prepuberal respecto a los grupos púberes (tabla 2). Mientras que, las concentraciones de GSH y la actividad de catalasa no mostraron diferencias significativas entre los 2 grupos de estudio (tabla 2). Al valorar en el conjunto de la serie la relación de GSH con LPO, se obtuvo una correlación significativa (fig. 1).
Valores salivares de productos de lipoperoxidación, glutatión reducido y actividad de catalasa en niños prepuberales y puberales
| Prepuberales | Puberales | p | |
| LPO (μmol) | 0,23±0,01 | 0,36±0,02 | <0,001 |
| GSH (μmol) | 40,30±6,20 | 45,9±5,25 | 0,164 |
| Catalasa (U/dl) | 1,11±0,18 | 1,35±0,20 | 0,333 |
Los valores se expresan como media (desviación estándar ±).
LPO: productos de lipoperoxidación; GSH: glutatión reducida.
Según los conocimientos de los autores de este artículo, éste es el primer estudio que intenta valorar y asociar la presencia de EO con cambios acontecidos en la adolescencia (prepuberales frente a puberales). Sobre la base de esto, el principal resultado de este estudio es la existencia de concentraciones superiores en el biomarcardor indicador de EO, LPO, en varones púberes frente a varones prepúberes.
El incremento en las concentraciones de los productos de lipoperoxidación es un fenómeno bioquímico característico del envejecimiento que manifiesta la acumulación acontecida en el devenir del tiempo en las macromoléculas13,23. Esto podría explicar, en parte, los cambios observados en el presente estudio entre niños prepuberales y puberales. Sin embargo, puede que estos cambios también se asocien a los cambios biológicos producidos en la pubertad respecto de la época prepuberal.
Por su parte, el presente estudio revela, que junto con los cambios acontecidos en LPO no aparecen variaciones significativas en las concentraciones de GSH y la actividad catalasa. Estos datos en su conjunto hablarían a favor de un aumento en las ERO como causante del desequilibrio que llevaría a la situación de EO observada. Además, los resultados de este estudio coinciden con los de Erden-Inal et al10, que publicaron que no había diferencias significativas en la medición del GSH plasmático entre los grupos de edad de 2 a 11 años, de 12 a 24 años y de 25 a 40 años, estos 3 grupos presentan valores más elevados que las series de 0,2 a 1 año y de 41 a 60 años; en las que se encontró una correlación negativa entre las concentraciones de GSH y la edad. Asimismo, un reciente estudio realizado en la población española por Casado y López-Fernández mostró que, en sujetos estratificados en 2 grupos (de 4 a 9 años y de 10 a 19 años) no había cambios estadísticamente significativos en la actividad catalasa plasmática14; lo que sigue la línea de los que se mostraron en este trabajo. Sin embargo, es importante mencionar el estudio desarrollado por el grupo de Inal et al. que encontró incrementos en el grupo de 12 a 24 años respecto a un grupo de niños de entre 2 a 11 años15, aunque no especifican si esta diferencia sería atribuible, al menos en parte, a la pubertad. Probablemente, la falta de coincidencia de este estudio con el presente trabajo pueda deberse a 2 hechos concordantes: el rango de edad que corresponde a los grupos de estudio comparados es diferente y, además, pueden influir las condiciones bioquímicas endocrinas generadas por la situación de ser prepuberal o puberal.
Finalmente, se pone de manifiesto una correlación positiva entre LPO y GSH en el conjunto total de los niños y adolescentes estudiados. En su conjunto, y si se tiene presente la tendencia a un aumento de GSH en el grupo puberal, estos resultados apoyan la idea de que probablemente esta etapa de la vida se caracterice por un aumento de ERO frente al que el organismo intentaría una respuesta compensadora por medio de las moléculas antioxidantes, respuesta que en estos sujetos puberales sería insuficiente, como puede desprenderse el incremento experimentado por los LPO.
ConclusionesEn resumen, los datos hallados en este estudio muestran que el estadio puberal acontece con EO caracterizado por aumento en las concentraciones de lipoperoxidación que podría estar, en parte, desencadenado por un incremento en la producción de ERO, probablemente secundario a un mayor metabolismo celular.
Esta situación podría contribuir a explicar, parcialmente, la aparición de determinadas enfermedades asociadas o características de la pubertad. No obstante, son necesarios más estudios en esta línea para analizar la función de las ERO durante la pubertad, así como para desarrollar posibles dianas terapéuticas.