Desde 1996, cuando se inició el tratamiento antirretroviral de gran actividad (TARGA), se ha producido un cambio en el curso de la infección por el VIH, convirtiéndose en una enfermedad crónica. Nuestro objetivo fue describir las características de los niños seguidos en nuestro hospital.
Pacientes y métodosSe realizó un estudio de corte transversal, de 32 niños infectados por VIH, seguidos hasta diciembre de 2010, en el Hospital Universitario de Getafe. La evaluación de los pacientes se efectuó con datos clínicos y de laboratorio, recogidos de la última visita.
ResultadosSe siguió a 32 niños con infección por VIH, 29 de ellos infectados por transmisión vertical. La edad media fue de 14 años. De acuerdo con la clasificación de los CDC, el 56% (18/32) de los niños estaban en la categoría A, el 28% (9/32) en la B y el 16% (5/32) en la C. Dentro de la categoría inmunológica, 24 (75%) se encontraban en la categoría 3, 3 (9%) en la categoría 2 y 5 (16%) en la categoría 1. La mediana del nadir de CD4 fue de 337 (12%). La mediana de CD4 en la última determinación fue de 749 (31%). Solo una adolescente con mala adherencia tenía un recuento absoluto de CD4 menor de 200 células/ml. Veintiocho pacientes (87%) recibían TARGA y 4 estaban sin tratamiento antirretroviral. De los pacientes en tratamiento, 26 (93%) presentaban cargas virales <200 copias/ml. La mediana de carga viral fue <20 copias/ml, y la mediana del tiempo de tratamiento antirretroviral fue de 10 años. La combinación más frecuente fue la de dos inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) y un inhibidor de la proteasa (IP), que la recibieron 15 pacientes (47%), seguida de 2 ITIAN y un inhibidor de la transcriptasa inversa no análogo (ITINN), que la recibieron 8 pacientes (29%). Dos niños con terapia de rescate recibieron raltegravir, uno con tipranavir y el otro darunavir. Un total de 12 pacientes (43%) recibían pautas una vez al día, de ellos con pautas fijas combinadas en un único comprimido se encontraron 7 pacientes (25%). Se observaron complicaciones metabólicas como hiperlipidemia o lipodistrofia en 17 niños (53%).
ConclusionesLa mayoría de nuestros pacientes reciben TARGA, con un buen control inmunovirológico. La prevalencia de alteraciones metabólicas es elevada. Es necesario desarrollar estrategias para mejorar la adherencia y disminuir la toxicidad en los niños con infección por VIH de transmisión vertical.
Since 1996, when HAART became available, there has been a change in the course of HIV-infection, leading it to become a chronic disease. Our aim was to describe the characteristics of the children followed up in our hospital.
Patients and methodsA cross-sectional study was conducted on 32 HIV-infected children followed up until December-2010, at the University-Hospital de Getafe.
Clinical and laboratory information from the last visit was collected for the evaluation of patients.
ResultsThirty-two children with HIV-1 were evaluated, 29 infected through vertical-transmission. The median age was 14 years. According to the CDC classification, 56% (18/32) of children were in category A, 28% (9/32) B and 16% (5/32) C. Immunological class was 3 in 75% of children, class 2 in 9% and class 1 in 16%. The median nadir of CD4 was 337 cells/ml (12%). The median current CD4 was 749 (31%). Only one adolescent had a CD4% below 200 cells/ml due to lack of adherence. Twenty-eight patients (87%) were receiving HAART, and 4 patients were off antiretroviral treatment. Among the patients treated, 26 (93%) had viral loads <200copies/ml. The median viral-load was<20 copies/ml. Median time on antiretroviral treatment was 10 years. The combination more frequently used was two nucleoside reverse transcriptase inhibitors (NRTI) and one protease inhibitor (PI), that was given to 15 patients (47%), followed by 2 NRTI, and one non-nucleoside reverse transcriptase inhibitor (NNRTI) in 8 patients (29%). Two children received rescue therapy including raltegravir, one with tipranavir and the other with darunavir. A total of 12 patients (43%) received medication once a day, 7 of them with fixed-dose combinations in a single tablet (25%). There were metabolic complications, including hyperlipidaemia or lipodystrophy were observed in 17 children (53%).
ConclusionsMost of our patients are receiving HAART, with good virological and immunological control. The prevalence of metabolic abnormalities was high. Strategies to improve adherence and decrease toxicities are needed in perinatally-acquired HIV-infected children.
Desde 1996, cuando se inició el tratamiento antirretroviral de gran actividad (TARGA), se ha producido un cambio en el curso de la infección por el virus de la inmunodeficiencia humana (VIH), con una disminución significativa en la progresión a sida, al igual que en la morbilidad, la transmisión y la mortalidad en adultos y niños1–3.
Aunque la transmisión vertical ha disminuido significativamente tras el inicio del tratamiento durante el embarazo y al recién nacido4,5, esta patología continúa siendo un grave problema mundial, con una estimación en diciembre de 2009 por la Organización Mundial de la Salud (OMS) de 33,3 millones de infectados en el mundo, siendo 2,5 millones de ellos menores de 15 años6,7.
Las actuales opciones terapéuticas y el aumento de la expectativa de vida han provocado que la infección por el VIH sea considerada como una enfermedad crónica2,8. La edad media de los niños infectados por transmisión perinatal va en aumento, con una elevada proporción entrando en la adolescencia, o siendo transferidos a unidades de adultos.
El éxito del tratamiento no sólo dependerá del buen control virológico e inmunológico, sino también de evitar en lo posible las complicaciones del tratamiento a largo plazo de los fármacos antirretrovirales9. Aun con los grandes avances acontecidos en la lucha contra la enfermedad en niños, continúan existiendo grandes retos, entre los que se incluyen la dificultad de una adherencia permanente, la selección de resistencias y las complicaciones a largo plazo del tratamiento10,11. Por otro lado, el seguimiento de estos pacientes es complejo, ya que muchos presentan situaciones socio-familiares difíciles, lo que unido a la afectación multiorgánica de la infección y a la toxicidad asociada al tratamiento antirretroviral dificulta el éxito de este9–11.
Además, a pesar de que exista una buena respuesta inicial al TARGA, puede producirse un fracaso virológico posterior, lo que conduce a una selección de resistencias a los antirretrovirales. A ello contribuye, además, la diferente farmacocinética de los antirretrovirales en pediatría, con el consiguiente riesgo de infradosificación y la escasez de pautas fijas combinadas pediátricas, así como las dificultades en la posología del tratamiento, que dificultan la adherencia terapéutica. Esta se ha considerado siempre un factor fundamental para el eficaz control de las enfermedades crónicas y su éxito terapéutico, en particular en la infección por el VIH, ya que la supresión duradera de la carga viral precisa una tasa de cumplimiento elevada10,12.
Con el objetivo de conocer las características actuales de una población de niños con infección por el VIH, se realiza una revisión del grupo de niños seguidos en nuestro hospital, el tratamiento que reciben, la respuesta a éste y algunas toxicidades asociadas.
Pacientes y métodosSe realizó un estudio de corte transversal de los niños infectados por el VIH, seguidos hasta diciembre de 2010, en el Hospital Universitario de Getafe.
Se incluyó a 32 pacientes, con edades comprendidas entre 1 y 20 años. En la recogida de los datos se incluyó toda la información de la historia clínica, así como de la evaluación clínica, de laboratorio y del registro de farmacia, registrada en la última visita. Entre las variables recogidas, se incluyeron datos sociodemográficos, raza, sexo, edad al diagnóstico, edad actual, modo de transmisión, categoría clínica e inmunológica de los Centers for Disease Control and Prevention (CDC), edad de inicio de TARGA, tiempo total de tratamiento antirretroviral (TAR), CD4 absolutos y porcentaje de CD4 en la última determinación, carga viral actual, nadir de CD4, tratamiento antirretroviral actual, pauta fija combinada, dosis al día, efectos adversos del tratamiento, cifras de colesterol y triglicéridos, tratamiento para dislipidemia, lipodistrofia y gravedad de lipodistrofia. Se recogió también la existencia de coinfección por virus hepatotropos.
La clasificación del estadio clínico e inmunológico se realizó según los criterios definidos por los CDC en 1994 Según la clínica se consideran cuatro categorías: asintomáticos (N), síntomas leves (A), síntomas moderados (B) y síntomas graves o que incluyen la definición de caso de sida (C)- La clasificación de los CDC también considera la situación inmunológica en 3 categorías, de menor (1) a mayor (3) grado de inmunosupresión, según el porcentaje de linfocitos CD4 en relación con la edad o el número total en niños mayores de 13 años13. La clasificación clínica e inmunológica de los pacientes con VIH es importante porque se asocia a la progresión de la enfermedad y la mortalidad.
El tratamiento antirretroviral se basa generalmente en la combinación de fármacos de diferentes familias: inhibidores de la transcriptasa inversa análogos de los núcleos(t)idos (ITIAN), como abacavir, zidovudina, lamivudina, emtricitabina, didanosina, estavudina y tenofovir; inhibidores de la transcriptasa inversa no análogos de los nucleósidos (ITINN), como el efavirenz o nevirapina, e inhibidores de la proteasa (IP), como lopinavir/ritonavir. El momento de inicio de TARGA se definió como el momento de administración, por primera vez, de al menos 3 antirretrovirales durante más de 2 semanas, incluyendo combinaciones de 2 ITIAN e IP, o 2 ITIAN y un ITINN.
Se consideró carga viral indetectable cuando presentaron un valor menor a 200 copias/ml, determinada por PCR-ARN, mediante la técnica-Amplicor® (Roche). Se consideró como pauta fija combinada la asociación de al menos 2 fármacos antirretrovirales en una sola presentación galénica. Se consideró hipercolesterolemia e hipertrigliceridemia cuando el valor plasmático fue superior a 200mg/dl y 170mg/dl, respectivamente. La definición de lipodistrofia se hizo por hallazgos clínicos.
Se inició tratamiento antirretroviral en todos los menores de un año de vida, en todos los pacientes con categoría B o C de la clasificación de los CDC. En niños dentro de la categoría A de los CDC, se inició tratamiento antirretroviral según la cifra de los CD4: en niños entre 1-3 años, si el porcentaje de CD4 fue menor del 25%, o con menos de 1.000 células/mm3; entre 3-5 años, si el porcentaje de CD4 fue menor del 20%, o con menos de 500 células/mm3; en mayores de 5 años, si el recuento de CD4 fue menor de 350 células/mm3. Además, se considero iniciar el tratamiento cuando la carga viral fue mayor a 100.000 copias/ml14.
Estos pacientes realizaron de forma protocolizada revisiones periódicas, con una evaluación clínica y analítica, cada 3 meses, que incluían hemograma, bioquímica, sedimento urinario, perfil lipídico, carga viral y recuento de CD4. La valoración de la adherencia se realizó según cuestionario de adherencia para niños con infección por el VIH, utilizado en ensayos PENTA (Grupo de Trabajo Europeo para el tratamiento de la infección por el VIH en pediatría)15. Se consideró como buena adherencia la toma de más del 90% de las dosis desde la última visita o la toma completa de todos los fármacos en los 3 días previos a la visita. Como herramienta complementaria se utilizaron los registros de farmacia de reparto y recogida de medicación. En todos los pacientes se realizó una evaluación psicosocial por un psicólogo clínico pediátrico y en aquéllos en quienes se consideró necesario también se efectuó una evaluación por asistentes sociales, tanto del hospital como de grupos de apoyo extrahospitalario.
Se realizó un análisis de frecuencias con paquete estadístico de SPSS versión15.0
ResultadosLas características generales de los pacientes, se muestran en la tabla 1. Desde julio de 2006 hasta diciembre de 2010, se siguió a 32 niños con infección por el VIH, 25 (78%) de estos pacientes eran seguidos previamente en otras unidades y fueron referidos a nuestro hospital. Sólo 7 (22%) pacientes fueron diagnosticados de infección por el VIH en nuestro hospital. Veintinueve (90%) de estos pacientes se infectaron por transmisión vertical. En 3 pacientes se desconoce el modo de infección, en dos casos las madres no tenían infección por el VIH y en el último caso el estado de infección de la madre era desconocido. El 64% de los pacientes fueron niñas (20/32). Veinticinco (78%) pacientes eran de raza blanca, 4 niñas subsaharianas y 3 niños eran latinoamericanos. Se diagnosticó desde el nacimiento a 18 (56%) niños; uno de estos niños fue diagnosticado en nuestro hospital y 17 en otras unidades desde donde se remitieron posteriormente. La mediana de edad al inicio del seguimiento fue de 6 meses (rango: 1 mes-156 meses). La mediana de edad al final del periodo de estudio fue de 14 años (rango: 1-20 años).
Características generales de los pacientes
| Paciente | Edad al diagnóstico (meses) | Edad actual (años) | Modo de transmisión | Categoría clínica | Categoría inmunológica | CD4 actual (células/mm3) | Carga viral actual (copias/ml) | Tratamiento antirretroviral |
| 1 | RN | 15 | Vertical | B | 3 | 360 | 18.619 | 1 ITINNa+1 IPb+1 II |
| 2 | RN | 2 | Vertical | B | 3 | 748 | <200 | 2 ITIAN+1 IP |
| 3 | 7 | 12 | Vertical | A | 1 | 750 | <200 | 2 ITIAN+1 IP |
| 4 | 156 | 14 | Desconocido | A | 2 | 542 | 14.555 | Sin tratamiento |
| 5 | 156 | 16 | Desconocido | B | 3 | 855 | <200 | 2 ITIAN+1 IP |
| 6 | 10 | 18 | Vertical | B | 3 | 861 | <200 | 2 ITIAN+1 ITINN |
| 7 | RN | 1 | Vertical | A | 1 | 2048 | <200 | 2 ITIAN+1 IP |
| 8 | 14 | 16 | Vertical | A | 2 | 748 | <200 | 2 ITIAN+1 IP |
| 9 | RN | 11 | Vertical | A | 3 | 588 | <200 | 2 ITIAN+1 IP |
| 10 | 21 | 3 | Vertical | A | 3 | 1012 | <200 | 2 ITIAN+1 IP |
| 11 | 1 | 14 | Vertical | A | 3 | 475 | <200 | 2 ITIAN+1 ITINN |
| 12 | RN | 9 | Vertical | B | 3 | 1000 | <200 | 2 ITIAN+1 IP |
| 13 | 18 | 18 | Vertical | A | 3 | 1377 | 23.107 | Sin tratamiento |
| 14 | 6 | 6 | Vertical | A | 1 | 1339 | 11.164 | Sin tratamiento |
| 15 | 15 | 16 | Vertical | C | 3 | 518 | <200 | 1 ITIAN+1 IP+1 ITINN |
| 16 | 10 | 20 | Vertical | A | 3 | 518 | <200 | 1 ITIAN+1 IP+1 ITINN |
| 17 | 6 | 15 | Vertical | A | 3 | 690 | <200 | 2 ITIAN+1 IP |
| 18 | 24 | 6 | Vertical | B | 2 | 537 | 14.307 | Sin tratamiento |
| 19 | 14 | 13 | Vertical | B | 3 | 819 | <200 | 2 ITIAN+1 ITINN |
| 20 | 2 | 9 | Vertical | A | 3 | 678 | <200 | 2 ITIAN+1 IP |
| 21 | RN | 20 | Vertical | A | 3 | 840 | <200 | 2 ITIAN+1 ITINN |
| 22 | 36 | 19 | Vertical | C | 3 | 1106 | <200 | 1 ITIAN+1 IP+1 ITINN |
| 23 | 132 | 12 | Desconocido | B | 3 | 769 | <200 | 2 ITIAN+1 IP |
| 24 | 5 | 12 | Vertical | A | 3 | 700 | <200 | 2 ITIAN+1 IP |
| 25 | 3 | 18 | Vertical | A | 3 | 915 | <200 | 2 ITIAN+1 ITINN |
| 26 | 3 | 19 | Vertical | A | 3 | 300 | 140.937 | 2 ITIAN+1 ITINN |
| 27 | 3 | 14 | Vertical | A | 1 | 893 | <200 | 2 ITIAN+1 IP |
| 28 | 3 | 15 | Vertical | B | 3 | 921 | <200 | 2 ITIAN+1 ITINN |
| 29 | 24 | 19 | Vertical | C | 3 | 828 | <200 | 1 ITIAN+1 IP+1 ITINN |
| 30 | 3 | 13 | Vertical | C | 3 | 442 | <200 | 2 ITIAN+1 IP |
| 31 | 24 | 16 | Vertical | A | 1 | 900 | <200 | 2 ITIAN+1 ITINN |
| 32 | 24 | 8 | Vertical | C | 3 | 958 | <200 | 1 ITIAN+1 IPb+1 II |
II: inhibidor de integrasa: raltegravir; IP: inhibidor de proteasa; ITIAN: inhibidor de la transcriptasa inversa análogo de nucleósidos; ITINN: inhibidor de la transcriptasa inversa no análogo; RN: recién nacido.
Desde el año 2000 han sido valorados 10 (31%) casos nuevos, 7 de ellos infectados por trasmisión vertical. En los últimos 5 años, se han diagnosticado 5 (9,6%) pacientes, 2 de ellos diagnosticados al nacimiento. Los otros 3 niños diagnosticados en los últimos 5 años fueron una niña de 2 años nacida en Ucrania, diagnosticada tras la valoración de su hermano finalmente no infectado nacido en nuestro hospital; una adolescente de 13 años procedente de Nigeria fue diagnosticada recién llegada a España tras ingresar en nuestro hospital por una neumonía neumocócica y una malaria por P. falciparum. Su hermana de 12 años también fue diagnosticada de infección por el VIH en el seguimiento.
En cuanto a la categoría clínica, 18 (56%) niños se encontraron en la categoría A, 9 (28%) pacientes en la B y 5 (16%) en la categoría C. Cuatro de los pacientes que se encontraban en la categoría C presentaban encefalopatía por el VIH; el otro paciente presentó una colitis por citomegalovirus. Dentro de la categoría inmunológica, 5 (16%) en la categoría 1, 3 (9%) niños en la categoría 2 y 24 (75%) pacientes se encontraban en la categoría 3. La mediana del nadir de CD4 absoluto fue de 337 células/mm3 (rango 0-2406 células/mm3) y la mediana del porcentaje del nadir de CD4 fue 12% (rango 0%-32%).
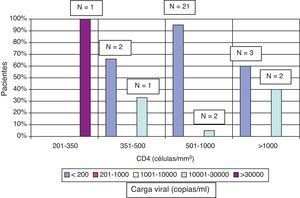
La mediana del último recuento de CD4 fue de 749 células/mm3 (rango: 165-2.048 células/mm3) y la mediana del porcentaje de CD4 fue del 31% (rango 8-47%). La mediana de la carga viral fue <20 copias/ml (rango <20-140.937 copias/ml). Veintiséis (81%) pacientes se encontraban con carga viral indetectable en el momento del estudio (<200 copias/ml); todos ellos recibían TARGA. De los 6 pacientes con cargas virales detectables, 2 recibían tratamientos complejos, con tomas 2 veces al día, debido a múltiples resistencias a antirretrovirales. Los otros 4 pacientes no recibían tratamiento; dos de estos eran mayores de un año y no habían recibido tratamiento antirretroviral porque presentaban porcentajes de CD4 altos (mayor del 30%), con cargas virales detectables, pero menores de 100.000 copias/ml, con previsión y preparación de inicio de TAR cuando bajen sus CD4 por debajo del umbral de 500 células/μl (en los menores de 5 años), o 350 células/μl (en los mayores de 5 años), o su porcentaje de CD4 sea menor del 25%. Otros 2 niños suspendieron medicación por mala adherencia y han mantenido posteriormente CD4 estables. Veintisiete (84%) pacientes han presentado cargas virales indetectables, en algún momento del seguimiento. La figura 1 muestra las características inmunovirológicas.
En cuanto al tratamiento antirretroviral, no recibieron tratamiento los 4 pacientes descritos anteriormente. La mediana del tiempo de inicio de TARGA fue 37 meses (rango: 1-168 meses). El tiempo total de tratamiento antirretroviral tuvo una mediana de 10 años (rango 6 meses-18años). Seis niños iniciaron TARGA antes del primer año de vida. Los 28 (87%) pacientes en tratamiento recibían 3 fármacos, incluyendo IP potenciado con ritonavir en 20 (71%) casos. La combinación más utilizada en los pacientes que recibían TARGA fue la de 2 ITIAN y 1 IP en 15 (47%) pacientes, siendo la combinación más utilizada abacavir, lamivudina y lopinavir/ritonavir en 6 (21%) pacientes. La combinación con ITINN más utilizada fue la pauta fija combinada de tenofovir, emtricitabina y efavirenz (Atripla®) en 7 (25%) pacientes.
Dentro de las familias de antirretrovirales, los más usados fueron los ITIAN, seguidos de los IP. Dos pacientes recibieron regímenes de rescate que incluían raltegravir, uno con tipranavir y el otro con darunavir. Trece (46%) pacientes recibían pauta fija combinada, siendo la más utilizada Atripla® en 7 (25%) pacientes, seguidas de abacavir más lamivudina (Kivexa®) en 3 (10,5%) niños y tenofovir más emtricitabina (Truvada®) en 3 (10,5%) pacientes. Un total de 12 (43%) pacientes recibieron pautas una vez al día; de ellos, con terapias fijas combinadas en un único comprimido se encontraron 7 (25%) pacientes.
La adherencia se consideró buena (>90% de la dosis recomendada) en 30 (93,7%) pacientes, según registros de farmacia, en los que se hizo valoración de datos de recogida de medicamentos y cuestionario de adherencia. El apoyo psicológico se hizo de manera individualizada, con revelado gradual del estado de infección, en los mayores de 10 años, por el equipo multidisciplinario, que siempre ha incluido pediatra y psicólogo.
Hasta el 53% de nuestros pacientes presentaron algún tipo de toxicidad metabólica asociada a los antirretrovirales. El 50% tenía más de 12 años de exposición a tratamiento antirretroviral. El 72% estaba clasificado en la categoría A de los CDC, todos excepto 2 recibían tratamiento con lopinavir/ritonavir, la mitad había recibido en algún momento esquema de TAR, que incluyó didanosina o estavudina. Presentaron hipercolesterolemia (colesterol >200mg/dl) el 43,7%; hipertrigliceridemia (triglicéridos >170mg/dl) el 15,6% y criterios clínicos de lipodistrofia, incluyendo lipohipertrofia y/o lipoatrofia, el 28%. De los 9 pacientes con lipodistrofia, 3 presentaban hipercolesterolemia o hipertrigliceridemia. No se registraron otras reacciones adversas secundarias al tratamiento. Sólo un paciente estuvo coinfectado por virus de hepatitis C, de transmisión vertical, y ninguno por el virus B de la hepatitis.
DiscusiónEste estudio transversal nos permite describir la situación actual de nuestra población de pacientes pediátricos y adolescentes infectados por el VIH, clínica y analíticamente, al igual que la relación con el tratamiento antirretroviral. Según lo esperado, por el aumento de la esperanza de vida, tras el inicio del TARGA, la mediana de edad de nuestros niños ha ido en aumento, siendo en la actualidad de 14 años16. Predominó el sexo femenino, al igual que en otras cohortes europeas17. Aunque el método de transmisión más frecuente continúa siendo el vertical, desde el año 1994 (momento en el que se inició el protocolo ACTG 076)4 ha disminuido de manera significativa la transmisión madre-hijo, con un descenso de la incidencia de infección perinatal5. Así que 3 de los 5 niños diagnosticados en los últimos 5 años eran inmigrantes procedentes de África y Ucrania.
Dado que la mitad de nuestros pacientes al final del estudio tuvieron edades mayores de 13 años, una gran parte de ellos recibió regímenes de tratamiento antirretroviral con monoterapia y biterapia hasta la aparición del TARGA. Asimismo iniciaron TARGA después del primer año de vida. La infección por el VIH se ha convertido en una enfermedad crónica con buen pronóstico a largo plazo tras el inicio del TARGA, de modo que la mayoría de nuestros pacientes se clasificaron en categoría A (56%) y no apreciamos las infecciones oportunistas, la comorbilidad asociada a la inmunosupresión ni la desnutrición secundaria observadas en otras épocas. Sin embargo, el 16% presentó enfermedades asociadas graves, encuadradas en la categoría clínica C. Los 4 pacientes con encefalopatía iniciaron tratamiento después del primer año de vida, ya que 3 fueron diagnosticados después de los 12 meses, y una paciente que actualmente es adolescente recibió inicialmente monoterapia hasta la aparición del TARGA. Todos ellos tuvieron un nadir de CD4 menor del 9% y actualmente son mayores de 8 años, similar a lo descrito en la literatura como factores de mal pronóstico8,18. Aunque todos ellos actualmente tienen cargas virales indetectables y situación clínica estable, la mayoría presentan secuelas motoras de su encefalopatía. En el conjunto de nuestra serie no se ha producido ninguna infección oportunista de clase C, en los últimos 5 años y ninguno de nuestros pacientes progresó a sida. En cuanto al estadio inmunológico, el 75% se clasificó en el estadio 3; sin embargo, actualmente sólo 1 paciente presenta menos del 15% de CD4 por mala adherencia al TARGA.
En cuanto al tratamiento, la triple terapia incluyendo 2 ITIAN más un IP fue la combinación más frecuente. Debemos reseñar en nuestro estudio la elevada proporción de niños-adolescentes que reciben pautas fijas combinadas, así como pautas una vez al día, estrategias que facilitan la adherencia. Es crucial potenciar el desarrollo de pautas fijas combinadas y combinaciones, dada la dificultad de la adherencia y la necesidad de mantenerla de forma continuada, sobre todo en periodos tan vulnerables como la adolescencia. De los 4 pacientes que no recibían tratamiento en el momento del estudio, 2 de ellos se mantuvieron con valores altos de linfocitos CD4 en estrecha observación, con evolución de lenta progresión de la enfermedad19,20. Los otros 2 pacientes que tuvieron cargas virales detectables, de más de 200 copias, recibían tratamientos complejos, con tomas 2 veces al día, debido a múltiples resistencias. En estos casos son adolescentes con pobre adherencia. En ellos se reforzó el apoyo psicológico y social con visitas más frecuentes y abordaje individualizado.
La toxicidad metabólica observada fue frecuente, a expensas de hipercolesterolemia, hipertrigliceridemia y lipodistrofia, estando presentes hasta en el 53% de nuestros pacientes con TARGA. Esta proporción fue más elevada entre los adolescentes y está probablemente asociada a mayor tiempo de exposición al TAR, cambios hormonales y dietas más flexibles. Nuestra experiencia es similar a la descrita en la literatura9. La mayoría recibían en su tratamiento un IP y habían recibido regímenes de antirretrovirales, incluyendo didanosina y estavudina en el pasado9,11,21,22. Todos los pacientes con toxicidad metabólica iniciaron cambios dietéticos y hábitos de vida saludable con ejercicio y cambios de ITIAN, y/o IP a ITINN, o simplificación a fármacos con menor toxicidad mitocondrial, con mejoría. Ninguno precisó tratamiento con medicamentos hipolipemiantes ni desarrolló diabetes. En un caso de lipohipertrofia troncular se propuso cirugía, que al final la paciente rechazó. No hemos observado reacciones de hipersensibilidad en los pacientes que recibían abacavir. Todos los pacientes que recibieron tenofovir fueron mayores de 13 años, excepto en el caso de un niño de 8 años, en que se utilizó como fármaco compasivo por estudios genotípicos con múltiples resistencias. Ninguno ha presentado toxicidad renal. No evidenciamos efectos sobre el SNC ni alteraciones del sueño en los pacientes con regímenes de tratamiento que incluían efavirenz.
En general, hemos observado un elevada proporción de pacientes con cargas virales indetectables y buen control inmunológico. La elevada proporción de pacientes con buen control virológico podría ser atribuible, en gran parte, a la disponibilidad de un equipo multidisciplinario, incluidos psicólogos y asistentes sociales, y grupo de apoyo. Además, a pesar del gran desarrollo de los antirretrovirales, existe un retraso en niños, y continúan produciéndose fracasos virológicos, principalmente asociados a mala adherencia, siendo necesario desarrollar estrategias para mejorarla. Así mismo se desconocen las secuelas a largo plazo de la infección y de la prolongada exposición al TAR. Estudios multicéntricos permitirán conocer más datos sobre los efectos metabólicos en niños con infección por el VIH y transmisión vertical expuestos durante largo tiempo al TARGA.
Nuestro estudio presenta una serie de limitaciones, ya que se trata de un estudio descriptivo, de corte transversal, que no permite realizar asociaciones estadísticas, con una muestra pequeña, y con un posible sesgo de selección al ser un centro de referencia, donde se siguen pacientes complejos.
En conclusión, es necesario desarrollar estrategias para mejorar la adherencia y disminuir la toxicidad, y potenciar el desarrollo de pautas fijas combinadas y combinaciones de tratamiento en los niños infectados por el VIH de transmisión vertical. Es necesario un seguimiento a largo plazo, enlazando con cohortes de adultos, para conocer la evolución futura de niños con exposición prolongada a antirretrovirales.
Conflicto de interesesEl Dr. José Tomás Ramos declara haber participado en conferencias y consejo asesor de BMS, ViiV y Gilead Sciences en los últimos 12 meses.
AgradecimientosA todos los niños y adolescentes con infección por el VIH que han sido objeto del estudio.