Introducción
El asma es una enfermedad inflamatoria crónica de las vías aéreas que cursa con obstrucción al flujo e hiperrespuesta bronquial. En los últimos años se ha estudiado la posibilidad de desarrollar distintos métodos de medida que permitan evaluar y cuantificar la magnitud de dicha inflamación. En este contexto se han investigado distintos marcadores de actividad inflamatoria, entre ellos la determinación de la fracción exhalada de óxido nítrico (FENO).
El óxido nítrico (NO) es un radical libre endógeno simple y difusible, que genera c-GMP y actúa en el sistema respiratorio como broncodilatador débil, vasodilatador potente y neurotransmisor del sistema no colinérgico y no adrenérgico. Se sintetiza a partir de la L-arginina y de tres isoformas de la enzima óxido nítrico-sintetasa (NOS), dos de ellas constitucionales (neuronal, nNOS o NOS1, y endotelial, eNOS o NOS3) y una inducible (iNOS o NOS2). En situaciones patológicas de estrés oxidativo, el NO inhibe los linfocitos Th1 y la producción de interferón gamma (IFN-γ), regulando a la baja la apoptosis de los eosinófilos y actuando como modulador en enfermedades como el asma, amplificando la respuesta inflamatoria.
El NO es un buen marcador reproducible y no invasivo de inflamación eosinófila de la vía aérea, que resulta útil en el diagnóstico de asma, en el control de la enfermedad y en la monitorización del tratamiento1,2.
El objetivo de este estudio ha sido analizar la concordancia entre dos dispositivos de medida de NO exhalado, un analizador de quimioluminiscencia estacionario (NIOX®, Aerocrine, Suecia), considerado como analizador ideal, y un analizador portátil (NIOX-MINO®, Aerocrine, Suecia), basado en análisis electroquímico.
Material y métodos
Estudio observacional y transversal de una muestra obtenida al azar de niños y niñas entre 6 y 19 años, en consultas externas de neumología infantil, en los que se ha determinado la FENO desde diciembre de 2006 hasta febrero de 2007. Las medidas se han realizado mediante registro on-line de respiración única (single breath on-line measurement). Se han obtenido tres medidas consecutivas mediante un analizador de quimioluminiscencia estacionario (NIOX®), con un máximo de seis intentos, y se ha calculado la media (valor medio NIOX®). Asimismo, y de forma sucesiva en cada uno de los niños estudiados, se realizó una única medición con un analizador portátil (NIOX-MINO®), basado en análisis electroquímico.
Todas las medidas se realizaron según las recomendaciones de la European Respiratory Society (ERS) y la American Thoracic Society (ATS) publicadas en el año 20053: inhalación de aire libre de NO, a través de la boquilla de ambos aparatos (< 5 partes por billón [ppb]), hasta capacidad pulmonar total, posición sentado, sin pinza nasal, flujo espiratorio 50 ml/s, tiempo de exhalación de 10 s, meseta alcanzada durante la exhalación de un tiempo mínimo de 3 s, presión durante la exhalación entre 5 y 20 cm de H2O y variablidad de tres medidas inferior o igual al 10 % o variabilidad de dos medidas inferiores o iguales al 5 %.
Se han analizado las variables cuantitativas edad, talla, peso, valor NIOX-MINO®, valor medio NIOX® y flujo de NO (nl/min). Las variables cualitativas analizadas han sido sexo, diagnóstico y tratamiento. Según distintas series publicadas en la literatura médica, se han considerado puntos de corte de normalidad 20 ppb para el sistema NIOX® y 30 ppb para el sistema NIOX-MINO®4,5.
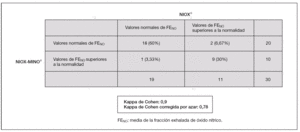
En el análisis estadístico se ha estudiado la regresión de las medias de FENO obtenidas con ambos dispositivos de medida respecto a la diferencia de las mismas, mediante el método Bland-Altman, tanto en valores absolutos como relativos6,7. Asimismo, se ha analizado el grado de acuerdo entre los dos dispositivos de medida, en relación con los valores de normalidad para ambos, mediante el estadístico kappa de Cohen.
Resultados
Se han evaluado 30 niños con edad media de 11,3 ± 3,09 años, 14 varones (46,67 %) y 16 mujeres (53,33 %). De los sujetos incluidos, 2 (6,67 %) no tenían patología pulmonar, 2 (6,67 %) tenían tos recurrente y 26 (86,67 %) estaban diagnosticados de asma, distribuidos en 14 (53,84 %) asma episódica ocasional, 4 (15,38 %) con asma episódica frecuente y 8 (30,76 %) con asma persistente. De los pacientes estudiados, 15 (50 %) estaban bajo tratamiento con glucocorticoides inhalados (GCI) en monoterapia, 9 (30 %) bajo terapia combinada con GCI asociados a β2-agonistas de larga duración y 6 casos (20 %) sin tratamiento.
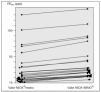
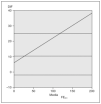
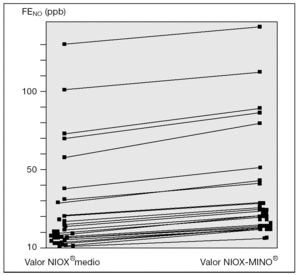
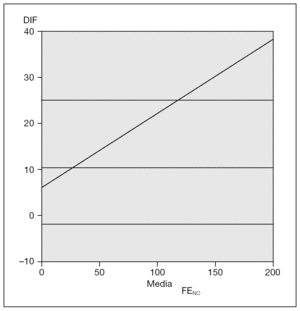
El 100 % de los casos realizaron las mediciones de FENO con ambos dispositivos de medida (fig. 1). La regresión de las medias obtenidas por ambos dispositivos de medida de FENO respecto a la diferencia de las mismas fue significativa, tanto en valores absolutos como relativos (p < 0,005) (fig. 2). Asimismo, hubo acuerdo entre los valores obtenidos con ambos dispositivos de medida, kappa de Cohen 0,78 (fig. 3).
Figura 1. Comparación de medidas de óxido nítrico exhalado obtenidas mediante dispositivos, sistema NIOX®y sistema NIOX-MINO®. Cada uno de los valores representados a la izquierda de la gráfica refleja el valor medio de las tres determinaciones sucesivas de FENO obtenidas con el sistema NIOX®(valor NIOX®medio) en los 30 pacientes incluidos en el estudio. Los valores representados a la derecha de la gráfica reflejan el valor de una única determinación realizada en cada uno de los pacientes incluidos mediante sistema NIOX-MINO®. FENO (ppb): fracción exhalada de óxido nítrico (partes por billón).
Figura 2. Análisis estadístico (Bland-Altman). Media FENO: media de la fracción exhalada de óxido nítrico; DIF: diferencia de las medias de FENO obtenidas con NIOX®y con NIOX-MINO®, en valores absolutos.
Figura 3. Análisis estadístico mediante el índice kappa de Cohen.
Discusión
Durante las dos últimas décadas se describen valores elevados de FENO en niños asmáticos y en otras patologías inflamatorias pulmonares. Se considera la FENO una variable válida y no invasiva para la monitorización y el tratamiento de la inflamación de la vía aérea y con una alta capacidad diferenciadora para diagnosticar asma8. Warke et al9 encontraron que la FENO sería un marcador no invasivo válido y reproducible para medir inflamación eosinofílica en las vías aéreas10,11. La combinación entre un incremento de la FENO superior o igual a 33 ppb y un volumen espiratorio forzado en el primer segundo (FEV1) inferior al 80 % del teórico refleja una sensibilidad de 94 % y una especificidad de 93 % para el diagnóstico de asma2,12. Asimismo, la FENO se ha utilizado satisfactoriamente para monitorizar el tratamiento antiinflamatorio con GCI en niños asmáticos, debido a su gran sensibilidad y rapidez para detectar cambios en respuesta a las dosis de corticoides inhalados o deterioro de la función pulmonar13. El incremento de FENO superior al 60 % del basal tenía un valor predictivo positivo entre el 80 y el 90 % para predecir la pérdida de control de la enfermedad14-16.
El NO en el aparato respiratorio sigue una distribución bicompartimental: difusión transversal del epitelio respiratorio a la luz bronquial y difusión vertical, desde la pequeña vía aérea a la vía respiratoria superior. Existen diferentes formas de medir el NO en los bronquios: el registro on-line de respiración única (single breath on-line measurement [SBOL]) es la técnica de elección en el caso de que el niño sea capaz de colaborar, realizando la medida durante una parte de la exhalación (fracción exhalada de óxido nítrico, FENO), evitando la contaminación del NO nasal (nNO) al crear una presión positiva que mantenga el paladar blando ocluyendo el espacio nasal. Con esta metodología, en España han llevado a cabo estudios Cobos Barroso et al17 y Balboa de Paz et al18, utilizando flujos espiratorios de 250 ml/s en ambos casos.
Los fundamentos teóricos, la metodología y las características técnicas fueron publicados en la década anterior por la ERS19 y la ATS20. La principal diferencia entre ambas entidades era la tasa de flujo espirado a la que se realizaba la medición. Posteriormente, Baraldi et al21, en colaboración con la ERS y la ATS, publicaron recomendaciones para la medición del NO exhalado en niños y, recientemente, se han publicado los criterios unificados ATS y ERS para la medición estandarizada del NO en niños y adultos.
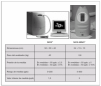
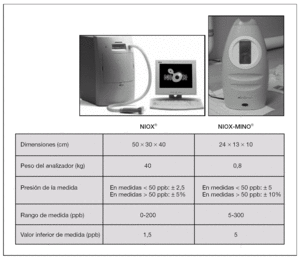
En el año 2004, Silkoff et al22 propusieron un sistema de monitorización de la FENO utilizando el método SBOL (NIOX®, Aerocrine, Suecia) con el objetivo de facilitar la estandarización de los procedimientos de medida recomendados por las distintas guías de ATS/ERS y con un desarrollo técnico y metodológico aprobado en el año 2003 por la Food and Drug Administration (FDA), para su aplicación clínica en niños asmáticos con inflamación alérgica (fenotipo inflamatorio eosinofílico). Las medidas de la FENO realizadas con NIOX® están basadas en un analizador de quimioluminiscencia estacionario y se considera la técnica de elección y el patrón de referencia para la medición on-line de la FENO en niños colaboradores. La determinación se realiza a través de un detector lumínico en el que el NO, al reaccionar con el ozono, produce dióxido de nitrógeno y emite una radiación lumínica proporcional a la concentración de NO en aire espirado cuando se estabiliza. El flujo espiratorio se estandariza a 50 ml/s. Se trata de una técnica validada, reproducible (variabilidad en tres mediciones consecutivas: 1,6 ppb; intervalo de confianza [IC] del 95 %: 1,49-1,64) y precisa (± 2,5 ppb para valores < 50 ppb, y ±5 % para valores ≥ 50 ppb) en niños con edad igual o superior a 5 y 6 años4,23. El analizador NIOX® ofrece, además, la posibilidad de representar gráficamente la meseta correspondiente a la FENO. Sin embargo, se trata de una técnica algo compleja (se requieren tres medidas, calibración necesaria cada 14 días) de uso hospitalario, con personal cualificado y entrenado para su correcta realización (fig. 4). El acceso a dichos analizadores de quimioluminiscencia es limitado, motivo por el que se ha propuesto un analizador portátil de FENO, NIOX-MINO®, validado en niños y basado en analizadores electroquímicos, que cumple las recomendaciones de la ATS.
Figura 4. Características de los dispositivos de medida de FENO, sistema NIOX®y sistema portátil NIOX-MINO®. ppb: partes por billón.
El sistema portátil analiza la FENO a través de una reacción electroquímica con control de flujo, mediante sensor lumínico y acústico. El tiempo de exhalación requerido oscila entre 6 y 10 s y la presión durante la exhalación, entre 10 y 20 cm de H2O, la cual permite establecer un flujo espiratorio entre 45 y 55 ml/s, controlado por un regulador de flujo-presión, guiado por imágenes interactivas de luz y sonido que incentivan al niño a alcanzar el flujo óptimo deseado.
En este sentido, McGill et al24 estudiaron 55 niños entre 4 y 15 años y encontraron que los niños con edad igual o superior a 5 años eran capaces de realizar la medición de la FENO utilizando el sistema portátil (NIOX-MINO®). Observaron también que el coeficiente de variación intrasujeto del analizador NIOX-MINO® era inferior al sistema NIOX®; por lo tanto, no existían diferencias entre la primera medida realizada y las posteriores, y sería suficiente una única medición, tal como recomiendan los fabricantes. Sin embargo, las distintas guías existentes (ATS/ERS) sugieren la obtención de al menos dos mediciones sucesivas. Se trata, pues, de una técnica sencilla, que no requiere calibración y que simplificaría enormemente el tratamiento en la práctica clínica diaria, tanto en atención especializada como en atención primaria. El tiempo total requerido para la medición es inferior a 2 min. Sin embargo, es una técnica algo menos precisa y de representación digital (fig. 4).
El objetivo de nuestro estudio ha sido analizar la concordancia entre dos dispositivos de medida para NO exhalado, sistema NIOX® y sistema portátil NIOX-MINO®. Según los datos obtenidos en nuestra muestra, observamos que existen diferencias significativas (p < 0,005) en la regresión de las medias obtenidas por ambos dispositivos de medida respecto a la diferencia de las mismas. Por tanto, los dos sistemas estudiados no son equivalentes, por lo que no son sustituibles (fig. 2). De acuerdo con otros investigadores, los valores obtenidos con el sistema NIOX-MINO® han sido significativamente superiores a los obtenidos con el sistema NIOX®, tanto más cuanto mayor ha sido el valor de FENO obtenido (fig. 1). Sin embargo, las diferencias no han sido significativas a la hora de clasificar los valores de FENO obtenidos como normales o anormales, al igual que lo referido previamente por otros autores25-27.
Fortuna et al28 estudiaron 28 adultos sanos, no fumadores, y compararon los resultados obtenidos con un medidor de quimioluminiscencia tradicional (N-6008® SIR, Madrid) y con el medidor portátil NIOX-MINO®, siguiendo en ambos casos las recomendaciones internacionales. Encontraron una correlación directa y estadísticamente significativa en la determinación de FENO entre ambos equipos (r = 0,92; p = 0,001). Sin embargo, al igual que lo publicado por otros autores, los valores obtenidos con el sistema portátil NIOX-MINO® fueron significativamente superiores a los obtenidos con el N-6008®, y propusieron un factor de corrección entre los valores de los dos equipos (x1,5 + 10) para cada valor de FENO obtenido con el equipo N-6008®. Asimismo, describieron valores de referencia de normalidad concordantes con la literatura médica publicada; media geométrica de la FENO para sistema N-6008® de 7 ± 5 ppb (rango, 1-19 ppb) y 20 ± 7 ppb (rango, 8-41) para NIOX-MINO®.
Recientemente, Pijnenburg et al29 han estudiado en 21 niños asmáticos con edad media de 14,5 años la fiabilidad y la variabilidad de dos medidas diarias domiciliarias de la FENO (mañana y noche) obtenidas con el analizador portátil NIOX-MINO® durante 2 semanas. Las medidas fueron realizadas con éxito y sin soporte profesional en el 93 % de los niños estudiados. Encontraron, a diferencia de lo comunicado por otros autores30, una variabilidad diurna de la FENO, con valores matutinos significativamente superiores (14 %) a los vespertinos (IC 95 %: 4-25 %; p = 0,01).
En nuestra muestra existe entre ambas técnicas un acuerdo sustancial en los valores de FENO obtenidos en relación con los valores de normalidad publicados, por lo que ambas técnicas resultan válidas para el tratamiento de los niños en la práctica clínica diaria.
A pesar de que los resultados obtenidos han sido concordantes con los comunicados en la literatura médica, debemos señalar que la muestra de los pacientes incluidos en el estudio no es demasiado extensa. Por tanto, si se analizaran los datos con un tamaño muestral mayor, la nube de puntos que representa las diferencias entre ambos dispositivos de medida podría aplanarse, al disminuir la relevancia de los valores extremos (fig. 2). Asimismo, hemos observado que mientras que los niños mayores de 9 años eran capaces de realizar ambas técnicas con garantías, los menores de esa edad obtenían mejores resultados con el sistema NIOX®.
En conclusión, la FENO, determinada mediante técnica electroquímica con sistemas portátiles, es válida en niños mayores de 5 años y ofrece la posibilidad de cuantificar de forma simple y no invasiva la inflamación eosinofílica de la vía aérea31-33, que resulta de gran utilidad como complemento a la función pulmonar en el diagnóstico de asma y en el control del tratamiento en niños.
Correspondencia: Dr. O. Sardón Prado.
Unidad de Neumología Infantil. Hospital de Donostia.
P.º de Begiristain, 107-115. 20014 San Sebastián. España.
Correo electrónico: osardon@euskalnet.net
Recibido en agosto de 2007.
Aceptado para su publicación en octubre de 2007.