Etiología y epidemiología de la otitis media aguda
La otitis media aguda (OMA) es una de las enfermedades infecciosas más frecuentes en el niño. Se estima que 2 de cada 3 niños han presentado algún episodio antes del primer año de vida, y más del 90 % a los 5 años1; el 10-20 % de los pacientes presenta episodios frecuentes de OMA2. Los patógenos más frecuentes de la OMA son Streptococcus pneumoniae (30 % de los casos), Haemophilus influenzae (20-25 %) y Moraxella catarrhalis (10-15 %)3, aunque en España este último microorganismo es una causa poco frecuente4. Otros patógenos menos habituales son Streptococcus pyogenes (3-5 %), Staphylococcus aureus (1-3 %) y, ya más excepcionalmente, bacilos anaerobios y gramnegativos, como Escherichia coli o Pseudomonas aeruginosa. La etiología de los virus en la OMA es muy discutida. Se acepta universalmente que la infección vírica de las vías respiratorias supone un factor favorecedor de la OMA, pero no todos los autores reconocen estos agentes como causa exclusiva, más aún cuando no se ha podido demostrar su replicación en la cavidad del oído medio5.
En los últimos años, el incremento de las resistencias bacterianas se ha convertido en un problema, especialmente frente al neumococo, lo que ha influido de manera importante en el tratamiento de esta afección. En el momento actual, más del 50 % de las cepas de S. pneumoniae han perdido sensibilidad a la penicilina, y una tercera parte de los aislamientos presenta resistencia a este microorganismo6. Esto es especialmente evidente en el niño y más aún en infecciones de las vías respiratorias altas, donde las cepas con pérdida de sensibilidad a la penicilina pueden llegan a representar hasta el 70 % de los casos7. No obstante, datos recientes en España indican un descenso de esta resistencia8, quizás en relación con un uso más racional de la antibioterapia y la administración de la vacuna neumocócica conjugada (VCN 7-v); no obstante, esta hipótesis queda pendiente de confirmación en los próximos años.
Otro cambio, aún más reciente, es la modificación de la colonización bacteriana de la vía respiratoria en los países con una elevada implantación de la vacuna neumocócica heptavalente9. Las cepas de neumococo incluidas en la vacuna han descendido de manera significativa como agentes causantes de OMA, al mismo tiempo que nuevas cepas no vacunales han reemplazado a las anteriores, pero con la particularidad de que son más sensibles a los antibióticos10. Este cambio se ha visto acompañado de un aumento de H. influenzae en niños con OMA vacunados con VCN 7-v y cuyo alcance epidemiológico y terapéutico se desconoce en este momento11.
Diagnóstico de la otitis media aguda
Aunque en los últimos años se han producido importantes avances en el conocimiento y el diagnóstico de la OMA, el diagnóstico de esta enfermedad aún es una asignatura pendiente: "Aunque existe un acuerdo general de que los antibióticos están indicados en el tratamiento de la OMA, no existe dicho acuerdo a la hora de realizar un diagnóstico"12. Sin embargo, estudios recientes han comenzado a aclarar el tema y han evidenciado que el diagnóstico de la OMA debe pasar por considerar los signos y los síntomas más específicos, como otalgia, otorrea aguda u otoscopia, con datos inequívocos de inflamación, y suprimir otros más inespecíficos, como fiebre, rinitis, vómitos y otoscopia poco significativa13-15. Lo que ocurre es que el dolor es difícil de evaluar en los niños más pequeños, precisamente en aquéllos en que la OMA es más grave y más frecuente. No existen estudios acerca de las características de la otalgia en los lactantes, y habitualmente se señala con el término impreciso de irritabilidad o desvelo. Sin embargo, aunque no contemos con estudios científicos en este sentido, es muy característico de la otalgia del lactante el despertar brusco y el llanto desconsolado varias horas después de un sueño profundo, o la irritabilidad diurna injustificada y prolongada16, aunque estos datos no se han señalado suficientemente en la literatura médica.
Muy recientemente se ha publicado una importante guía sobre la actitud que se debe seguir en la OMA que, en gran medida, pone las bases para el establecimiento de políticas comunes, aunque deja sin resolver algunos aspectos importantes17. Si la OMA es una inflamación local, es lógico exigir para su diagnóstico los signos clásicos de dolor, edema (en este caso exudado) y enrojecimiento. Por ello, los nuevos criterios diagnósticos que propone la guía americana son: a) presentación aguda; b) presencia de exudado en la cavidad media del oído, demostrada por abombamiento timpánico, neumatoscopia patológica u otorrea, y c) signos y síntomas inflamatorios, como otalgia o evidente enrojecimiento del tímpano. Sin embargo, si se realiza una crítica razonada de esta magnífica propuesta, se encuentra que su aplicación estricta no incluye todos los casos posibles de OMA, por lo que no es una garantía de diagnóstico, ya que su traducción a la realidad origina 2 situaciones diagnósticas diferentes.
1.En una se cumplen los 3 criterios y podría llamarse OMA confirmada, como ocurre en el caso de la otorrea aguda (reciente + exudado + inflamación) o en la otalgia aguda con exudado transtimpánico demostrado (reciente + exudado + inflamación).
2.En la otra no se cumplen todos los criterios, pero hay una alta posibilidad de que el paciente presente una OMA: a) otalgia con imposibilidad de confirmación de exudado en el oído medio (presencia de cerumen no extraíble, conducto auditivo externo complicado, otoscopia de difícil interpretación), y b) confirmación de exudado en el oído medio por otoscopia, pero sin otalgia. En ausencia de dolor u otorrea no hay seguridad plena de que el exudado sea por una OMA y no una otitis media secretora, ya que el dolor es lo único que las diferencia18. Tampoco la otalgia tiene una sensibilidad absoluta de OMA14 y, además, como se ha señalado, puede ser un síntoma difícil de reconocer en el niño pequeño16.
Para obviar esta dificultad y ofrecer al pediatra una solución aceptable, proponemos que la segunda situación se denomine OMA probable, y se considere OMA confirmada cuando se acompaña de un catarro de las vías altas reciente, dada la fuerte asociación entre ambos procesos (tabla 1). En cualquier caso, el diagnóstico de OMA probable debe ser muy ponderado, y el pediatra debe valorar su propia experiencia y los riesgos de un diagnóstico equivocado. También creemos que, en caso de duda diagnóstica (OMA probable), el pediatra debe tener en cuenta la presencia de factores de mal pronóstico evolutivo (tabla 2), ya que estos factores son causas de OMA recurrente, sordera y un mayor número de intervenciones quirúrgicas19,20. Nuestra propuesta es que una OMA probable debe considerarse confirmada si existen estos factores de mal pronóstico evolutivo. El diagnóstico diferencial más importante de la OMA se recoge en la tabla 3.
Formas clínicas de otitis media aguda
Otitis media aguda recurrente
La OMA recurrente se define como la presentación de una OMA con una frecuencia mínima de un episodio cada 2 meses y una historia mínima de 6 meses de evolución; es decir, un mínimo de 3 episodios durante los últimos 6 meses21. Sin embargo, esta forma clínica incluye 2 situaciones bien diferenciadas: pacientes que presentan efusión mantenida (otitis media secretora crónica), entre los episodios de OMA, y pacientes con otoscopia normal entre los episodios de OMA. En el primer caso, los episodios de OMA se pueden considerar reagudizaciones de un continuum, conocido por algunos autores como enfermedad ótica22, y el segundo como OMA recurrente, en sentido estricto. No obstante, el diagnóstico y el seguimiento de la OMA recurrente en ambas situaciones no deben ser diferentes, y únicamente se debe valorar la implantación o no de tubos de timpanostomía en el caso de la otitis media secretora crónica y señalar que los tratamientos médicos en esta entidad presentan unos resultados escasos o nulos23.
Entre los posibles factores de riesgo de presentar una OMA recurrente se pueden citar los siguientes: bajo nivel socioeconómico, meses fríos, asistencia a guardería, sexo masculino, historia familiar de OMA recurrente, lactancia artificial, tabaquismo domiciliario e inicio temprano del primer episodio20,24.
Otitis media aguda persistente o recaída verdadera
No existe una definición universalmente aceptada para este proceso, y en la literatura médica con frecuencia se confunde con la OMA recurrente y con el fracaso terapéutico25. Desde el punto de vista microbiológico, la recaída verdadera o la persistencia se considera cuando el microorganismo causal es el mismo en el primer y en el segundo episodios, y la recurrencia cuando éstos son distintos. No obstante, esta definición es poco útil en la práctica diaria. Estudios recientes, sin embargo, ofrecen cierta ayuda al encontrar que la recaída verdadera por H. influenzae ocurre en las primeras 2 semanas, mientras que por S. pneumoniae lo hace en cualquier período, aunque predomina también el de los primeros 15 días26. Por ello, consideramos que cualquier otro episodio en el primer mes postratamiento, más aún en los primeros 15 días, debe considerarse el mismo y tratarse como tal y, en este caso, no contabilizarse como una nueva OMA a la hora del seguimiento de una OMA recurrente.
Otitis media aguda en oído con perforación previa
Se define como la presencia de supuración aguda en pacientes diagnosticados o tratados de otitis media crónica, con alteraciones en la integridad de la membrana timpánica. Se incluye en este tipo de pacientes con perforación timpánica crónica a los portadores de tubos de timpanostomía. En estos casos, es frecuente la presencia de P. aeruginosa, enterobacterias y S. aureus en el exudado purulento.
Complicaciones de la otitis media aguda
El 25 % de los pacientes con OMA u otitis media crónica presenta complicaciones en la fase preantibiótica27. Un 2 % desarrolla complicaciones intracraneales supurativas, con resultado de muerte en el 75 % de los casos. Sin embargo, a pesar del uso extendido de los antibióticos para el tratamiento de la OMA en los últimos 50 años, todavía hay secuelas y complicaciones que incluso pueden afectar a la propia vida. En los últimos años, se ha producido un incremento de las publicaciones acerca de la creciente incidencia de complicaciones intratemporales e intracraneales de la OMA28,29.
La complicación más frecuente es la mastoiditis aguda, especialmente frecuente en lactantes y niños de corta edad. Otras complicaciones son parálisis facial, como consecuencia de la compresión y el edema del nervio facial; laberintitis, por extensión de la infección desde el oído medio o desde las celdas mastoideas, y meningitis, bien por extensión directa o por una bacteriemia. La incidencia de la mastoiditis ha disminuido tras la introducción de la antibioterapia, aunque en los últimos años se ha producido un incremento30, incluso en España31. Las otras complicaciones son excepcionales en el momento actual.
El diagnóstico de mastoiditis se basa, fundamentalmente, en criterios clínicos. El cuadro se presenta con dolor, tumefacción y eritema en la región mastoidea, asociados en general con anteversión del pabellón auricular. Puede haber otorrea. La presencia de fluctuación en la zona retroauricular debe hacer sospechar la presencia de absceso subperióstico. En los casos dudosos o en aquéllos en que se sospeche la presencia de abscesos subperiósticos, debe realizarse una exploración radiológica mediante tomografía computarizada. En caso de duda, se recomienda un tratamiento intravenoso antes de llevar a cabo una tomografía computarizada, valorando la evolución posterior32.
Papel del otorrinolaringólogo en la otitis media aguda
En el diagnóstico
El otorrinolaringólogo desempeña un papel esencial en el diagnóstico de la OMA33 (tabla 4). Las dificultades de la otoscopia convencional, debida en unos casos a problemas de interpretación y en otros a cerumen en el conducto auditivo externo, pueden superarse mediante el uso de cánulas de aspiración o pinzas específicas y de microscopia otoscópica por el otorrinolaringólogo. Esto es especialmente importante en el caso de la OMA probable, cuando exista la necesidad de una confirmación diagnóstica.
En la evolución
La mala evolución de una OMA o la sospecha de complicaciones pueden hacer necesaria la consulta del otorrinolaringólogo, para valorar la necesidad de estudios de imagen o de intervención quirúrgica.
En la terapia
La actuación más específica del otorrinolaringólogo en el diagnóstico es la práctica de una timpanocentesis o una miringotomía34. La indicación de esta técnica se recoge en la tabla 5. Es aconsejable que se realice con sedación y en algunos casos con anestesia general, valorando la colocación de un tubo de timpanostomía. A continuación, se ofrecen algunas indicaciones de esta técnica en la OMA no complicada:
Recoger otras muestras para cultivo sin necesidad de nueva miringotomía.
Controlar la evolución de la OMA, por la presencia de exudado a través del tubo.
Utilizar tratamientos tópicos si la microbiología lo indica.
Prevenir recidivas de la enfermedad.
Tratamiento
Sintomático
El tratamiento de elección en todos los casos es la analgesia, y en la mayoría de los casos es suficiente el ibuprofeno o el paracetamol17. En caso de que no haya respuesta, debe plantearse la timpanocentesis.
Antibioterapia
El tratamiento antibiótico de una OMA debe ser la suma de un buen conocimiento de los antibióticos disponibles, así como de las características del paciente y del proceso patológico. Por ello, para una correcta elección de la antibioterapia es indispensable conocer la actividad y las propiedades farmacológicas de los antibióticos, así como tener en cuenta las características propias de la enfermedad. La OMA es una enfermedad con una curación espontánea del 80-90 %35. No obstante, esta curación espontánea no es igual en los diferentes patógenos causales, y es de alrededor del 80 % en M. catarrhalis, del 50 % en H. influenzae y del 16 % en S. pneumoniae36. Esta elevada tasa de curación espontánea dificulta el estudio de la enfermedad y limita los resultados de muchos ensayos científicos acerca de la antibioterapia37; además, enmascara la supuesta eficacia clínica. En algunos metaanálisis de efectividad de los antibióticos en la OMA se ha encontrado que es necesario tratar a 14-17 pacientes para que uno de ellos se beneficie del tratamiento, con la particularidad de que no se conoce en el momento cuál es el paciente favorecido38,39. Sí sabemos, sin embargo, que la curación espontánea de la enfermedad es inferior en los niños de menos de 2 años35 y que la respuesta a la antibioterapia es mejor en pacientes con OMA grave (fiebre elevada o fuerte otalgia)40. Así mismo, se sabe que los lactantes con OMA y los pacientes con historia familiar positiva son más propensos a presentar OMA de repetición y un mayor número de intervenciones quirúrgicas41,42. Por todo esto, los niños pequeños con OMA, los pacientes de cualquier edad con OMA grave y aquéllos con antecedentes familiares de secuelas óticas por OMA son los que más se benefician de la antibioterapia.
Hay numerosos antibióticos que pueden utilizarse en la OMA. Sin embargo, la elección de la antibioterapia debe estar orientada por criterios farmacodinámicos y de actividad frente a los patógenos causales. Estudios previos y recientes han demostrado que hay una correlación entre la erradicación bacteriológica y la curación clínica. Un estudio clásico encontró una tasa de respuesta clínica del 93 % en los pacientes en los que se erradicaron las cepas patógenas del oído medio en comparación con el 63 % de aquéllos en que no se erradicaron las bacterias causantes43. En otro trabajo más reciente se han confirmado estos resultados44. Por ello, es necesario utilizar antibióticos con un fuerte poder erradicador. La administración de amoxicilina oral a dosis altas (80-90 mg/kg/ día) consigue concentraciones en el oído medio que permiten erradicar neumococos sensibles, intermedios e incluso resistentes a la penicilina45-47. Por tanto, el uso empírico de amoxicilina a dosis altas conlleva una alta tasa de erradicación de neumococo. Sin embargo, la amoxicilina sola podría fracasar en la erradicación de H. influenzae productor de betalactamasas, donde las elevadas dosis de amoxicilina son insuficientes47. H. influenzae es causa de alrededor del 20 % de las OMA y tiene un 20-25 % de cepas resistentes a amoxicilina, lo que significa que, aproximadamente, una de cada 8 o 9 OMA puede estar causada por cepas resistentes a la amoxicilina48, con el consiguiente riesgo de fracaso. Sólo la amoxicilina-ácido clavulánico y las cefalosporinas orales (especialmente la cefuroxima axetilo, la cefpodoxima proxetilo y el cefnidir) presentan una buena actividad frente a H. influenzae y M. catarrhalis productores de betalactamasas, pero con una discreta actividad frente al neumococo no sensible a la penicilina49,50. No obstante, la amoxicilina a dosis altas, asociada a ácido clavulánico en relación 8:1, presenta una actividad adecuada frente a todas las cepas antes señaladas, por lo que es el antibiótico de elección en casos en que sea necesario cubrir todo el espectro. Los macrólidos tienen poca actividad en los patógenos extracelulares presentes en el oído medio y, además, las resistencias del neumococo a éstos se sitúan alrededor del 30-50 % en España7,8; por ello, su uso en la OMA debería quedar restringido a las situaciones en que no haya otra alternativa, como pacientes con reacción anafiláctica grave a los betalactámicos. La ceftriaxona no debería emplearse en el tratamiento extrahospitalario de una OMA (para el que no está autorizada), salvo en situaciones excepcionales, con indicación precisa efectuada desde un hospital y bajo estricto control especializado. Las gotas óticas con antibióticos no están indicadas nunca en la OMA habitual. Sí se puede contemplar su utilización en agudizaciones de otitis medias crónicas con perforación y en pacientes portadores de tubos de timpanostomía.
Nuestra propuesta se recoge en la tabla 6. El antibiótico de primera elección es la amoxicilina, a dosis de 80-90 mg/kg/día, repartido en 3 dosis. La amoxicilina a altas dosis asociada a ácido clavulánico, en relación 8:1, es un antibiótico de segunda elección. Su indicación exacta no está científicamente definida, aunque podría estar indicada en pacientes con fiebre elevada u otalgia importante, así como en pacientes con fracaso de un tratamiento inicial con amoxicilina17. Las guías de la Asociación Americana de Pediatría y la Asociación Americana de Médicos de Familia consideran también que la administración de amoxicilina a altas dosis con ácido clavulánico debería ser de primera elección en la OMA causada por H. influenzae o Moraxella catarrhalis con resistencia a la ampicilina17. Sin embargo, en la clínica diaria esto es imposible de saber, excepto supuestamente en el caso de un fracaso previo con amoxicilina. Sin embargo, dado que la OMA en lactantes, especialmente en menores de 6 meses y en niños con antecedentes familiares de secuelas por OMA, presenta un elevado riesgo repetición, nuestra propuesta es que la amoxicilina a altas dosis con ácido clavulánico sea el tratamiento de primera elección en estos casos (tabla 6).
Hay controversia respecto a la duración óptima del tratamiento. Al comparar 5 días de antibioterapia con 7-10 días, la pauta larga resultó discretamente más eficaz al final del tratamiento, pero a los 20-30 días ambos eran similares, de forma que habría que tratar a 44 niños durante 7-10 días, en vez de durante 5 días, para que uno se beneficiase51. Por consiguiente, la duración del tratamiento debería contemplar la edad del niño, la historia previa de OMA recurrente y la existencia o no de fracaso previo. Se aconseja una duración de 10 días en niños de corta edad, en OMA graves y recurrentes17. Si existe una recaída temprana (OMA persistente), se repetirá la misma antibioterapia, pero con una duración más prolongada en el segundo ciclo.
Tratamiento de las complicaciones
Mastoiditis aguda
Existe una importante controversia acerca del tratamiento de la mastoiditis aguda, cuya base es la antibioterapia intravenosa. Los antibióticos de elección son la amoxicilina-ácido clavulánico, 100-150 mg/kg/día, o cefotaxima, 100-150 mg/kg/día. Esta antibioterapia se modificará si se dispone de información microbiológica del exudado del oído medio o del exudado mastoideo. Sin embargo, la miringotomía temprana es más discutida, ya que algunos autores la aconsejan en todos los casos de mastoiditis aguda30, mientras que otros opinan que hay que posponerla según la respuesta a la antibioterapia. La mastoidectomía está indicada a los 2-5 días, si no hay respuesta al tratamiento antimicrobiano o en el caso de que se presenten complicaciones52. En el pasado, la mastoidectomía era una práctica habitual en casi todos los pacientes con complicaciones, aunque en los últimos años su práctica ha descendido, y actualmente los tratamientos son más conservadores.
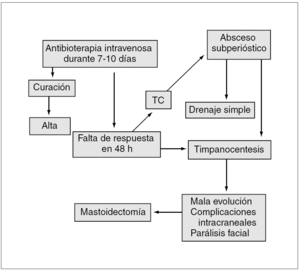
Hoy por hoy, se recomienda comenzar con antibioterapia intravenosa con o sin miringotomía. Si existe un absceso subperióstico, se realiza un drenaje simple53. La mastoidectomía se lleva a cabo si, después de un drenaje simple, el paciente no evoluciona de forma favorable en un plazo de 48 h, cuando se presenta parálisis facial o si existen complicaciones intracraneales. Este consenso recomienda el tratamiento indicado en la figura 1.
Figura 1. Algoritmo del tratamiento de la mastoiditis aguda. TC: tomografía computarizada.
Mastoiditis sin absceso subperióstico
Inicio del tratamiento con antibioterapia intravenosa con amoxicilina-ácido clavulánico por vía intravenosa o cefotaxima/ceftriaxona por vía intravenosa. Si no hay respuesta favorable en 48 h, se realizará una timpanocentesis.
Si la evolución es desfavorable o se produce absceso subperióstico, se procederá a su drenaje simple. No se precisa necesariamente la realización de una mastoidectomía, que se indicará sólo en los casos de mala evolución tras los tratamientos previamente descritos o si se presentan parálisis facial o complicaciones intracraneales.
Parálisis facial sin mastoiditis aguda
Si existe esta segunda complicación, se procederá simplemente a realizar una timpanocentesis y a instaurar antibioterapia.
Laberintitis aguda
El tratamiento consiste en antibioterapia, como en la OMA, sin precisar medidas quirúrgicas.
Complicaciones intracraneales
Se requiere la presencia de un equipo multidisciplinario compuesto por un neurocirujano, un pediatra y un otorrinolaringólogo, por lo que queda fuera de este Consenso.
Profilaxis
Existen tres grandes líneas de profilaxis: antibiótica, vacunal y quirúrgica.
La profilaxis antibiótica está indicada en la OMA recurrente (véase anteriormente) y se realiza con amoxicilina, 20 mg/kg/día, en una sola dosis, durante los meses de invierno. Sin embargo, la profilaxis reduce 0,1-0,2 episodios de OMA al mes en niños menores de 2 años54, al mismo tiempo que facilita las resistencias bacterianas, por la selección de cepas intermedias y resistentes. Por esto, su uso es muy controvertido.
La vacuna frente al neumococo tiene una prevención del 6-7 % en casos de OMA y es algo mayor en la OMA recurrente9,55. Otra buena alternativa preventiva frente a la OMA es el uso de vacunas antigripales56, especialmente si se regulariza su uso intranasal57, aunque estos datos precisan una información más exhaustiva que la que actualmente está disponible.
La alternativa quirúrgica consiste en la implantación de tubos de timpanostomía. Su actividad es sustituir la trompa de Eustaquio y facilitar la ventilación y la presión positiva de la cavidad del oído medio. La adenoidectomía exclusiva no está indicada en la OMA recurrente, aunque se valorará tras un estudio radiológico y en el caso de que se vaya a realizar una implantación de tubos58.
De acuerdo con los autores y los editores, este artículo se publica simultáneamente y de forma íntegra en las siguientes publicaciones: Anales de Pediatría (2007;66[6]) y Acta Otorrinolaringológica Española (2007;58[6]).
Documento de Consenso de la Asociación Española de Pediatría (AEP) y de la Sociedad Española de Otorrinolaringología y Patología Cérvico-Facial (SEORL-PCF).
Coordinador: Prof. A. Delgado Rubio.
Conflicto de intereses: este documento se ha realizado gracias al apoyo logístico de GlaxoSmithKline.
Correspondencia: A. Delgado Rubio.
Asociación Española de Pediatría.
C/ Aguirre, 1, bajo dcha. 28009 Madrid.
Correo electrónico: oppderua@lg.ehu.es