Los factores y patrones asociados al consumo de antibióticos en los lactantes no están claros. Nuestro objetivo fue evaluar la incidencia acumulada de consumo de antibióticos desde el nacimiento hasta los 16meses e identificar los factores asociados al consumo de antibióticos entre lactantes de 4 a 16meses.
Material y métodosSe realizó un estudio transversal en 2016 que incluyó una muestra de la población de 18.882 mujeres españolas de Galicia que habían dado a luz a un niño vivo entre el 1 de septiembre de 2015 y el 31 de agosto de 2016. Se calculó la incidencia acumulada de consumo de antibióticos a partir de los resultados de la entrevista a la madre sobre el consumo del lactante desde el nacimiento hasta los 14meses; no se estimó a los 15 y 16meses debido al reducido tamaño muestral. Para valorar las características asociadas al consumo de antibióticos se anidó en el estudio transversal un estudio de casos y controles emparejando por mes de nacimiento, un control por caso.
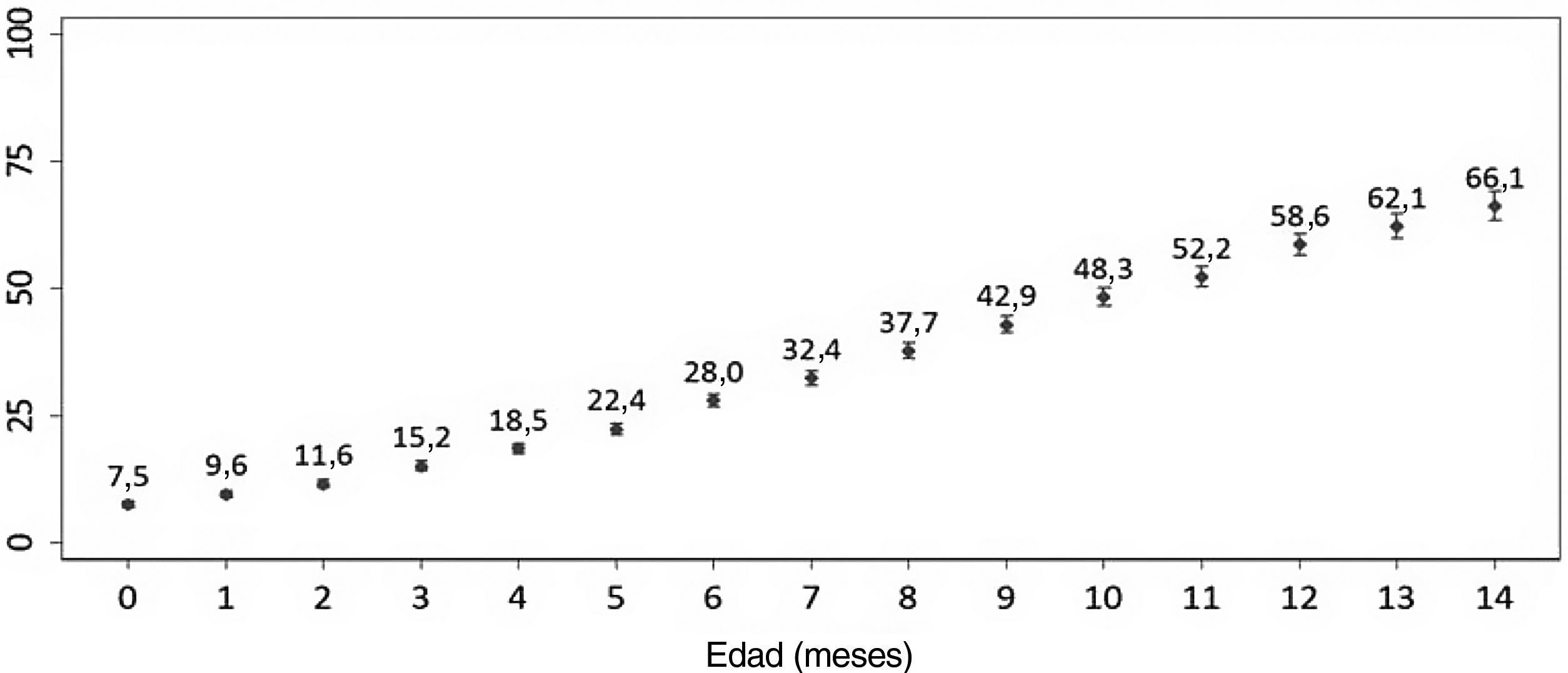
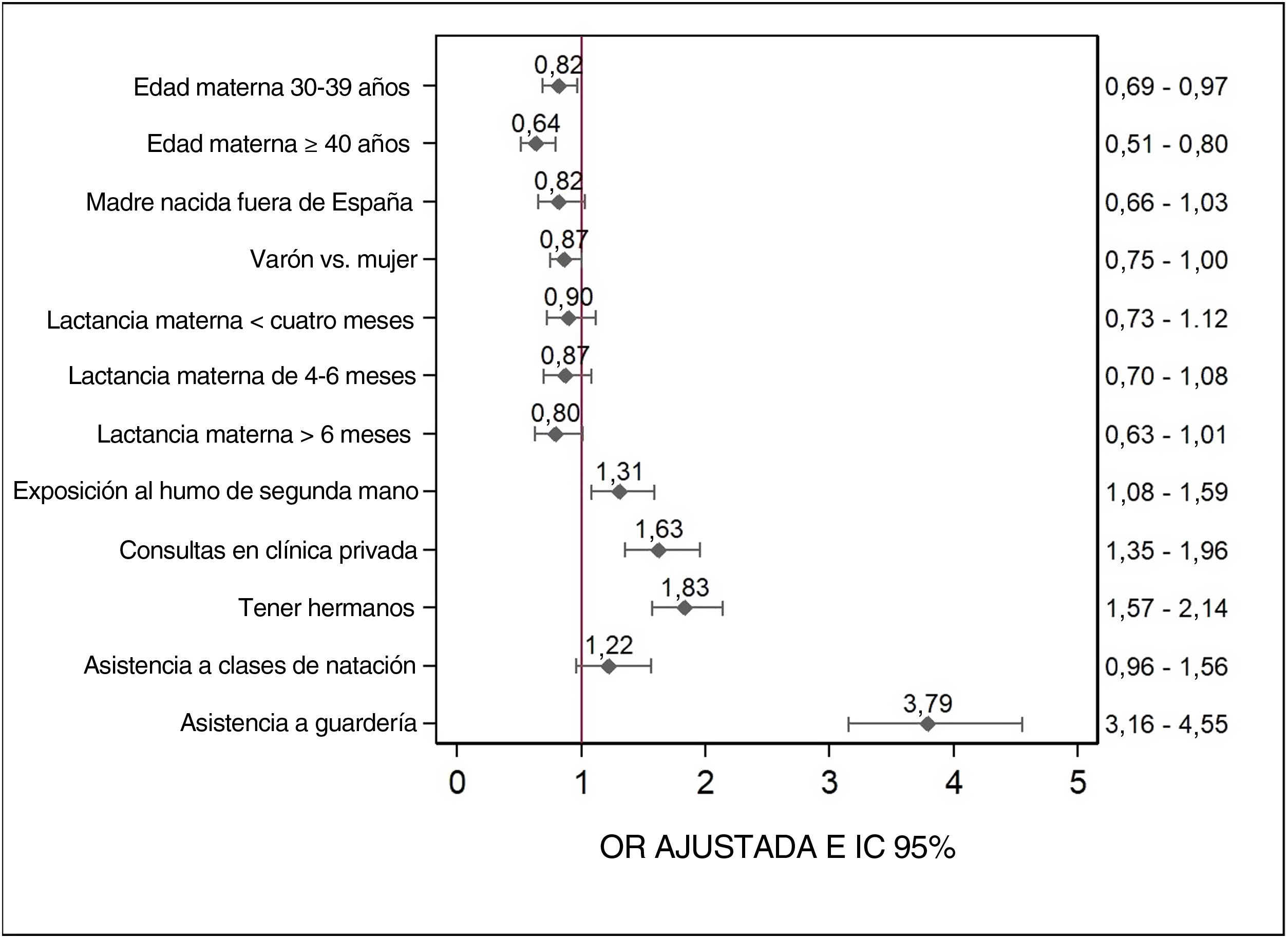
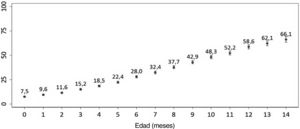
ResultadosLa incidencia acumulada de consumo de antibióticos entre los lactantes de 0 a 14meses de edad aumentó del 7,5% al 66,0%. Para el estudio de casos y controles, se obtuvo información de 1.852 casos y de 1.852 controles. La asistencia a la guardería (OR: 3,8 [IC95%: 3,2-4,6]), tener hermanos/as mayores (OR: 1,8 [IC95%: 1,6-2,1]), las consultas sanitarias en la clínica privada (OR: 1,6 [IC95%:1,4-2,0]) o haber estado expuesto al humo ambiental de tabaco (OR: 1,3 [IC95%: 1,1-1,6]) se asociaron con un mayor riesgo de consumo de antibióticos. Tener madres de entre 30 y 39años o de 40años y más en el momento del parto se asoció con un menor riesgo de consumo de antibióticos (OR: 0,8 [IC95%: 0,7-1,0] y OR: 0,6 [IC95%: 0,5-0,8], respectivamente).
ConclusionesAlgunos de los factores asociados al consumo de antibióticos en los lactantes pueden ser modificables y deben ser considerados en el desarrollo de medidas de salud pública dirigidas a reducir el consumo de antibióticos.
The factors and patterns associated with antibiotic consumption in infants are unclear. Our aim was to assess the cumulative incidence of antibiotic consumption from birth to 16 months and identify factors associated with antibiotic consumption among infants aged 4 to 16 months.
Material and methodsWe conducted a cross-sectional study in 2016 in a sample of 18,882 women from Galicia, Spain, who had given birth to a live child between September 1, 2015 and August 31, 2016. We calculated the cumulative incidence of antibiotic consumption based on maternal reports regarding the infant's consumption from birth to 14 months obtained through interviews; we did not estimate consumption at ages 15 and 16 months due to the small sample size. To assess which factors were associated with antibiotic consumption, we carried out a nested case-control study matching cases and controls for birth month on a 1:1 ratio.
ResultsThe cumulative incidence of antibiotic consumption among infants aged 0 to 14 months increased from 7.5% to 66.0%. The case-control study included data for 1,852 cases and 1,852 controls. Daycare attendance (OR: 3.8 [95%CI: 3.2-4.6]), having older siblings (OR: 1.8 [95%CI: 1.6-2.1]), health care visits to private clinics (OR: 1.6 [95%CI: 1.4-2.0]), and passive smoking (OR: 1.3 [95%CI: 1.1-1.6]) were associated with an increased probability of antibiotic consumption. Maternal age between 30-39 years or 40 years and over at the time of birth was associated with a decreased probability of antibiotic consumption (OR: 0.8 [95%CI, 0.7-1.0] and OR: 0.6 [95%CI: 0.5-0.8], respectively).
ConclusionsSome of the factors associated with antibiotic consumption in infants are modifiable and should be considered in the development of public health measures aimed at reducing antibiotic consumption.
La resistencia a los antimicrobianos, asociada al uso indiscriminado y en ocasiones inapropiado de antibióticos, constituye un problema de salud pública importante debido a su papel en la reducción de la efectividad de la antibioterapia1. Las resistencias microbianas están emergiendo a un ritmo que supera el del desarrollo de nuevos agentes antimicrobianos por la industria farmacéutica2.
Los datos sobre el consumo de antibióticos de la encuesta del Centro Europeo para la Prevención y el Control de las Enfermedades de 2021 mostraron que en España, cada día, 20 de cada 1.000 habitantes (2%) recibían tratamiento antibiótico, con lo que España se encontraba entre los siete países europeos con el mayor consumo de antimicrobianos3. Un estudio previo encontró diferencias acusadas en el uso de estos medicamentos entre los países nórdicos y los mediterráneos, e incluso una variación considerable dentro de diferentes áreas geográficas4. Globalmente, el consumo de antibacterianos de uso sistémico en el ámbito comunitario descendió entre los años 2019 y 2020 en Europa, coincidiendo con la pandemia por coronavirus 2019 (COVID-19), especialmente en Grecia, Polonia, España, Luxemburgo, Eslovaquia y Francia5.
En 2017, la segunda línea estratégica establecida en el Plan Nacional frente a la Resistencia a los Antibióticos (PRAN) priorizaba la necesidad de reducir la prescripción de antimicrobianos en España, a nivel global y particularmente en la población pediátrica y en enfermedades de etiología no bacteriana6. Los antibióticos se encuentran entre los medicamentos recetados con mayor frecuencia en la infancia, pero aproximadamente entre el 20% y el 50% de estas prescripciones tienen por fin el manejo de infecciones del tracto respiratorio superior no bacterianas, frente a las que estos medicamentos no son efectivos7-9. Por añadidura, una parte significativa de estas prescripciones son para fármacos de amplio espectro, sin tener en consideración la considerable variación estacional, las guías de práctica clínica o la evidencia científica, lo que refleja prácticas inapropiadas de prescripción antibiótica4,10,11.
Desde la introducción de las vacunas neumocócicas conjugadas polivalentes (VNC10 y VNC13) en los programas de vacunación infantil y la implementación de medidas dirigidas a restringir la prescripción de antibióticos a condiciones médicas para las que estén indicados, el consumo de antibióticos se ha reducido en la población pediátrica a nivel mundial12-14. Estudios previos en la población pediátrica española han evidenciado una reducción en el consumo de antibióticos desde el año 201615-17. Un estudio realizado en Albacete mostró que la prevalencia del consumo de antibióticos descendió entre 2017 y 2019 en niños de 0 a 14 años (38,9% versus 35,2%) y era mayor en los primero 4 años de vida17. Otro estudio encontró un consumo medio en la población pediátrica asturiana de 11,9 dosis diarias definidas por cada 1.000 habitantes y día (1,2%) en 2018, en comparación con 14,7/1.000/día (1,5%) en 201616.
El consumo de antibióticos en los primeros meses de vida puede estar influido por las actitudes de médicos y padres, factores sociales y culturales, desigualdades en la salud, las características sociodemográficas de los padres y ciertos rasgos o conductas en el niño18,19. No obstante, la evidencia disponible en la actualidad sobre los factores que pueden promover el uso de antibióticos en la vida temprana sigue siendo escasa para muchas áreas geográficas.
El objetivo del estudio fue evaluar la incidencia acumulada de consumo de antibióticos desde el nacimiento hasta los 16 meses e identificar los factores asociados al consumo de antibióticos entre lactantes de 4 a 16 meses.
Materiales y métodosÁmbito y muestra del estudioEstudio transversal realizado en 2016 en mujeres residentes en la comunidad de Galicia (noroeste de España), de 18 años de edad o mayores, que habían dado a luz a un niño vivo entre el 1 de septiembre de 2015 y el 31 de agosto de 2016 (n=18.882). El estudio se llevó a cabo en el marco del Sistema de Información sobre Conductas de Riesgo (SICRI). Se reclutó a las participantes a través del registro del Programa para la Detección Precoz de Enfermedades Endocrinas y Metabólicas en Período Neonatal. Se obtuvo una muestra representativa de madres por grupo de edad (18-24; 25-29; 30-34; 35-39; 40 y mayores) mediante muestreo aleatorizado y estratificado (tabla suplementaria 1). El tamaño muestral se calculó independientemente para cada estrato de edad para una prevalencia esperada del 50%, un error del 2% o inferior y un nivel de confianza del 95%.
El estudio incluyó a todos los niños nacidos de las madres seleccionadas durante el período establecido, con excepción de aquellos fruto de embarazos múltiples, en cuyo caso se seleccionó aleatoriamente a un solo lactante. En el momento de la encuesta los lactantes tenían de 4 a 16 meses de edad.
Fuentes de informaciónEl consumo de antibióticos se determinó en base a las respuestas de la madre en la encuesta. Se preguntó a las madres si sus hijos habían recibido antibióticos al menos en una ocasión, y, en caso afirmativo, la edad en que se utilizaron por primera vez. La información se recogió mediante entrevistas telefónicas asistidas por ordenador (computer-assisted telephone interviewing [CATI]). El software CATI proporciona al usuario (entrevistador) instrucciones preprogramadas para recoger datos específicos e introducirlos en el ordenador. A continuación, el ordenador presenta automáticamente la siguiente pregunta de acuerdo con el protocolo estructurado y dependiendo de la respuesta del entrevistado. Además, todos los datos recogidos se vuelcan a un sistema central para que puedan ser extraídos posteriormente para su análisis20. El cuestionario incluía varias preguntas sobre las conductas, las actitudes y las prácticas maternas asociadas con anterioridad al consumo de antibióticos. Se recogió la siguiente información sobre la madre en referencia a los 6 meses previos a la detección del embarazo, el período del embarazo, el momento del parto y el momento de la encuesta: grupo etario (edad en el momento del parto: 18-29, 30-39, ≥40 años), nivel educativo (básico: madres que no sabían leer o escribir, no habían recibido ningún tipo de educación, o no habían completado la educación primaria; medio: educación secundaria/bachillerato; alto: estudios universitarios), situación laboral (ocupada: trabajadora en activo o de baja; en paro/desempleada; inactiva: estudiante, ama de casa que no está buscando empleo, pensionista por jubilación/prejubilación u otras razones), país de nacimiento y consumo de tabaco durante el embarazo.
También se recogieron datos sobre las características personales y sociodemográficas del lactante desde el nacimiento hasta los 16 meses de edad: sexo asignado al nacer, tipo de parto (vaginal, cesárea), prematuridad (edad gestacional <37 semanas), pequeño para la edad gestacional (peso al nacer <percentil 10), hospitalización después del parto por razones distintas al nacimiento, estado de salud al nacer reportado por la madre (muy bueno/bueno, intermedio, mal/muy malo), duración de la lactancia materna (nunca, <4 meses, 4-6 meses, >6 meses), uso de chupete, exposición al humo de segunda mano (HSM) de la madre u otros fumadores reportada por la madre, tener hermanos mayores, asistencia a guardería, clases de natación, visitas a clínicas privadas en comparación con el uso exclusivo del sistema público para el programa de salud infantil.
Para examinar los factores asociados al consumo de antibióticos se llevó a cabo un estudio de casos y controles anidado dentro del estudio transversal, incluyendo un control por cada caso. La definición de caso fue de un lactante de 4 a 16 meses de edad que había recibido antibióticos entre estas edades de acuerdo con la información proporcionada por la madre en el momento de la encuesta. La definición de control fue la de un lactante que nunca había recibido antibióticos. Cabe reseñar que se excluyeron a los lactantes menores de 4 meses del estudio anidado debido a la inclusión en el análisis de variables como la asistencia a guardería o a clases de natación como factores que podrían influir en el consumo de antibióticos.
En los casos, se analizó la lactancia materna, el uso de chupete, la asistencia a la guardería y a clases de natación en el momento en que se utilizaron los antibióticos por primera vez. En los controles, se analizaron las mismas variables cuando el lactante tenía la misma edad que el caso pareado cuando recibió antibióticos por primera vez.
Análisis de datosSe calculó la incidencia acumulada del consumo de antibióticos para cada mes transcurrido desde el nacimiento según la edad a la que comenzó el consumo de antibióticos. El porcentaje representaba al grupo de lactantes de al menos X meses de edad que habían consumido antibióticos antes o en el mes X de vida. También se calcularon los intervalos de confianza del 95% (IC95%) para cada porcentaje. No se estimó la incidencia acumulada del consumo de antibióticos en lactantes de 15 y 16 meses debido al reducido tamaño muestral (487 y 179 lactantes, respectivamente) (tabla suplementaria 2).
En el estudio anidado de casos y controles se seleccionó un control por cada caso pareado por la fecha de nacimiento (la misma o la más próxima) para asegurar que la edad del control era lo más cercana posible a la del caso en el momento en que el caso recibió el tratamiento antibiótico. En este análisis se excluyó a los lactantes menores de 4 meses (n=79) o que hubieran recibido antibióticos antes de dicha edad (n=951), los que habían asistido a la guardería en algún momento pero luego se habían desapuntado (n=64) o para los que no nos fue posible obtener información sobre el consumo de antibióticos (n=2). Por último, se excluyó a otros 255 lactantes del análisis por la falta de disponibilidad de controles que pudieran parearse por mes de nacimiento, por lo que la muestra final incluyó un total de 1.852 casos y 1.852 controles.
Se ajustó un modelo de regresión logística condicional para establecer la asociación entre las distintas características de la madre y del lactante y el consumo de antibióticos. Se realizó un análisis bivariante para estimar odds ratios (OR) crudas del consumo de antibióticos para cada variable independiente categórica (edad materna, nivel educativo materno, madre nacida fuera de España, consumo materno de tabaco durante el embarazo, sexo del lactante, tipo de parto, prematuridad, peso bajo para la edad gestacional, hospitalización tras el nacimiento, evaluación del estado de salud al nacer, lactancia materna, uso de chupete, exposición a HSM del lactante, asistencia a guardería, clases de natación, consultas en clínicas privadas y tener hermanos). A continuación se ajustó un modelo multivariante para evaluar la influencia de todas las variables seleccionadas sobre el consumo de antibióticos. Las variables incluidas en el modelo final (grupo de edad materno, madre nacida fuera de España, sexo del lactante, lactancia materna, exposición del lactante a HSM, asistencia a guardería, natación, consultas en clínicas privadas y tener hermanos) se seleccionaron según su relevancia y la significación estadística de la asociación (valor de p inferior o cercano a 0,05). Por último, todas las variables seleccionadas tenían valores de p inferiores a 0,1. Las OR se presentan con los IC95% correspondientes.
El análisis estadístico de la muestra ponderada se realizó con el software Stata, versión 14.2.
Consideraciones éticas y consentimiento informadoLa investigación se llevó a cabo en conformidad con la Declaración de Helsinki y la legislación nacional e institucional española concerniente a la investigación clínica y la protección de datos personales. La participación en el estudio fue voluntaria y anónima, garantizando la confidencialidad absoluta. El estudio se llevó a cabo por teléfono, por lo que la decisión de participar implicó el consentimiento a dicha participación.
ResultadosUn total de 6.436 mujeres de 18 a 49 años de edad accedieron a participar en el estudio, de las que el 71,3% tenían 30 o más años de edad. Fue necesario realizar 10.771 llamadas telefónicas, de las que 6.436 llevaron a entrevistas con participantes, 1.998 a negativas a participar y el resto en contactos fallidos (números no existentes). Por lo tanto, la tasa de respuesta en el estudio, calculada como el porcentaje de mujeres entrevistadas del total que fueron contactadas, fue del 76%.
Obtuvimos información acerca de 6.436 lactantes de 0 a 16 meses de edad en el momento de la entrevista con la madre. De ellos, el 48,8% (IC95%: 47,5%-50,1%) habían recibido antibióticos al menos en una ocasión (tabla suplementaria 3). La incidencia acumulada del consumo de antibióticos en los primeros 14 meses de vida aumentó con cada mes de edad: del 7,5% a los 0 meses al 66,1% a los 14 meses de vida (fig. 1). Independientemente de la edad, la incidencia acumulada del consumo de antibióticos fue mayor en lactantes con madres menores de 40 años en comparación con aquellos cuyas madres tenían al menos 40 años de edad.
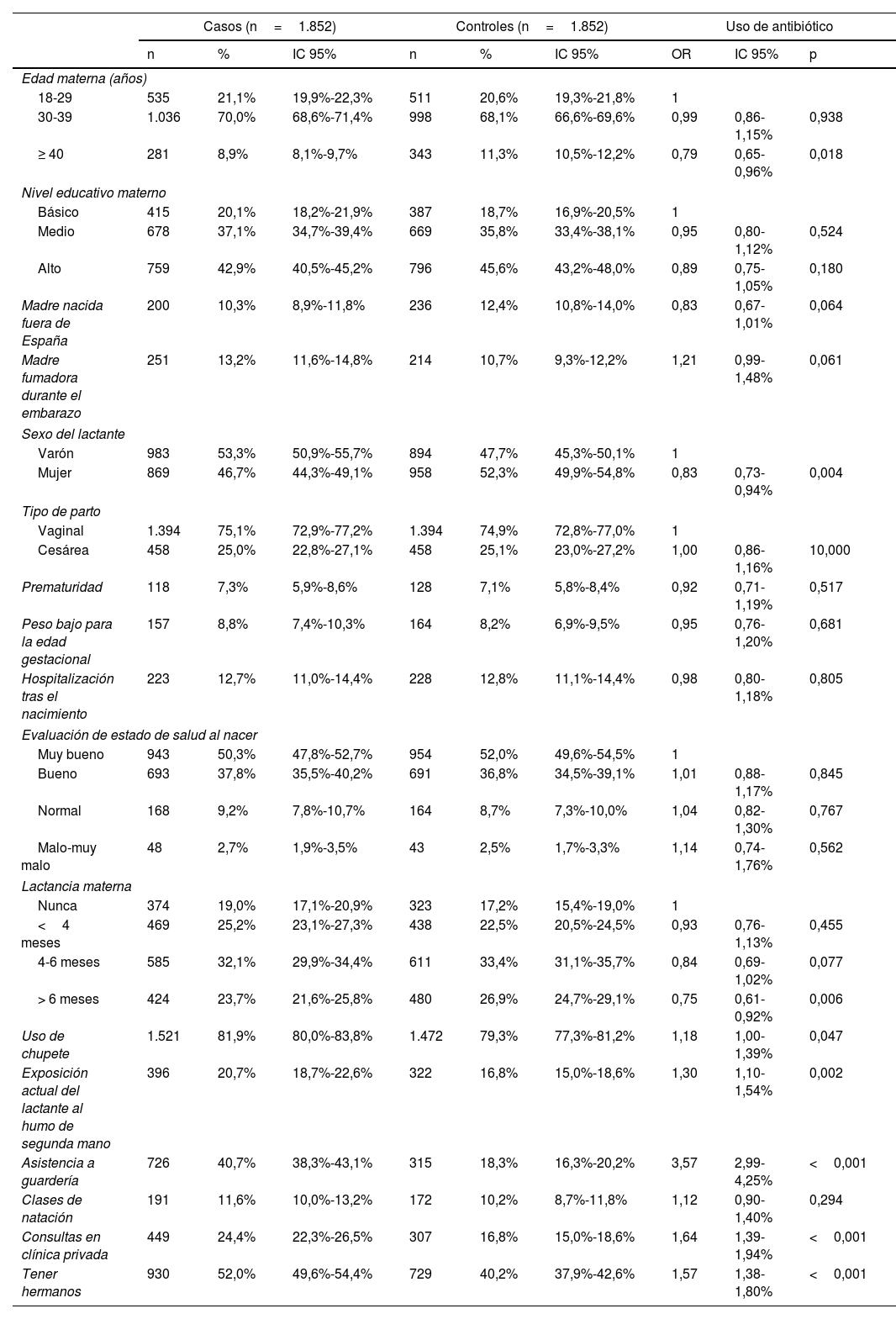
El estudio de casos y controles anidado incluyó 1.852 casos y 1.852 controles. De este total, el 22% de los lactantes eran menores de 6 meses, el 39% tenían de 6 a 8 meses, el 26% tenían de 9 a 11 meses y el 13% tenía un año o más de edad. La tabla 1 resume las características de las madres y de los lactantes en los grupos de casos y de controles, así como las OR crudas para cada una de las variables de estudio.
Odds ratios (OR) del consumo de antibióticos según las características de la madre y del lactante. Análisis bivariante
| Casos (n=1.852) | Controles (n=1.852) | Uso de antibiótico | |||||||
|---|---|---|---|---|---|---|---|---|---|
| n | % | IC 95% | n | % | IC 95% | OR | IC 95% | p | |
| Edad materna (años) | |||||||||
| 18-29 | 535 | 21,1% | 19,9%-22,3% | 511 | 20,6% | 19,3%-21,8% | 1 | ||
| 30-39 | 1.036 | 70,0% | 68,6%-71,4% | 998 | 68,1% | 66,6%-69,6% | 0,99 | 0,86-1,15% | 0,938 |
| ≥ 40 | 281 | 8,9% | 8,1%-9,7% | 343 | 11,3% | 10,5%-12,2% | 0,79 | 0,65-0,96% | 0,018 |
| Nivel educativo materno | |||||||||
| Básico | 415 | 20,1% | 18,2%-21,9% | 387 | 18,7% | 16,9%-20,5% | 1 | ||
| Medio | 678 | 37,1% | 34,7%-39,4% | 669 | 35,8% | 33,4%-38,1% | 0,95 | 0,80-1,12% | 0,524 |
| Alto | 759 | 42,9% | 40,5%-45,2% | 796 | 45,6% | 43,2%-48,0% | 0,89 | 0,75-1,05% | 0,180 |
| Madre nacida fuera de España | 200 | 10,3% | 8,9%-11,8% | 236 | 12,4% | 10,8%-14,0% | 0,83 | 0,67-1,01% | 0,064 |
| Madre fumadora durante el embarazo | 251 | 13,2% | 11,6%-14,8% | 214 | 10,7% | 9,3%-12,2% | 1,21 | 0,99-1,48% | 0,061 |
| Sexo del lactante | |||||||||
| Varón | 983 | 53,3% | 50,9%-55,7% | 894 | 47,7% | 45,3%-50,1% | 1 | ||
| Mujer | 869 | 46,7% | 44,3%-49,1% | 958 | 52,3% | 49,9%-54,8% | 0,83 | 0,73-0,94% | 0,004 |
| Tipo de parto | |||||||||
| Vaginal | 1.394 | 75,1% | 72,9%-77,2% | 1.394 | 74,9% | 72,8%-77,0% | 1 | ||
| Cesárea | 458 | 25,0% | 22,8%-27,1% | 458 | 25,1% | 23,0%-27,2% | 1,00 | 0,86-1,16% | 10,000 |
| Prematuridad | 118 | 7,3% | 5,9%-8,6% | 128 | 7,1% | 5,8%-8,4% | 0,92 | 0,71-1,19% | 0,517 |
| Peso bajo para la edad gestacional | 157 | 8,8% | 7,4%-10,3% | 164 | 8,2% | 6,9%-9,5% | 0,95 | 0,76-1,20% | 0,681 |
| Hospitalización tras el nacimiento | 223 | 12,7% | 11,0%-14,4% | 228 | 12,8% | 11,1%-14,4% | 0,98 | 0,80-1,18% | 0,805 |
| Evaluación de estado de salud al nacer | |||||||||
| Muy bueno | 943 | 50,3% | 47,8%-52,7% | 954 | 52,0% | 49,6%-54,5% | 1 | ||
| Bueno | 693 | 37,8% | 35,5%-40,2% | 691 | 36,8% | 34,5%-39,1% | 1,01 | 0,88-1,17% | 0,845 |
| Normal | 168 | 9,2% | 7,8%-10,7% | 164 | 8,7% | 7,3%-10,0% | 1,04 | 0,82-1,30% | 0,767 |
| Malo-muy malo | 48 | 2,7% | 1,9%-3,5% | 43 | 2,5% | 1,7%-3,3% | 1,14 | 0,74-1,76% | 0,562 |
| Lactancia materna | |||||||||
| Nunca | 374 | 19,0% | 17,1%-20,9% | 323 | 17,2% | 15,4%-19,0% | 1 | ||
| <4 meses | 469 | 25,2% | 23,1%-27,3% | 438 | 22,5% | 20,5%-24,5% | 0,93 | 0,76-1,13% | 0,455 |
| 4-6 meses | 585 | 32,1% | 29,9%-34,4% | 611 | 33,4% | 31,1%-35,7% | 0,84 | 0,69-1,02% | 0,077 |
| > 6 meses | 424 | 23,7% | 21,6%-25,8% | 480 | 26,9% | 24,7%-29,1% | 0,75 | 0,61-0,92% | 0,006 |
| Uso de chupete | 1.521 | 81,9% | 80,0%-83,8% | 1.472 | 79,3% | 77,3%-81,2% | 1,18 | 1,00-1,39% | 0,047 |
| Exposición actual del lactante al humo de segunda mano | 396 | 20,7% | 18,7%-22,6% | 322 | 16,8% | 15,0%-18,6% | 1,30 | 1,10-1,54% | 0,002 |
| Asistencia a guardería | 726 | 40,7% | 38,3%-43,1% | 315 | 18,3% | 16,3%-20,2% | 3,57 | 2,99-4,25% | <0,001 |
| Clases de natación | 191 | 11,6% | 10,0%-13,2% | 172 | 10,2% | 8,7%-11,8% | 1,12 | 0,90-1,40% | 0,294 |
| Consultas en clínica privada | 449 | 24,4% | 22,3%-26,5% | 307 | 16,8% | 15,0%-18,6% | 1,64 | 1,39-1,94% | <0,001 |
| Tener hermanos | 930 | 52,0% | 49,6%-54,4% | 729 | 40,2% | 37,9%-42,6% | 1,57 | 1,38-1,80% | <0,001 |
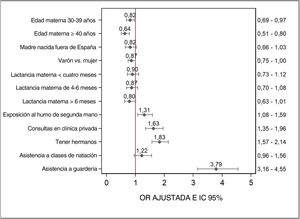
La figura 2 presenta las OR ajustadas para cada una de las variables independientes. La probabilidad del consumo de antibióticos era menor en lactantes de madres menores de 30 años. Tener hermanos mayores, la exposición al HSM, la asistencia a guardería y las consultas en centros privados para el cuidado preventivo del lactante se asociaron a una probabilidad mayor de consumo de antibióticos.
DiscusiónLos resultados del presente estudio muestran que más de la mitad de los lactantes en Galicia habían recibido antibióticos antes de los 12meses de vida. El consumo de antibióticos en el primer año de vida se asoció a una edad materna inferior a 30 años, tener hermanos mayores, exposición a HSM, asistencia a la guardería y las visitas a clínicas privadas para los cuidados preventivos del niño sano. Aunque estos factores de riesgo ya se habían identificado en estudios previos, nunca se habían analizado juntos para cuantificar la contribución individual de cada variable al riesgo total. Esta caracterización permite identificar factores modificables que pueden servir para dirigir los esfuerzos dedicados a reducir la tasa de utilización de antibióticos.
El uso inapropiado de antibióticos en la vida temprana no solo puede causar daño individual, sino que también puede contribuir a la resistencia bacteriana, que se ha convertido en una de las principales amenazas para la salud pública en el presente siglo veintiuno. Aunque entre 2011 y 2020 se observó un descenso estadísticamente significativo en la mayoría de los países occidentales gracias a diversas iniciativas para promover el uso racional de los antibióticos, especialmente en lactantes5,21-23, hay diferencias considerables entre países e incluso entre regiones, habiéndose observado diferencias de hasta 7,5 veces en el consumo pediátrico de antibióticos entre distintos países industrializados24,25. Uno de los mayores retos en la lucha contra este problema es identificar las áreas con riesgo alto y los posibles factores que contribuyen a dicho riesgo. El presente estudio muestra que el consumo de antibióticos en la comunidad de Galicia es muy superior al estimado en otros países europeos18,26. De este modo, corrobora los hallazgos de estudios anteriores que ya habían identificado a España como uno de los países de la Unión Europea con el mayor consumo de antibióticos3.
Uno de los hallazgos interesantes de nuestro estudio fue que la edad materna podría afectar a la prescripción de antibióticos. Esto está en línea con evidencia previa de una disminución en el consumo de antibióticos según aumenta la edad materna19. Aunque la causa exacta de este fenómeno no se conoce, puede que esté relacionado con el hecho de que una mayor edad materna suele asociarse con un mayor bienestar psicosocial y un nivel socioeconómico más alto. Una encuesta transversal realizada en Queensland mostró que las madres de mayor edad reportaban con mayor frecuencia haber recibido información óptima y una buena relación con el equipo de atención sanitaria27.
Los resultados de nuestro estudio también sugieren que la lactancia materna podría tener un efecto profiláctico frente al consumo de antibióticos, aunque esta asociación es incierta porque su significación estadística no se mantuvo en el modelo final. La lactancia materna se ha asociado a beneficios tanto para la madre como para el lactante en otros estudios (aumento en la resistencia a la infección, reducción en el riesgo de obesidad y de alergia)28. No obstante, aunque el efecto profiláctico de la lactancia materna frente a las infecciones del tracto digestivo se ha demostrado claramente en los países desarrollados, sus beneficios con respecto a las infecciones respiratorias son controvertidos29-31 y algunos autores han argumentado que el hecho de que no siempre es posible diferenciar entre la lactancia materna mixta y la exclusiva puede haber afectado a los resultados32.
Por el contrario, encontramos que la exposición al HSM constituye un factor de riesgo modificable para el consumo de antibióticos en el primer año de vida. Al igual que en otros estudios realizados en lactantes menores de 1año, encontramos una probabilidad mayor de consumo de antibióticos tanto en lactantes expuestos a HSM como en lactantes con padres fumadores18. La exposición al HSM es un factor de riesgo conocido de infección de las vías aéreas inferiores y del oído medio33. Los lactantes son particularmente vulnerables a los efectos adversos del HSM debido a sus características anatómicas y fisiológicas, como el menor tamaño de sus bronquios, una mayor frecuencia respiratoria y la inmadurez de su sistema inmune34. Una revisión sistemática con metaanálisis de 60 estudios que evaluó los factores de riesgo para infecciones de las vías aéreas inferiores en los primeros 2años de vida concluyó que la exposición al humo de tabaco es uno de los principales factores de riesgo para infecciones de las vías aéreas inferiores, y que el riesgo aumenta con la exposición, especialmente en niños cuyas madres son fumadoras tras el nacimiento35. En nuestro estudio, el 2% de las madres reportaron que sus lactantes menores de 1año pasaban tiempo en ambientes en los que estaban expuestos al humo de tabaco.
La asistencia a guardería y tener hermanos mayores también se identificaron como factores de riesgo para el uso de antibióticos en nuestro estudio. Estudios anteriores han sugerido que los niños que tienen hermanos mayores podrían contraer infecciones respiratorias más precozmente que los primogénitos, aunque, por otro lado, su sistema inmune también podría madurar antes, lo que les proporcionaría una resistencia mayor a la infección más adelante a lo largo de su infancia36. En cuanto al sexo, se ha propuesto que el riesgo de infección respiratoria durante la infancia, y por lo tanto del consumo de antibióticos, es mayor en los varones debido al menor calibre de sus vías respiratorias37. Nuestros resultados sugieren que la probabilidad de consumo de antibióticos podría ser menor en las lactantes de sexo femenino, si bien esta asociación es incierta porque su significación estadística no se mantuvo en el modelo final.
También encontramos que la elección de servicios de salud privados en lugar de públicos para las revisiones del lactante se asoció a un consumo más frecuente de antibióticos en el primer año de vida. En nuestro estudio, el 24,4% de los consumidores de antibióticos acudían a centros privados para sus revisiones de salud. Algunas madres prefieren llevar a sus hijos a clínicas privadas cuando están enfermos en lugar de utilizar la salud pública por el acceso más rápido y fácil (sin lista de espera), la posibilidad de elegir médico y el deseo de recibir el diagnóstico y el tratamiento con mayor celeridad38. Una revisión sistemática realizada en África también encontró una frecuencia mayor de prescripción de antibióticos en centros privados en comparación con los públicos (51,3% versus 45,0%, respectivamente)39. La probabilidad de que los médicos que trabajan en el sector privado prescriban antibióticos podría ser mayor por los potenciales conflictos de interés en relación con la industria farmacéutica, por el miedo a perder a los clientes que exigen antibióticos, por la sobrecarga de pacientes o por la falta de tiempo, que podrían interferir en una toma de decisiones correcta39-41.
Es probable que el consumo de antibióticos en la población pediátrica de Galicia haya disminuido en los últimos años, especialmente después de la pandemia por COVID-19, en base a los hallazgos de un estudio reciente realizado en España42. Esto podría deberse a la reducción de las enfermedades infecciosas respiratorias tras la adopción de medidas estrictas por el Gobierno español durante la pandemia por SARS-CoV-2 (cierre de centros educativos, negocios y actividades no esenciales, confinamiento y uso obligatorio de mascarilla); otra posible razón sería la mayor concienciación del público con respecto al uso racional de antibióticos6,42. Lamentablemente no fue posible ponderar esta tendencia en nuestro estudio por la falta de datos recientes.
Nuestro estudio tiene varias fortalezas y limitaciones. La fortaleza principal es el tamaño muestral, ya que ascendía a más de un tercio de las 19.000 mujeres que dieron a luz en Galicia durante el período bajo estudio. Otras fortalezas fueron la representatividad de la muestra y la disponibilidad de datos de natalidad para el año entero. Además, se recogieron datos sobre múltiples variables potencialmente asociadas al consumo de antibióticos que ya habían sido identificadas en distintos estudios pero que nunca se habían evaluado en conjunto. En el estudio de casos y controles, para evitar sesgos en la probabilidad de prescripción antibiótica relacionados con la estación del nacimiento, los casos y los controles se parearon por mes de nacimiento19.
La limitación más importante concierne a la naturaleza transversal del estudio y a la presencia de sesgos, dado que los datos fueron autoinformados por las madres (sesgo de información) y que las preguntas hacían referencia a exposiciones pasadas (sesgo de memoria). Somos conscientes de los motivos por los que el cálculo de incidencias acumuladas en un diseño transversal puede ser problemático. Dicho lo cual, hemos de tener en cuenta que este es el primer estudio que ha anidado un estudio de casos y controles para analizar los factores asociados al consumo de antibióticos en la población pediátrica española. Además, se recogieron datos sobre las prácticas de consumo de antibióticos desde el nacimiento hasta la edad en meses del lactante en el momento del estudio (4-16meses) durante un periodo ininterrumpido de 1año. Aunque es importante considerar la posibilidad del sesgo de memoria, el tiempo de recuerdo era relativamente corto (4-16meses). Así mismo, es poco probable que hubiera tendencias temporales que pudieran influir en la incidencia estimada en los participantes debido a la brevedad del periodo de estudio (12meses). Otra de las limitaciones del estudio es que se basaba en datos autoinformados. Esto es particularmente importante en relación con variables como el consumo de tabaco o la exposición del lactante al HSM, pues el sesgo social podría llevar a que la frecuencia reportada por las madres fuera inferior a la real. El hecho de que los datos fueran autoinformados por las madres podría entrañar un riesgo de clasificación errónea, pero no tenemos motivo para sospechar que haya un error sistemático o diferencial en la estimación del consumo de antibióticos, toda vez que las madres ignoraban la hipótesis de estudio.
Aunque el Streptococcus pneumoniae se considera una causa frecuente de infección en niños menores de 3años, no se incluyó el estado vacunal en el análisis, porque estudios previos han estimado una cobertura vacunal muy alta en la población pediátrica española tras la inclusión de la vacuna conjugada frente al neumococo en el calendario oficial de vacunación infantil7. Además, el 98,8% de las madres residentes en Galicia que participaron en el estudio reportaron que sus hijos habían recibido todas las vacunas recomendadas por el pediatra.
Reconocemos que desde el punto de vista de la vigilancia epidemiológica hubiera sido interesante recabar información sobre el fármaco prescrito, el ámbito sanitario en el que se prescribió (hospital, ámbito comunitario/centro de día) o la patología del lactante. No obstante, ese no era el objetivo de este estudio en particular.
En resumen, los resultados del presente estudio muestran que el consumo de antibióticos en el primer año de vida es considerablemente alto en los lactantes gallegos. El estudio proporciona datos valiosos sobre los factores asociados a un consumo mayor de antibióticos en los lactantes. Esta información podría ser muy útil para diseñar intervenciones y campañas dirigidas a la reducción del uso de antibióticos en muchos países, como España, en los que su consumo es considerable.
FinanciaciónEl estudio no recibió fondos específicos de agencias financiadoras públicas, privadas o sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.