Estudios recientes sugieren el contaje absoluto de linfocitos (CAL) como un nuevo indicador pronóstico en enfermedades malignas, de forma que aquellos pacientes que posean CAL superiores en determinados momentos del tratamiento, tendrán mayores posibilidades de supervivencia. En particular se ha visto la influencia de las células T y las células naturales asesinas en la inmunidad de pacientes con cáncer.
Materiales y métodosSe realizó un estudio retrospectivo en pacientes pediátricos con leucemia aguda linfoblástica tratados en el Instituto de Hematología e Inmunología entre los años 1995 y 2008 (105 pacientes), con el objetivo de evaluar la influencia del conteo absoluto de linfocitos como factor pronóstico en la sobrevida libre de enfermedad (SLE) y la sobrevida global (SG) a los 5 años.
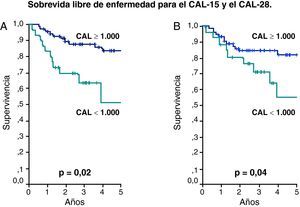
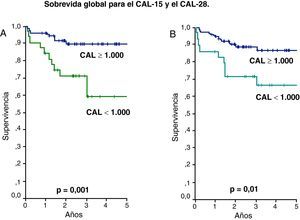
ResultadosEvolucionaron desfavorablemente 24,8% y la mediana del CAL determinado los días 15 y 28 de tratamiento de estos pacientes fue de 1.000 células/μl. Los pacientes con CAL el día 15 (CAL-15) y 28 (CAL-28) <1.000 y ≥1.000/μl, mostraron una SLE de 51% vs 83% y 55% vs 82% (p=0,02 y p=0,04), respectivamente. Igualmente la SG para aquellos con CAL-15 y CAL-28 ≥1.000/μl fue 89% y 86% contra un 59% y 66% para valores <1.000 (p=0,001 y p=0,01), respectivamente.
Al realizar el análisis multivariado junto a otros factores de riesgo como la edad, el estudio molecular, la respuesta al tratamiento y el contaje inicial de leucocitos, el CAL-15 mostró significación estadística tanto para la SLE (p=0,006) como para la SG (p=0,001).
ConclusionesEl CAL fue un predictor significativo de supervivencia y recaída. Además tuvo un comportamiento independiente como factor pronóstico.
Recent studies have suggested that the absolute lymphocyte count (ALC) may be a prognostic indicator in malignant diseases, in that those patients who have higher ALC at certain times during treatment may have a better chance of survival. The influence of T cells and natural killer cells in the immune system of the patient with cancer as a response to cancer cells is particularly noted.
Materials and MethodWe prospectively assessed the prognostic value of absolute lymphocytic count (ALC) in 105 pediatric patients with acute lymphoblastic leukemia (ALL), treated in the Cuban Immunology and Hematology Institute from 1995 to 2008. ALC was studied at days 15 (ALC-15) and 28 (ALC-28) of treatment.
ResultsIn our patients, 1000 cells/uL was the median ALC value for patients who relapsed or died. Using 1000/uL we found that ALL patients with an ALC-15 <1000 cells/μl had a 5-year relapse free survival (RFS) of 51%. In contrast, an ALC-15 >1000 cells/uL showed an excellent prognosis, with a 5-year RFS of 83% (p=0.02). Similarly in our study, an ALC-28 <1000 cells/μl predicted a 5-year overall survival (OS) of 66%, whereas an ALC-28 >1000 cells/μl predicted excellent outcome, with a 5-year OS of 86% (p=0.01). Importantly, ALC is also a strong predictor in multivariate analysis with known prognostic factors.
ALC is a simple, statistically powerful measurement for patients with de novo ALL.
ConclusionsThe results, when combined with previous studies, demonstrate that ALC is a powerful new prognostic factor for a range of malignancies.
Las leucemias agudas constituyen la enfermedad maligna más común en pediatría con una frecuencia de 30% en pacientes menores de 15 años. La leucemia linfoide aguda (LLA) es 4 veces más frecuente que la de origen mieloide y representa tres cuartas partes del total1.
A pesar de los avances terapéuticos, las leucemias aun constituyen la causa principal de muerte por enfermedades malignas. Cerca de 25% de los pacientes con LLA presentan una recaída y cuando esta ocurre en un momento precoz y con infiltración medular, la sobrevida es menor de 10%2.
Los regímenes de tratamiento en la LLA se basan en indicadores pronósticos específicos que permiten estratificar los pacientes en diferentes grupos de riesgo. Estos indicadores al inicio de la enfermedad lo conforman la edad del paciente, el conteo de leucocitos, el inmunofenotipo y las alteraciones citogenéticas como las translocaciones t(9;22) y t(4;11), hipodiploidías entre otras. Otros factores que pueden modificar los grupos de riesgo se incluyen en la respuesta al tratamiento. Entre estos tenemos la respuesta al esteroide el día 8 de tratamiento y el aspirado medular del día 15 y 33 de la inducción3–5.
Estudios recientes sugieren el contaje absoluto de linfocitos (CAL) como un nuevo indicador pronóstico en enfermedades malignas, de forma que aquellos pacientes que posean CAL superiores en determinados momentos del tratamiento, tendrán una mejor respuesta y supervivencia2,6–9. Esto se hace extensivo a pacientes trasplantados de forma autóloga por varias enfermedades malignas10–14. En particular se ha demostrado el papel de linfocitos T y de las células naturales asesinas (NA) autólogas en la supervivencia global y libre de enfermedad de pacientes con LMA, donde aquellos que poseían una actividad de las células NA elevada postratamiento, las posibilidades de recaer o fallecer eran menores15.
Teniendo en cuenta estos antecedentes nos propusimos evaluar la influencia del CAL como factor pronóstico, así como su independencia en el análisis multivariado, de pacientes tratados por LLA entre los años 1995 y 2008, en el servicio de clínica pediátrica del Instituto de Hematología e Inmunología (IHI).
Material y métodosPacientesSe analizaron los pacientes diagnosticados con LLA entre los años 1995 y 2008 tratados en el servicio de clínica pediátrica del IHI. El universo lo conformaron 123 pacientes de los cuales 18 fueron excluidos del estudio por omisión de datos en las historias clínicas, inicio del tratamiento fuera de la institución y pérdida del seguimiento.
Factores pronósticosLas variables consideradas de buen pronóstico fueron la edad entre 1 y 10 años, el conteo inicial de leucocitos menor de 20 x 109/L, el inmunofenotipo B, el estudio molecular favorable (ausencia de t(9;22), t(4;11) o hipodiploidía) y la buena respuesta al tratamiento de inducción (conteo absoluto de blastos en sangre periférica el día 8 de tratamiento menor de 1.000 células/μl y tener un aspirado medular el día 15 con menos de 25% de blastos y el día 33 con menos de 5% de blastos).
Además se determinó el valor del CAL los días 15 y 28 de la inducción; la mediana del CAL de los pacientes que fallecieron y/o recayeron fue el valor utilizado para evaluar la implicación pronóstica, este procedimiento fue similar al desarrollado por otros investigadores acerca del tema2.
Análisis y estadísticaLos datos obtenidos fueron almacenados en una base de datos con soporte en el programa Excel y el análisis estadístico se realizó con el programa SPSS, versión 11,5.
Las curvas de SG y SLE se realizaron por el método de Kaplan y Meier16. La significación estadística de la diferencia entre las curvas se analizó con la prueba de Log Rank. El análisis univariado y multivariado se realizó a través de la regresión de Cox17. El nivel de confianza se estableció en 95% para una significación estadística de <0,05.
ResultadosLa tabla 1 muestra las principales características de los pacientes estudiados, incluyendo la distribución de los factores pronósticos. La mediana de la edad fue 5 años y la SLE y SG a los 5 años resultó 84 y 85%, respectivamente. El 80% de los pacientes debutó con edades entre 1 y 10 años y solo 27% presentó conteo de leucocitos superior a 20 x 109/L. En relación a las características de las células tumorales, el origen de precursores B superó al T (75% vs 25%, respectivamente), solo 2 pacientes portaron alteraciones moleculares de mal pronóstico y morfológicamente en 95% de los pacientes, los blastos fueron L-1. La respuesta al tratamiento fue buena en 99% de los casos.
Características y distribución de los factores pronósticos en la muestra
| Características | Mediana (rango) |
| Edad al diagnóstico | 5 (1-17) |
| Contaje inicial de leucocitos (x 109/l) | 9 (9-350) |
| Sobrevida global: 5 años (IC: 95%) | 85% (79-91%) |
| Sobrevida libre de enfermedad: 5 años (IC 95%) | 84% (78-90%) |
| Factores pronósticos | N (%) |
| EDAD (años) | |
| < de 1 y > de 10 | 21 (20) |
| Entre 1 y 10 años | 84 (80) |
| CONTAJE DE LEUCOCITOS | |
| < 20 x103/L | 77 (73) |
| >20 x103/L | 28 (27) |
| ESTUDIO MOLECULAR Y CITOGENÉTICO | |
| Favorable: t(12;21), Hiperdiploidía | 30 (29) |
| Desfavorable: t(9;22) o t(4;11) o Hipodiploidías | 2 (2) |
| INMUNOFENOTIPO | |
| Favorable: Precursor B | 50 (75) |
| Desfavorable: Precursor T | 17 (25) |
| CLASIFICACIÓN FAB | |
| L-1 | 100 (95) |
| L-2 | 3 (2,9) |
| L-3 | 2 (2,1) |
| RESPUESTA AL TRATAMIENTO | |
| Buena | 99 (94) |
| Mala | 6 (6) |
La evolución de los pacientes que recayeron o fallecieron fue considerada como desfavorable y la mediana del CAL de este grupo fue 1.000/uL como se observa en la tabla 2. Este valor fue utilizado para determinar la SLE y SG a los 5 años según CAL-15 y CAL-28 menor de 1.000 células/uL contra valores mayores o iguales a esta cifra. De esta forma la SLE para el CAL-15 fue 51% vs 83%, respectivamente (p=0,02) y para el CAL-28 fue 55% vs 82%, respectivamente (p=0,04) (fig. 1). La SG tuvo un comportamiento similar con 59% vs 89% para el CAL-15 (p=0,001) y 66% vs 86% para el CAL-28 (p=0,01) según conteos <1.000 células/μl y >=a 1.000 células/μl, respectivamente (fig. 2).
Mediana del CAL según la evolución del paciente
| Evolución | Mediana del CAL-15 | Mediana del CAL-28 | Mediana general |
| Desfavorable | 954 | 1.150 | 1.000 |
| Favorable | 2.218,5 | 1.722 | 1.970 |
CAL-15: contaje absoluto de linfocitos el día 15 de tratamiento; CAL-28: contaje absoluto de linfocitos el día 28 de tratamiento.
Método de Kaplan Meier para la sobrevida libre de enfermedad (SLE).
Pacientes con CAL en los días 15 y 28 menores de 1.000 células/uL contra pacientes con CAL mayor o igual de 1.000 células/uL. (A) Para el CAL-15 la SLE de 51 vs 83%, respectivamente (p=0,002). (B) Para el CAL-28 la SLE fue de 55 vs 82%, respectivamente (p=0,04).
Método de Kaplan Meier para la sobrevida global (SG). Pacientes con CAL en los días 15 y 28 menores de 1.000 células/μl contra pacientes con CAL mayor o igual de 1.000 células/μl. (A) Para el CAL-15 la SG fue de 59 vs 89%, respectivamente (p=0,001). (B) Para el CAL-28 la SG fue de 66 vs 86%, respectivamente (p=0,01).
Los análisis univariado y multivariado se exponen en las tablas 3 y 4. Variables como el conteo de leucocitos, la respuesta al tratamiento, el estudio molecular, el CAL-15 y el CAL-28 definieron el pronóstico en la SG al realizarse el análisis univariado, sin embargo, solo el estudio molecular y el CAL-15 resultaron significativos para el análisis multivariado (p=0,000 y 0,001, respectivamente) confiriéndoles actividad independiente como factor pronóstico. Estos propios indicadores (CAL-15 y el estudio molecular) tuvieron significación estadística en el estudio multivariable para la SLE.
Análisis univariado para la sobrevida libre de enfermedad y la sobrevida global
| Variables Pronósticas | Sobrevida libre de enfermedad | Sobrevida global | ||||
| p | Wald | IC 95% | p | Wald | IC 95% | |
| Edad | 0,267 | 1,230 | 0,227–1,509 | 0,125 | 2,35 | 0,174–1,238 |
| Conteo de leucocitos | 0,824 | 0,049 | 0,327–2,438 | 0,008* | 6,97 | 0,113–0,725 |
| Respuesta al tratamiento | 0,257 | 0,285 | 0,100–1,850 | 0,032* | 4,617 | 0,074–0,887 |
| Estudio molecular | 0,000* | 16,95 | 0,036–0,308 | 0,000* | 21,03 | 0,032–0,252 |
| CAL al día 15 | 0,005* | 7,950 | 1.466–8.402 | 0,003* | 8,890 | 1,642–11,00 |
| CAL al día 28 | 0,049* | 3,743 | 0,989–5,618 | 0,022* | 5,278 | 1,172–1,172 |
| Inmunofenotipo | 0,127 | 2,328 | 0,638–36,91 | 0,878 | 0,024 | 0,304–4,023 |
CAL-15: contaje absoluto de linfocitos el día 15 de tratamiento; CAL-28: contaje absoluto de linfocitos el día 28 de tratamiento; p*=p<0,05.
Análisis multivariante para la sobrevida libre de enfermedad y la sobrevida global
| Variables Pronósticas | Sobrevida libre de enfermedad | Sobrevida global | ||||
| p | Wald | IC 95% | p | Wald | IC 95% | |
| Conteo de leucocitos | N.I | N.I | N.I | 0,875 | 0,025 | 0,135–1,286 |
| Respuesta al tratamiento | N.I | N.I | N.I | 0,989 | 0,000 | 0,183–5,325 |
| Estudio molecular | 0,000* | 19,153 | 0,027–0,251 | 0,000* | 14,362 | 0,021–0,292 |
| CAL al día 15 | 0,006* | 7,552 | 1,437–8,728 | 0,001* | 10,609 | 1,947–14,58 |
| CAL al día 28 | 0,204 | 1,613 | 0,730–4,361 | 0,300 | 1,073 | 0,617–0,786 |
CAL: contaje absoluto de linfocitos; CAL-15: contaje absoluto de linfocitos el día 15 de tratamiento; CAL-28: contaje absoluto de linfocitos el día 28 de tratamiento; N.I: no incluidas; p*=p<0,05.
Estudios recientes han planteado la implicación pronóstica del conteo absoluto de linfocitos en la supervivencia de pacientes con cáncer, de forma tal que aquellos que posean valores elevados en determinados momentos del tratamiento, tienen menores posibilidades de recaer o fallecer2,6–9,18,19.
La explicación de tales supuestos se ha atribuido a la participación de los linfocitos autólogos como primera línea de la respuesta inmune contra las células leucémicas. Específicamente se ha probado la actividad antileucémica de las células NA, que además son capaces de madurar sin la presencia del timo y por esto es posible que su recuperación sea más rápida2,20–23. Al respecto Lowdell et al han demostrado la importancia de la actividad de las células NA, en promover la remisión prolongada de pacientes con LMA. Igualmente Ohnishi al analizar subpoblaciones de linfocitos en 30 pacientes con LMA, comprobó el papel de las células T citotóxicas y las células NA en la inmunovigilancia de estos enfermos, posterior a la administración de la quimioterapia24,25.
Nuestra investigación demostró que los pacientes pediátricos tratados por LLA, con CAL menor de 1.000 células/uL durante la inducción, tenían un pronóstico de supervivencia pobre. Específicamente la SLE fue significativamente menor en los pacientes con CAL menor de 1.000 células/uL, tanto el día 15 como el 28 de tratamiento (fig. 1, A y B). De forma similar se comportó la SG, con diferencias significativas en la supervivencia para el CAL-15 y 28 (fig. 2, A y B). Estos resultados concuerdan con lo descrito por Angulo del Centro del Cáncer M D Anderson y Porrata de la Clínica Mayo2,6,10–13.
El comportamiento univariado tanto del CAL-15 como el del día 28 (tabla 3) resultó significativo en la SG junto a otros determinantes de riesgo como el estudio molecular, la respuesta al tratamiento y el conteo inicial de leucocitos; sin embargo, al evaluar la implicación pronóstica de forma independiente en el análisis multivariado (tabla 4), solo el CAL-15 y el estudio molecular resultaron significativos para la SG (p=0,001 y p<0,0001, respectivamente) y la SLE (p=0,006 y p<0,0001). De esta forma el CAL-15 se comportó como un predictor independiente de supervivencia y recaída en los pacientes estudiados. Esta conclusión es similar a la de investigaciones desarrolladas en la última década2,6 y por ende queda demostrado el papel del conteo absoluto de linfocitos en predecir una mejor o peor evolución en pacientes con LLA y así, un método sencillo y poco invasivo puede contribuir al mejor manejo de las enfermedades malignas, en particular la leucemia aguda linfoblástica del niño.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.