Los inmunoensayos múltiples permiten la valoración simultánea de diferentes variables en volúmenes reducidos de muestras biológicas. Nuestro objetivo ha sido establecer los valores normales de citocinas e insulina durante el desarrollo puberal, así como su relación con esteroides adrenales y gonadales.
Sujetos y métodosSe estudiaron las concentraciones séricas de insulina, adiponectina, resistina, leptina, factor de necrosis tumoral-α, interleucina-1β, interleucina-6 e interleucina-8 en 147 niños sanos (Tanner I, 18 varones y 18 mujeres; Tanner II, 17 varones y 13 mujeres; Tanner III y IV, 21 varones y 19 mujeres, y Tanner V, 18 varones y 23 mujeres). Además, se analizó la relación de estas variables con las concentraciones de testosterona total y libre, estradiol, proteína transportadora de los esteroides sexuales, 17-hidroxiprogesterona, sulfato de dehidroepiandrosterona, glucurónido de 3α-androstanodiol y Δ4-androstendiona.
ResultadosLas concentraciones de insulina, resistina y leptina se incrementaron durante el desarrollo, y son superiores en mujeres, mientras que las de adiponectina no se modificaron, aunque son también mayores en mujeres que en varones. Los niveles de interleucina-6 y 8 aumentaron y los de interleucina-1β disminuyeron, sin presentar dimorfismo sexual. Existe una buena correlación entre adiponectina y proteína transportadora de los esteroides sexuales, así como entre leptina y Δ4-androstendiona.
ConclusionesLas variaciones de estos parámetros parecen estar relacionadas con la función adrenal y gonadal. Por este motivo, para la utilización de los datos de normalidad de las citocinas en la infancia y adolescencia mediante inmunoensayo múltiple debe tenerse en cuenta el estadio puberal y el sexo.
Multiplexed immunoassays allow the simultaneous determination of multiple parameters from minute biological samples. Our aim was to establish the normal values of cytokines and insulin during pubertal development, as well as their relationship with adrenal and gonadal steroids.
Subjects and methodsSerum insulin, adiponectin, resistin, leptin, tumoral necrosis factor-α, interleukin-1β, interleukin-6 and interleukin-8 concentrations were studied in 147 healthy children (Tanner I, 18 males and 18 females; Tanner II, 17 males and 13 females; Tanner III and IV, 21 males and 19 females and Tanner V, 18 males and 23 females). The relationship of these parameters with free and total testosterone, estradiol, sex-hormone binding globulin, 17-hidroxyprogesterone, dehydroepiandrosterone sulphate, 3α-androstanediol glucuronide and Δ4-androstenedione levels were also analyzed.
ResultsThe concentrations of insulin, resistin and leptin increased during development, with higher levels found in females. Adiponectin levels did not change, although higher concentrations were also observed in femalesthan in males. Interleukin-6 and 8 increased and interleukin-1β levels decreased throughout development, without any evidence of sexual dimorphism. There are good correlations between adiponectin and sex-hormone binding globulin, as well as between leptin and Δ4-androstenedione.
ConclusionsChanges in these parameters seem to be related with adrenal and gonadal function. Pubertal stage and sex must be taken into consideration when these data are used.
La cuantificación de citocinas en suero es de interés diagnóstico en diferentes enfermedades, como el cáncer y la septicemia1, así como en el seguimiento de situaciones que conllevan un estado inflamatorio2, especialmente, en la obesidad. La aplicación diagnóstica de estos parámetros precisa de su normalización previa para poder establecer comparaciones con los hallazgos efectuados en condiciones patológicas. No obstante, la disponibilidad de estos datos en la literatura es escasa, especialmente durante la infancia3. Otra dificultad es el requerimiento de una gran cantidad de muestra para la determinación de estos parámetros por los inmunoensayos clásicos, ya que se encuentran en bajas concentraciones y existe un número muy elevado de analitos4.
El número de citocinas descubiertas ha aumentado de forma exponencial en los últimos años5. Entre estas, se encuentran las adipocinas como la leptina y la adiponectina, sintetizadas por el adipocito; la resistina, producida por células mononucleares presentes en el tejido adiposo, y numerosas interleucinas con acciones inflamatorias y que se encuentran estrechamente relacionadas con la sensibilidad a la acción de la insulina6. Las concentraciones séricas de muchas de estas moléculas se correlacionan con la cantidad y distribución de tejido adiposo, el cual sufre modificaciones con el desarrollo puberal7, por lo que se hace necesaria la obtención de valores de normalidad diferenciados por estadios puberales. Estos cambios en la composición corporal y en la cantidad y distribución del tejido graso corporal presentan dimorfismo sexual, modulado por diferentes esteroides adrenales y gonadales8.
En los últimos años, el desarrollo de inmunoensayos múltiples en suspensión ha permitido un avance notable en la bioquímica clínica. Actualmente, es posible emplear una combinación de la citometría de flujo con la detección por fluorescencia, mediante el inmunoensayo de formato «Multiplex»9, que permite determinar simultáneamente diferentes parámetros con mayor sensibilidad en una cantidad pequeña de muestra y en las mismas condiciones. Estas características son de gran importancia si tenemos en cuenta la dificultad que tiene la obtención de muestra en niños, particularmente en neonatos, lactantes y malnutridos, así como el gran número de parámetros que conlleva analizar un panel de citocinas, por lo que este tipo de inmunoensayos es un método de elección en pediatría.
Las variaciones de las concentraciones séricas de adipocinas e interleucinas determinadas mediante inmunoensayo múltiple y su relación con esteroides adrenales y sexuales durante la infancia y la adolescencia no están adecuadamente establecidas. Por lo tanto, los objetivos de este estudio fueron establecer, mediante inmunoensayo múltiple, los valores normales circulantes de adiponectina, resistina, leptina, insulina, factor de necrosis tumoral-α (TNF-α), interleucina-1β (IL-1β), IL-6 e IL-8 durante la infancia y la adolescencia y determinar su eventual relación con los niveles de 17-hidroxiprogesterona, sulfato de dehidroepiandrosterona (SDHEA), glucurónido de 3α-androstanodiol (GA), Δ4-androstendiona, testosterona total y libre, estradiol y la proteína transportadora de los esteroides sexuales (SHBG).
Sujetos y métodosPoblaciónSe estudiaron los niveles séricos de insulina, adiponectina, resistina, leptina, TNF-α, IL-1β, IL-6 e IL-8 en una población de 147 niños y adolescentes sanos (74 varones y 73 mujeres). Teniendo en cuenta su grado de desarrollo puberal (estadio de Tanner), se distribuyeron en 4 grupos: prepuberales (Tanner I), 18 varones y 18 mujeres; inicio de la pubertad (Tanner II), 17 varones y 13 mujeres; pubertad media (Tanner III y IV), 21 varones y 19 mujeres, y adultos jóvenes (Tanner V), 18 varones y 23 mujeres. Estos individuos sanos acudieron al servicio de endocrinología por sospecha de anomalías endocrinológicas y no se encontró ninguna alteración clínica, auxológica ni analítica, por lo que se incluyeron en el estudio, previo consentimiento de los sujetos y/o sus padres, a los que se informó del propósito de este proyecto, como requirió el comité ético del hospital, que previamente había aprobado el estudio. El índice de masa corporal (IMC) se calculó mediante el empleo de la fórmula (peso [kg]/altura [m2]). Las desviaciones estándar (DE) del IMC se obtuvieron a partir de datos de referencia para niños españoles sanos10. Los niños con un IMC que excedía la media en 1 DE o más se excluyeron de este estudio. El IMC conjunto del grupo de estudio fue –0,11±0,52 DE. Los valores de IMC en los varones y mujeres en los diferentes estadios puberales se indican en la tabla 1. No existen diferencias significativas entre los grupos estudiados (p=0,94; ANOVA).
Índice de masa corporal, expresado en desviaciones estándar a partir de los datos de referencia para niños españoles sanos10, en los varones y mujeres integrantes del estudio en los diferentes estadios puberales
| Tanner I | Tanner II | Tanner III + IV | Tanner V | |
| Varones | –0,18±0,42 | –0,23±0,47 | –0,17±0,46 | 0,02±0,55 |
| Mujeres | 0,17±0,57 | 0,01±0,49 | 0,06±0,68 | –0,12±0,34 |
Las muestras de sangre se obtuvieron entre las 8 y 10h de la mañana en ayunas, depositándose en tubo seco. Tras la centrifugación, se obtuvo el suero que se congeló a –80° C hasta la determinación de los parámetros objeto de este estudio.
Determinaciones hormonalesLos niveles séricos de insulina, adiponectina, resistina, leptina, TNF-α, IL-1β, IL-6 e IL-8 se determinaron mediante dos inmunoensayos múltiples en suspensión de Millipore (Millipore, Billerica, MA, Estados Unidos). El principio del ensayo es igual en ambos casos, empleándose una suspensión de microbolas, cada una de ellas ligada a un anticuerpo diferente y una emisión de fluorescencia específica. Se inició el ensayo incubándose 25μl de suero con esta suspensión durante 18h a 4°C. Tras este periodo, la hormona libre se eliminó por aspiración con un sistema de vacío y se añadió un segundo anticuerpo conjugado con biotina. Después de 30min de incubación a temperatura ambiente, se añadieron 50μl de estreptavidina conjugada con ficoeritrina. Tras la aspiración, se resuspendieron las microbolas y se analizaron un mínimo de 50 microbolas por parámetro en el Bio-Plex 200 Suspension System (Laboratorios Bio-Rad, Madrid). Los datos de fluorescencia obtenidos fueron clasificados y analizados mediante el programa de análisis Bio-Plex Manager Software 4.1 (Laboratorios Bio-Rad). Los coeficientes de variación intraensayo fueron inferiores al 10% en todos los casos, mientras que los coeficientes interensayo eran algo superiores a este límite para la mayoría de las variables analizadas, siendo en todo caso inferiores al 15%.
Las concentraciones séricas de 17-hidroxiprogesterona, SDHEA, testosterona total y libre y estradiol se determinaron por radioinmunoensayo (Diagnostic Products Corporation, Los Ángeles, CA, Estados Unidos) y los de SHBG mediante ensayo inmunorradiométrico del mismo laboratorio. Los niveles de GA y Δ4-androstendiona se valoraron por radioinmunoensayo (Diagnostic Systems Laboratorios, Webster, TX, Estados Unidos). En estos inmunoensayos, los coeficientes de variación intra e interensayo fueron inferiores al 10%.
Análisis estadísticoLos niveles séricos de los parámetros analizados se expresaron como media±DE. Dada la distribución normal de las variables analizadas, las diferencias entre grupos se compararon mediante ANOVA empleando la prueba de la F de Scheffé. Las comparaciones entre dos grupos se realizaron mediante la prueba de la t de Student y las correlaciones mediante regresión lineal. Se asignó un valor de p<0,05 como el nivel de significación estadística. El análisis estadístico se realizó con el paquete estadístico Stat-View 5.0.1 (SAS Institute, Inc., Cary, NC, Estados Unidos).
ResultadosValores de normalidadLos valores medios de los diferentes parámetros analizados en función del estadio puberal y sexo se muestran en las tablas 2 y 3. Los valores séricos de insulina presentaron un incremento durante el desarrollo y fueron superiores en mujeres con Tanner III y IV y en varones con Tanner V respecto a estadios posteriores. Los niveles de adiponectina no presentaron diferencias durante el desarrollo en el sexo femenino, mientras que en el sexo masculino se observó un descenso no significativo de estos a partir de la media pubertad que determinaba la existencia de un dimorfismo sexual (tabla 2).
Valores normales de insulina, adiponectina, resistina y leptina en varones y mujeres en los diferentes estadios puberales
| Estadio puberal (Tanner) | Insulina (mU/ml) | Adiponectina (μg/ml) | Resistina (ng/ml) | Leptina (ng/ml) |
| I | ||||
| Varones | 5,06±1,75 | 16,20±5,58 | 12,63±6,34 | 3,92±2,74 |
| Mujeres | 5,41±1,81 | 15,61±4,15 | 13,46±4,96 | 4,83±3,62 |
| II | ||||
| Varones | 5,77±1,57 | 16,98±4,96 | 16,92±7,10 | 4,14±2,79 |
| Mujeres | 5,40±1,55 | 16,74±12,20 | 15,95±4,30 | 5,75±2,70 |
| III + IV | ||||
| Varones | 6,67±2,75 | 13,39±6,82 | 16,81±7,02 | 6,37±2,74 |
| Mujeres | 8,36±3,12*,** | 17,98±6,24* | 16,54±3,81 | 11,42±4,17*,** |
| V | ||||
| Varones | 9,04±2,62** | 12,08±4,90 | 22,80±8,52** | 6,18±3,12 |
| Mujeres | 9,80±2,41 | 18,34±5,19* | 29,41±8,95*,** | 12,15±4,30* |
Datos expresados como media±desviación estándar de la media.
Valores normales de factor de necrosis tumoral-α (TNF-α) (pg/ml), interleucina 1-β (IL-1β) (pg/ml), IL-6 (pg/ml) e IL-8 (pg/ml) en varones y mujeres en los diferentes estadios puberales
| Estadio puberal (Tanner) | TNF-α (pg/ml) | IL-1β (pg/ml) | IL-6 (pg/ml) | IL-8 (pg/ml) |
| I | ||||
| Varones | 4,21±1,98 | 1,25±1,38 | 1,93±1,87 | 4,33±3,12 |
| Mujeres | 4,17±1,60 | 0,72±0,75 | 2,55±2,24 | 3,98±3,22 |
| II | ||||
| Varones | 3,98±1,35 | 0,64±0,41 | 2,36±1,78 | 4,86±3,71 |
| Mujeres | 4,02±1,63 | 0,69±0,13 | 2,61±2,18 | 5,05±3,22 |
| III + IV | ||||
| Varones | 4,37±1,29 | 0,62±0,33 | 1,48±0,56* | 4,85±1,41 |
| Mujeres | 4,58±1,75 | 0,81±1,17 | 1,31±0,42* | 3,88±2,96 |
| V | ||||
| Varones | 4,64±1,56 | 0,36±0,29* | 0,99±0,48 | 10,38±8,06* |
| Mujeres | 4,92±1,14 | 0,24±0,14* | 1,47±1,18 | 9,30±5,81* |
Datos expresados como media±desviación estándar de la media.
Las concentraciones de resistina fueron estables hasta el final de la pubertad, sin existir diferencias entre sexos hasta este momento. Sus valores aumentaron en el estadio Tanner V en ambos sexos, existiendo valores superiores en mujeres jóvenes. Se observó un aumento significativo de los niveles séricos de leptina en mujeres durante la pubertad media con respecto tanto al estadio puberal anterior como con varones del mismo estadio, persistiendo este dimorfismo sexual hasta la finalización del desarrollo (tabla 2).
Los niveles de TNF-α no cambiaron durante el desarrollo ni mostraron diferencias entre sexos. Las concentraciones de IL-1β e IL-8 tampoco presentaron dimorfismo sexual, aunque se observó una disminución de los niveles de IL-1β, así como un aumento de los de IL-8 en adultos jóvenes. Finalmente, aunque tampoco se encontró dimorfismo sexual en los niveles de IL-6 durante el desarrollo, sí se encontró una disminución significativa de las concentraciones de esta interleucina a partir de la pubertad media en ambos sexos (tabla 3).
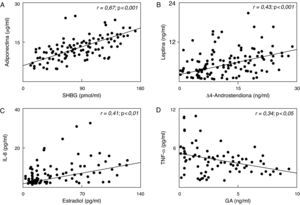
CorrelacionesEn el análisis de correlación entre citocinas y esteroides adrenales y gonadales, encontramos correlaciones positivas (p<0,001) entre adiponectina y SHBG (fig. 1A), leptina y Δ4-androstendiona (fig. 1B) e IL-8 y estradiol (fig. 1C). También existe una correlación inversa entre el TNF-α y glucurónido de androstendiol (fig. 1D). Otras correlaciones positivas (p<0,05), pero más débiles, se obtuvieron entre Δ4-androstendiona con insulina (r=0,28) y resistina (r=0,27).
DiscusiónEste estudio provee información sobre los valores normales de insulina, adipocinas e interleucinas en niños y adolescentes sanos agrupados de acuerdo con su estadio puberal y sexo; muchos de estos marcadores presentando muchos una potencial utilidad diagnóstica en pediatría. Estos resultados muestran que algunos de estos parámetros sufren una modificación de sus niveles por influencia del estadio de desarrollo y del sexo. Existen datos previos referentes a valores normales en niños mediante otras técnicas3; sin embargo, se presentan en una franja de edad estrecha11, que no permite estudiar los cambios de acuerdo con el grado de desarrollo puberal ni la posible influencia de los esteroides, mientras que los estudios publicados en sujetos controles se han realizado habitualmente en adultos12.
Se ha analizado previamente la influencia del desarrollo puberal y del sexo sobre los niveles séricos de algunas adipocinas empleando para su estudio metodología clásica13. Sin embargo, la utilización de estas técnicas para la determinación de estos parámetros requirió volúmenes grandes de suero. En este sentido, el empleo de inmunoensayos múltiples ha permitido trabajar con volúmenes de muestra menores, habiendo mostrado previamente suficiente sensibilidad para la evaluación de los cambios en las concentraciones de citocinas tras restricción calórica en niños obesos14.
El estudio mediante Multiplex corroboró el dimorfismo sexual previamente descrito11 a partir de la pubertad media, que podría deberse a un aumento de los niveles de testosterona libre secundario a la disminución de las concentraciones de SHBG durante la pubertad, que reduciría los niveles de adiponectina en varones. Esto se vería avalado por la correlación observada entre los niveles de adiponectina y los de SHBG y sería concordante con la descripción de niveles superiores de adiponectina en adultos afectados de hipogonadismo, que se reducen tras la administración de testosterona15. Al analizar los niveles circulantes de insulina, de nuevo el empleo del Multiplex permite observar diferencias a lo largo del desarrollo, con un dimorfismo sexual durante la pubertad media, que está de acuerdo con resultados previos16, en los que muestran un incremento coincidente con la pubertad en ambos sexos sin aumento de la glucemia, lo que parece indicar un incremento de la resistencia insulínica durante la pubertad. Además, cabe destacar la existencia de una relación positiva entre los niveles de insulina y Δ4-androstendiona, coincidente con el efecto inhibidor de la insulina de la aromatasa, así como la reducción de los niveles de Δ4-androstendiona tras la disminución de los niveles de insulina en el tratamiento del síndrome de ovario poliquístico17.
Existe un incremento de las concentraciones de resistina al final de la pubertad, con niveles mayores en mujeres, así como una correlación entre estos y los de Δ4-androstendiona. Esta interrelación se ha descrito previamente en el síndrome de ovario poliquístico con un aumento de ambas hormonas18,19. El incremento de los niveles de leptina durante el desarrollo7 puede estar condicionado tanto por el aumento de producción de esteroides como por las variaciones en la composición corporal durante el desarrollo. En efecto, existe un aumento de los depósitos grasos al final de la pubertad, especialmente en mujeres y en varones se ha descrito una disminución de los niveles séricos de leptina relacionada con la adquisición de masa muscular20. Asimismo, se ha descrito una asociación entre el aumento de grasa corporal, leptina y Δ4-androstendiona en niños obesos21; este dato está en concordancia con la relación observada entre la leptina y este andrógeno.
Entre las interleucinas analizadas, se observó una disminución de los valores de IL-6 durante la pubertad media. Aunque no se ha encontrado una relación inversa entre esta citocina y los esteroides sexuales, tanto la testosterona como el estradiol tienen un efecto inhibidor sobre su producción22. También hubo una disminución de los niveles sistémicos de IL-1β al final de la pubertad, que podría estar relacionada con el aumento de esteroides sexuales, ya que se ha descrito un efecto inhibidor de la testosterona sobre la expresión y liberación de esta citocina inflamatoria23.
Estos resultados muestran un aumento de los niveles de IL-8 al final de la pubertad. Así, se ha descrito que el estradiol incrementa la síntesis y secreción de la IL-824; estos hallazgos están en concordancia con la relación directa entre ambos factores observada en este estudio. Sin embargo, no se ha encontrado una relación significativa con los niveles de testosterona libre o total. Una posible explicación al incremento de IL-8 al final de la pubertad en varones es que estos aumentan su masa muscular en este periodo y el músculo esquelético libera cantidades significativas de esta citocina25, con su consiguiente elevación sérica posterior. Por el contrario, no se encuentran cambios en los niveles de TNF-α a lo largo del desarrollo. Existen datos en la literatura que apuntan a una posible modulación por testosterona, aunque existe controversia al respecto26, así como una posible relación con esteroides adrenales27. Hemos encontrado una relación inversa entre el TNF-α y el GA, y dado que los niveles del GA aumentan con el desarrollo puberal19, este incremento podría contrarrestar el efecto de otros factores moduladores de su síntesis y liberación.
En conclusión, el empleo del inmunoensayo múltiple en suspensión nos ha permitido corroborar los cambios en adipocinas a lo largo del desarrollo previamente descritos mediante el empleo de metodología clásica, así como en otras citocinas proinflamatorias. Esta técnica aporta tres ventajas fundamentales: la necesidad de volúmenes de muestra más reducidos, la eliminación de las variaciones interensayo al realizar todas las determinaciones al unísono y una mejor relación coste/utilidad cuando se determina un número elevado de analitos. Asimismo, hemos comprobado que los niveles séricos de citocinas son dependientes del estadio puberal y el sexo, por lo que hay que tener en cuenta estos factores al realizar comparaciones con pacientes pediátricos, así como la relación de estas citocinas con diferentes esteroides adrenales y gonadales. Finalmente, cabe destacar que, presumiblemente, la utilización de estos datos será de interés en el estudio de enfermedades que cursan con un estado inflamatorio, tales como la obesidad y la diabetes.
FinanciaciónEste trabajo ha sido financiado por el Fondo de Investigación Sanitaria (PI09/91060, PI10/0747 y CD07/00256 a E.B.R.), CIBERobn (CB03/06 a S.C.), Fundación de Investigación Médica Mutua Madrileña (AP2561/2008) y Fundación Endocrinología y Nutrición.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Dra. Julie A. Chowen la revisión crítica del manuscrito y a Dña. Francisca González la ayuda técnica prestada.