La diabetes MODY (maturity onset diabetes of the young) tipo 3 pertenece al grupo de las diabetes monogénicas y está causada por mutaciones en los genes del factor nuclear hepático 1 alfa (HNF1-α). Aunque en la infancia la forma más frecuente es la tipo 2, en la población general es la tipo 3. Presentamos el caso de un niño de 12 años con hiperglucemia basal y posprandrial. No se refieren síntomas cardinales de diabetes tipo 1. Existen numerosos casos de diabetes en su familia. El péptido C es 1,13 ng/ml y los marcadores de autoinmunidad pancreática son negativos. Se encuentra una mutación en el gen HNF1-α en el paciente, así como en su padre y en su hermana. Se inicia tratamiento con glibenclamida a dosis de 2,5 mg/día para disminuir el riesgo de afectación microvascular, que en la diabetes MODY tipo 3 es tan alto como en la diabetes tipo 1. De ese modo, las glucemias se normalizan y la hemoglobina glucosilada se sitúa entre el 4,9 y el 5,6%. No se observan efectos colaterales, salvo algunas hipoglucemias leves.
MODY 3 type diabetes belongs to the group of monogenic diabetes and is caused by mutations in the gene for hepatocyte nuclear factor 1-alpha (HNF1-α). Although MODY 2 type diabetes is the most frequent form of MODY diabetes in childhood, type 3 is the most frequent in the general population. We report the case of a 12 year old child with basal and post-prandrial hyperglycaemia. No cardinal symptoms of type 1 diabetes mellitus were present. There are numerous cases of diabetes in his family. C-Peptide was 1.13 ng/ml and pancreatic autoimmunity markers were negative. HNF-1α gene mutation was found in the patient as well as in his father and sister. Treatment with glibenclamide was started at a dose of 2.5 mg/day in order to reduce the risk of microvascular disease, as this as high in MODY 3 type diabetes as in type 1 diabetes mellitus. Blood glucose returned to normal and glycosylated haemoglobin was maintained between 4.9 and 5.6 %. Side-effects were not observed except some mild hypoglycaemias.
La diabetes MODY (maturity onset diabetes of the young) es un tipo de diabetes monogénica que se caracteriza por producir hiperglucemia (generalmente asintomática) en individuos menores de 25 años. Se transmite siguiendo un patrón de herencia autosómica dominante, de modo que van a existir antecedentes familiares de diabetes en, al menos, tres generaciones consecutivas. Aunque en la práctica clínica puede plantear problemas de diagnóstico diferencial con la diabetes tipo 2, la obesidad en la diabetes MODY es un hallazgo mucho menos frecuente (tabla 1).
Diagnóstico diferencial entre diabetes MODY y diabetes mellitus tipo 2
| Diabetes MODY | Diabetes tipo 2 | |
| Modo de herencia | Monogénica (autosómica dominante) | Poligénica |
| Árbol genealógico | Afectación de más de dos generaciones consecutivas | Rara vez tiene afectación multigeneracional |
| Edad de comienzo | Menores de 25 años | Mayores de 25 años la mayoría |
| Presencia de obesidad | Generalmente no | Generalmente sí |
| Existencia de síndrome metabólico | Generalmente no | Generalmente sí |
Hasta el momento se han descrito siete tipos de diabetes MODY (tabla 2), teniendo todas en común una disfunción de la célula beta pancreática que conlleva una disminución de la secreción de insulina mediada por la glucosa. Aunque en la edad pediátrica la diabetes MODY tipo 2 es la forma más común1,2, en la mayoría de las series que incluyen a pacientes adultos es la MODY tipo 3 la más frecuente, ya que ésta se diagnostica a menudo por encima de los 18 años de edad3,4.
Principales características de los distintos tipos de diabetes MODY
| MODY 1 | MODY 2 | MODY 3 | MODY 4 | MODY 5 | MODY 6 | MODY 7 | MODY X | |
| Locus genético | 20 q | 7p | 12 q | 13 q | 17 cen-q 21.3 | 2q | 9q | Desconocido |
| Gen afectado | HNF-4α | GCK | HNF-1α | ipp-- | HNF-1α | NeuroD1 | CEL | Desconocido |
| Frecuencia de familias MODY | Rara | 8-63% | 21-64% | Rara | Rara | Rara | Rara | 16-45% |
| Edad al diagnóstico | Pospuberal | Infancia | Pospuberal | Adulto joven | Pospuberal | Adulto joven | Adulto joven | Heterogéneo |
| Características asociadas | Alteraciones lipídicas | Bajo peso al nacer | Glucosuria | Agenesia pancreática (en homocigotos) | Malformaciones genito-urinarias | – | Insuficiencia pancreática exocrina | – |
| Complicaciones microvasculares | Frecuentes y graves | Raras | Frecuentes y graves | Desconocido | Frecuentes y graves | Desconocido | Desconocido | Heterogéneo |
Debido a su diferente pronóstico, la distinción entre diabetes MODY tipo 2 y 3 es esencial ya que, mientras que en la tipo 2 no suelen aparecer complicaciones microvasculares, en la MODY tipo 3 existe una incidencia similar a la de la diabetes tipo 1, por lo que requiere tratamiento con insulina o con antidiabéticos orales2,5.
CASO CLÍNICOPaciente varón de 12 años de edad que es remitido para estudio por presentar desde los meses previos episodios esporádicos de palidez, sudoración fría y sensación de mareo. En el estudio previo aportado por el paciente no se han objetivado alteraciones cardíacas ni neurológicas. Con el fin de descartar hipoglucemias como causa de los síntomas referidos, se realizan perfiles de glucemia capilar durante varios días observándose de forma habitual valores de glucemia basal mayores de 126mg/dl y valores de glucemia posprandrial superiores a 200mg/dl. En ningún momento refería síntomas cardinales de diabetes. No presentaba obesidad ni se observaban alteraciones en la exploración física. No había antecedentes personales de interés.
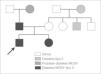
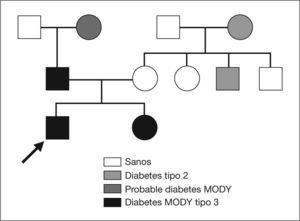
Destacaba la presencia de numerosos casos familiares de diabetes (fig. 1): por la rama materna, un tío de 33 años (con sobrepeso) y la abuela, diagnosticada desde los 45 años y en tratamiento con insulina; por la rama paterna, el padre presenta hiperglucemias detectadas desde los 38 años y la abuela desde los 50 años, ambos sin tratamiento en la actualidad. No existían antecedentes de enfermedades cardiovasculares. En el estudio inicial el hemograma y la bioquímica sanguínea eran normales. Se realizó sobrecarga oral de glucosa, obteniéndose una glucemia basal de 85mg/dl y una glucemia a las 2h de 80mg/dl. El péptido C era de 1,13ng/ml y el estudio de autoinmunidad pancreática (anticuerpos antiislotes, antidecarboxilasa del ácido glutámico y antitirosinfosfatasa) resultó negativo.
Ante la sospecha diagnóstica de una diabetes MODY, se realizó el estudio genético observándose la mutación G31D en el exón 1 del gen HNF1-α, alteración relacionada con una diabetes MODY tipo 3. Posteriormente se amplió el estudio a otros miembros de la familia, encontrándose la misma mutación en el padre y en la hermana. A la abuela paterna (posible diabetes MODY) no fue posible realizarle el estudio del gen HNF1-α. En el resto de familiares maternos afectados de diabetes no se hallaron mutaciones relacionadas con diabetes MODY.
Teniendo en cuenta las características clínicas y el pronóstico de la enfermedad se inició tratamiento con una sulfonilurea (glibenclamida), inicialmente a dosis de 1,25mg/día. En las semanas siguientes, tras comprobar la persistencia de glucemias basales alteradas sin evidencia de hipoglucemias, se aumentó la dosis a 2,5mg/día. En los controles clínicos posteriores las glucemias basales y posprandriales se encuentran dentro de la normalidad, manteniendo valores de hemoglobina glucosilada (HbA1c) entre el 4,9 y el 5,6 %. Salvo alguna hipoglucemia leve ocasional, no se han recogido hasta el momento otros efectos colaterales del tratamiento. Tampoco se han encontrado alteraciones microvasculares en la retina ni en el riñón.
DISCUSIÓNLas mutaciones en el gen HNF1-α del brazo largo del cromosoma 12 son las causantes de la diabetes MODY tipo 36, y aunque dichas mutaciones se han descrito en todos los grupos étnicos, existe un claro predominio en la población caucásica y en la japonesa7. Dicho gen codifica uno de los factores nucleares hepáticos que regulan la transcripción del gen de la insulina, y que se expresa sobre todo en el páncreas, el hígado y el riñón8.
Una característica de la diabetes MODY tipo 3 es la gran variabilidad que existe en la penetrancia y en la expresión clínica de la enfermedad, de forma que ésta aumenta progresivamente con la edad9. En este sentido, se han encontrado factores tanto genéticos como ambientales que influyen sobre la forma de presentación; así, parece que las mutaciones en los exones 1 al 6 del gen HNF1-α están relacionados con un inicio más precoz de la enfermedad, mientras que las que afectan a los exones del 7 al 10 tienen un inicio más tardío10. Asimismo, se ha sugerido que en aquellos casos en los que la mutación es transmitida por la madre, la enfermedad se expresa antes11, sobre todo si tuvo hiperglucemia durante el embarazo12. En el caso descrito, con una edad de presentación ciertamente temprana para tratarse de una diabetes MODY tipo 3, destaca la mutación en el exón 1 del gen HNF1-α, que se relacionaría con lo expuesto anteriormente, aunque por el contrario dicha mutación es transmitida por vía paterna, sin que la madre presente ninguna forma de diabetes ni sea portadora de la mutación.
Es bien conocido el alto riesgo de complicaciones microvasculares de esta forma de diabetes MODY, similar al de otras formas de diabetes donde predomina el déficit de insulina (como la diabetes tipo 1). Por esta razón debe iniciarse el tratamiento tan pronto como se haya realizado el diagnóstico para mantener valores de HbA1c inferiores al 7 %. Aunque se ha descrito en estos pacientes una alta sensibilidad a las sulfonilureas, que puede ser incluso mayor que en la diabetes tipo 2 y mantenerse durante muchos años después del diagnóstico13, conviene recordar que a lo largo de la evolución de la enfermedad la mayoría de los pacientes (hasta el 74 %)14 precisará tratamiento insulínico para conseguir un mejor control metabólico, lo cual podría estar relacionado con un descenso progresivo de la secreción de insulina por parte de la célula beta pancreática.
Las sulfonilureas son un grupo de fármacos hipoglucemiantes que ejercen su acción principal uniéndose al receptor SUR1 de los canales de potasio-ATP dependientes y cerrándolos; así, se produce un cambio en el potencial de membrana que a su vez abrirá los canales de calcio dando lugar a la exocitosis de los gránulos de insulina15. Además, las sulfonilureas parecen estimular directamente la secreción de insulina al unirse a un receptor de membrana de los gránulos que la contienen16. Como puede deducirse, este mecanismo de acción precisa la existencia de un páncreas con la capacidad secretora de insulina conservada al menos parcialmente, y por esta razón un deterioro en el control glucémico de un paciente tratado con una sulfonilurea debe hacer sospechar, entre otros motivos, una disminución en la funcionalidad pancreática. La glibenclamida es una sulfonilurea de segunda generación caracterizada por su gran potencia farmacológica, ya que alcanza concentraciones altas en los islotes pancreáticos y posee una alta afinidad por el receptor SUR1 del canal de potasio-ATP dependiente17. Su vida media larga (entre 15 y 20h) permite a nuestro paciente tomar una sola dosis al día sin los inconvenientes de otras sulfonilureas de segunda generación (glipicida y glimepirida), con un inicio de acción más rápido pero con una vida media más corta y, por tanto, con la necesidad de administrarlas en tres dosis diarias18. Por el contrario, su vida media prolongada puede dar lugar a hipoglucemias de larga duración, que fue el motivo principal por el que se comenzó con dosis bajas. En cuanto a su eficacia clínica, se ha observado en diabetes tipo 2 que la reducción de la HbA1c obtenida tras el tratamiento con glibenclamida es del 1 % respecto al placebo19.
Aunque son escasas las referencias bibliográficas sobre el uso de las sulfonilureas en la diabetes MODY tipo 3 durante la edad pediátrica1,20, parecen tener inicialmente tres ventajas respecto a la insulina: como se ha dicho anteriormente, una mayor sensibilidad terapéutica que puede mantenerse en el tiempo, una disminución en la frecuencia tanto de hipoglucemias totales (20 %/año de las sulfonilureas frente al 36,5 %/año de la insulina) como de hipoglucemias graves (0,5 %/año de las sulfonilureas frente al 2,3 %/año de la insulina)21, y por último, una mayor calidad de vida percibida por parte del paciente que, a su vez, puede condicionar un mayor cumplimiento con el tratamiento, aspecto muy importante en una enfermedad crónica y asintomática. En el caso concreto de nuestro paciente hay que destacar cómo con 2,5mg/día de glibenclamida se objetivó una normalización tanto en las glucemias basales como posprandriales, presentando tan sólo alguna hipoglucemia leve que se resolvió satisfactoriamente con la ingestión de una ración adicional de hidratos de carbono.
Incluso así, y a pesar de la evolución satisfactoria del paciente hasta el momento, no hay que olvidar el carácter progresivo de la diabetes MODY tipo 3, que probablemente provoque a medio o largo plazo la necesidad de instaurar una pauta de insulinoterapia para conseguir un control metabólico adecuado, y así disminuir la probabilidad de aparición de complicaciones microvasculares.