Numerosas publicaciones destacan la utilidad de la ecocardiografía funcional (EcoFn) en neonatología. No existen datos sobre su uso en unidades españolas.
ObjetivoEvaluar la frecuencia de uso, pacientes, indicaciones, mediciones y repercusión sobre el tratamiento de la EcoFn en un año en una unidad de cuidados intensivos neonatales (UCIN) española.
MétodosEstudio descriptivo retrospectivo en pacientes ingresados en UCIN en un año. Variables: edad gestacional, peso, diagnóstico principal, días de vida en el momento del estudio, indicación, parámetros medidos y modificaciones del tratamiento.
ResultadosSe realizaron 168 ecografías en 50 pacientes, con una media ± desviación estándar de 3,4 ± 2,83 por paciente. Las indicaciones más frecuentes fueron la valoración del ductus (58,3%) seguida de la inestabilidad hemodinámica (22,2%). El resultado de la ecografía modificó el tratamiento en 62 casos (36,9%). En un 17,4% se inició tratamiento con ibuprofeno y en un 1,2% de los casos se adelantó el fin de este. En un 10,8% de los casos, la ecografía modificó el soporte hemodinámico. Los parámetros principales valorados fueron: valoración de presencia/repercusión del ductus 100%; función miocárdica: fracción de eyección/acortamiento 23,8%, gasto ventrículo del izquierdo 24,4%, gasto del ventrículo derecho 21,4%; flujo sistémico 42,3%; signos de hipertensión pulmonar 7,7%.
ConclusionesLa EcoFn es utilizada frecuentemente en UCIN y en muchos casos guía el tratamiento de los pacientes. La valoración del ductus y de la inestabilidad hemodinámica son las indicaciones más frecuentes. Queda por determinar si el uso de la EcoFn modifica la evolución de los pacientes de UCIN.
Several publications highlight the usefulness of functional echocardiography (FnECHO) in neonatal intensive care. Data is lacking on its use in units neonatal in Spain.
ObjectivesTo evaluate frequency of use, patient characteristics, indications, measurements, and impact on patient management of FnECHO in a neonatal intensive care unit (NICU) in Spain over a 1 year period.
MethodsA retrospective study conducted in NICU patients during 1 year. Variables: gestational age, birthweight, admission criteria, days of life at examination, indication for FnECHO, parameters assessed, and treatment modifications.
Results168 echocardiographic studies were performed in 50 patients (mean 3,4. SD 2,83). The most frequent indication was patent ductus (PDA) assessment (58.3%), followed by hemodynamic instability (22.2%). The results of FnECHO modified treatment in 62 cases (36.9%). In 17.4% of them treatment with ibuprofen was initiated, and in 1.2% it was discontinued. In 10.8% of the cases, the results of FnECHO modified hemodynamic support. Echocardiographic evaluation included: assessment of presence/hemodynamic significance of PDA (100%); myocardiac function: ejection fraction/shortening fraction (EF/SF) 23.8%, left ventricular output 24.4%, right ventricular output 21.4%, systemic blood flow 42.3%; and signs of pulmonary hypertension 7.7%.
ConclusionsFnECHO is frequently used in the NICU, and in many cases it guides treatment. PDA assessment and hemodynamic instability are the most frequent indications. It still needs to be elucidated if the use of FnECHO modifies patient outcomes.
El recién nacido puede presentar diversos problemas hemodinámicos cuya fisiopatología es variable y compleja, y con una expresividad clínica en ocasiones limitada. Esta vulnerabilidad cardiocirculatoria puede explicarse por una serie de peculiaridades del recién nacido, como son la inmadurez del miocardio, la presencia de cortocircuitos fetales, las variaciones en las resistencias vasculares pulmonares y sistémicas y, en definitiva, los complejos cambios hemodinámicos que se producen durante el proceso de transición a la vida extrauterina1. A pesar de la progresiva tecnificación de los cuidados intensivos neonatales, la monitorización hemodinámica del recién nacido se sigue basando en la mayoría de los casos en la valoración de la frecuencia cardiaca, la presión arterial (PA), el equilibrio ácido-base, el gasto urinario o en parámetros clínicos escasamente validados como el relleno capilar2,3. Todos ellos, a pesar de aportar información importante y útil para el clínico, no son más que variables relacionadas, en mayor o menor medida, con la perfusión tisular, que es, en último término, el parámetro hemodinámico fundamental y para el que desafortunadamente no existe un sistema de monitorización adecuado4. La medición de la saturación regional de oxígeno mediante espectroscopía cercana al infrarrojo ofrece un potencial interesante en este sentido, aunque todavía son necesarios más estudios para confirmarlo5. Numerosas publicaciones ponen de manifiesto la mala correlación existente entre la PA y el gasto cardiaco3,6. Así, con frecuencia se pueden encontrar situaciones con PA normal y flujo sistémico disminuido. Esto puede tener implicaciones importantes, ya que se ha relacionado el bajo flujo sistémico en las primeras horas de vida con el desarrollo de lesión cerebral y alteración del desarrollo cognitivo en el recién nacido prematuro7,8. Por otro lado, no existe una definición clara de normalidad de la PA en el recién nacido9,10. El uso de la valoración clínica, junto con los parámetros clásicos antes referidos para tratar de dilucidar la fisiopatología subyacente a un problema hemodinámico, puede conducir a conclusiones erróneas y a la adopción de estrategias terapéuticas equivocadas y, en ocasiones, perjudiciales11. La ecocardiografía realizada por el cardiólogo en el recién nacido tiene habitualmente como fin la valoración estructural y de la función. Generalmente, se trata de un único estudio para descartar malformación congénita o disfunción miocárdica global y, el momento de su realización, depende, en muchos casos, de la disponibilidad del cardiólogo. Esto puede ser un factor importante en unidades con limitado acceso a un cardiólogo o en situaciones en las que son necesarias reevaluaciones frecuentes para valorar la respuesta al tratamiento o los cambios hemodinámicos durante la transición fetal-neonatal. Hay que tener en cuenta que estos cambios son, en ocasiones, muy diferentes de lo esperado, basándose en la valoración clínica clásica2. La EcoFn o ecografía cardiaca realizada por el neonatólogo, según la terminología sugerida por algunos autores2,12, se está introduciendo progresivamente en las unidades de cuidados intensivos neonatales (UCIN) como una herramienta de apoyo en la toma de decisiones terapéuticas. La EcoFn se suma a la valoración de los datos clínicos habituales, en un intento de individualizar los tratamientos en función de la fisiopatología concreta en cada situación. Debe considerarse una prolongación de la exploración física y no un sustituto de la valoración por parte del cardiólogo, ya que su función es diferente y complementaria. La EcoFn permite al neonatólogo obtener información hemodinámica en el momento en que esta es necesaria y de forma seriada según las necesidades clínicas2. Los objetivos de la EcoFn son la valoración de la función miocárdica, del flujo sistémico y pulmonar, y de los cortocircuitos intra y extracardiacos, así como la perfusión tisular13. La EcoFn se utiliza habitualmente para la valoración hemodinámica durante la transición fetal-neonatal en el prematuro extremo, para el estudio de la presencia y repercusión del DAP, para determinar la fisiopatología en situaciones de inestabilidad hemodinámica, o en recién nacidos con altos requerimientos de oxígeno2,13-15. La EcoFn ha demostrado tener un impacto positivo en el manejo del paciente adulto16-18. Sin embargo, no existen todavía evidencias claras de que el uso de la EcoFn se asocie a una mejoría en la evolución de los recién nacidos en la UCIN, a pesar de que algunas publicaciones indican un efecto positivo en este sentido11,19,20. Hasta donde sabemos, no existen publicaciones sobre la utilización de la EcoFn en UCIN en España. Presentamos los resultados de un estudio retrospectivo sobre el uso de la EcoFn en una UCIN española a lo largo de un año, en el que se analizan la frecuencia de uso, el tipo de pacientes, las indicaciones y su efecto sobre el manejo clínico de los pacientes.
MétodosSe trata de un estudio retrospectivo sobre todas las EcoFn realizadas en recién nacidos ingresados en la UCIN del Hospital Clínico San Carlos de Madrid entre enero del 2012 y enero del 2013. Esta unidad, con capacidad para 11 camas, atiende todo tipo de afección neonatal con la excepción de cirugía cardiaca y ECMO (nivel iiib). Todos los estudios fueron realizados, a petición de los médicos responsables de los pacientes, por 2 neonatólogos de la unidad (AC y LA) con más de 5 años de experiencia en EcoFn. Las valoraciones y las mediciones ecográficas se hicieron mediante un procedimiento estandarizado previamente descrito y recogido en la tabla 113,21. Las indicaciones, así como los resultados de los estudios, se anotaron en la historia clínica de cada paciente. Una vez realizado el estudio, los resultados se discutieron con los médicos responsables para decidir la actitud terapéutica.
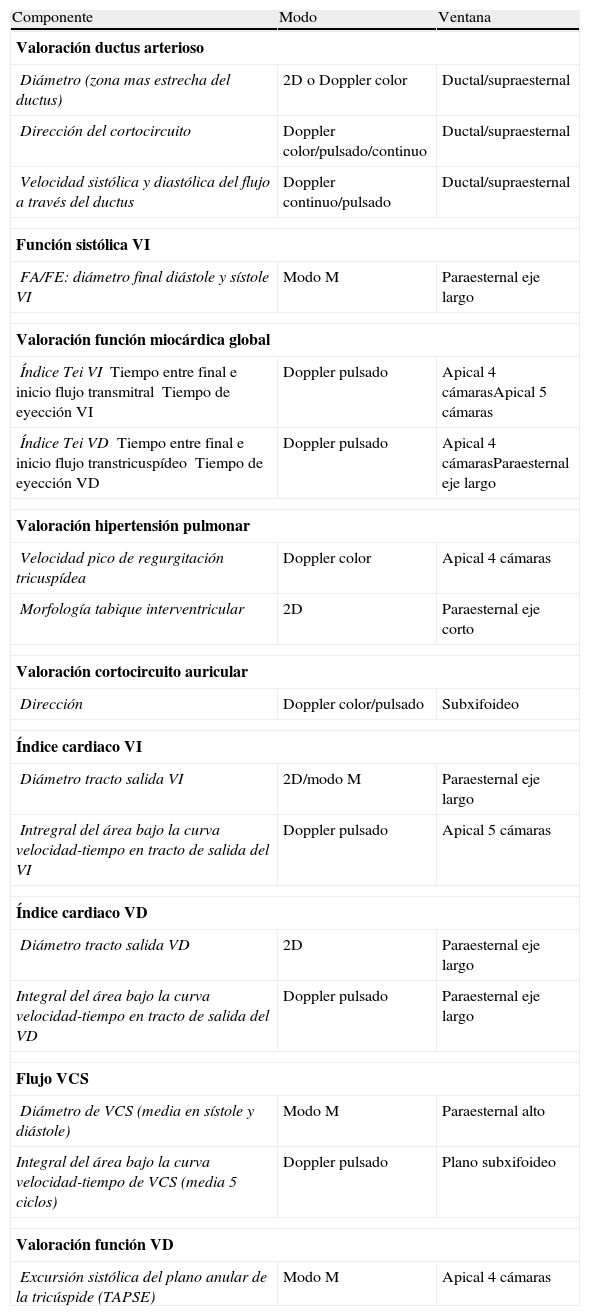
Componentes de la ecografía funcional y técnica utilizada para su valoración
| Componente | Modo | Ventana |
| Valoración ductus arterioso | ||
| Diámetro (zona mas estrecha del ductus) | 2D o Doppler color | Ductal/supraesternal |
| Dirección del cortocircuito | Doppler color/pulsado/continuo | Ductal/supraesternal |
| Velocidad sistólica y diastólica del flujo a través del ductus | Doppler continuo/pulsado | Ductal/supraesternal |
| Función sistólica VI | ||
| FA/FE: diámetro final diástole y sístole VI | Modo M | Paraesternal eje largo |
| Valoración función miocárdica global | ||
| Índice Tei VITiempo entre final e inicio flujo transmitralTiempo de eyección VI | Doppler pulsado | Apical 4 cámarasApical 5 cámaras |
| Índice Tei VDTiempo entre final e inicio flujo transtricuspídeoTiempo de eyección VD | Doppler pulsado | Apical 4 cámarasParaesternal eje largo |
| Valoración hipertensión pulmonar | ||
| Velocidad pico de regurgitación tricuspídea | Doppler color | Apical 4 cámaras |
| Morfología tabique interventricular | 2D | Paraesternal eje corto |
| Valoración cortocircuito auricular | ||
| Dirección | Doppler color/pulsado | Subxifoideo |
| Índice cardiaco VI | ||
| Diámetro tracto salida VI | 2D/modo M | Paraesternal eje largo |
| Intregral del área bajo la curva velocidad-tiempo en tracto de salida del VI | Doppler pulsado | Apical 5 cámaras |
| Índice cardiaco VD | ||
| Diámetro tracto salida VD | 2D | Paraesternal eje largo |
| Integral del área bajo la curva velocidad-tiempo en tracto de salida del VD | Doppler pulsado | Paraesternal eje largo |
| Flujo VCS | ||
| Diámetro de VCS (media en sístole y diástole) | Modo M | Paraesternal alto |
| Integral del área bajo la curva velocidad-tiempo de VCS (media 5 ciclos) | Doppler pulsado | Plano subxifoideo |
| Valoración función VD | ||
| Excursión sistólica del plano anular de la tricúspide (TAPSE) | Modo M | Apical 4 cámaras |
FA: fracción acortamiento; FE: fracción eyección; VCS: vena cava superior; VI: ventrículo izquierdo; VD: ventrículo derecho; VM: válvula mitral.
Se recogieron los siguientes datos generales de los pacientes: edad gestacional (EG), peso al nacimiento y diagnóstico principal. Se registraron los siguientes datos clínicos en el momento de realización de las ecografías: frecuencia cardiaca, presencia de soplo, presencia de gradiente de saturación de oxígeno de la hemoglobina pre y posductal>10%, PA media (PAM; mmHg), niveles de lactato (mmol/L) y presencia de oliguria (diuresis<1ml/kg/h).
Datos sobre los estudios ecográficos: días de vida en el momento del estudio, número de ecografías por paciente y motivo de la indicación. Se registró si los resultados de la EcoFn modificaron el tratamiento y, en caso afirmativo, qué modificaciones se hicieron. No se tuvieron en cuenta en el análisis aquellas ecografías realizadas en recién nacidos con sospecha o confirmación de la presencia de una cardiopatía congénita (CC) estructural. A pesar de que en nuestra unidad la EcoFn realizada por el neonatólogo también se utiliza para la localización de catéteres, la valoración de la presencia de derrames y su evacuación, el estudio del flujo cerebral o para el cribado de lesiones intracraneales groseras, en el presente estudio solo se tuvieron en cuenta los estudios ecocardiográficos.
Parámetros ecográficos estudiados: todos los estudios fueron realizados con un ecógrafo portátil con sonda neonatal (Titan. SonoSite Inc. Bothell, EE. UU., Sonda C11/5-8 MHz): 1) valoración de presencia/repercusión del ductus: presencia, diámetro en Doppler color o 2 dimensiones, dirección del cortocircuito, relación aurícula izquierda/aorta, patrón del Doppler ductal; 2) valoración de la función miocárdica y el flujo sistémico: fracción de eyección (FE), fracción de acortamiento (FA), gasto cardiaco del ventrículo izquierdo (VI) y derecho (VD), flujo en la vena cava superior, y 3) valoración de la hipertensión pulmonar: cálculo de la presión en la arteria pulmonar en presencia de regurgitación tricuspídea, rectificación del tabique interventricular, dirección de los cortocircuitos.
Las variables cualitativas se describen con frecuencias absolutas y relativas, y las cuantitativas con media ± desviación estándar o mediana y rango intercuartílico en caso de asimetría o elevada dispersión. Para el análisis se utilizó el paquete estadístico STATA 12.
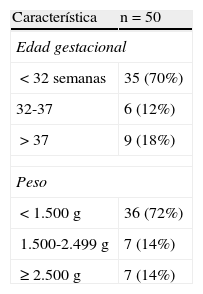
ResultadosSe realizaron un total de 168 ecografías en 50 pacientes durante el periodo señalado, con una media de 3,4 ± 2,83 estudios por paciente. En la tabla 2, se recogen las características generales de los pacientes. La media de EG de los pacientes fue 31,3 semanas, con un rango entre 24,1 y 40,2 semanas, y con una media de peso de 1.549g (590-4.160g). El 70% de los pacientes fueron menores de 32 semanas. El diagnóstico más frecuente al ingreso fue la prematuridad extrema y/o extremado bajo peso al nacimiento (38%). Un 34% de los pacientes fueron de muy bajo peso al nacimiento (1.000-1.500g). Otros diagnósticos principales (tabla 3) al ingreso fueron encefalopatía hipóxico-isquémica para tratamiento con hipotermia (10%), el síndrome de distrés respiratorio (8%), pulmón húmedo (6%) y otros (4%). La mediana de días de vida en el momento de la realización de las ecografías fue de 6 días (2-19 días). La valoración de la presencia y la repercusión del ductus fue el motivo más frecuente de realización del estudio, representando el 58,3% de las indicaciones (tabla 4). Otras indicaciones fueron la inestabilidad hemodinámica (22,2%), la presencia de soplo (8,3%), la valoración de la transición fetal-neonatal en el prematuro extremo (5,4%), el cribado de hipertensión pulmonar (1,2%) y otras (4,8%). Respecto al impacto de la realización de la EcoFn sobre el manejo de los pacientes, el resultado de la ecografía modificó el tratamiento en 62 casos (36,9%). Las modificaciones más frecuentes tuvieron que ver con el manejo del ductus. Así, en un 17,4% de los pacientes, se inició tratamiento con ibuprofeno tras la realización de la ecografía, mientras que en un 1,2% de los casos se adelantó el fin del tratamiento con este fármaco. En cuanto al soporte hemodinámico, en un 10,8% de los casos se modificó el tratamiento en función de los resultados del estudio mediante expansión de líquidos (0,6%), inicio o modificación de tratamiento inotrópico (9.6%) o inicio de hidrocortisona (0,6%). Un 36,3% de las ecografías se realizaron en pacientes sin soplo, hipotensión arterial, oliguria, aumento de lactato, taquicardia o presencia de gradiente de saturación. El 21,7% de estas ecografías correspondieron a estudios rutinarios en los primeros días de vida. Otro 78,3% de ellas fueron estudios de seguimiento en pacientes evaluados previamente. Cabe destacar que en 14 de estos casos (22,9%) el resultado de la ecografía conllevó una modificación en el tratamiento. Doce de ellos correspondían a DAP. Con respecto a los parámetros ecográficos valorados, se estudiaron la presencia y la repercusión del DAP en el 100% de los casos. En cuanto a la función miocárdica, se determinaron la FE/FA en el 23,8%, el gasto del VI en el 24,4% y gasto del VD en el 21,4%, y se midió el flujo sistémico en la vena cava superior en el 42,3% de los estudios. Se valoró la presencia de hipertensión pulmonar en el 7,7% de los casos.
Diagnósticos principales de los pacientes estudiados
| Diagnóstico principal | n=50 |
| Prematuridad extrema/extremado bajo peso | 19 (38%) |
| Síndrome de distrés respiratorio | 4 (8%) |
| Encefalopatía hipóxico isquémica/hipotermia terapéutica | 5 (10%) |
| Prematuridad moderada/muy bajo peso | 17 (34%) |
| Pulmón húmedo | 3 (6%) |
| Otras | 2 (4%) |
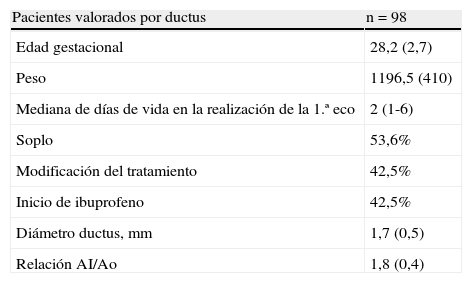
Características de los pacientes valorados por ductus arterioso persistente
| Pacientes valorados por ductus | n=98 |
| Edad gestacional | 28,2 (2,7) |
| Peso | 1196,5 (410) |
| Mediana de días de vida en la realización de la 1.ª eco | 2 (1-6) |
| Soplo | 53,6% |
| Modificación del tratamiento | 42,5% |
| Inicio de ibuprofeno | 42,5% |
| Diámetro ductus, mm | 1,7 (0,5) |
| Relación AI/Ao | 1,8 (0,4) |
Los resultados se muestran como medias ± desviación estándar, porcentaje o mediana con rango intercuartílico.
AI: aurícula izquierda; Ao: aorta.
En este estudio, se describe por primera vez el uso de la EcoFn en una UCIN española. A la vista de los resultados expuestos, se deduce que es una técnica que se utiliza con frecuencia y que modifica el tratamiento en un porcentaje significativo de casos. Un estudio similar muy reciente, describe la realización de 512 EcoFn en una unidad canadiense en un periodo de 3 años y medio, lo cual supone una media de 142 estudios anuales, cifra muy cercana a la que describimos en nuestro trabajo, con 168 estudios en 12 meses22. En ese estudio, además, se observa un uso creciente de esta técnica a lo largo del periodo analizado, lo cual confirma el interés por la EcoFn y su progresiva implantación y aceptación en las unidades de neonatología. Un trabajo basado en encuestas refleja que, ya hace 10 años, un 41% de las unidades de referencia de neonatología en Australia y Nueva Zelanda contaban con, al menos, un neonatólogo capaz de realizar EcoFn23. Esta cifra se había incrementado por encima del 90% en el año 201024. Los primeros usos de la EcoFn por parte del neonatólogo en nuestra unidad comenzaron hace 10 años, fundamentalmente para el diagnóstico y el seguimiento de la respuesta al tratamiento del DAP. Desde entonces, se ha incrementado el espectro de indicaciones hasta convertirse prácticamente en una prolongación de la exploración física ante problemas hemodinámicos. La indicación más frecuente de realización de la EcoFn, según nuestro estudio, es el diagnóstico o seguimiento del DAP (58,3% de los casos), seguida de la valoración fisiopatológica ante inestabilidad hemodinámica (22,2%). Esto coincide con los datos del estudio de El-Kuffash et al., en el que la valoración del DAP supone el 51% de las indicaciones de EcoFn22.
En nuestro estudio, encontramos que en un 36,9% de los casos los resultados de la EcoFn dan lugar a una modificación en el tratamiento de los pacientes, cifra muy similar a la descrita por El-Kuffash, con un 41% de modificaciones en el tratamiento tras la ecografía22. Publicaciones en adultos señalan que la EcoFn modifica el manejo de los pacientes hasta en el 51,4% de los casos25. Esto apoya el concepto de la EcoFn como una herramienta de ayuda en la toma de decisiones terapéuticas. En el presente trabajo, un 36,3% de las ecografías se realizaron en pacientes sin alteración de otros parámetros hemodinámicos habituales ni soplo, a pesar de lo cual en un 22,9% de ellos se hicieron modificaciones del tratamiento tras el estudio. Casi todos estos casos se trataban de DAP. Se ha señalado previamente que los hallazgos encontrados en la EcoFn en ocasiones no son predecibles teniendo en cuenta la valoración clínica clásica2. Así, El-Kuffash et al. encuentran un 6% de diagnósticos inesperados22. De hecho, estudios realizados en unidades de cuidados intensivos de adultos mediante EcoFn encuentran alteraciones graves no conocidas previamente hasta en un 7,5% de los casos16. En nuestro trabajo, observamos una media de 3,4 ecografías por paciente, con realización de hasta 16 ecografías por paciente en algunos casos. Esto demuestra el papel de la EcoFn para el seguimiento de los pacientes o la monitorización de la respuesta al tratamiento2.
A pesar de la clara utilidad práctica de esta técnica, todavía no existen evidencias firmes que demuestren un impacto positivo de la utilización de la EcoFn en la UCIN sobre el pronóstico de los pacientes. Sin embargo, varios estudios retrospectivos11,19,20 y algún ensayo clínico26 indican un beneficio en este sentido. En cualquier caso, son necesarios más estudios aleatorizados para aclarar si la EcoFn modifica la evolución de los pacientes.
La controversia fundamental sobre la utilización de la ecocardiografía por parte del neonatólogo radica en el potencial peligro de pasar por alto una CC o bien la realización de un diagnóstico erróneo y el inicio de un tratamiento incorrecto en un paciente con CC. Sin embargo, a pesar de que este peligro es real, en la mayoría de los casos la presencia de una cardiopatía estructural es detectada en la EcoFn, aunque el diagnóstico completo no se haga27,28. En cualquier caso, es necesaria una estrecha colaboración entre cardiólogos y neonatólogos, debiéndose siempre solicitar una valoración cardiológica completa en caso de duda. Con el fin de disminuir estos riesgos, resulta esencial una formación adecuada en EcoFn2. A pesar de ello, y de la enorme difusión internacional de esta técnica, lamentablemente, en muchos países, entre ellos España, no existe ningún programa estandarizado de formación. En estos casos, con frecuencia la formación depende del propio interesado, se hace en paralelo a la labor asistencial y se fundamenta en la colaboración desinteresada de cardiólogos y/o en soportes específicos disponibles como libros de texto o CD29. Este ha sido el proceso que se ha seguido en nuestra unidad para la formación en EcoFn y no habría sido posible sin la colaboración de cardiólogos pediátricos que entendieron la utilización de esta técnica por parte del neonatólogo como una herramienta de ayuda en la clínica y no como una intrusión en su campo. Otros países como Australia y Nueva Zelanda, EE. UU., Canadá y algunos países europeos cuentan con programas de formación acreditados13,29,30. La Sociedad Americana de Ecocardiografía, en colaboración con la Asociación Europea de Ecocardiografía y la Asociación Europea de Cardiólogos Pediátricos, ha publicado recientemente unas recomendaciones específicas para neonatólogos sobre la formación en EcoFn, en las que se recoge con detalle cómo debería ser el proceso de formación y de acreditación13, recomendaciones que han sido matizadas por otros autores12. Dado el creciente interés por esta técnica y su enorme difusión, sería deseable el desarrollo de programas de formación y acreditación en España auspiciados por la Sociedad Española de Neonatología.
Este estudio presenta numerosas limitaciones, fundamentalmente derivadas de su naturaleza retrospectiva. Así, la realización de cambios en el tratamiento tras la EcoFn dependía, en último término, de la decisión del médico a cargo del paciente y no solo de los datos aportados por la ecografía, lo cual podría haber modificado significativamente, en un sentido u otro, la percepción de la influencia de esta técnica sobre el manejo de los recién nacidos. Por otro lado, este estudio no puede aclarar si las decisiones terapéuticas hubieran sido diferentes en ausencia de la EcoFn ni si estas fueron adecuadas. Además, la propia decisión de realizar o no la ecografía dependía también del médico responsable y no de un protocolo de estudio, lo cual podría modificar notablemente la frecuencia de uso observada. Por otro lado, la ventana ecográfica puede ser una limitación importante en algunos pacientes16. A pesar de que en el presente estudio no se recogió sistemáticamente este dato, las limitaciones técnicas derivadas de ello y del uso de una sonda de 5-8 MHz en lugar de una de mayor frecuencia (8-12 MHz), como sería recomendable, podrían haber influido en la calidad de algunos estudios13.
ConclusionesLa EcoFn es una herramienta útil que se utiliza con frecuencia en la UCIN y que aporta información complementaria que ayuda al clínico en la toma de decisiones terapéuticas. Su uso se está extendiendo en las unidades de neonatología, aunque son necesarios ensayos clínicos que determinen su impacto sobre el pronóstico de los pacientes. Hace falta la diseminación de programas de formación y acreditación estructurados conforme a las recomendaciones existentes para asegurar un uso correcto y seguro de esta técnica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses. Efectivamente, no existe conflicto de intereses.