Sr. Editor:
La enteropatía pierde-proteínas en la infancia constituye un proceso diferente al del adulto. Es una situación transitoria y benigna, con clínica, pronóstico y etiología diferentes, denominándose gastropatía hipertrófica pierde-proteínas infantil (GHPP).
Se presenta hacia los 5 años de vida como cuadro sutil: fiebre, dolor abdominal, vómitos y edema. Suele autolimitarse y su cronificación es excepcional. Se desconoce la etiopatogenia; parece que una variedad de factores (infecciones, fármacos e inmunes) probablemente influidos por una predisposición genética, inducen una serie de cambios histológicos en la mucosa gástrica. La edad parece ser importante en la sensibilidad y respuesta a los diferentes agentes implicados en la etiología y determinante en la evolución. Presentamos un caso de GHPP secundario a infección por citomegalovirus (CMV).
Paciente de 2 años con náuseas y vómitos (2-3 diarios) de 10 días y edema facial de 5-6 días de evolución. No refiere otra sintomatología, ni antecedentes personales o familiares de interés. A la exploración física destaca: edema palpebral superior bilateral, abdomen discretamente distendido, depresible y no doloroso. No se palpan masas, megalias ni signos de ascitis. Presenta tumefacción blanda, con fóvea, del tercio inferior de extremidades inferiores, sin signos de inflamación articular y con movilidad conservada. La presión arterial es normal. La analítica evidencia hipoproteinemia de 35 g/l e hipoalbuminemia de 18 g/l, siendo el resto de parámetros, incluida función hepatorrenal normales. No presenta proteinuria. La a1-antitripsina en heces es 5,17 mg/g heces (valor referencia < 0,62). Las serologías para CMV, IgM e IgG son positivas. La carga viral es indetectable en sangre y positiva en orina. Los marcadores de celiaquía son negativos. La ecografía abdominal muestra pliegues gástricos hipertróficos y la endoscopia engrosamiento del antro y cuerpo gástrico, con pliegues edematosos, eritematosos y friables, recubiertos de material blanquecino adherido. Se biopsia y determina la PCR a CMV que resulta positiva, siendo la PCR a herpes y la detección de H. pylori (test de urea rápida y cultivo) negativos. La histología evidencia cambios celulares en cuerpo gástrico sugestivos de infección por CMV, con inclusiones intranucleares eosinófilas rodeadas por un halo claro. En mucosa esofágica se describen cambios similares.
El paciente ingresa con tratamiento de soporte, determinándose niveles de proteínas y albúmina de control, requiriendo 2 dosis de seroalbúmina. Evoluciona favorablemente, desapareciendo los síntomas a los 15 días y normalizando los parámetros analíticos a los 17 días del inicio del cuadro.
La enfermedad de Ménétrier es una entidad caracterizada por hiperplasia de la superficie mucosas del cuerpo y fundus gástrico. Cursa con secreción excesiva de moco, produciendo hipoproteinemia con hipoalbuminemia.
Afecta típicamente a adultos. En niños, por tener un curso diferente, se utiliza el término gastropatía pierde-proteínas infantil (GHPP). Se han descrito más de 50 casos, entre 7 meses y 18 años, de los que 4 corresponden a lactantes entre 0-2 meses1.
Su etiología es desconocida; se ha asociado a diversos estímulos: dietéticos, tóxicos, inmunológicos, autoinmunes, reacciones alérgicas y factores infecciosos2, en especial el CMV. Otros relacionados son: Helicobacter pylori, Campylobacter jejunii, herpes, parainfluenzae, micoplasma, Treponema pallidum, histoplasma, etc.
El primer caso asociado a CMV fue descrito en 1971 por Lachman.3 Desde entonces un tercio de los casos publicados de GHPP se han relacionado con este agente, por infección primaria, reactivación o reinfección por una cepa diferente4. Se establece una relación causal entre enfermedad e infección con la positividad de la PCR CMV e histología compatible, como en nuestro caso.
El papel del H. pylori está poco claro. Se han publicado 4 trabajos en niños5-6 donde la curación se inicia tras el tratamiento erradicador, sin poder confirmar si dicha curación es consecuencia de la erradicación del germen o forma parte del curso natural. Inmunológicamente se comprobó una correlación entre niveles elevados de TGF-α en la mucosa gástrica de paciente con GHPP. Su unión al receptor del factor de crecimiento epidérmico provocaría una hiperplasia de la mucosa gástrica7-9. Mencionar la relación del tratamiento con PGE1 e inducción de hiperplasia antral en neonatos10.
La duración media de la enfermedad es de 2 a 18 semanas. Su presentación abarca un amplio espectro clínico; fiebre, dolor abdominal, astenia, anorexia, pérdida de peso, edemas, vómitos y diarreas. Todos presentan hipoproteinemia e hipoalbuminemia. Un 10 % hemorragia gastrointestinal y anemia y un 61 % eosinofilia. En todos se descarta la enfermedad hepática y renal.
La pérdida proteica se demuestra cuantificando la α1-antitripsina en heces o el test de Gordon. Se confirma determinando el contenido proteico en el jugo gástrico o por gammagrafía abdominal con albúmina-99mTc11. El estudio radiológico baritado tiene poco valor y la ecografía abdominal ayuda en la evolución, observando pliegues gástricos engrosados en forma de "circunvoluciones cerebrales". La endoscopia con biopsia de todo el grosor de la mucosa da el diagnóstico definitivo, mostrando hiperplasia foveolar con infiltrado linfocítico. Se han descrito casos pediátricos con mínima inflamación, propios del adulto. Precisamente los casos con anatomía patológica atípica, son los que presentan un curso clínico más tórpido con posibilidad de malignización12. En éstos podría estar justificado realizar un seguimiento estricto hasta la edad adulta.
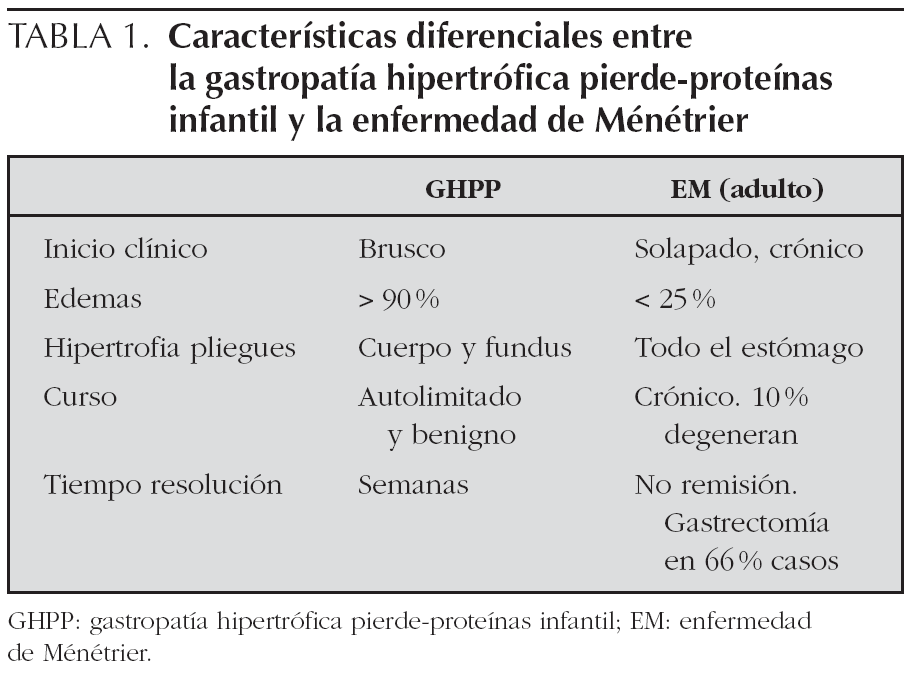
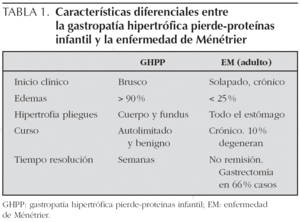
En la tabla 1 se reflejan las diferencias entre la GHPP y la enfermedad de Ménétrier del adulto.
El tratamiento es sintomático y de sostén. Se discute el papel de la terapia erradicadora de H. pylori; si bien en adultos su erradicación ha mejorado la sintomatología, en los casos pediátricos está poco documentado.
Como conclusión, la GHPP se sospechará en niños que, bruscamente, presenten edemas e hipoproteinemia y tras descartar enfermedad hepática o renal. El caso presentado apoya el papel del CMV en la etiología de la GHPP, aunque se serían necesarios más estudios. En niños esta entidad constituye un proceso transitorio y benigno, si bien en los casos con curso tórpido e histología atípica, podría plantearse realizar un seguimiento estricto por la posibilidad de malignización.