Los objetivos de este estudio son evaluar la efectividad del etanercept en el tratamiento de la artritis idiopática juvenil (AIJ) a los 6 meses de tratamiento; valorar la contribución de diferentes variables clinicodemográficas en la respuesta, y valorar la seguridad y la tolerancia del fármaco a los 12 meses de tratamiento.
Pacientes y métodosEstudio retrospectivo de pacientes con AIJ que iniciaron tratamiento con etanercept entre enero de 2000 y junio de 2007. Se recogieron variables clinicodemográficas y variables analíticas antes de iniciar el tratamiento y después de 3 y 6 meses. La mejoría se evaluó mediante el índice ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’]).
ResultadosSe estudiaron 71 pacientes. A los 6 meses del tratamiento el 77,5% de los pacientes alcanzó el ACRped30, el 70,4% de los pacientes alcanzó el ACRped50 y el 54,9% de los pacientes alcanzó el ACRped70. La mejoría según el ACRped30 fue del 100% en pacientes con artritis y entesitis, del 91,7% en pacientes con oligoartritis y del 66,7% en pacientes con poliartritis. Aunque 19 de los niños con AIJ sistémica (63%) alcanzaron una mejoría ACRped30, la fiebre no se controló en ninguno de los 12 pacientes que la presentaban y todos (menos 3 pacientes) precisaron aumento de corticoides sistémicos o infiltraciones articulares con esteroides. El etanercept se suspendió en 12 pacientes, en 6 durante el primer semestre y en 6 durante el segundo semestre. En 7 pacientes el tratamiento se interrumpió por ineficacia o recaída. El 80,3% de los pacientes continuaba el tratamiento a los 12 meses.
ConclusionesEl etanercept es un tratamiento efectivo y bien tolerado en niños con AIJ, aunque es de escasa utilidad en pacientes con formas sistémicas.
1) To assess the efficacy of etanercept in the treatment of children with juvenile idiopathic arthritis (JIA) after 6 months of therapy, 2) to analyse the contribution of several variables in the clinical response, and 3) to evaluate the safety and tolerability of the drug after 12 months of treatment.
Patients and methodsRetrospective chart review of JIA patients started on etanercept from January 2000 to June 2007. The same clinical and laboratory variables were considered at the beginning of therapy and 3 and 6 months afterwards. Clinical improvement was defined according to the American College of Rheumatology pediatric criteria for improvement (ACRped).
ResultsSeventy one patients were studied. The ACRpedi30 response was achieved by 77.5% of the children, the ACRped50 by 70.4% and the ACRped70 by 54.9%. All children (100%) with enthesitis related arthritis, 91.7% of those with oligoarthritis and 66.7% with polyarthritis responded according to ACRped30. An ACRped30 response was achieved by 63% of children with systemic JIA (n=19), although fever was not controlled in any of the 12 children who presented it, and all but three required an increase in the steroid dose (oral and/or intra-articular). Etanercept was discontinued in 12 patients, 6 during the first six months and six between 7 and 12 months of therapy. In 7 of them because of inefficacy or flare-up. At the 12 month follow-up 80.3% of the patients continued taking etanercept.
ConclusionEtanercept is effective for the treatment of JIA and is well tolerated by children. Its clinical usefulness is very much reduced in children with systemic JIA.
La artritis idiopática juvenil (AIJ) es la enfermedad reumática crónica más frecuente en la infancia, con una incidencia de 10 cada 100.000 pacientes y una prevalencia de 80 cada 100.000 pacientes en menores de 16 años1,2. Esta enfermedad ha recibido distintos nombres (artritis crónica juvenil, en Europa; artritis reumatoide juvenil, en América) al utilizar diferentes criterios diagnósticos, lo que dificulta la interpretación de los estudios. Por esto, la Liga Internacional contra el Reumatismo impulsó la emisión de unos criterios diagnósticos que definieran formas clínicas homogéneas de la enfermedad, a la que denominaron AIJ3, y que se pudieran aplicar mundialmente. Estos criterios se aceptaron internacionalmente y se validaron en España4.
Las formas clínicas de AIJ se definen en función del número de articulaciones afectadas, la presencia de síntomas sistémicos, de entesitis (puntos de inserción de tendones en el hueso), etc. Se denomina oligoartritis si hay afectación de 4 o menos articulaciones durante los primeros 6 meses de la enfermedad; si ya ha pasado este tiempo y se «extiende» a más de 4 articulaciones, se denomina oligoartritis extendida y, si no se «extiende», oligoartritis persistente. Se denomina poliartritis si en los primeros meses afecta a 5 o más articulaciones pudiendo ser factor reumatoide (FR) positivo o negativo. La presencia de síntomas sistémicos (fiebre, exantema, serositis, órgano o adenomegalias), independientemente del número de articulaciones afectadas, define a la AIJ sistémica. Las restantes categorías incluyen la artritis psoriásica (definida por la presencia de artritis y psoriasis o sus estigmas) y la artritis relacionada con entesitis (ésta se asimila a la espondiloartropatía juvenil). Por último, los pacientes cuya artritis no puede ser clasificada en las categorías anteriores, se incluyen en el grupo de indiferenciadas.
El desarrollo mediante ingeniería genética de «agentes biológicos» dirigidos contra las moléculas inflamatorias o células implicadas en la patogenia de la AIJ supone un avance terapéutico significativo5 en el tratamiento de aquellos pacientes que han tenido efectos secundarios o han sido refractarios al tratamiento convencional con metotrexato (MTX), esteroides intraarticulares, etc6. En la actualidad se dispone de 3 fármacos contra el TNF (tumor necrosis factor 'factor de necrosis tumoral') α, etanercept7, infliximab8 y adalimumab9, de anticuerpos antiinterleucina 1, anakinra10 y antiinterleucina 6, tocilizumab11, así como de una molécula anti-CTLA4 (implicada en la activación de linfocitos T), abatacept12. El único aprobado en ficha técnica para su uso pediátrico es etanercept, proteína de fusión que combina el dominio extracelular del receptor p75 del TNF-α humano unido al fragmento Fc de la inmunoglobulina G1 humana7,13.
Los objetivos de este estudio son evaluar la efectividad del etanercept en el tratamiento de la AIJ a los 6 meses de tratamiento, la contribución de diferentes variables clinicodemográficas en la respuesta al tratamiento y la seguridad y tolerancia del fármaco mediante la determinación tanto del número de pacientes que seguía tratamiento a los 12 meses del inicio como de las causas por las que se había interrumpido.
Pacientes y métodosSe realizó un estudio retrospectivo de los pacientes diagnosticados de AIJ y controlados en la Unidad de Reumatología Pediátrica de un hospital terciario, que habían recibido tratamiento con etanercept entre enero de 2000 y junio de 2007. Se incluyeron todos los pacientes que en diciembre de 2007 hubieran podido seguir el tratamiento con etanercept durante 6 meses, independientemente de que el fármaco se hubiera suspendido antes.
Se elaboró un protocolo de recogida de datos que incluía variables demográficas (edad, sexo, tiempo transcurrido desde el inicio de los síntomas hasta el diagnóstico, etc.), variables clínicas (número de articulaciones activas, índice funcional, dosis de corticoides orales y de MTX, infiltraciones articulares, etc.) y variables de laboratorio (hemoglobina y velocidad de sedimentación globular [VSG]). Se procedió a una revisión de historias clínicas en la que se recogía información antes de empezar el tratamiento y a los 3 y 6 meses de éste.
Para el estudio de extensión se analizó el número de pacientes que continuaban el tratamiento a los 12 meses, las causas por las que se suspendió y los efectos adversos registrados.
La mejoría de la artritis se evaluó mediante un índice validado internacionalmente, el ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’])14. Este índice es una combinación de 4 criterios clínicos (número de articulaciones activas, de articulaciones limitadas, valoración de la enfermedad por el médico y valoración de la enfermedad por el paciente o sus padres), un criterio de funcionalidad física (cHAQ [Children′s Health Assessment Questionnaire ‘cuestionario pediátrico de evaluación de la salud’]) y un criterio analítico (velocidad de sedimentación globular [VSG]). Para que se considere que hay mejoría de la enfermedad se requiere que 3 de los 6 criterios mejoren en un porcentaje determinado (el 30, el 50 o el 70%) sin que ninguno de los restantes empeore más de un 30%. Esta variable sólo admite 2 resultados, «cumple ACRped» (el paciente mejora o «responde») o «no cumple ACRped» (el paciente «no responde»). Por convención el criterio de mejoría que se utiliza es el ACRped30.
La valoración de la enfermedad por el médico o los padres se realizó con una escala visual analógica (EVA), línea horizontal de 10cm en la que en los extremos figuraban el valor 0 («enfermedad inactiva») y el valor 10 («actividad máxima»). La capacidad funcional se evaluó con la versión validada al español del cHAQ15, que valora la dificultad del niño para realizar diversas actividades cotidianas. Sus resultados se expresan en una escala que oscila entre 0 (ninguna limitación) y 3 (muy dependiente, precisa ayuda para realizar la mayoría de las actividades diarias).
El análisis estadístico se realizó mediante la utilización del paquete estadístico SPSS 11.0. Las características descriptivas de las variables cuantitativas se representan como mediana y rango intercuartílico dado su carácter no paramétrico, mientras que las variables cualitativas se representan como porcentajes. El contraste de hipótesis univariado se realizó mediante el test de la U de Mann-Whitney para las variables cuantitativas y el test de la χ2 (que aplica el estadístico exacto de Fisher cuando corresponde) para las variables cualitativas. El contraste de hipótesis de las formas clínicas de AIJ se realizó mediante regresión logística con utilización de la AIJ oligoarticular como categoría de referencia. Se incluyó en el análisis a todos los pacientes, independientemente del tiempo que hubieran recibido tratamiento con etanercept (análisis por intención de tratar). Se consideraron significativos los valores de p inferiores a 0,05.
ResultadosSe estudiaron 71 pacientes, de los cuales 43 eran niñas (60,6%) y 28 eran varones que habían sido refractarios a MTX. Las características clínicas al comienzo del tratamiento se muestran en la tabla 1. Doce pacientes tenían una AIJ oligoarticular, con evolución «extendida» en 10 de éstos, 21 pacientes tenían AIJ poliarticular FR negativo, 19 pacientes forma sistémica, 16 pacientes artritis relacionada con entesitis y 3 pacientes artritis psoriásica. Todos tenían afectación poliarticular con excepción de 2 pacientes en los que se indicó por refractariedad al tratamiento con MTX e infiltraciones articulares.
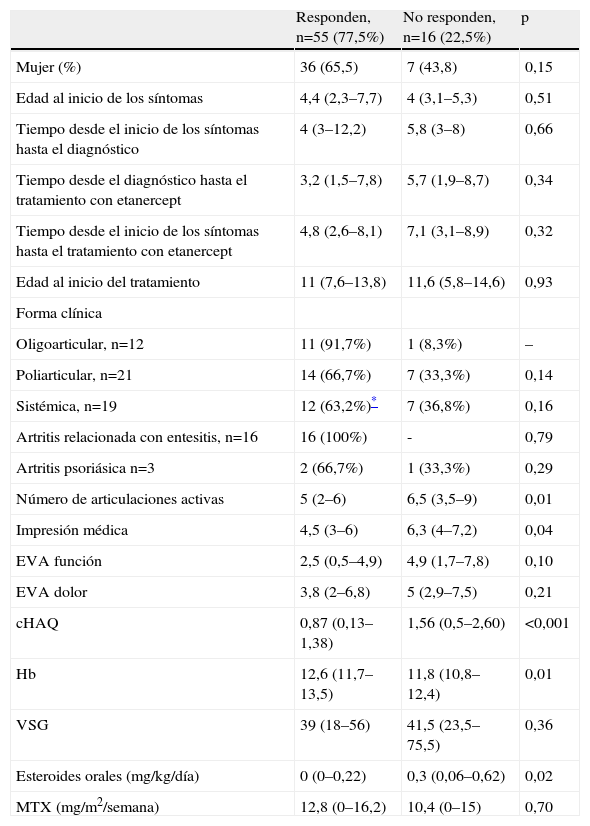
Respuesta del índice ACRped30 a etanercept según las características de los pacientes al inicio del tratamiento
| Responden, n=55 (77,5%) | No responden, n=16 (22,5%) | p | |
| Mujer (%) | 36 (65,5) | 7 (43,8) | 0,15 |
| Edad al inicio de los síntomas | 4,4 (2,3–7,7) | 4 (3,1–5,3) | 0,51 |
| Tiempo desde el inicio de los síntomas hasta el diagnóstico | 4 (3–12,2) | 5,8 (3–8) | 0,66 |
| Tiempo desde el diagnóstico hasta el tratamiento con etanercept | 3,2 (1,5–7,8) | 5,7 (1,9–8,7) | 0,34 |
| Tiempo desde el inicio de los síntomas hasta el tratamiento con etanercept | 4,8 (2,6–8,1) | 7,1 (3,1–8,9) | 0,32 |
| Edad al inicio del tratamiento | 11 (7,6–13,8) | 11,6 (5,8–14,6) | 0,93 |
| Forma clínica | |||
| Oligoarticular, n=12 | 11 (91,7%) | 1 (8,3%) | – |
| Poliarticular, n=21 | 14 (66,7%) | 7 (33,3%) | 0,14 |
| Sistémica, n=19 | 12 (63,2%)* | 7 (36,8%) | 0,16 |
| Artritis relacionada con entesitis, n=16 | 16 (100%) | - | 0,79 |
| Artritis psoriásica n=3 | 2 (66,7%) | 1 (33,3%) | 0,29 |
| Número de articulaciones activas | 5 (2–6) | 6,5 (3,5–9) | 0,01 |
| Impresión médica | 4,5 (3–6) | 6,3 (4–7,2) | 0,04 |
| EVA función | 2,5 (0,5–4,9) | 4,9 (1,7–7,8) | 0,10 |
| EVA dolor | 3,8 (2–6,8) | 5 (2,9–7,5) | 0,21 |
| cHAQ | 0,87 (0,13–1,38) | 1,56 (0,5–2,60) | <0,001 |
| Hb | 12,6 (11,7–13,5) | 11,8 (10,8–12,4) | 0,01 |
| VSG | 39 (18–56) | 41,5 (23,5–75,5) | 0,36 |
| Esteroides orales (mg/kg/día) | 0 (0–0,22) | 0,3 (0,06–0,62) | 0,02 |
| MTX (mg/m2/semana) | 12,8 (0–16,2) | 10,4 (0–15) | 0,70 |
Los valores se presentan como mediana (rango intercuartílico). La edad y los tiempos se muestran en años, si no se especifica con otra medida. El análisis de las formas clínicas se realizó mediante regresión logística utilizando como categoría de referencia la forma clínica oligoarticular.
EVA: Escala visual analógica; cHAQ: Children′s Health Assessment Questionnaire ‘cuestionario pediátrico de evaluación de la salud’; Hb: hemoglobina; MTX: metotrexato; VSG: velocidad de sedimentación globular.
El sexo, la edad al inicio de los síntomas o al comienzo del tratamiento, así como el tiempo trascurrido desde el diagnóstico al inicio del tratamiento no mostraron diferencias significativas entre los pacientes que respondieron y los que no respondieron.
Los pacientes con oligoartritis y artritis relacionada con entesitis respondieron en el 91,7 y el 100% de los casos respectivamente y las formas poliarticulares en el 66,7% de los casos (tabla 1). En lo que respecta a los niños con AIJ sistémica (19 pacientes), hay que destacar que aunque el 63% alcanzó una mejoría ACRped30, la fiebre no se controló en ninguno de los 12 pacientes que la presentaban y 16 pacientes precisaron un aumento de corticoides sistémicos o infiltraciones articulares.
Los pacientes que respondieron al etanercept presentaban al comienzo del tratamiento menos articulaciones inflamadas, menos limitación funcional, mejor impresión médica, mayor concentración de hemoglobina y recibían menores dosis de corticoides (tabla 1). No se realizó un análisis multivariable dado el grado de correlación existente entre las variables analizadas (inferior a 0,05 entre todas las variables cuantitativas) y la utilización como variable dependiente de un índice compuesto por las principales variables independientes (colinealidad).
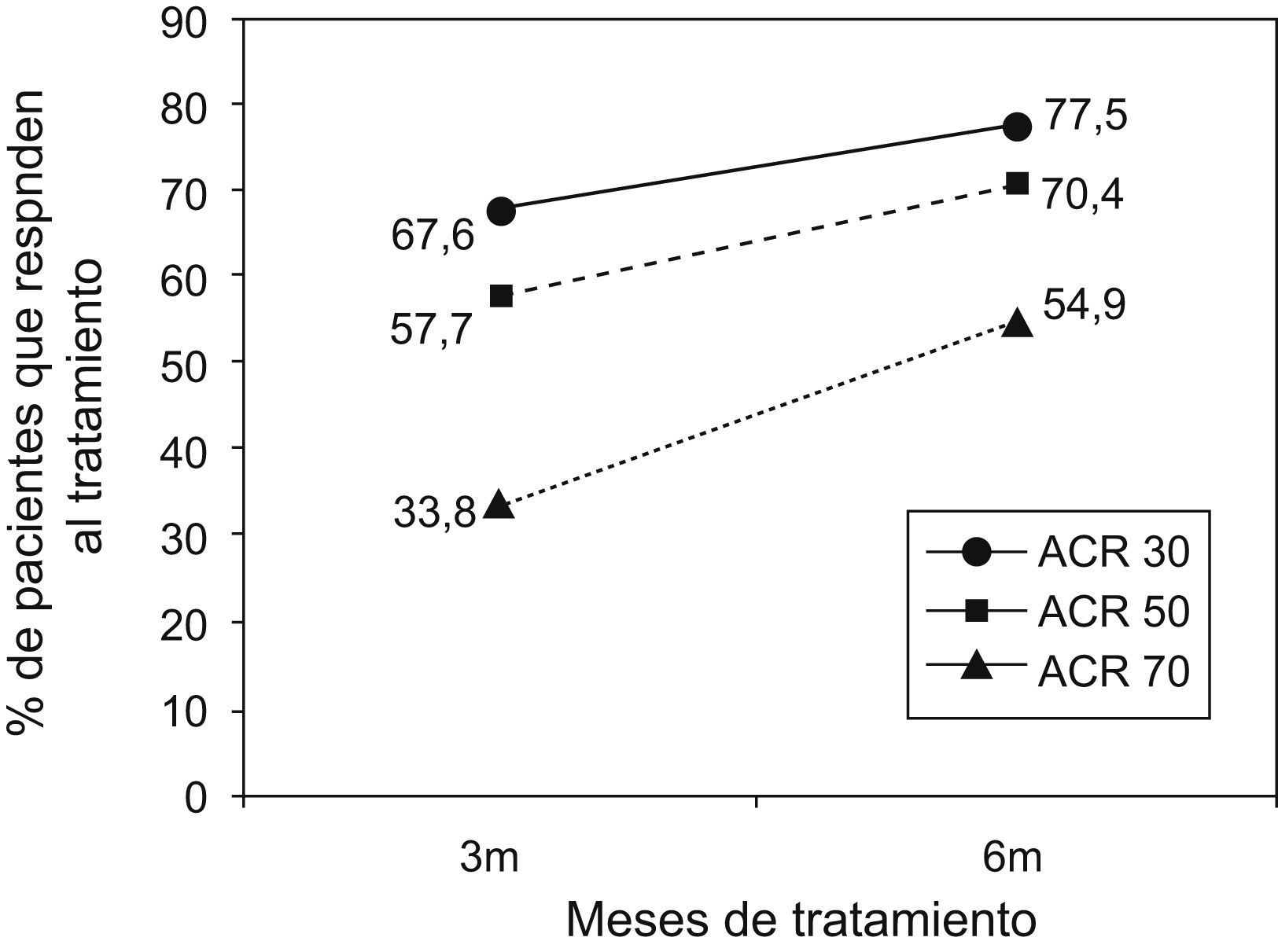
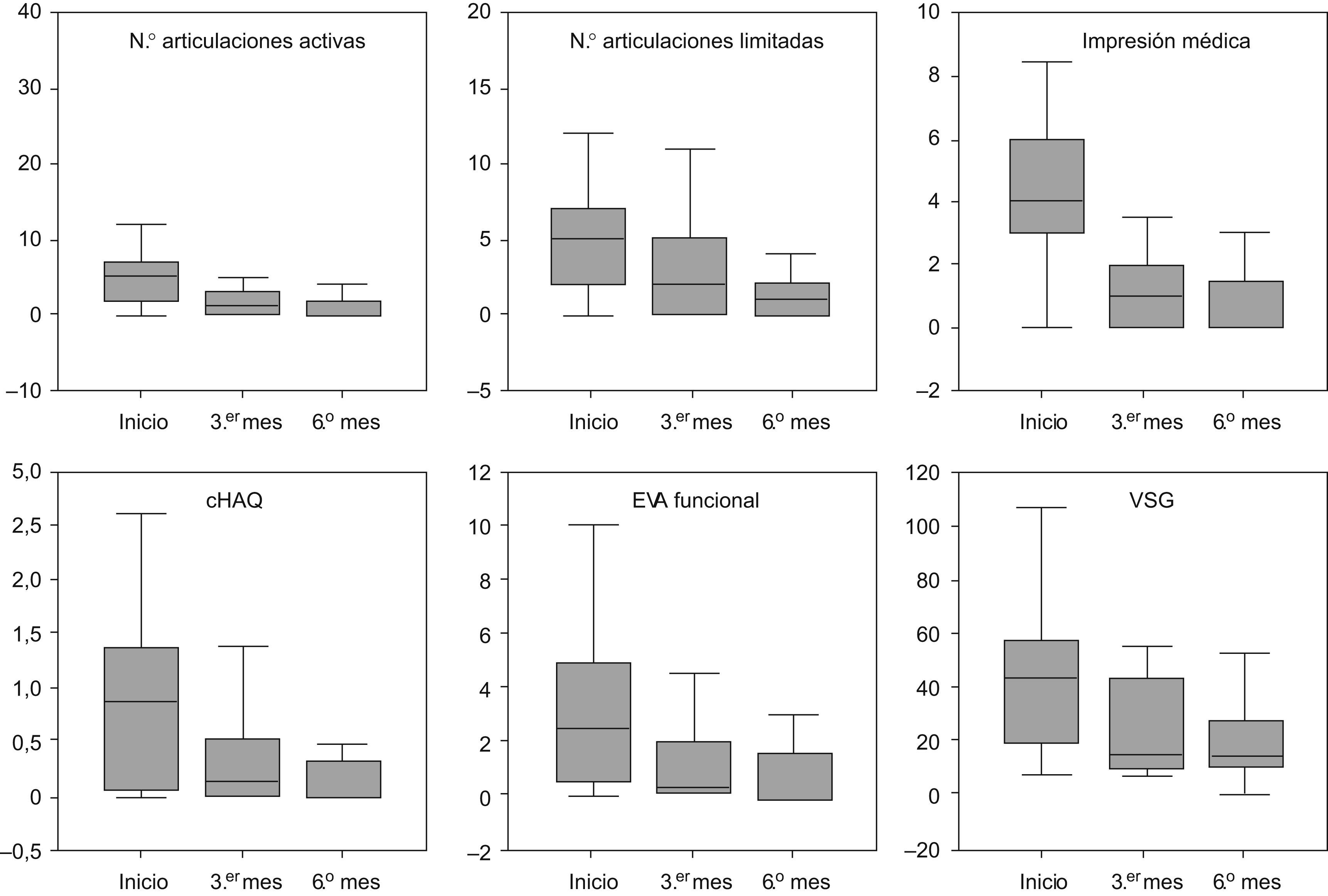
En la figura 1 se representa la mejoría de acuerdo con los criterios ACRped30, ACRped50 y ACRped70 a los 3 y 6 meses, según éstos el etanercept fue efectivo (para ACRped30) en el 77,5% de los pacientes a los 6 meses. Un porcentaje algo inferior (el 70,4%) alcanzó en este período el ACRped50, mientras que algo más de la mitad de los pacientes (54,9%) alcanzó el ACRped70. En la figura 2 se representa la evolución de las distintas variables que forman el índice de mejoría ACRped.
Evolución del índice de mejoría ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’]) durante el estudio. La gráfica representa el porcentaje de pacientes (eje de ordenadas) que cumplen el criterio de mejoría ACRped30, ACRped50 o ACRped70 a los 3 y 6 meses del tratamiento (eje de abscisas).
Evolución de las variables que forman el índice ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’]) antes de iniciar el tratamiento y a los 3 y 6 meses de éste. Los diagramas de cajas representan la mediana (línea horizontal) y los percentiles 25 (límite inferior de la caja) y 75 (límite superior). cHAQ: children′s Health Assessment Questionnaire ‘cuestionario pediátrico de evaluación de la salud’. EVA: escala visual analógica.
Al analizar los resultados de acuerdo con las formas clínicas destacaba la menor proporción de pacientes con AIJ sistémica que, en comparación con el resto de las formas clínicas, alcanzaba los índices de mejoría ACRped50 (el 52,6 frente al 76,9%; p=0,05) y ACRped70 (el 21,1 frente al 67,3%; p=0,001). Esta observación resulta aún más significativa si se tiene en cuenta que a los 6 meses de tratamiento con etanercept más niños con enfermedad sistémica continuaban recibiendo corticoides orales (el 87,5 frente al 15,6%; p<0,001) en unas dosis ajustadas al peso superiores (0,36 frente a 0,03 mg/kg/día; p<0,001) y que un mayor porcentaje había precisado esteroides intraarticulares (el 52,6 frente al 13,5%; p=0,001) con una media de articulaciones infiltradas también superior (3,1 contra 0,8; p=0,007). Además, un mayor número de niños con enfermedad sistémica mantenía a los 6 meses de iniciar etanercept tratamiento con MTX (el 64,3 frente al 12,8%; p<0,001).
Otros hallazgos reflejaban la demografía de la enfermedad, incluido el predominio de niñas entre los pacientes con AIJ oligoarticular (91,7%; p=0,02) o de varones en pacientes con artritis relacionada con entesitis (62,5%; p=0,03).
El etanercept se suspendió en 12 casos (16,9%), 6 casos durante el primer semestre y 6 casos durante el segundo semestre. Las causas de la retirada fueron ineficacia o recaída en 7 casos (4 casos en los primeros 6 meses), mejoría en 3 casos, varicela no complicada en un niño en que la enfermedad estaba inactiva y uveítis en otro caso. No se produjeron otras infecciones relevantes. No se pudo continuar el seguimiento en 2 pacientes con buena respuesta clínica debido a su traslado a otros hospitales. Cinco de los 7 niños que no respondieron al etanercept o que tuvieron recaídas tenían la forma sistémica de la enfermedad (71,4%).
Dos pacientes, uno con oligoartritis extendida y otro con artritis relacionada con entesitis, en los que se retiró etanercept al año y a los 5 años por remisión, respondieron bien (ACRped70) tras su reintroducción por recaída.
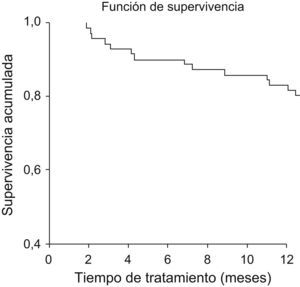
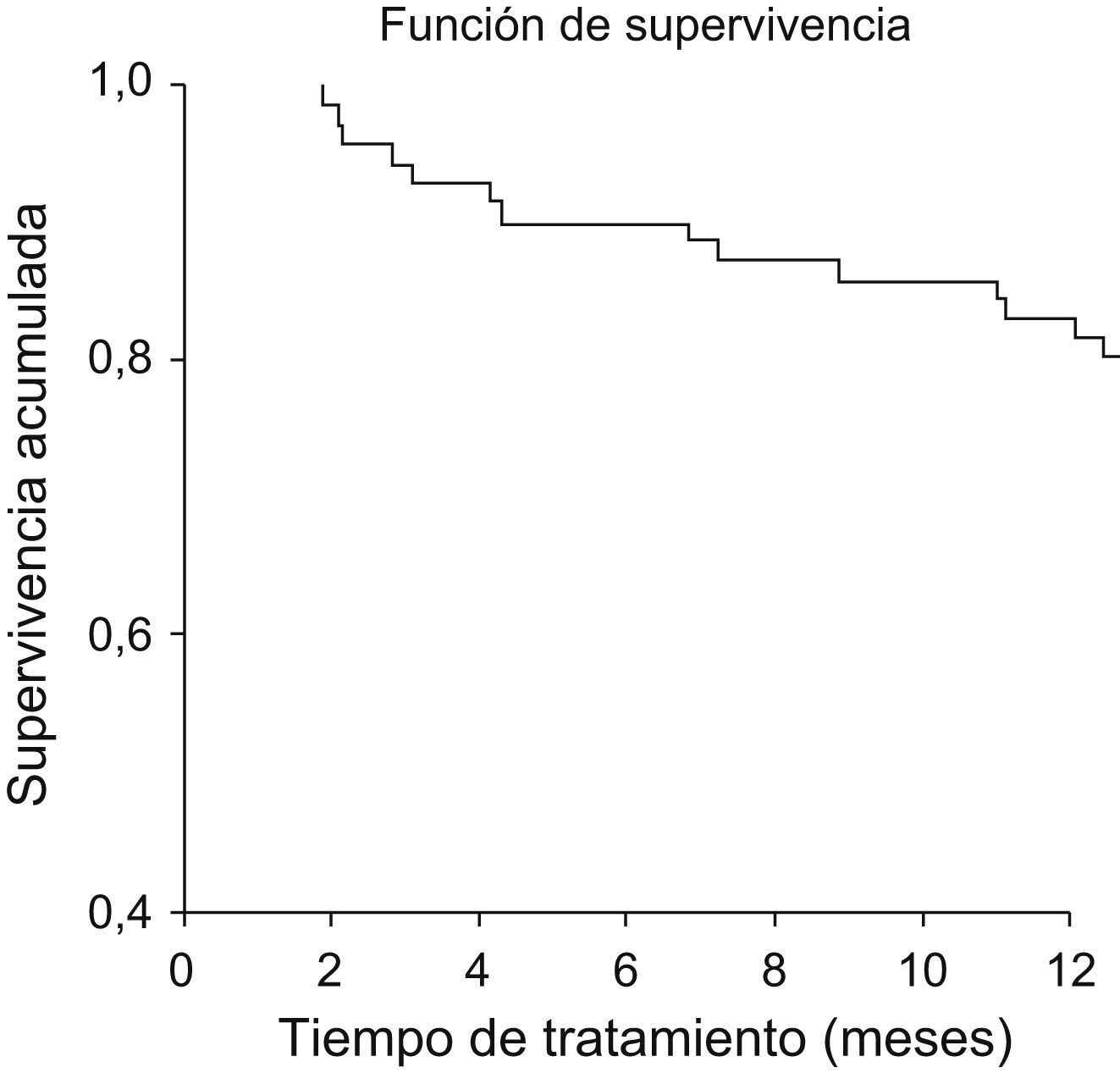
Después de los 12 primeros meses de tratamiento 57 pacientes (80,3%) continuaban recibiendo etanercept (fig. 3). En diciembre de 2007 11 pacientes llevaban 36 meses ininterrumpidos de tratamiento y 8 de éstos sobrepasaron los 48 meses. Se mantuvo la mejoría alcanzada sin efectos adversos destacables.
DiscusiónEste estudio confirma que el etanercept es un tratamiento efectivo de la AIJ, ya que a los 6 meses de tratamiento el 77,5% de los pacientes alcanzó el criterio de mejoría del 30% (ACRped30); si bien es cierto que este umbral de mejoría es el más frecuentemente empleado en los estudios de eficacia y efectividad16, no por esto deja de ser modesto. Por esto, lo que cabe destacar que un 70% cumpliera el criterio ACRped50 (mejoría de 3 de las 6 variables del índice en al menos un 50% sin que ninguna de las restantes variables empeorase más de un 30%) y que más de la mitad alcanzara una mejoría del 70%.
Estos resultados son similares a los que se han comunicado en otros estudios. El Registro Alemán de etanercept en AIJ publicó en el año 2004 sus resultados sobre 322 pacientes. La distribución de las distintas formas clínicas de AIJ fue similar a la de esta serie, con un mayor porcentaje de pacientes con AIJ poliarticular FR positivo (el 12% en la serie alemana y ninguno en este estudio) y un menor número de niños con artritis relacionada con entesitis (el 8 y el 22,5%, respectivamente)17. El porcentaje de pacientes del Registro Alemán que alcanzó los criterios fue del 78% para ACRped30, del 61% para ACRped50 y del 38% para ACRped70 a los 3 meses, y del 83% para ACRped30, del 72% para ACRped50 y del 52% para ACRped70 a los 6 meses.
Con anterioridad se habían publicado los datos del Registro Nacional Francés, con menos pacientes (n=61) y diferente distribución de formas clínicas: AIJ poliarticular en el 21,3% de los casos, AIJ oligoarticular en el 39% de los casos, AIJ sistémica en el 36% de los casos y artritis psoriásica en el 3% de los casos18. Los porcentajes de mejoría fueron similares tras 3 meses (el 73% para ACRped30, el 54% para ACRped50 y el 38% para ACRped70), pero, al contrario que el Registro Alemán o este estudio, estos porcentajes disminuyeron a los 6 meses (el 61% para ACRped30, el 52% para ACRped50 y el 33% para ACRped70). Se desconoce hasta qué punto este hecho puede estar relacionado con una mayor presencia de pacientes con enfermedad sistémica (el 36% en el Registro Francés, el 21% en el Registro Alemán y el 27% en esta serie) o a una mayor gravedad de la enfermedad (la media de articulaciones activas al inicio fue de 16 en la serie francesa, la media en la serie alemana fue de 10 y la media en esta serie fue de 6). El Registro Español ofrecía, con 103 pacientes, las cifras de mejoría a los 6 meses más elevadas: el 84,6% para ACRped30, el 84,6% para ACRped50 y el 76,9% para ACRped7019.
Los resultados de este estudio son también comparables a los de Lovell et al cuando se aplica su metodología7, esto es, considerar sólo a pacientes que después de los 6 primeros meses de enfermedad tuvieran poliartritis, independientemente de la forma de inicio. De acuerdo con este criterio de inclusión alcanzaron la definición ACRped30 el 75% de los pacientes de esta serie (33 de 44 pacientes) y el 74% de aquellos pacientes seguidos en la fase abierta por estos autores (51 pacientes de un total de 69).
La respuesta a etanercept, sin embargo, no es constante entre las diversas formas clínicas de la enfermedad. Así, mientras el 100% de los pacientes con oligoartritis persistente y artritis relacionada con entesitis alcanzaron en este estudio el ACRped30 a los 6 meses la mayoría de los niños con AIJ sistémica precisaron corticoides orales o intraarticulares y mantener el tratamiento con MTX para conseguir mejoría, ya que no podía controlarse la fiebre en éstos. Asimismo, el 75% de los niños que no respondieron al etanercept y el 66% de los niños que tuvieron recaídas tenían AIJ sistémica. La observación de que pacientes con esta forma clínica son refractarios al etanercept es constante en todas las series17,18,20,21, como también lo es la excelente respuesta a agentes anti-TNF-α de pacientes con espondiloartropatías, sean adultos22 o niños23,24.
La experiencia que se adquiere en el uso de etanercept ha sido determinante para reconocer su utilidad en el tratamiento de pacientes que pueden no presentar una poliartritis grave, pero cuya enfermedad limita significativamente las actividades cotidianas. Este es el caso de pacientes con artritis de tarso o de tobillo, ya que interfieren significativamente con la deambulación, la asistencia escolar y las actividades diarias. Esta observación explica el porcentaje de pacientes con artritis relacionada con entesitis de esta serie (22,5%), y la utilización del etanercept en pacientes con poliartritis de moderada intensidad refractaria a MTX que se traducen en una mediana de articulaciones afectadas inicialmente inferior a otras series.
Con respecto a las variables que se estudiaron, su análisis debe interpretarse con cautela dado que el tamaño de la serie limita el análisis estratificado por forma clínica, respuesta al tratamiento, etc. En cualquier caso, no se apreciaron diferencias destacables en la edad o en los tiempos de evolución entre los pacientes que respondían al etanercept y los que no respondían al etanercept, por lo que se puede atribuir la mayor parte de las diferencias encontradas (impresión médica, EAV función, cHAQ, concentración de hemoglobina y dosis inicial de esteroides orales) a la menor respuesta observada en pacientes con enfermedad sistémica activa.
Inicialmente se publicaron series que sugerían la utilidad de etanercept para el tratamiento de la uveítis, aunque después se comunicó la aparición de uveítis en pacientes que recibían el fármaco17,18,25,26. Ese fue el caso de una niña de esta serie que desarrolló uveítis al noveno mes de tratamiento, una vez que la enfermedad articular había remitido. Un ensayo clínico que se realizó con un pequeño número de pacientes con uveítis no demostró diferencias entre etanercept y placebo27. En la actualidad, se considera que otros agentes anti-TNF-α pueden resultar más eficaces para esta indicación28,29.
Como con cualquier otro fármaco, además de evaluar su efectividad se debe considerar su seguridad. El etanercept es una medicación bien tolerada con un bajo número de suspensiones por toxicidad. Sin embargo, los agentes anti-TNF-α interfieren con la respuesta inmune y favorecen el desarrollo de infecciones cutáneas, respiratorias, etc. El Registro Español BIOBADASER puso de manifiesto un aumento del riesgo de tuberculosis asociado a estos tratamientos, que pasó de una incidencia basal de 21 cada 100.000 habitantes a 1.893 cada 100.000 habitantes en pacientes tratados con infliximab y de 1.113 cada 100.000 pacientes que recibían etanercept30. En esta serie no hubo casos de tuberculosis; un niño recibió profilaxis con isoniacida por tener un Mantoux positivo antes de iniciar tratamiento con etanercept.
Otros efectos secundarios graves relacionados con el tratamiento incluyen el desarrollo de enfermedad desmielinizante31,32 y neuritis óptica33, incluidos 2 casos en el Registro Nacional Francés17, un caso en en el Registro Alemán16 y ningún caso en esta serie. Asimismo, se ha relacionado el etanercept con el desarrollo del síndrome de activación macrofágica34, aunque también se ha utilizado para su tratamiento35,36. Recientemente un centro terciario italiano ha publicado su experiencia sobre los efectos adversos del etanercept: un 11% de los casos presentó cefalea, un 9,4% de los casos presentó reacciones cutáneas, en un 2,4% de los casos se diagnosticó enfermedad inflamatoria intestinal durante el tratamiento y en un 1,6% de los casos se desarrollaron infecciones graves37.
Los autores del presente estudio no registraron tantos efectos adversos, aunque en un paciente con artritis relacionada con entesitis que inicialmente respondió al etanercept se desarrolló a los 2 años del tratamiento enfermedad de Crohn. Los resultados del estudio italiano contrastan con los de otras series, que indican una tasa de efectos adversos después de 4 años de seguimiento de 0,13 pacientes por año y de infecciones graves de 0,04 paciente-año38. Los estudios de seguimiento demuestran un buen perfil de seguridad, tanto clínica (tras 8 años de tratamiento)39 como inmunológica40; la aparición de autoanticuerpos contra antígenos nucleares es, a diferencia de lo que sucede en adultos, infrecuente en niños, habitualmente a títulos bajos, y sin repercusión clínica.
En resumen, el etanercept ha demostrado ser un fármaco eficaz en el tratamiento de la AIJ y bien tolerado. Los buenos resultados encontrados llevan a su utilización de forma relativamente precoz en las formas poliarticulares, artritis relacionadas con entesitis y artritis psoriásica; su disponibilidad acorta el periodo de tratamiento con otros fármacos modificadores de enfermedad cuando no se aprecia mejoría franca y evita la administración de corticoides de manera prolongada. Lamentablemente, los pacientes con AIJ sistémica activa parecen ser los menos beneficiados por este tratamiento. Los posibles efectos adversos a medio o largo plazo obligan a recomendar una estrecha vigilancia de estos pacientes.
Conflicto de interesesEste trabajo ha sido financiado en parte por una Beca aportada por Laboratorios Wyeth a la Fundación para la Investigación Biomédica Hospital Universitario La Paz.


![Evolución del índice de mejoría ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’]) durante el estudio. La gráfica representa el porcentaje de pacientes (eje de ordenadas) que cumplen el criterio de mejoría ACRped30, ACRped50 o ACRped70 a los 3 y 6 meses del tratamiento (eje de abscisas). Evolución del índice de mejoría ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’]) durante el estudio. La gráfica representa el porcentaje de pacientes (eje de ordenadas) que cumplen el criterio de mejoría ACRped30, ACRped50 o ACRped70 a los 3 y 6 meses del tratamiento (eje de abscisas).](https://static.elsevier.es/multimedia/16954033/0000007000000004/v1_201304301823/S1695403309001696/v1_201304301823/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)
![Evolución de las variables que forman el índice ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’]) antes de iniciar el tratamiento y a los 3 y 6 meses de éste. Los diagramas de cajas representan la mediana (línea horizontal) y los percentiles 25 (límite inferior de la caja) y 75 (límite superior). cHAQ: children′s Health Assessment Questionnaire ‘cuestionario pediátrico de evaluación de la salud’. EVA: escala visual analógica. Evolución de las variables que forman el índice ACRped (criterio de mejoría pediátrico del ACR [American College of Rheumatology ‘Colegio Americano de Reumatología’]) antes de iniciar el tratamiento y a los 3 y 6 meses de éste. Los diagramas de cajas representan la mediana (línea horizontal) y los percentiles 25 (límite inferior de la caja) y 75 (límite superior). cHAQ: children′s Health Assessment Questionnaire ‘cuestionario pediátrico de evaluación de la salud’. EVA: escala visual analógica.](https://static.elsevier.es/multimedia/16954033/0000007000000004/v1_201304301823/S1695403309001696/v1_201304301823/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w95erwEulN6Tmh1xJpRhO+VE=)