Los estudios sobre efectividad y seguridad de los bisfosfonatos en osteoporosis infantil secundaria (OIS) son escasos. El objetivo fue analizar efectividad y seguridad de los bisfosfonatos en OIS.
Pacientes y métodosEstudio multicéntrico retrospectivo en <18 años afectos de OIS tratados con bisfosfonatos. Se recogieron variables clínicas. Se valoró densidad mineral ósea mediante el Z-score de densidad mineral ósea en columna lumbar (ZDMOcl) medido por absorciometría de rayos X de doble energía (DXA). Valoramos efectividad en función del cambio del ZDMOcl al año y a los dos años de su inicio y del descenso del número de fracturas/año. Los eventos adversos reportados fueron recogidos. Se realizó análisis descriptivo y bivariante.
ResultadosSe reclutaron 32 pacientes. El ZDMOcl se incrementó al año del inicio del tratamiento ([-2,46±0,96] vs. [-1,54±1,38]; p<0,001). El número de fracturas/año disminuyó significativamente (1 [1-2] vs. 0 [0-0,61]; p<0,001). El cambio en el ZDMOcl fue mayor en los pacientes deambulantes (1,88+/- 0,72 vs. 0,55+/-0,82; p=0,07) y se correlacionó positivamente con el percentil del IMC (rho:0,564; p<0,001). El descenso del número de fracturas/año fue mayor en los pacientes con menor tasa inicial de fracturas (rho:-0,47; p=0,006) y cuanto mayor era el Z-score inicial (rho:-0,47; p=0,07). Se reportaron 10 eventos adversos leves en 7 pacientes (22%), todos con bisfosfonatos intravenosos. No se halló relación entre eventos adversos y las variables estudiadas.
ConclusionesLos bisfosfonatos son efectivos en OIS. La respuesta parece ser mejor en pacientes deambulantes, bien nutridos y en estadios precoces de la enfermedad. Resultan seguros, siendo los efectos adversos leves, aunque frecuentes.
There are few studies on effectiveness and safety of bisphosphonate therapy in secondary osteoporosis in children. The aim of this research was to analyse effectiveness and safety of bisphosphonates in secondary osteoporosis in children.
Patients and methodsMulticentre retrospective study in patients younger than 18 suffering from secondary osteoporosis and who had received bisphosphonates. Clinical data were recorded. Bone mineral density was assessed in terms of bone mineral density Z-score in lumbar spine (ZBMDls) measured by dual-energy X-ray absorptiometry (DXA). Effectiveness was valued at changes in ZBMDls one and two years after the onset of bisphosphonates and at the decrease in the number of fractures a year. Adverse events reported were recorded. Descriptive and bivariant analysis were performed.
Results32 patients were recruited. ZBMDls increased one year after the onset of treatment ([−2.46±0.96] vs. [−1.54±1.38]; p<.001). Fractures a year decreased significantly (1 [1–2] vs. 0 [0–0.61]; p<,001). ZBMDls increase was higher in patients who were able to walk (1.88±0.72 vs. 0.55±0.82; p=.07) and correlated positively with body mass index (BMI) for age percentile (rho: 0.564; p<.001). The decrease in the number of fractures a year was higher in patients with lower initial fracture rate (rho: −0.47; p=.006) and with higher initial ZBMDls (rho: −0.47; p=.07). 10 adverse events were reported in 7 patients (22%), all of them intravenous bisphosphonates related. No association was found between adverse events and studied variables.
ConclusionsBisphosphonates are effective in secondary osteoporosis in children. Response seems to be better in patients who are able to walk, well-nourished and in the early stages of the disease. Adverse events were frequent but mild.
La osteoporosis secundaria es una patología cada vez más prevalente en el niño debido al aumento de la esperanza de vida de los enfermos crónicos pediátricos y al uso de medicaciones osteotóxicas, entre otros factores1. Es una enfermedad caracterizada por una disminución de la masa ósea y alteraciones de la microarquitectura del hueso, que conducen a un incremento de la fragilidad ósea y, consecuentemente, a un riesgo elevado de presentar fracturas2.
El abordaje de la osteoporosis infantil secundaria debe ser multidisciplinar, implicando a rehabilitadores, nutricionistas, reumatólogos y endocrinólogos, entre otros1.
Para combatirla es fundamental la corrección de los factores de riesgo y la suplementación con calcio y vitamina D en aquellos pacientes con un aporte insuficiente a través de la dieta. Estas medidas pueden ser efectivas en casos leves, pero sin embargo, con frecuencia resultan insuficientes1. Por esto, y ante los alentadores resultados obtenidos en osteoporosis del adulto y osteogénesis imperfecta, los bisfosfonatos son cada vez más utilizados en osteoporosis infantil secundaria3.
Los bisfosfonatos son análogos sintéticos del pirofosfato que se depositan en el hueso. Al inicio de la fase de resorción, son liberados y captados por el osteoclasto, deteriorando su capacidad de formar el borde en cepillo, de adherirse a la superficie del hueso y de producir los protones y enzimas lisosómicas necesarios para continuar la resorción ósea4. Se concentran selectivamente en el esqueleto, en lugares con alta tasa de remodelado y reducen la resorción ósea y aumentan la densidad mineral ósea (DMO), manteniendo e incluso mejorando las propiedades estructurales y materiales del hueso en condiciones de normalidad5.
Son fármacos hidrofílicos con una baja absorción intestinal (< 1%) y un elevado volumen de distribución y se excretan por orina, por lo que su dosis debe ajustarse en función del filtrado glomerular. Se eliminan muy lentamente del tejido óseo, manteniéndose en el organismo años tras la administración5. Este hecho, junto a la escasez de trabajos que valoraran la seguridad de estos fármacos a largo plazo cuando son administrados en la infancia y a la observación de efectos teratógenos en ratas, ha hecho que durante mucho tiempo su uso en Pediatría se redujera al contexto de ensayos clínicos pediátricos y a casos graves donde la fragilidad ósea tenía una repercusión significativa en la calidad de vida del paciente.
Su uso generalizado en osteogénesis imperfecta ha arrojado datos muy positivos sobre su perfil de seguridad a corto, medio y largo plazo en niños6, por lo que diferentes consensos de expertos recomiendan considerarlos en pacientes con osteoporosis infantil secundaria3,7, especialmente, en casos con escaso potencial de recuperación por estadio puberal, persistencia de factores de riesgo, etc. Sin embargo, los trabajos que valoran la eficiencia y seguridad de los bisfosfonatos en osteoporosis infantil secundaria son escasos8.
ObjetivoEl objetivo de este trabajo es analizar la efectividad y seguridad del tratamiento con bisfosfonatos en osteoporosis infantil secundaria (OIS).
MétodosEstudio multicéntrico longitudinal retrospectivo en menores de 18 años afectos de OIS según los criterios de la International Society for Clinical Densitometry (ISCD) 20199 y tratados con bisfosfonatos, a los que se les hubiera realizado al menos dos absorciometrías de rayos X de doble energía (DXA) de columna lumbar, una previa al inicio del tratamiento y otra al año, aproximadamente.
Tras la obtención del consentimiento informado, se recogieron datos demográficos, antropométricos, clínicos y de tratamiento. Se valoró la DMO mediante el Z-score de DMO en columna lumbar (ZDMOcl) medido por DXA, con ajuste según la talla, según la fórmula de ajuste propuesta por Zemel et al.10, si la talla era igual o inferior al percentil 3.
Valoramos la efectividad del tratamiento en función del cambio del ZDMOcl al año y a los dos años de su inicio y del descenso del número de fracturas/año, evaluados mediante prueba T para datos apareados. Se calculó la incidencia de fracturas antes del inicio del tratamiento, como el número de fracturas de huesos largos y vertebrales que presentó el paciente hasta el inicio del tratamiento con bisfofonatos, dividido por el número de años transcurridos desde la presentación de la primera fractura hasta el inicio de dicho tratamiento. Igualmente, la incidencia de fracturas tras el inicio del tratamiento con bisfosfonatos, se definió como el número de fracturas de huesos largos y vertebrales sufridas por el paciente desde el inicio del tratamiento antirresortivo hasta el reclutamiento, dividido por el número de años transcurridos desde el inicio del bisfosfonato. Todos los eventos adversos reportados fueron recogidos.
Se realizó inicialmente estudio descriptivo de las variables recogidas, y posteriormente, análisis bivariante para identificar factores relacionados con la efectividad y seguridad de los bisfosfonatos. El cambio en el Z-score y el de la incidencia de fracturas no seguían distribución normal, por lo que se utilizó el test U de Mann-Whitney para las variables cualitativas y se calculó el coeficiente rho de Spearman para las cuantitativas. Se consideró 0,05 como el límite de significación estadística.
El estudio se adhirió a los principios de la Declaración de Helsinki y la legislación internacional vigente en derechos humanos, biomedicina y protección de datos personales y fue aprobado por el Comité de Ética de Investigación del Hospital Regional Universitario de Málaga. Se mantuvo la confidencialidad de todos los datos, que fueron anonimizados.
ResultadosSe reclutaron 32 pacientes de 6 centros hospitalarios. Sus características se recogen en la tabla 1. Las pautas de dosificación se ajustaron en todos los pacientes a las recomendadas en OIS7 (tabla 2).
Características demográficas, antropométricas, clínicas y de tratamiento
| Características demográficas y antropométricas de los pacientes (n=32) | |
|---|---|
| Sexo (varón), n (%) | 21 (65,6) |
| Edad (años), m (DE) | 10,6 (3,55) |
| DE talla, m (DE) | -1,95 (1,92) |
| DE peso, m (DE) | 0,09 (1,74) |
| DE IMC, me (RIQ) | -0,99 (-1,39- 0,00) |
| Características clínicas de los pacientes (n=32) | |
| Etiología de osteoporosis secundaria, n (%) | |
| Neurológica | 19 (59,4) |
| Hematológica | 6 (18,8) |
| Otras | 7 (21,9) |
| Bipedestación, n (%) | 20 (62,5) |
| Deambulación, n (%) | 14 (43,8) |
| Fracturas pretratamiento, me (RIQ) | 1 (1-2) |
| Presencia de fracturas vertebrales (sí), n (%) | 12 (38,7) |
| ZDMOclapretratamiento, m (DE) | -2,46 (±0,96) |
| Edad primera fractura (años), m (DE) | 8,9 (± 3,5) |
| Tratamientos recibidos (n=32) | |
|---|---|
| Corticoesteroides sistémicos, n (%) | 8 (25) |
| Antiepilépticos, n (%) | 11 (34,4) |
| Suplementos vitamina D3, n (%) | 23 (71,9) |
| Fisioterapia, n (%) | 20 (62,5) |
| Características del tratamiento con bisfosfonatos (n=32) | |
|---|---|
| Vía de administración (iv), n (%) | 25 (78,1) |
| Tipo de bifosfonato, n (%) | |
| Pamidronato | 8 (25) |
| Aledronato | 5 (15,6) |
| Zoledronato | 17 (53,1) |
| Risedronato | 2 (6,3) |
| Duración del tratamiento (meses), mediana (RIQ) | 21,5 (14-24) |
| Suspensión del tratamiento, n (%) | 21 (65,6) |
| Motivo de suspensión del tratamiento, n (%) | |
| ZDMOcla> -2 y ausencia de fracturas en un año | 13 (40,6) |
| Ausencia de fracturas | 3 (9,4) |
| Éxitusb | 2 (6,3) |
| Otros | 3 (9,4) |
| Efectos adversos, n (%) | |
| Síndrome pseudogripal | 6 (18,9) |
| Hipocalcemia asintomática | 4 (12,5) |
DE: desviación estándar; IMC: índice de masa corporal; iv: intravenoso; M: media; me: mediana; RIQ: rango intercuartílico; ZDMOcl: Z-score de DMO en columna lumbar.
Pautas de dosificación bisfosfonatos utilizados en la muestra
| Fármaco | Vía de administración | Dosis |
|---|---|---|
| Pamidronato | Intravenosa (diluida en 100-250ml de SSF, infundido en 3-4 horas) | <1 año: 0,5 mg/kg cada 2 meses1–2 años: 0,25-0,5 mg/kg/día 3 días consecutivos cada 3 meses2–3 años: 0,375–0,75 mg/kg/día 3 días consecutivos cada 3 meses> 3 años: 0,5–1 mg/kg/día 3 días consecutivos cada 4 mesesDosis máxima: 60 mg/dosis y 11,5 mg/kg/año |
| Zoledronato | Intravenosa (diluir en 50ml de SSF, infundir en 1 hora) | 0,025-0,05 mg/kg cada 6 -12 mesesDosis máxima: 4 mg |
| Alendronato | Oral | <40 kg: 35 mg/semana>40 kg: 70 mg/semana |
| Risedronato | Oral | <40 kg: 15 mg/semana>40 kg: 30 mg/semana |
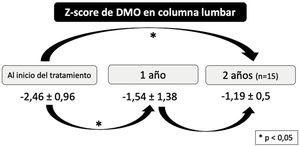
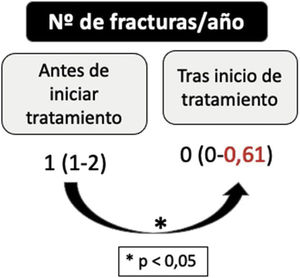
Observamos un incremento significativo en ZDMOcl al año ([-2,46±0,96] vs. [-1,54±1,38]; p<0,001) y a los dos años ([-2,46±0,96] vs. [-1,19±0,5]; p=0,001) del inicio del tratamiento, aunque las diferencias encontradas entre el ZDMOcl al año y a los dos no fueron significativas (fig. 1). El número de fracturas/año también disminuyó de forma significativa tras el inicio del tratamiento (1 [1-2] vs. 0 [0-0,61]; p<0,001), con un porcentaje medio de reducción del 63,75+/- 29,60% (fig. 2).
La magnitud del cambio en ZDMOcl al año del inicio del tratamiento fue mayor en los pacientes que deambulaban (1,88+/- 0,72 vs. 0,55+/-0,82; p=0,07) y se correlacionó positivamente con el percentil de IMC al inicio del tratamiento (rho:0,564; p<0,001) (tabla 3).
Cambio Z-score de DMO en columna lumbar al año de tratamiento según variables estudiadas
| Variables cualitativas | Cambio ZDMOcla | p |
|---|---|---|
| Sexo | ||
| Varón, me (RIQ) | 0,7 (0,38-1,24) | 0,658 |
| Mujer, me (RIQ) | 0,3 (0,00- 1,60) | |
| Fisioterapia | ||
| Sí, me (RIQ) | 0,55 (0,00-0,85) | 0,098 |
| No, me (RIQ) | 0,85 (0,63-1,54) | |
| Suplementación con vitamina D | ||
| Sí, me (RIQ) | 0,70 (0,30 – 1,37) | 0,363 |
| No, me (RIQ) | 0,70 (-0,05 – 1,73) | |
| Corticoterapia sistémica | ||
| Sí, me (RIQ) | 0,75 (0,31- 1,25) | 0,131 |
| No, me (RIQ) | 0,70 (0,08 – 1,4) | |
| Tratamiento antiepiléptico | ||
| Sí, me (RIQ) | 0,4 (-0,1- 0,9) | 0,247 |
| No, me (RIQ) | 0,7 (0,33 -1,55) | |
| Bipedestación | ||
| Sí, me (RIQ) | 0,76 (0,31 – 1,47) | 0,089 |
| No, me (RIQ) | 0,65 (0,00 – 0,85) | |
| Deambulación | ||
| Sí, me (RIQ) | 0,95 (0,64- 1,37) | 0,007 |
| No, me (RIQ) | 0,65 (0,00-0,92) | |
| Presencia fracturas vertebrales | ||
| Sí, me (RIQ) | 0,33 (-0,08 – 1,25) | 0,678 |
| No, me (RIQ) | 0,70 (0,40 – 1,10) | |
| Vía administración bisfosfonato | ||
| IV, me (RIQ) | 0,70 (0,15 – 0,90) | 0,671 |
| Oral, me (RIQ) | 1,37 (0,30 – 1,60) | |
| Suspensión del tratamiento | ||
| Sí, me (RIQ) | 0,8 (0,30 – 1,55) | 0,155 |
| No, me (RIQ) | 0,4 (-0,1 – 0,71) | |
| Presencia efectos secundarios | ||
| Sí, me (RIQ) | 0,70 (0,04 – 2,1) | 0,852 |
| No, me (RIQ) | 0,70 (0,00 – 1,24) | |
| Variables cuantitativas | Coeficiente rho de Spearman | p |
|---|---|---|
| Edad (años) | -0,219 | 0,229 |
| DE de talla al inicio del tratamiento | -0,096 | 0,606 |
| DE de peso al inicio del tratamiento | -0,359 | 0,064 |
| DE de IMC al inicio del tratamiento | 0,587 | <0,001 |
| Z-score al inicio del tratamientoa | -0,182 | 0,319 |
| Fracturas/añob | 0,235 | 0,195 |
| Duración tratamiento (meses) | -0,179 | 0,326 |
DE: desviación estándar; IMC: índice de masa corporal; me: mediana; RIQ: rango intercuartílico; ZDMOcl: Z-score de DMO en columna lumbar.
El descenso del número de fracturas/año fue mayor en los pacientes con menor tasa inicial de fracturas (rho:-0,47; p=0,006) y cuanto mayor era el Z-score al inicio del tratamiento (rho:-0,47; p=0,07) (tabla 4).
Descenso n.° fracturas/año (%) según variables estudiadas
| Variables cualitativas | % reducción fracturas | p |
|---|---|---|
| Sexo | ||
| Varón, me (RIQ) | 100 (20,88-100,00) | 0,870 |
| Mujer, me (RIQ) | 100 (17,31 -100,00) | |
| Fisioterapia | ||
| Sí, me (RIQ) | 100,00 (100,00-100,00) | 0,157 |
| No, me (RIQ) | 91,75 (0,00-100,00) | |
| Suplementación con vitamina D | ||
| Sí, me (RIQ) | 100,00 (0,00-100,00) | 0,114 |
| No, me (RIQ) | 100,00 (100,00-100,00) | |
| Corticoterapia sistémica | ||
| Sí, me (RIQ) | 100,00 (0,00 - 100,00) | 0,413 |
| No, me (RIQ) | 100,00 (83,50 – 100,00) | |
| Tratamiento antiepiléptico | ||
| Sí, me (RIQ) | 100,00 (23,08 -100,00) | 0,811 |
| No, me (RIQ) | 100,00 (0,00 – 100,00) | |
| Bipedestación | ||
| Sí, me (RIQ) | 100,00 (0,00 – 100,00) | 0,852 |
| No, me (RIQ) | 100,00 (23,08 – 100,00) | |
| Deambulación | ||
| Sí, me (RIQ) | 100,00 (0,00 – 100,00) | 0,114 |
| No, me (RIQ) | 100,00 (100,00 -100,00) | |
| Fracturas vertebrales | ||
| Sí, me (RIQ) | 100,00 (0,00 – 100,00) | 0,359 |
| No, me (RIQ) | 100,00 (80,77 – 100,00) | |
| Vía administración bisfosfonato | ||
| IV, me (RIQ) | 100,00 (0,00 -100,00) | 0,214 |
| Oral, me (RIQ) | 100,00 (100,00 – 100,00) | |
| Suspensión del tratamiento | ||
| Sí, me (RIQ) | 100,00 (83,50 – 100,00) | 0,576 |
| No, me (RIQ) | 100,00 (0,00 – 100,00) | |
| Efectos secundarios | ||
| Sí | 100,00 (100,00 – 100,00) | 0,413 |
| No | 100,00 (0,00 – 100,00) | |
| Variables cuantitativas | Coeficiente rho de Spearman | p |
|---|---|---|
| Edad (años) | 0,193 | 0,307 |
| DE de talla al inicio del tratamiento | 0,011 | 0,957 |
| DE de peso al inicio del tratamiento | 0,501 | 0,065 |
| DE de IMC al inicio del tratamiento | 0,124 | 0,514 |
| Z-score al inicio del tratamientoa | 0,525 | 0,030 |
| Fracturas/añob | -0,47 | 0,006 |
| Duración tratamiento (meses) | 0,252 | 0,179 |
DE: desviación estándar; IMC: índice de masa corporal; me: mediana; RIQ: rango intercuartílico.
Se reportaron 10 eventos adversos leves (6 síndromes pseudogripales y 4 hipocalcemias asintomáticas) en 7 pacientes (22%), todos ellos en relación con bisfosfonatos intravenosos. No se halló relación entre los eventos adversos y el sexo, la edad, la patología de base, la vía de administración del antirresortivo ni ninguna de las demás variables estudiadas.
Dos pacientes fallecieron, estando en período de tratamiento, por complicaciones de su enfermedad de base.
DiscusiónA pesar de la reciente generalización en el uso de bisfosfonatos en OIS y de la recomendación del mismo en diferentes consensos de expertos3,7, los estudios sobre su efectividad y seguridad en dicha patología son escasos8,11–14. La mayoría evalúan su papel en el contexto de patologías primarias determinadas11,12,14, y con frecuencia no se valora la reducción en la tasa de fracturas como variable resultado12, o son trabajos realizados con tamaños de muestra muy pequeños11,14.
En nuestro estudio se recogieron pacientes de 6 centros hospitalarios nacionales diferentes.
Respecto a los datos de efectividad, aunque la última revisión de la Cochrane concluyó que no existía evidencia suficiente para recomendar el tratamiento con bisfosfonatos en pacientes pediátricos con osteoporosis secundaria15, estudios realizados con posterioridad han demostrado un incremento en la DMO medida mediante DXA en diferentes grupos de pacientes pediátricos8,11,14,16,17, de forma congruente con nuestros resultados, que mostraron un incremento estadísticamente significativo del Z-score al año del inicio del tratamiento antirresortivo, y que se mantenía a los dos años.
En cuanto al efecto en la tasa de fracturas por fragilidad, son escasos los trabajos que han evaluado este parámetro8,11,14,17, arrojando resultados contradictorios. En el trabajo realizado por Nasomyont et al. no se hallaron diferencias en la incidencia de fracturas en pacientes con osteoporosis primaria, secundaria e inducida por corticoides, tratados con bisfosfonatos intravenosos8. Sin embargo, hasta el 20% de su muestra no cumplía criterios de osteoporosis según la ISCD y el 12% no había presentado ninguna fractura antes del inicio del tratamiento con bisfosfonatos. Además, algunos de los pacientes incluidos habían recibido bisfosfonatos orales antes de iniciar zoledronato o pamidronato intravenosos, por lo que la incidencia de fracturas pretratamiento podría haber sido infraestimada. Tampoco halló diferencias en la tasa de fracturas el estudio realizado por Rooney et al., probablemente porque la mayor parte de los pacientes incluidos no cumplían los criterios de osteoporosis de la ISDC y la tasa de fracturas pretratamiento era extremadamente baja17. En consonancia con nuestros resultados, sí que hallaron una reducción significativa en la tasa de fracturas tras el inicio del bisfosfonato los estudios realizados por Moon et al. en pacientes con parálisis cerebral infantil y osteoporosis secundaria14, y los llevados a cabo por Nasomyont et al. en pacientes con atrofia musculoespinal11, que mostraron una reducción estadísticamente significativa en la tasa de fracturas.
Respecto a las variables que podrían influir en la efectividad de los bisfosfonatos, no han sido previamente estudiadas en niños. En adultos, sin embargo, hay trabajos que señalan que el número de fracturas disminuye más en mujeres y se relaciona de forma directa con el índice FRAX18, un score que valora el riesgo de presentar fracturas por fragilidad en función de edad, sexo, IMC, consumo de tóxicos como alcohol y tabaco, tratamiento con glucocorticoides, antecedentes familiares de fractura de cadera, fracturas previas, presencia de patologías fuertemente asociadas a osteoporosis y DMO en cuello femoral19. El grupo de pacientes en el que la reducción de las fracturas fue mayor, fueron mujeres con osteoporosis inducida por corticoides18. Curiosamente, en nuestro trabajo, se ha observado mayor efectividad de los bisfosfonatos en los pacientes que tienen menor riesgo de presentar fracturas por fragilidad, que se encuentran en estadios más iniciales de la enfermedad, como son los pacientes que mantienen la deambulación, con menor incidencia de fracturas y Z-score más elevado al inicio del tratamiento. No se observaron diferencias con respecto al sexo, ni tampoco en función de si habían recibido corticoides orales. Probablemente, estas diferencias se deban a las peculiaridades del metabolismo óseo del niño, que combina el remodelado óseo con el modelado, proceso fundamental para el crecimiento del hueso en la etapa infantil20. Además, también influyen las diferencias hormonales de ambas etapas, ya que los estudios publicados en adultos incluyen mujeres posmenopaúsicas. Por último, al contrario de lo que ocurre en adultos, no encontramos diferencias en función del tratamiento con corticoides. Este hecho puede ser debido a que las pautas de corticoides en niños se prescriben habitualmente a dosis bajas y se mantienen el menor tiempo posible, y al mayor potencial de recuperación del tejido óseo del niño respecto al adulto. Además, cabe destacar que en las variables del estudio únicamente se recogió si los pacientes habían recibido o no en algún momento a lo largo de su vida, sin analizar la dosis o la duración.
Sin embargo, tanto los estudios en adultos como nuestro trabajo, muestran una mejor respuesta en los pacientes con mayor IMC18. Si tenemos en cuenta que los pacientes de nuestra muestra tenían, en general, DE de IMC bajas (tabla 1), aquel dato podría reflejar cómo un adecuado estado nutricional repercute positivamente en la adquisición de masa ósea. Además, el estímulo mecánico que recibe el hueso en aquellos pacientes con mayor IMC21, podría favorecer el efecto de los bisfosfonatos.
Es probable que otros factores, como el estadio puberal o la patología de base del paciente, influyan en la efectividad de los bisfosfonatos, sin embargo esto no pudo ser demostrado con nuestro trabajo en el que el tamaño muestral fue pequeño y la metodología, retrospectiva.
En cuanto al perfil de seguridad, el porcentaje de eventos adversos publicado en diferentes trabajos sobre bisfosfonatos en osteoporosis infantil secundaria oscila entre el 1616 y el 48%8, según la patología de base y la proporción de bisfosfonatos intravenosos utilizados. En nuestro estudio, el 22% de los pacientes presentaron algún evento adverso, todos ellos en relación con bisfosfonatos intravenosos. En otros estudios se ha observado una mayor incidencia de efectos secundarios en estos frente a los de administración oral22, lo que nos podría llevar a plantearnos, dado que no parecen presentar diferencias en su eficiencia, si deberían ser de elección los bisfosfonatos orales en el tratamiento de la OIS. Sin embargo, es importante destacar que, tanto en nuestro estudio como en otros publicados, los bisfosfonatos orales se indican únicamente en aquellos pacientes que pueden tragar el comprimido entero y mantener posición erguida 30 min tras su administración y que no presentan factores de riesgo de esofagitis, el efecto adverso más temido cuando los bisfofonatos son usados por esta vía. En este grupo de pacientes, podrían ser de elección los bisfosfonatos orales, sin embargo de no cumplirse estos requisitos, la recomendación actual es utilizar la vía intravenosa. Además, los efectos adversos observados con bisfosfonatos intravenosos son leves, como síndrome pseudogripal tras la primera infusión o hipocalcemia asintomática. Esto, unido a la comodidad de la posología del zoledronato, hace que sea uno de los más utilizados en pediatría, como refleja nuestro trabajo.
Este estudio presenta algunas limitaciones. Al ser un trabajo retrospectivo, algunas variables importantes como el aporte de calcio en la dieta, parámetros de actividad física o la dosis acumulada de corticoides no pudieron ser recogidos. Además, el tiempo medio de seguimiento fue insuficiente para poder valorar efectividad y seguridad a largo plazo y el tamaño muestra fue pequeño. Igualmente, no valoramos la evolución tras la suspensión del tratamiento.
Sin embargo, sí que podemos concluir que los bisfosfonatos constituyen una alternativa efectiva en OIS. La respuesta al tratamiento parece ser mejor en pacientes con buen estado nutricional, menor edad y estadios precoces de la enfermedad.
Además, aunque presentan efectos adversos leves relativamente frecuentes, podemos afirmar que son fármacos seguros en la infancia.
En cualquier caso, son necesarios estudios prospectivos y con mayor tamaño de muestra para poder conocer mejor la eficacia y seguridad de los bisfosfonatos en osteoporosis infantil secundaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los resultados de este trabajo fueron presentados en el Congreso SERPE 2019, celebrado en Madrid del 21 al 23 de noviembre de 2019.