El tratamiento con radioyodo en la enfermedad de Graves (EG) es una opción terapéutica curativa cada vez más utilizada en niños por encima de 5 años. En Estados Unidos su uso está muy extendido, pero en Europa sigue existiendo controversia respecto a su indicación en la edad pediátrica.
ObjetivoPresentar nuestra experiencia con la administración de I131 en la EG en edad pediátrica y analizar su eficacia y seguridad.
Pacientes y métodosEstudio retrospectivo descriptivo de los pacientes pediátricos (< 18 años) diagnosticados de EG en nuestro hospital desde 1982 hasta 2012. Al alcanzar la pubertad, se ofreció una opción curativa a aquellos pacientes que no habían respondido al tratamiento con fármacos antitiroideos (AT). Analizamos las características de los pacientes, niveles de hormona tirotropa, T3 y T4, y autoanticuerpos, respuesta a AT, frecuencia de la remisión de la enfermedad post-I131, aparición de hipotiroidismo y efectos secundarios del I131.
ResultadosDesde 1982 hasta 2012 fueron diagnosticados de EG 50 pacientes. Todos recibieron como tratamiento inicial AT, con una duración media 35,3±25,9 meses. Se consiguió remisión permanente en el 46%. Se realizó tiroidectomía a 5 pacientes y se administró I131 a 14 pacientes. La dosis de yodo administrada osciló entre 8,5 y 13 mCi (10,9±1,09). Se obtuvo remisión en el 100%. La tasa de hipotiroidismo permanente fue del 90%. No se observaron progresión de la oftalmopatía ni efectos secundarios en ningún paciente tratado con I131.
ConclusionesEl tratamiento con 131I en la EG pediátrica es seguro, lleva a la remisión completa a costa de hipotiroidismo y no exacerba la oftalmopatía. Puede considerarse su utilización en mayores de 5 años cuando no existe respuesta a AT o ante efectos secundarios importantes con esta medicación.
Radioiodine is an important therapeutic option in young patients with Grave's disease (GD). In the United States it is a widespread therapy, but in Europe its use in paediatrics is still controversial.
AimTo report our experience in radioiodine therapy of paediatric GD patients and analyse its effectiveness and safety.
Patients and methodsWe retrospectively studied our paediatric population (<18 years of age) with GD, diagnosed from 1982 to 2012. A curative option was offered to patients who did not respond to anti-thyroid drug (AT) at puberty. We analysed, the patient characteristics, TSH, T4, T3 and thyroid antibodies levels, AT response, remission post I131, side effects, and hypothyroidism rates.
ResultsA total of 50 patients were diagnosed with GD from 1982 to 2012. All patients received AT as initial treatment (mean duration: 35.3±25.9 months). Permanent remission was achieved in 46%. Thyroidectomy was performed in 5 patients, and 14 patients received I131 (mean dose: 10.9±1.09 mCi). Remission with I131 was obtained in 100%. The rate of permanent hypothyroidism was 90%. There was no progression of ophthalmopathy or side effects in any patients treated with I131.
ConclusionRadioiodine treatment of paediatric GD patients is safe, leads to complete remission at the expense of hypothyroidism, and does not exacerbate ophthalmopathy. It can be considered in patients older than 5 years, who do no not respond to AT or with significant side effects with this medication.
La enfermedad de Graves (EG), de origen autoinmunitario, es la causa más frecuente de hipertiroidismo en niños y adolescentes1. Su incidencia en la edad pediátrica se estima entre 0,1 casos/100.000 niños antes de la pubertad y 3/100.000 durante la adolescencia2,3. Es más frecuente en mujeres, con una relación 3-5 a 14.
El objetivo del tratamiento de la EG en la edad pediátrica es el control de la hiperfunción tiroidea para evitar sus consecuencias negativas con la menor incidencia posible de efectos secundarios5. Las opciones terapéuticas incluyen los fármacos antitiroideos (AT), el radioyodo y la tiroidectomía, ninguna de ellas exenta de posibles efectos adversos. Actualmente, la elección del tratamiento varía considerablemente entre distintos países e instituciones, y la determinación de cuál es la mejor opción terapéutica sigue siendo cuestión de debate. La edad del paciente, el tipo de presentación y la probabilidad de remisión son factores que se deben tener en cuenta al considerar la opción terapéutica más adecuada para cada paciente.
La mayoría de los niños y adolescentes con EG responden a la terapia con AT, que es la primera opción terapéutica, consiguiendo en el 87-100% una función tiroidea normal en semanas o meses6. Sin embargo, los AT no son un tratamiento curativo, ya que la tasa de recaídas es alta. En nuestra experiencia, con tratamiento con AT con una duración prolongada conseguimos remisión en el 40% de los casos, con pocos efectos secundarios7. En Europa y Asia el tratamiento con AT es el tratamiento establecido como primera opción terapéutica, pero en la mayoría de los casos no resultan eficaces, por lo que se requiere una opción curativa y en estos casos se considera la cirugía o el I131131I
La tiroidectomía es un tratamiento efectivo, pero requiere la participación de centros con experiencia8 y se asocia a mayor tasa de complicaciones en la edad pediátrica que en adultos9. Es el tratamiento de elección cuando se requiere un tratamiento curativo y han fallado los AT y el tratamiento con 131I no está indicado por la edad del paciente, presencia de un bocio grande u oftalmopatía grave.
En Estados Unidos, el tratamiento con radioyodo está muy extendido, incluso, a veces, como primera elección terapéutica. La American Thyroid Association y la American Association of Clinical Endocrinologist establecen que es un tratamiento seguro en la edad pediátrica10. No está indicado en menores de 5 años, dado que los efectos de la radiación son más importantes a menor edad del paciente. En niños entre los 5 y los 10 años se utiliza en EE. UU. si la dosis calculada requerida no supera los 10 mCi. En cualquier caso, aunque las dosis no están aún establecidas, recomiendan la utilización de dosis ablativas>150 mCi/g de glándula para evitar el riesgo teórico de cáncer10.
En Europa, la utilización de yodo radiactivo en pacientes menores de 21 años se ha incrementado en los últimos años (0,2% del total en 1990 y 1,5% en 2008)11, aunque sigue siendo una opción muy debatida, debido a la controversia respecto a los posibles riesgos de la radiación en la edad pediátrica12. Los resultados de los estudios en la edad pediátrica son heterogéneos.
El objetivo del presente estudio es presentar nuestra experiencia del tratamiento con I131 en la EG en edad pediátrica y analizar tanto su eficacia como los efectos adversos del mismo.
Pacientes y métodosSe diseñó un estudio retrospectivo descriptivo de los pacientes pediátricos diagnosticados de EG en nuestro hospital desde 1982 hasta 2012. Para la selección de pacientes se revisaron las historias clínicas y se utilizó el sistema informático Excalibur de registro de informes de nuestro hospital. Se excluyó a los pacientes con edad superior a 18 años al diagnóstico de la enfermedad.
En todos los casos, el diagnóstico se sospechó en función de la historia clínica y exploración física. La hiperfunción tiroidea se confirmó con la determinación de TSH por RIA (valor normal: 0,350-4.950 uU/ml), T4 total (VN: 4,5-12,5μg/dl) o libre (VN: 0,7-1,48ng/ml) y T3 total (VN: 80-180ng/dl) o libre (VN: 1,71-4,53pg/dl). El estudio de autoinmunidad incluyó la determinación de inmunoglobulina estimulante del tiroides (TSI), antiperoxidasa (anti-TPO) y antitiroglobulina (anti-TG) mediante la técnica ELISA, considerando positivos valores por encima de 1,5, 100 y 344 U/ml, respectivamente. Se realizaron una ecografía y, en algunos casos, una gammagrafía, para la determinación del tamaño, la morfología y la estructura de la glándula tiroidea.
Todos los pacientes recibieron inicialmente tratamiento con fármacos AT (metimazol) a dosis entre 0,5 a 1mg/kg/día. El seguimiento incluyó revisiones periódicas con determinación analítica de la función tiroidea cada 4 semanas, hasta que se consiguió el estado eutiroideo y, posteriormente, cada 3-6 meses.
Se recogieron los datos de la historia clínica: edad, sexo, antecedentes personales y familiares de enfermedades tiroideas y autoinmunitarias, exploración física incluyendo la presencia de bocio y oftalmopatía, y pruebas complementarias (TSH, T4T/L y T3T/L, ecografía y gammagrafía tiroidea), tratamientos recibidos (AT, radioyodo, tiroidectomía), recidivas, efectos secundarios y evolución clínica.
Los pacientes que recibieron eventualmente tratamiento con yodo y sus familias fueron informados y aceptaron cumplir las medidas preventivas recomendadas tras la administración de I131. Se descartó embarazo en todas las pacientes en edad fértil antes de administrar el tratamiento.
La dosis de I131 fue calculada por el servicio de Medicina Nuclear según el porcentaje de captación tiroidea a las 24 h de una dosis media de 6 mCi de Tc99m en forma de pertecnetato.
Analizamos las características de los pacientes, la frecuencia de la remisión de la enfermedad post I131, tiempo hasta la aparición de hipotiroidismo y los efectos secundarios del I131.
Para el análisis de los datos se utilizó el programa SPSS versión 2011. Los datos se expresan en porcentajes, mediana y rango.
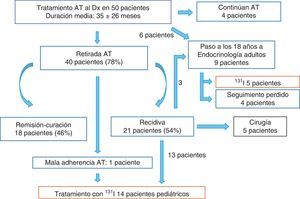
ResultadosDesde 1982 hasta 2012 fueron diagnosticados de EG 50 pacientes, 7 varones (15%) y 43 mujeres (85%), con una edad media ± desviación estándar de 11,6±4,2 años. Todos recibieron como tratamiento inicial AT (metimazol), con una duración media 35,3±25,9 meses. Se consiguió remisión permanente en el 46%. Entre las afecciones asociadas destacan la diabetes mellitus tipo 1 (5 pacientes) y la enfermedad celíaca (3 pacientes). Las características de los pacientes al diagnóstico de EG se resumen en la tabla 1. La evolución queda reflejada en la figura 1. Al llegar la pubertad, se ofreció terapia resolutiva a 19 pacientes. Se realizó una tiroidectomía a 5 pacientes (4 por bocio grande y en un caso por elección del paciente), y se administró I131 a 14 pacientes (13 por recaída tras suspender el tratamiento con AT y en un caso antes, por mal cumplimiento del mismo). La dosis de yodo administrada osciló entre 8,5 y 13 mCi (10,9±1,09). Precisaron 2 dosis de I131 2 pacientes y 3 dosis una paciente (en ellos los niveles de TSI al retirar los AT fueron 12,9, 25,30 y 11,9 U/l y los de TPO 162, > 2.600 y 697 U/l, respectivamente, obteniendo la remisión en el 100%. No se observaron efectos secundarios en ningún paciente tratado con I131. La tabla 2 resume el análisis de los pacientes tratados con I131.
Características de los pacientes diagnosticados de enfermedad de Graves (n=50)
| Edad (años) | 11,6±4,2 |
| Sexo (mujeres) | 85% |
| Bocio | 86% |
| Oftalmopatía leve/grave | 41%/0 |
| Remisión con antitiroideos | 46% |
| Tiempo medio de recaída tras AT (meses) | 7,87±5,2 |
| Autoinmunidad (TSI/anti-TPO/anti-TG) | 79%/78%/50% |
| Antecedentes familiares de enfermedad tiroidea | 39% |
Características de los pacientes tratados con en la edad pediátrica (n=14)
| Edad al administrar 131I (años) | 15,4 ± 1,54 |
| Bocio | 85% |
| Oftalmopatía leve/grave | 42%/0% |
| Tiempo AT previos (meses) | 34,6±31,7 |
| Hipotiroidismo post of t | 90% |
| Tiempo hasta hipotiroidismo (días) | 53,2±27,7 |
| Tiempo de seguimiento después del I131 (meses) | 27±11 |
| Efectos secundarios de I131 | Ninguno |
En nuestra serie de 50 pacientes, encontramos una distribución de edad y sexo similar a la descrita en estudios previos, con prevalencia de sexo femenino 5:1 y un pico de edad al diagnóstico de 11 años2,13-15. La presencia de bocio y oftalmopatía al diagnóstico también fue similar a la descrita16.
La enfermedad autoinmunitaria asociada con más frecuencia en nuestra serie fue la diabetes mellitus tipo 1 (5 pacientes, 10%), aunque esta asociación no se describe en otras series y un estudio recientemente publicado describe una prevalencia de EG en pacientes pediátricos con diabetes mellitus similar a la de la población general (0,53%)17. Recientemente, se ha descrito una prevalencia superior de EG en pacientes con síndrome de Down (6,5%)18, aunque en nuestra serie no encontramos ningún caso.
Encontramos una tasa de remisión prolongada con AT del 46%, discretamente más alta a la evidenciada en otros estudios19,20, probablemente en relación con una duración más prolongada del tratamiento. Entre los factores relacionados con la probabilidad de remisión con AT se encuentran: mayor edad, niveles más bajos de hormonas tiroideas en la presentación y el estado eutiroideo a los 3 meses de tratamiento19-21. En nuestro estudio no encontramos asociación con estos factores. Sin embargo, ningún paciente que requirió dosis altas de AT consiguió la remisión, lo que parece ser un factor predictivo de mala respuesta al tratamiento7.
Todos los pacientes que recibieron I131 en nuestro estudio presentaron remisión de la enfermedad. Sin embargo, a pesar de utilizar dosis altas, 3 pacientes requirieron dosis repetidas de yodo para conseguir la remisión de la enfermedad, como también describen otros autores22,23. Los factores que han sido relacionados con una pobre respuesta al I131 son una mayor edad de los pacientes, el tratamiento prolongado con AT y niveles altos de hormonas tiroideas y de autoanticuerpos, sobre todo anti-TPO24,25. Las 3 pacientes que precisaron dosis repetidas tenían una edad similar a la media del total de pacientes tratados y recibieron AT previos con una duración de 30 meses, 3 meses y 7 meses, que no podemos considerar más prolongada que la media (34±31 meses). Sin embargo, los niveles de hormonas tiroideas fueron altos al diagnóstico (T4 total: > 100, 77 y 24ng/ml) y T3 (2,2, 5,8 y 600pg/dl) y muy positivos de TSI en los 3 casos, por lo que consideramos que estos pueden ser factores predictores de pobre respuesta al I131.
La tasa de hipotiroidismo permanente (90%) fue similar a otros estudios en los que las dosis administradas fueron similares6,26,27 y superior a aquellos en que las dosis utilizadas fueron más bajas24. La mayoría de los autores consideran conseguir el hipotiroidismo como objetivo del tratamiento y recomiendan dosis ablativas (> 150 mCi/g de glándula) para evitar la persistencia de tejido glandular residual parcialmente irradiado, con potencial riesgo de desarrollo de cáncer10. Sin embargo, otros autores abogan por utilizar dosis más bajas, con las que la tasa de hipotiroidismo es más baja, y describen ausencia de efectos secundarios durante 12 años de seguimiento tras la administración de I13124.
En nuestro estudio no se observaron progresión de la oftalmopatía ni otros efectos secundarios tras la administración de I13122,24,28. La preocupación acerca del riesgo de neoplasias tras la administración de yodo se basa en el aumento de cáncer de tiroides observado en niños menores de 6 años expuestos a radiación externa en Hiroshima y Chernóbil, pero no se ha demostrado aumento del riesgo en población con EG tratada con I131. Sin embargo, existen pocos estudios en población pediátrica, las cohortes estudiadas son pequeñas, con un seguimiento a corto-medio plazo y son también heterogéneos en cuanto a las características de los pacientes y las dosis administradas. El estudio publicado con el seguimiento más largo, en una población de 116 pacientes a lo largo de 36 años, no mostró desarrollo de cáncer de tiroides ni leucemia en ningún paciente29. Hay que destacar el pequeño tamaño muestral, lo que hace que el poder estadístico del estudio sea insuficiente para poder asumir conclusiones. Este estudio se incluye en un metaanálisis publicado recientemente que analiza los resultados de una población total de 1.874 pacientes pediátricos con EG que recibieron I131 procedentes de 29 estudios distintos y describe una tasa de curación del 49,78%, una incidencia de hipotiroidismo del 37,85%, un 6,3% de recaídas y una incidencia de efectos adversos del 1,5%, entre los que se consideran: carcinogénesis, leucemia y defectos genéticos inducidos por la radiación5. Otro efecto secundario descrito tras la administración de I131 es la hipocalcemia por afectación de la glándula paratiroides30, que no ha sido evidenciada en ninguno de nuestros pacientes.
En nuestra opinión y experiencia, el tratamiento con I131 es una alternativa segura y eficaz en pacientes puberales y consideramos más recomendable utilizar dosis ablativas con el objetivo de la destrucción de la glándula y la inducción de hipotiroidismo.
En conclusión, el tratamiento con 131I en la EG pediátrica es seguro, lleva a la remisión completa a costa de hipotiroidismo y no exacerba la oftalmopatía. Puede considerarse en pacientes puberales o por lo menos mayores de 5 años, como opción curativa cuando no existe respuesta a AT o ante efectos secundarios importantes con esta medicación. La cirugía quedaría restringida a los casos con bocio grande, oftalmopatía grave o niveles muy altos de anticuerpos anti-TPO. Sin embargo, serían necesarios estudios en grupos amplios y homogéneos de pacientes que incluyan seguimientos prolongados para determinar las dosis más adecuadas y la seguridad a largo plazo.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.