La profilaxis con arándano americano de la infección de orina recurrente infantil se ha mostrado eficaz en el modelo experimental del adulto. Existen pocos datos sobre su eficacia, seguridad y dosis recomendadas en la población pediátrica.
MétodosSe desarrolla un ensayo clínico controlado, doble ciego en fase iii en niños mayores de un mes de edad para evaluar la eficacia y seguridad del arándano americano en la infección urinaria recurrente infantil. Se parte del supuesto de no inferioridad del arándano americano frente a trimetoprima. El análisis estadístico se realiza mediante un análisis de Kaplan Meier.
ResultadosSe reclutan 85 pacientes menores de un año de edad y 107 mayores de un año. Setenta y cinco pacientes reciben arándano y 117 trimetoprima. El porcentaje acumulado de infección de orina asociado a la profilaxis con arándano en menores de un año fue de 46% (IC 95%: 23-70) en niños y del 17% (IC 95%: 0-38) en niñas, con eficacia a las dosis utilizadas inferior a trimetoprima. En los niños mayores de un año de edad el arándano se mostró no inferior a trimetoprima, con un porcentaje acumulado de infección de orina de 26% (IC 95%: 12-41). El arándano americano fue bien tolerado, no registrándose efectos adversos.
ConclusionesNuestro estudio confirma que el arándano americano es seguro y eficaz en la profilaxis de infección urinaria recurrente en lactantes y niños. Con las dosis utilizadas su eficacia no es inferior a la observada para trimetoprima entre los mayores de un año de edad (Clinical Trials Registry ISRCTN16968287).
Cranberry prophylaxis of recurrent urinary tract infection in infants has proven effective in the experimental model of the adult. There are few data on its efficacy, safety and recommended dose in the pediatric population.
MethodsA controlled, double-blind Phase III clinical trial was conducted on children older than 1 month of age to evaluate the efficacy and safety of cranberry in recurrent urinary tract infection. The assumption was of the non-inferiority of cranberry versus trimethoprim. Statistical analysis was performed using Kaplan Meier analysis.
ResultsA total of 85 patients under 1 year of age and 107 over 1 year were recruited. Trimethoprim was prescribed to 75 patients and 117 received cranberry. The cumulative rate of urinary infection associated with cranberry prophylaxis in children under 1 year was 46% (95% CI; 23-70) in children and 17% (95% CI; 0-38) in girls, effectively at doses inferior to trimethoprim. In children over 1 year-old cranberry was not inferior to trimethoprim, with a cumulative rate of urine infection of 26% (95% CI; 12-41). The cranberry was well tolerated and with no new adverse effects.
ConclusionsOur study confirms that cranberry is safe and effective in the prophylaxis of recurrent urinary tract infection in infants and children. With the doses used, their efficiency is not less than that observed for trimethoprim among those over 1 year-old. (Clinical Trials Registry ISRCTN16968287).
Aunque controvertida, la evidencia existente en la actualidad respalda el uso de antibióticos en bajas dosis durante largos periodos de tiempo para el control de las infecciones urinarias recurrentes, con un número necesario para tratar (NNT) para evitar una infección de orina de 1,91. Sin embargo, uno de los principales problemas de prescribir antibióticos a dosis bajas por largos periodos de tiempo es el incremento de las resistencias bacterianas a antibióticos y el efecto de esta terapia sobre la selección de flora bacteriana multirresistente. Desde hace varias décadas el arándano americano se utiliza en la prevención de las infecciones urinarias recurrentes del adulto1. La mayoría de los estudios han ido dirigidos a poblaciones con mayor riesgo de desarrollar infecciones urinarias, tales como gestantes o ancianos; en todos ellos se concluye que, aunque el efecto del arándano americano parece ser beneficioso, se desconoce la dosis óptima y su posible utilidad en la población pediátrica, existiendo pocos datos sobre su seguridad en esta población. Las infecciones de orina son relativamente frecuentes en niños, observándose en un 8% de las niñas y en un 2% de los niños. La recurrencia de infección urinaria después de pielonefritis puede llegar a ser del 20%2. Aunque la efectividad de la profilaxis antibiótica para la prevención de la infección del tracto urinario no ha sido demostrada, el concepto posee plausibilidad biológica3,4. Algunas evidencias2,5 parecen indicar que la profilaxis con antibióticos no modifica la frecuencia de cicatrices renales, incluso en los pacientes con reflujo de alto grado, cuestionándose su utilidad. Otros estudios6 demuestran que los pacientes pediátricos con infección de orina recurrente en profilaxis con trimetoprima-sulfametoxazol a bajas dosis experimentan un descenso del riesgo de infección de orina de un 6% comparados con placebo (IC 95%: 1-11). Por otro lado, la profilaxis con cefalosporinas se relacionan con un espectro de uropatógenos productores de betalactamasas o multirresistentes; esta circunstancia ha sido utilizada por algunos autores7 para recomendar la profilaxis con trimetoprima relacionada con menos inducción de resistencias.
El presente estudio aborda el estudio de la eficacia y seguridad del arándano americano en la población infantil como profilaxis de la infección urinaria recurrente. Se parte del supuesto de no inferioridad con respecto a intervenciones profilácticas que ya han demostrado su eficacia, como es el caso de la trimetoprima.
MétodosEl estudio se plantea como un ensayo clínico aleatorizado en fase iii con intervención enmascarada al paciente y al investigador, con 2 ramas de intervención: arándano americano al 3% en jarabe de glucosa y trimetoprima. Durante un periodo de 2 años se reclutan niños atendidos en las consultas de nefrología y urología infantil de nuestro hospital con edades comprendidas entre un mes y 13 años. La duración máxima del seguimiento de cada paciente reclutado es de un año. El ensayo fue aprobado por el comité de ética local y se solicitó en todos los casos consentimiento informado escrito de los padres de los pacientes.
Se valoran como criterios de inclusión un antecedente de infección urinaria recurrente (más de 2 episodios de infección en los últimos 6 meses) asociada o no a reflujo vesicoureteral de cualquier grado. Los criterios de exclusión en el reclutamiento fueron la coexistencia de la infección de orina con otras enfermedades infecciosas, la coexistencia de enfermedades metabólicas, la insuficiencia renal crónica, la litiasis renal, la insuficiencia hepática, la existencia de alergia o intolerancia a alguno de los componentes del arándano o trimetoprima, la existencia de discrasias sanguíneas y el deseo manifiesto del responsable legal de no participar en el estudio.
Una vez seleccionado un paciente y firmado el consentimiento informado para participar en el ensayo se le asigna un número de registro. El investigador, tras incluir a un paciente en el ensayo, entrega a los padres una cartulina con el número de identificación; esta cartulina se presenta en el servicio de farmacia hospitalaria para retirar el tratamiento asignado que está enmascarado y etiquetado de acuerdo con la normativa de la Agencia Española del Medicamento.
El extracto de arándano fue cedido por una marca registrada. Para la preparación de las intevenciones se realiza una dispersión de extracto de arándano al 3% en jarabe de glucosa y una suspensión de trimetoprima en jarabe de glucosa a una concentración de 8mg/ml. Se realizó una caracterización del jarabe de arándano, a fin de asegurar el contenido de proantocianidinas administrado y conocer las restantes fracciones polifenólicas8.
El grupo experimental recibe una dosis nocturna de 0,2ml/kg de jarabe de arándano. El grupo de tratamiento estándar recibe una dosis nocturna de 0,2ml/kg de una suspensión enmascarada en color de trimetoprima, para ello se añade colorante CC-1000-WS (E-120), (Lab. CHR-Hansen) a una concentración de 0,1% (no superando las 100ppm permitidas de carmín). La administración debe ser antes de la cena, y de producirse vómito en los 30min siguientes a su administración se repite la dosis íntegra.
Se mantiene en todo momento el principio de intención de tratar.
Para el seguimiento de los pacientes se realizan revisiones periódicas cada 2 meses o a demanda del paciente cuando la sintomatología así lo requiera. Se da al paciente la instrucción de realizar un cultivo de orina ante la presencia de fiebre, síntomas urinarios, vómitos o pérdida de peso. La confirmación de infección urinaria se realiza con sedimento urinario patológico (más de 20 leucocitos por campo) y urocultivo (>100.000UFC/ml) en una muestra de orina recogida al acecho o con bolsa colectora de orina, previa asepsia de meato uretral con clorhexidina, o más de 10.000UFC/ml si la orina se obtuvo tras sondaje.
El cultivo de orina se realiza siempre antes de iniciar cualquier tratamiento antibiótico. Se registran los datos relativos al número de la intervención asignada, los datos clínicos y analíticos de cada una de las revisiones programadas del paciente y los resultados periódicos de los cultivos de orina. La efectividad de una intervención se valora en función del tiempo de permanencia en el estudio sin recurrencia de la infección de orina. Se registra el momento en que se produce la infección de orina que motiva la salida del paciente del estudio.
Para el cálculo del tamaño muestral se estima un riesgo de recurrencia de infección urinaria del 20% durante el primer año en los pacientes que reciben profilaxis antibiótica2,9. Se postula que la profilaxis con arándano americano es equivalente a trimetoprima. Se asume el límite de equivalencia en±10%. El error alfa se estima en 5% y la potencia del estudio en 80%. Con estos datos se obtiene un tamaño muestral de 109 pacientes por grupo.
Control de sesgosLa posibilidad de obtener falsos positivos o negativos en los urocultivos de control del paciente hace que nos planteemos la ocurrencia de un sesgo de información. Existe posibilidad de obtener un urocultivo negativo en pacientes que realmente tienen una infección urinaria si han recibido de forma previa a la recogida de la muestra de orina tratamiento antibiótico. Por ello se insistirá en la necesidad de recoger un urocultivo, de preferencia mediante sondaje, ante cualquier proceso febril antes de iniciar cualquier tratamiento antibiótico prescrito. Se pueden obtener urocultivos positivos por mala técnica en la recogida de orina y contaminación de la orina, los urocultivos positivos a más de un microorganismo acompañados de sedimentos urinarios normales se consideran contaminados y motivan su repetición.
El sesgo de información se pretende evitar además con las técnicas de depuración de los datos, el uso de bases de datos informáticas con sistemas de limitación en la entrada de datos erróneos (fechas).
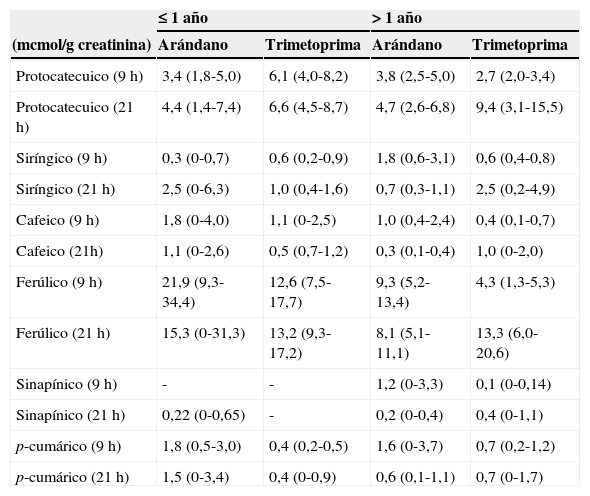
Determinación de ácidos fenólicos en orinaSe analizaron en orina de las 9 de la mañana y 9 de la noche 6 ácidos fenólicos dietéticos: protocatecuico, siríngico, cafeico, ferúlico, sinapínico, p-cumárico. Las determinaciones se realizaron en el Institute of Public Health and Clinical Nutrition, Kuopio, Finlandia. Algunos de estos ácidos fenólicos se consideran productos de fragmentación de las procianidinas, flavonoles y catequinas contenidas en la dieta o en el arándano10,11.
El análisis estadístico final se plantea como un análisis de supervivencia (Kaplan-Meier) donde la aparición del evento (infección urinaria) motiva la finalización del periodo de seguimiento. En los casos donde se produce retirada voluntaria del estudio o salida del mismo por causas diferentes a la infección de orina se considerarán censurados durante el resto del periodo de seguimiento. Se valoran las curvas de Kaplan-Meier de la intervención experimental y la del tratamiento estándar. La comparación de la excreción de polifenoles en orina entre grupos se realizó mediante un t-test para muestras independientes. Se llevó a cabo un análisis de regresión lineal para las concentraciones de los diferentes componentes polifenólicos ingeridos con el jarabe de arándano americano y la excreción de ácidos fenólicos en orina.
Para el análisis de no inferioridad consideramos la diferencia de prevalencia de infección urinaria entre ambas ramas de intervención (d), calculamos el error estándar
Como los límites de equivalencia se estimaron en±0,15 (15%) δL=–0,10, δU=0,10 para un valor zα=1,96.
Analizamos el test de no inferioridad del arándano vs. trimetoprima mediante una hipótesis unilateral:
H1L=Pr arándano–Pr trimetoprima>δL→H0L=Prarándano–Pr trimetoprima≤δL
Que se evidencia por zL = d−δLSE ≥Zα
H1U=Prarándano–Prtrimetoprima>δU δ H0U=Prarándano–Prtrimetoprima≥δU
Que se evidencia por zL = d−δLSE ≤–Zα
Se estudian 85 niños menores de un año de edad, 53 reciben profilaxis con trimetoprima y 32 con jarabe de arándano. Ciento siete niños mayores de un año de edad son incluidos igualmente en el estudio, 64 reciben profilaxis con trimetoprima y 43 con arándano.
Entre los niños con menos de un año de edad el porcentaje acumulado de infección de orina asociada a la profilaxis con trimetoprima fue del 19% (IC 95%: 4-35) en niños y del 43% (IC 95%: 18-68) en niñas. En los menores de un año de edad el porcentaje acumulado de infección de orina asociado a la profilaxis con arándano fue de 46% (IC 95%: 23-70) en niños y del 17% (IC 95%: 0-38) en niñas. Independientemente del género el porcentaje acumulado de infección urinaria en los pacientes que reciben trimetoprima fue del 28% (IC 95%: 13-42) y del 35% (IC 95%: 17-52) entre los que reciben arándano.
Globalmente los niños mayores de un año de edad tienen un porcentaje acumulado de infección de orina del 35% (IC 95%: 21-50) entre los que reciben trimetoprima y del 26% (IC 95%: 12-41) entre los que reciben arándano. Por géneros los varones que reciben trimetoprima tienen un porcentaje acumulado de infección del 33% (IC 95%: 1,8-65) frente a un 8% (IC 95%: 0-26) entre los que reciben arándano.
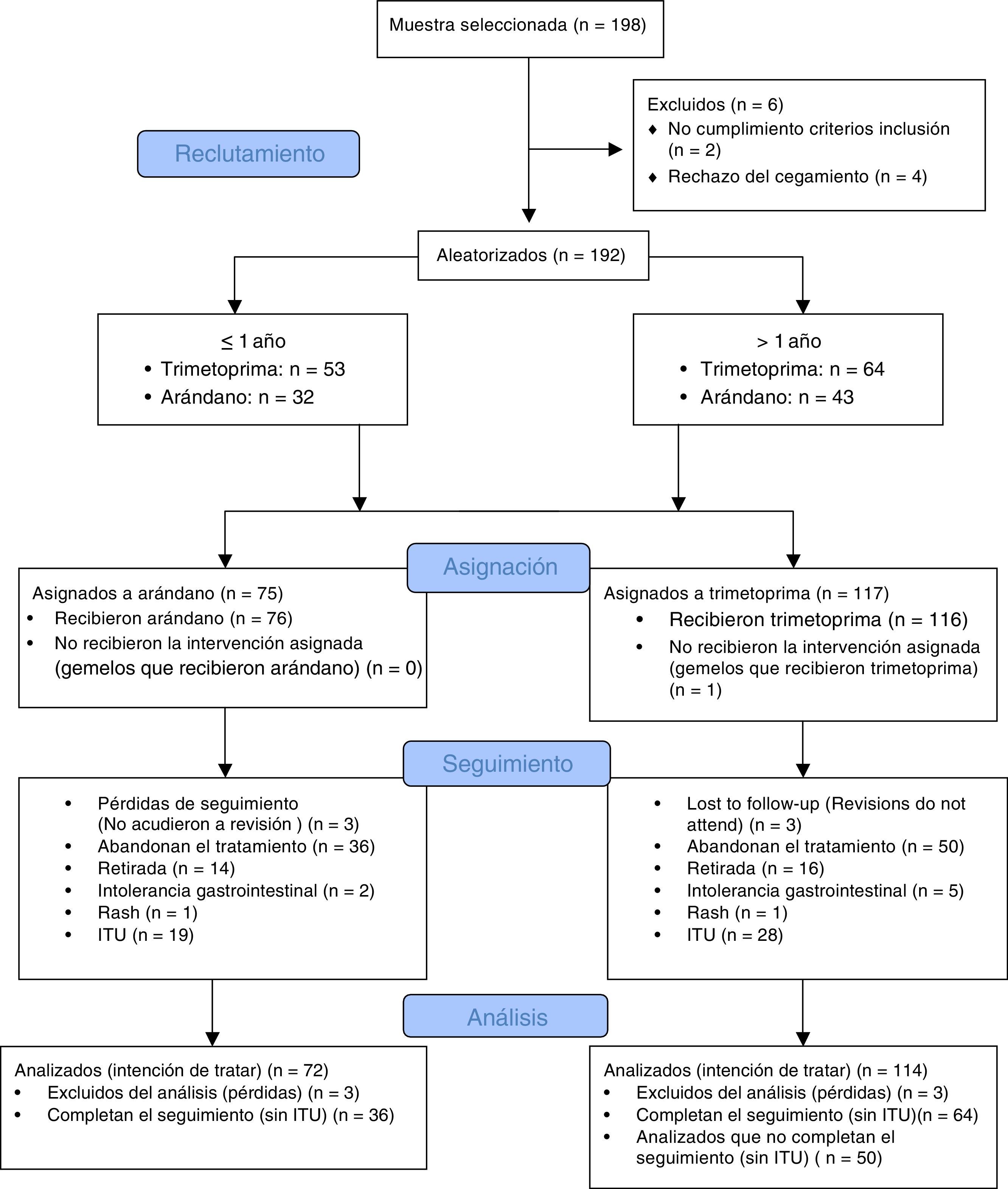
El diagrama CONSORT (fig. 1) recoge los eventos adversos detectados en los menores y mayores de un año durante el periodo de seguimiento. Llama la atención el escaso número de reacciones adversas, no apreciándose ningún efecto adverso entre los menores de un año. La tabla 1 muestra la excreción urinaria de ácidos fenólicos en pacientes menores y mayores de un año que reciben profilaxis con trimetoprima y arándano, no apreciándose diferencias significativas en la excreción de ácidos fenólicos entre estratos.
Excreción urinaria de ácidos fenólicos en pacientes con profilaxis nocturna con arándano americano o trimetoprima
| ≤1 año | >1 año | |||
|---|---|---|---|---|
| (mcmol/g creatinina) | Arándano | Trimetoprima | Arándano | Trimetoprima |
| Protocatecuico (9h) | 3,4 (1,8-5,0) | 6,1 (4,0-8,2) | 3,8 (2,5-5,0) | 2,7 (2,0-3,4) |
| Protocatecuico (21h) | 4,4 (1,4-7,4) | 6,6 (4,5-8,7) | 4,7 (2,6-6,8) | 9,4 (3,1-15,5) |
| Siríngico (9h) | 0,3 (0-0,7) | 0,6 (0,2-0,9) | 1,8 (0,6-3,1) | 0,6 (0,4-0,8) |
| Siríngico (21h) | 2,5 (0-6,3) | 1,0 (0,4-1,6) | 0,7 (0,3-1,1) | 2,5 (0,2-4,9) |
| Cafeico (9h) | 1,8 (0-4,0) | 1,1 (0-2,5) | 1,0 (0,4-2,4) | 0,4 (0,1-0,7) |
| Cafeico (21h) | 1,1 (0-2,6) | 0,5 (0,7-1,2) | 0,3 (0,1-0,4) | 1,0 (0-2,0) |
| Ferúlico (9h) | 21,9 (9,3-34,4) | 12,6 (7,5-17,7) | 9,3 (5,2-13,4) | 4,3 (1,3-5,3) |
| Ferúlico (21h) | 15,3 (0-31,3) | 13,2 (9,3-17,2) | 8,1 (5,1-11,1) | 13,3 (6,0-20,6) |
| Sinapínico (9h) | - | - | 1,2 (0-3,3) | 0,1 (0-0,14) |
| Sinapínico (21h) | 0,22 (0-0,65) | - | 0,2 (0-0,4) | 0,4 (0-1,1) |
| p-cumárico (9h) | 1,8 (0,5-3,0) | 0,4 (0,2-0,5) | 1,6 (0-3,7) | 0,7 (0,2-1,2) |
| p-cumárico (21h) | 1,5 (0-3,4) | 0,4 (0-0,9) | 0,6 (0,1-1,1) | 0,7 (0-1,7) |
Los episodios de recurrencia de infección urinaria se originan en un 60% por E. coli, sin diferencias significativas entre los 2 grupos de tratamiento. El 33,3% de los pacientes que reciben trimetoprima tienen urocultivos por bacterias multirresistentes frente al 22,9% de los que reciben arándano.
Para el conjunto de la muestra observamos que ZL=2,04>Zα y ZU=–1.65>–Zα, por lo que podemos admitir que el tratamiento con arándano no es inferior al tratamiento trimetoprima. En lactantes menores de un año obtenemos ZL=0,69<Zα y ZU=–1,9>–Zα, por lo que debemos admitir que en lactantes el arándano a la dosis administrada es inferior a trimetoprima.
En los pacientes menores de un año 13 presentaban reflujo vesicoureteral (RVU) 4, con RVU grado ≤2 y 5 con RVU≥3, de los cuales recibieron arándano 2 y 5 respectivamente; no observamos diferencias en la recurrencia de infección urinaria entre grupos. En los pacientes mayores de un año observamos RVU en 27 pacientes, 11 con RVU grado ≤2 y 16 con RVU ≥3, de los cuales recibieron arándano 3 y 8 respectivamente; no observamos diferencias en la recurrencia de infección urinaria entre grupos.
DiscusiónNuestro estudio confirma que el arándano americano es seguro en lactantes y niños. La eficacia del arándano americano no es inferior a trimetoprima en la profilaxis de infección urinaria recurrente infantil, si bien en los lactantes con menos de un año de edad su eficacia puede considerarse inferior a trimetoprima a las dosis utilizadas.
En 1984 Sobota12 observa que el extracto de arándano interfiere con la adhesión de E. coli P-fimbriado al epitelio, demostrando que puede ser uno de los mecanismos principales que expliquen el efecto antiadherente del arándano. La fructosa contenida en muchos zumos de fruta, también en el arándano, puede inhibir además la adhesión de E. coli mediada por fimbrias tipo 113, sin embargo la adherencia mediada por fimbrias P se ha asociado con la lectina específica α-Gal(1-4)β-Gal contenida en el epitelio urinario que no resulta inhibida por la adición de fructosa14,15. Foo et al.16 identifican las proantocianidinas triméricas y las procianidinas diméricas de tipo A como las responsables del efecto antiadhesivo del arándano americano. Se trata de flavonoles polifenólicos que no están presentes en otros extractos ricos en polifenoles, como el té verde o el chocolate. El extracto de arándano que hemos utilizado en nuestro ensayo contiene un 22% de proantocianidinas de tipo A, lo que tiene interés de cara a comparar nuestros resultados con otros estudios, dada la gran variabilidad en las concentraciones de proantocianidina observadas en diferentes extractos de arándano17,18.
Dos estudios evaluaron la efectividad del jarabe de arándano en los niños con vejiga neurógena pediátrica; estos fueron controlados mediante una sonda intermitente estéril19,20. El primero de los estudios tenía un diseño cruzado simple que incluía 40 niños, y el segundo era aleatorizado y controlado con placebo e incluía 15 niños. Ambos estudios concluyen que el jarabe de arándano no es más eficaz que placebo para el control de la infección de orina en pacientes con vejiga neurógena. Sin embargo, en ambos estudios queda patente la ausencia de caracterización del contenido polifenólico de los jarabes utilizados.
McMurdo et al.21 realizan un ensayo clínico aleatorizado y doble ciego con arándano o trimetoprima en mujeres con riesgo de infección urinaria recurrente. Los autores observan que el riesgo de recurrencia de infección urinaria es un 60% mayor en las pacientes que reciben arándano, aunque sin significación estadística. En un ensayo clínico realizado por Uberos et al.22 se demostró la no inferioridad del arándano americano frente a trimetoprima en población infantil menor de 14 años; este trabajo no estratificaba la población por edad y no tiene en cuenta las relaciones entre ingesta de arándano americano y excreción urinaria de ácidos fenólicos. La revisión sistemática publicada por Jepson1 sobre un total de 10 estudios (1.049 pacientes) concluye que el arándano comparado con placebo/control disminuye significativamente la incidencia de infección urinaria a los 12 meses de seguimiento (RR: 0,65; IC del 95%: 0,46 a 0,90). El arándano fue más efectivo en la reducción de la incidencia de infección urinaria en mujeres con infección de orina recurrente que en hombres y mujeres de edad avanzada o en personas que requirieron sondaje.
Estudios previos23 demostraron el efecto beneficioso del arándano americano en la prevención de infecciones urinarias en mujeres, con una reducción del riesgo absoluto de infección de orina con respecto a placebo. Ferrara et al.24, en un ensayo clínico controlado frente a placebo en niños mayores de 3 años, demuestran que el arándano americano previene la recurrencia de infecciones de orina sintomáticas. Nuestro ensayo es el primer ensayo clínico controlado, aleatorizado y doble ciego que demuestra la seguridad del arándano americano en lactantes y niños. Howell et al.25 demostraron una mayor actividad antiadherente del arándano cuando la concentración de proantocianidina administrada con el arándano era superior a los 18mg. En nuestro estudio, al no existir referencias previas sobre el uso de arándano americano en lactantes, se optó por una extrapolación de la dosis del adulto, adoptando la dosificación de 0,2ml de jarabe por kg de peso. Nuestros resultados demuestran que el arándano americano no es inferior a la trimetoprima cuando se garantiza una dosis de proantocianidina superior a los 18mg, que es la dosis que se administraría por kg de peso a un lactante de un año.
Los ácidos fenólicos se consideran productos de fragmentación de las procianidinas, flavonoles y catequinas contenidas en la dieta o en el arándano10,11. Encontramos niveles de ácido p-cumárico y ácido ferúlico en lactantes a las 9h discretamente mayores, en el límite de la significación estadística, en el grupo que recibe arándano. No observamos diferencias en el resto de ácidos fenólicos dietéticos estudiados. En nuestro estudio se determinaron los ácidos fenólicos considerados de origen dietético, es decir, aquellos cuya excreción urinaria se ve fuertemente modificada por la dieta. Otros metabolitos fenólicos, no determinados en este trabajo, tienen una excreción que puede verse modificada, además de por la dieta, por el metabolismo de otras moléculas de origen endógeno como las catecolaminas26,27. Se analizaron las concentraciones de cianidinas eliminadas por los pacientes durante su periodo de seguimiento, observándose valores por debajo de los límites de detección28. Los metabolitos fenólicos urinarios que se relacionaron más con la ingestión de arándano americano fueron el ácido cafeico, dihidroferúlico, p-cumárico, dihidroxibenzoico y el ácido 4-O-b-D-glucurónido28.
Dado que la actividad antiadherente del arándano americano es dependiente de la dosis y que los mejores resultados se obtienen por encima del año de edad, donde se garantiza la administración de más de 18mg de proantocianidina, pensamos que son precisos más estudios que evalúen la eficacia de otras dosificaciones de arándano americano en lactantes por debajo de un año de edad.
FinanciaciónEste ensayo clínico ha sido financiado por el Fondo de Investigaciones Sanitarias del Instituto de Salud Carlos III, Madrid.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la Dra. Tarja Nurmi, Universidad Kuopio, Finlandia, por el asesoramiento en las determinaciones analíticas de este estudio.