La enfermedad de Ménétrier es una entidad poco frecuente en el niño, caracterizada por una gastroenteropatía pierde proteínas con engrosamiento de la mucosa gástrica y edemas generalizados. La etiología vírica es la más frecuente, siendo el citomegalovirus el agente infeccioso más habitualmente implicado. A diferencia del adulto, es un trastorno autolimitado y con buen pronóstico en el niño.
Se revisa a 4 pacientes (3 varones y una mujer) diagnosticados de enfermedad de Ménétrier en los últimos 5 años. La edad media de presentación fue de 28,7 meses (rango: 10-48 meses). La sintomatología clínica más común fue fiebre, vómitos y edemas. La endoscopia demostró engrosamiento de pliegues gástricos y erosiones en grado variable. Todos los pacientes asociaban infección gástrica por citomegalovirus y presentaron una evolución favorable, con resolución del trastorno en pocas semanas.
Menetrier's disease is a rare entity in children, characterized by a protein-losing gastroenteropathy with thickening of the gastric mucosa and generalized edema. The most common etiology is viral, and cytomegalovirus is the agent most frequently implicated. Unlike in the adult, it is a self-limited disorder with a good prognosis in children.
Four patients (three boys and one girl) diagnosed with Ménétrier disease in the past five years were reviewed. The mean age at presentation was 28.7 months (range: 10-48 months). The most common clinical symptoms were fever, vomiting, and edema. Endoscopy showed thickened gastric folds and erosions in several stages. All patients had an associated gastric cytomegalovirus infection, and a favorable outcome, with resolution of the disorder,was observed within a few weeks.
La enfermedad de Ménétrier (EM) infantil, también llamada gastritis hipertrófica, se caracteriza por un engrosamiento de pliegues gástricos con hipoalbuminemia secundaria a la pérdida de proteínas a través de la mucosa gastrointestinal. La mayoría de los casos pediátricos publicados consideran al citomegalovirus (CMV) como el agente etiológico más probable. A diferencia de la enfermedad del adulto, es un trastorno agudo con curso benigno y autolimitado.
Se debe sospechar esta enfermedad en pacientes con síntomas gastrointestinales inespecíficos, hipoproteinemia y edemas, en los que se hayan excluido causas hepáticas, renales y cardíacas.
Pacientes y métodosSe revisó, de forma retrospectiva, a los pacientes diagnosticados de EM infantil en los últimos 5 años. Se analizaron variables epidemiológicas, clínicas y analíticas. En todos los pacientes se descartó la pérdida proteica de origen no digestivo y se realizó endoscopia digestiva alta con toma de biopsias de cuerpo, antro gástrico y duodeno. Se realizó estudio histológico convencional con tinciones de HE, PAS y Giemsa modificado e inmunohistoquímica para detección de CMV. Se investigó la existencia de infección activa por CMV mediante serología (IgM e IgG) y reacción en cadena de la polimerasa (PCR) en sangre y mucosa gástrica. En algunos pacientes, se determinó antigenemia y PCR de CMV en orina. Se descartó la infección por Helicobacter pylori (H. pylori) mediante prueba de la ureasa y cultivo de mucosa gástrica.
ResultadosDurante los últimos 5 años, se diagnosticó a 4 pacientes con EM. Tres fueron varones y una mujer. La edad media de presentación fue de 28,7 meses (rango: 10-48 meses). El tiempo medio transcurrido desde el inicio de la clínica hasta el momento del ingreso fue de 7,5 días (rango: 4-11 días). Todos presentaron inicialmente síntomas inespecíficos: fiebre, vómitos, diarrea y dolor abdominal, desarrollando posteriormente edemas localizados y/o generalizados. Un paciente presentaba derrame pleural bilateral y ascitis significativa, y otro hepatoesplenomegalia con trombocitopenia y afectación del estado general.
Todos presentaban hipoalbuminemia significativa al ingreso, con valores entre 1,5-2,1g/dL (valor normal: 3,5-5g/dL). La cifra de albúmina sérica descendió en todos los pacientes durante los primeros días de hospitalización hasta cifras de 1,2-1,4g/dL. Se determinó α-1-antitripsina fecal en los pacientes 1 y 2 obteniendo valores de 17,9 y 7,63mg/g de heces secas (valor normal: < 0,7mg/g de heces secas).
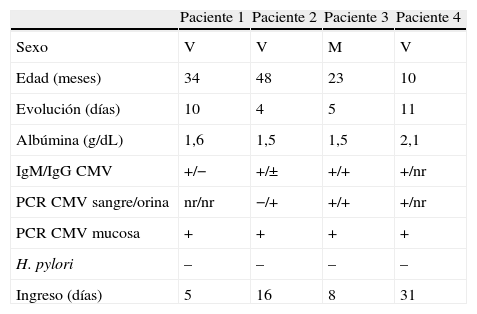
Se demostró infección aguda por CMV en todos los pacientes (tabla 1). La serología IgM y la PCR para CMV en mucosa gástrica fue positiva en todos ellos. La investigación de H. pylori fue negativa en todos los casos.
Características generales de los pacientes con enfermedad de Ménétrier
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | |
| Sexo | V | V | M | V |
| Edad (meses) | 34 | 48 | 23 | 10 |
| Evolución (días) | 10 | 4 | 5 | 11 |
| Albúmina (g/dL) | 1,6 | 1,5 | 1,5 | 2,1 |
| IgM/IgG CMV | +/− | +/± | +/+ | +/nr |
| PCR CMV sangre/orina | nr/nr | −/+ | +/+ | +/nr |
| PCR CMV mucosa | + | + | + | + |
| H. pylori | – | – | – | – |
| Ingreso (días) | 5 | 16 | 8 | 31 |
M: mujer; nr: no realizado; V: varón.
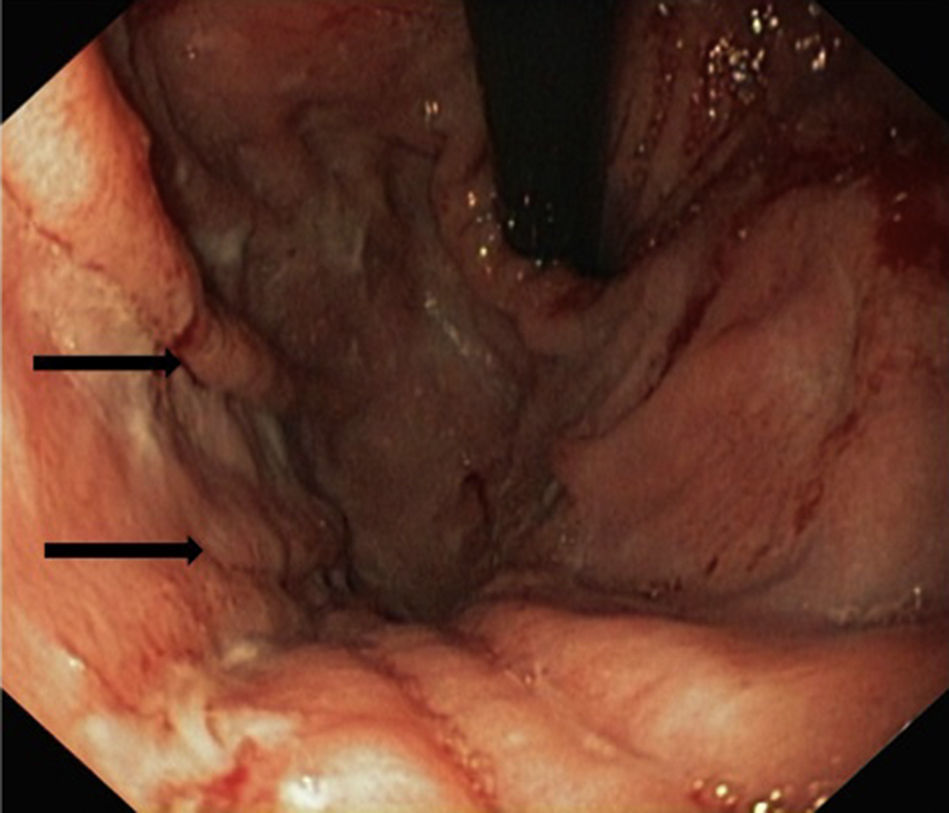
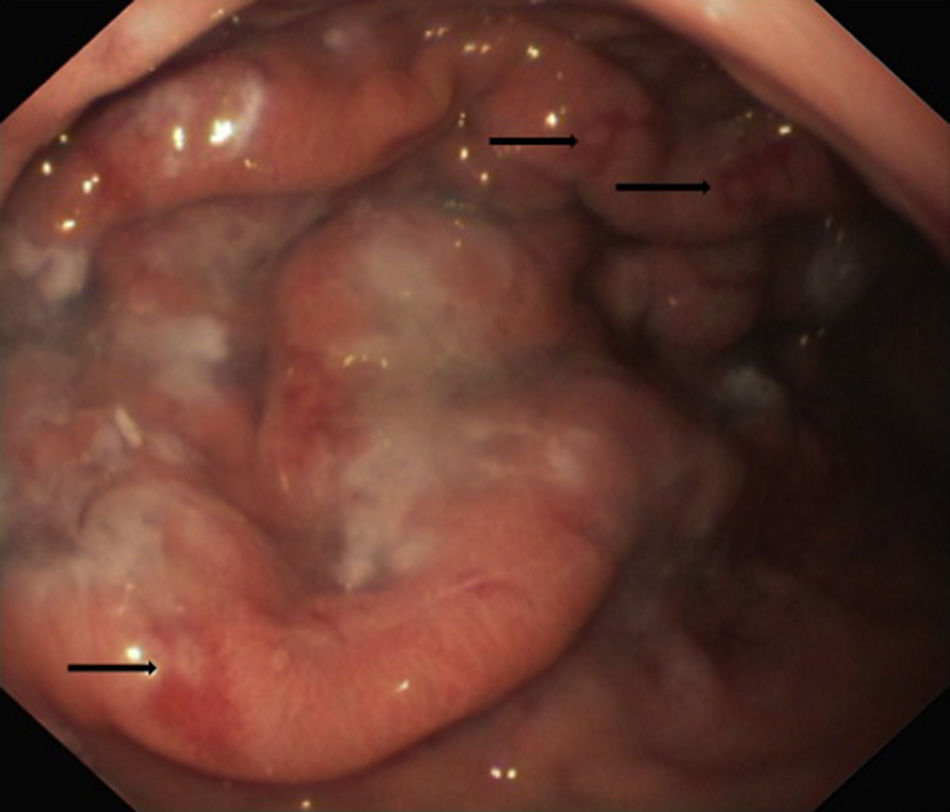
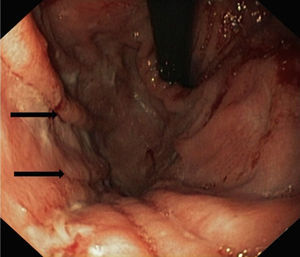
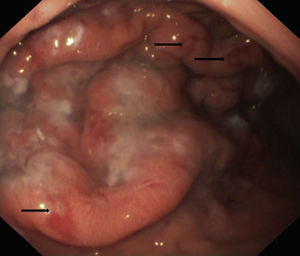
La endoscopia mostró en todos engrosamiento de pliegues gástricos, sobre todo de fundus y cuerpo (fig. 1), asociado en los pacientes 3 y 4 a erosiones más o menos extensas (fig. 2). El estudio histológico demostró infiltrado inflamatorio agudo y edema con hiperplasia del epitelio gástrico y dilatación glandular. El estudio inmunohistoquímico fue positivo en 2 pacientes.
Se instauró tratamiento de soporte con dieta hiperproteica, baja en sal y grasas, protección gástrica y manejo hidroelectrolítico. Todos precisaron administración de albúmina por vía intravenosa y furosemida para la corrección de los edemas hipoproteinémicos. Dos pacientes recibieron tratamiento antiviral. El paciente número 3 recibió tratamiento con valganciclovir por vía oral y el número 4, debido a la afectación del estado general, con ganciclovir por vía intravenosa. El tiempo medio de ingreso fue de 15 días (rango entre 5-31 días).
Los pacientes fueron revisados ambulatoriamente, observando normalización clínica y analítica entre 1-2 semanas después del alta hospitalaria.
DiscusiónLa EM infantil es una entidad rara, caracterizada por una gastroenteropatía con hipertrofia de la mucosa gástrica, motivo por el que también se denomina gastritis hipertrófica, que condiciona secundariamente pérdida proteica y edemas1-5. En la mayoría de los casos, se evidencia relación con la infección por CMV. Entre otros posibles agentes infecciosos, se encuentra el H. pylori6-8 y otros menos frecuentes, como Mycoplasma pneumoniae9, Giardia intestinalis y herpes simple3,4,10.
El mecanismo por el que la infección por CMV afecta a la mucosa gástrica no se conoce completamente. Algunos estudios demostraron el posible efecto del CMV a través del factor transformador del crecimiento alfa (TGF-α)11. En condiciones normales, el TGF-α estimula la proliferación y la secreción de mucina por parte de las células epiteliales gástricas. En la EM del adulto, el TGF-α se incrementa, produciendo hiperplasia gástrica e hipersecreción, por lo que existe una similitud patogénica. Sferra et al.12 demostraron una mayor inmunorreactividad para el TGF-α en la superficie mucosa de estos pacientes comparados con los controles normales. Dempsey et al.13 encontraron en ratones transgénicos que sobreexpresaban TGF-α, hiperplasia de la mucosa y aumento de la secreción de moco que conducía a pérdida intestinal de proteínas similar a la que ocurre en la EM.
La EM afecta habitualmente a pacientes menores de 6 años y suele presentar un comienzo agudo1-3. Los síntomas iniciales son inespecíficos2,14, similares a cualquier cuadro vírico, con fatiga, pérdida de peso, náuseas, vómitos o dolor abdominal. Cuando existe una hipoalbuminemia establecida se produce inicialmente edema periférico, pudiendo llegar a una situación de anasarca, con ascitis, derrame pleural y pericárdico4. Todos los pacientes de nuestra serie eran menores de 4 años y, tras una sintomatología inespecífica, desarrollaron edemas hipoproteinémicos.
Analíticamente, es característica la presencia de hipoproteinemia e hipoalbuminemia. La α-1-antitripsina fecal es un marcador sensible y específico de pérdida proteica a nivel del tubo digestivo3,4. Existen resultados falsamente negativos cuando la pérdida proteica se produce a nivel gástrico por el efecto de la acidez gástrica sobre la α-1-antitripsina; sin embargo, en los 2 pacientes de nuestra serie en los que se realizó esta determinación se demostró un valor significativamente elevado.
El diagnóstico de la infección aguda por CMV es, a veces, complejo. La evidencia de relación con la infección por CMV se establece por el hallazgo de células infectadas en la mucosa gástrica, mediante técnicas de PCR, detección de antígenos virales por inmunohistoquímica, cultivo viral de mucosa gástrica o la visualización inclusiones virales típicas. La detección de antigenemia, PCR en sangre o las serologías son menos sensibles en lo que respecta a la detección de la afectación gastrointestinal; sin embargo, permiten detectar la infección y establecer la sospecha diagnóstica.
Aunque la hibridación in situ y la inmunohistoquímica se han propuesto como las técnicas de laboratorio más sensibles15-17, existen diversos casos en los que no se ha identificado la presencia del CMV por ninguna de estas 2 técnicas2. El problema es que, en estos casos, la infección por CMV puede corresponder a una primoinfección, reactivación o reinfección. La excreción viral en orina y la serología IgM positiva pueden mantenerse durante meses, por lo que su hallazgo aislado no permite confirmar que la infección por CMV sea la causa de la EM. En todos nuestros pacientes, se demostró mediante PCR la presencia de CMV en la mucosa gástrica junto a una serología IgM positiva y una PCR en sangre y orina positiva en algunos casos.
Los hallazgos radiológicos en la EM infantil son similares a los observados en el adulto, con engrosamiento de pliegues gástricos, predominantemente a nivel del cuerpo y fundus, respetando el antro en la mayoría de los casos2,14,15. Los pliegues hipertróficos pueden demostrarse con el tránsito baritado gastrointestinal superior, la ecografía y con tomografía computarizada. Estas 2 últimas técnicas permiten definir el grado de engrosamiento de la pared gástrica mejor que el tránsito baritado18.
Endoscópicamente, se aprecia engrosamiento de los pliegues gástricos, con diferentes grados de inflamación mucosa, pudiéndose llegar a producir ulceraciones gástricas severas10,19, como las observadas en los pacientes 2 y 3 de nuestra serie. Histológicamente, los hallazgos son similares a la EM del adulto, caracterizándose por hipertrofia e hiperplasia del epitelio gástrico, con engrosamiento de la mucosa por proliferación, elongación y dilatación quística de glándulas gástricas, con hipersecreción, edema e infiltrado inflamatorio4.
Determinados autores20 defienden la mejoría clínica tras tratamiento con ganciclovir; sin embargo, no existen un acuerdo unánime ni certeza de los beneficios de su administración en pacientes inmunocompetentes, ya que la historia natural de la enfermedad llevará a su resolución espontánea. Puede valorarse el tratamiento con ganciclovir en aquellos pacientes con curso prolongado y ausencia de mejoría en torno a 4-6 semanas4,6,20 o de gravedad significativa, como nuestro paciente 4.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.