A nivel mundial se describe un incremento de las infecciones por Staphylococcus aureus (S. aureus) resistente a meticilina (SARM). El espectro clínico de la enfermedad incluye desde colonización nasal hasta infecciones superficiales e invasoras.
ObjetivoDescribir la frecuencia, características clínicas y factores de riesgo asociados a la enfermedad por SARM en menores de 15 años, establecer la prevalencia de colonización y la susceptibilidad a antimicrobianos de las cepas aisladas.
Materiales y métodosEstudio descriptivo. Se incluyó a sujetos con edades comprendidas entre 1 mes a 15 años de edad atendidos en el Hospital del Niño de Panamá con infección invasora o superficial por S. aureus entre el 1 de junio de 2009 al 30 de junio de 2010. El estado de portador fue evaluado a través de la realización de muestra nasal. Se analizaron variables epidemiológicas, clínicas, tratamiento de la enfermedad y patrones de resistencia antimicrobiana.
ResultadosCohorte constituida por 146 sujetos con infecciones por S. aureus, de los cuales el 8,9% (13/146) presentaron infección por SARM, 38,5% de los cuales fueron adquiridos en la comunidad. El 53,8% de los sujetos con SARM presentó infección invasora. No se identificaron factores de riesgo para el desarrollo de infecciones por SARM. La prevalencia de portador nasal fue del 8,3%. Las tasas de resistencia a eritromicina y clindamicina fueron de 15,4%.
ConclusionesLa incidencia de infecciones por SARM fue baja comparada con otras regiones. Se recomienda la vigilancia epidemiológica activa a fin de establecer guías de tratamiento basadas en criterios epidemiológicos locales.
Infections due to methicillin-resistant Staphylococcus aureus (MRSA) are increasing worldwide. The clinical spectrum of the disease ranges from nasal colonization to superficial and invasive infections.
ObjectivesTo describe the frequency, clinical characteristics and risk factors associated with MRSA disease in children under 15years old. To establish the prevalence of colonization and antimicrobial susceptibility of isolates.
Material and methodsRetrospective study. Included subjects; aged 1 month to 15years old treated in the Hospital del Niño in Panama with invasive or superficial infection by S. aureus in the period from June 1, 2009 to June 30, 2010. Carrier status was assessed by performing nasal swabs. Demographic, clinical features, treatment of disease and antimicrobial resistance patterns.
ResultsA total of 146 subjects were collected with S.aureus infections, of which 8.9% (13/146) were infected by MRSA. Community-acquired MRSA accounted for 38.5% of the isolates. We did not identify any risk factors for developing MRSA infections. The prevalence of nasal carriage was 8.3%. The resistance rates to erythromycin and clindamycin were 15.4%.
ConclusionsThe incidence of MRSA infections was low compared with other regions. We recommend active surveillance in order to establish measures to prevent nosocomial infections and treatment guidelines based on local epidemiological criteria.
El aumento de infecciones por Staphylococcus aureus resistente a meticilina (SARM) constituye un problema de salud pública y se asocia con mayor morbilidad, mortalidad, días de hospitalización y costo1. En Estados Unidos de América, Japón y algunas regiones de Europa y de Latinoamérica hasta un 40% de los aislamientos por S. aureus son resistentes a meticilina2. En áreas de los Estados Unidos la mayor parte los aislamientos de SARM son adquiridos en la comunidad (SARM-AC), mientras que en Latinoamérica esta proporción varía entre 20 a 70%3–5. Estas cepas resistentes se aíslan principalmente de infecciones en la piel y los tejidos blandos; sin embargo, son de particular interés las infecciones invasoras por SARM-AC, por su alta mortalidad.
Debido a la ausencia de datos epidemiológicos en población pediátrica panameña, se realizó este estudio con el objetivo de estimar la frecuencia, describir las características clínicas e identificar los factores de riesgo asociados a la enfermedad por SARM, así como establecer la frecuencia de colonización nasal y los patrones de susceptibilidad a antimicrobianos de las cepas de S. aureus aisladas.
Material y métodosEstudio observacional, prospectivo, en sujetos de 1 mes a 15 años de edad, atendidos en el cuarto de urgencias o admitidos a salas de hospitalización, con infección superficial o invasora por S. aureus, en el período comprendido del 1 de junio de 2009 al 30 de junio 2010. Dado la ausencia de datos previos, se realizó un muestreo por conveniencia donde se consideró reclutar el universo de niños con aislamiento de S. aureus en hemocultivos o cultivos de secreción, independientemente de que hubiesen recibido tratamiento ambulatorio. Se excluyó a aquellos sujetos fuera del rango etario del estudio, sin consentimiento informado y/o asentimiento, así como a los sujetos con infecciones de tejidos blandos manejados ambulatoriamente con lesión no fluctuante.
Se definió como infección por SARM-AC a aquella infección por SARM aislados en pacientes ambulatorios o dentro de las primeras 48h de hospitalización (excluida la infección de herida quirúrgica). Se incluyeron aquellos casos en los que al momento de la admisión tenían signos de infección focal pero que no se cultivaron hasta después de las 48h de hospitalización. Se consideró como infección por SARM nosocomial a aquella infección de sitio quirúrgico o de cualquier otro sitio después de las 48h de hospitalización y como infecciones por SARM asociadas a asistencia médica frecuente a aquella infección por SARM en pacientes con exposición frecuente a asistencia médica por patología médica preexistente o con antecedente de hospitalización en el año previo.
Se definió como infecciones invasoras a las infecciones del sistema nervioso central, músculos, huesos, articulaciones, mastoides, pulmón, líquido pleural, tejido linfático o sangre y, como infección superficial a las infecciones en piel y tejidos blandos.
Se consideró como tratamiento discordante al uso de un antibiótico no efectivo contra el patógeno aislado de acuerdo al antibiograma. Cuando se indicó más de un antibiótico y al menos uno era eficaz se consideró, concordante.
Se realizó una entrevista con cumplimentación de una encuesta para obtener datos demográficos, clínicos y de factores de riesgo y se tomó muestra nasal mediante hisopo para cultivo.
Los cultivos, los aislamientos y la caracterización de las cepas se realizaron de acuerdo con los procedimientos estándares de microbiología clínica. La susceptibilidad a antibióticos se realizó por el método de difusión en disco para oxacilina, clindamicina, eritromicina, vancomicina, TMP/SMX y cefoxitina para predicción de resistencia a oxacilina mediada por el gen mecA (CLSI M100-S18). La susceptibilidad a vancomicina fue establecida por el método de E-test. Se utilizaron los puntos de corte establecidos por CLSI M100-S18.
Los factores de riesgo fueron analizados con odds ratio. Se consideró un intervalo de confianza del 95%. Una p ≤ 0,05, se consideró estadísticamente significativa. Las variables categóricas fueron analizadas mediante la prueba de la chi cuadrado y la prueba exacta de Fisher, mientras que las variables numéricas continuas, mediante al prueba de la t de Student o test de Mann-Whitney en caso de que la distribución no fuera normal. Las variables cualitativas fueron descritas en frecuencia absoluta y porcentaje. Se utilizó el programa SPSS 16.0 para el análisis de datos.
El protocolo fue aprobado por el Comité de Bioética en Investigación del Hospital del Niño y por el Comité de Bioética del Instituto Conmemorativo Gorgas de Estudios de la Salud.
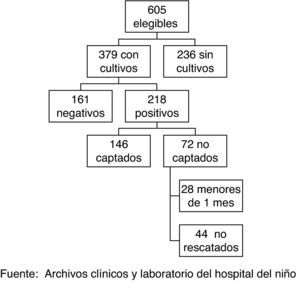
ResultadosDurante el período de estudio fueron tratados en el Hospital del Niño 605 pacientes con infecciones superficiales o invasoras de probable etiología estafilocócica. Se obtuvieron cultivos en 379 casos, de los cuales, en 218 (57%) fueron positivos por S. aureus, y de éstos, un total de 146 sujetos fueron incluidos en el estudio. Se excluyó a 72 pacientes (fig. 1).
Se identificó a un total de 13 (8,9%) pacientes con infección por SARM. El 38,5% (5/13) de las infecciones por SARM fueron comunitarias, 23% (3/13) nosocomiales y 38,5% (5/13) asociadas a asistencia médica frecuente. De los pacientes con infecciones asociadas a asistencia médica frecuente, 2 fueron de origen comunitario y 3 hospitalarios. En el caso de las infecciones por S.aureus sensible a meticilina (SASM), el 86,5% (115/133) fueron adquiridas en la comunidad y el 13,5% (18/133) fueron nosocomiales.
Las características demográficas de los pacientes se describen en la tabla 1. No se encontraron diferencias estadísticamente significativas respecto a la distribución por sexo, edad o raza entre los sujetos con infecciones por SARM versus SASM.
Características demográficas
| Variable | SASM n=133(%) | SARM n=13 (%) | p |
| Sexo | |||
| Masculino | 57 (42,9) | 6 (46,2) | 0,8 |
| Edad, años±DS | 4,57±4,2 | 3,54±3,4 | 0,39 |
| Raza | |||
| Mestizo | 73 (54,9) | 9 (69,2) | 0,32 |
| Indígena | 44 (33,1) | 1 (7,7) | 0,06 |
| Negra | 13 (9,8) | 1 (7,7) | 0,62 |
| Caucásico | 3 (2,2) | 2 (15,4) | 0,3 |
SARM: Staphylococcus aureus resistente a meticilina; SASM: S.aureus sensible a meticilina.
Fuente: formulario de recolección de datos.
Se identificó a 30 (20%) sujetos con antecedentes de enfermedades subyacentes. Las condiciones crónicas más frecuentes fueron: patologías respiratorias crónicas, neoplasias hematológicas y VIH/sida. En el grupo de sujetos con infecciones por SARM, 3 sujetos tenían patologías subyacentes: asma, broncodisplasia pulmonar y leucemia linfocítica aguda (LLA), de los cuales 2 sujetos presentaron infecciones invasoras.
El 53,8% (7/13) de las infecciones por SARM fueron invasoras, en comparación con 30,8% (41/133) de las infecciones por SASMS (p=0,09). Los abscesos fueron las infecciones superficiales más frecuentemente diagnosticadas (tabla 2). El 57% (4/7) de las infecciones invasoras por SARM fueron bacteriemias comparadas con 39% (16/41) en el caso de SASM, esta diferencia no fue estadísticamente significativa (tabla 2).
Infecciones superficiales e invasoras por Staphylococcus aureus de acuerdo con la sensibilidad a meticilina
| Infección | SASM (%) | SARM (%) |
| Superficial | 92 | 6 |
| Abscesos | 50 (54,3) | 3 (50) |
| Celulitis | 15 (16,3) | 1 (16,7) |
| Impétigo | 9 (9,8) | 1 (16,7) |
| Heridas quirúrgicas infectadas | 8 (6,5) | 1 (16,7) |
| Otros | 12 (13,1) | 0 |
| Invasora | 41 | 7 |
| Bacteriemia | 16 (39) | 4 (57,1) |
| Neumonía | 10 (24,4) | 1 (14,3) |
| Osteoarticular | 7 (17,1) | 1 (14,3) |
| Endocarditis | 0 | 1 (14,3) |
| Otros | 8 (19,4) | 0 |
SARM: Staphylococcus aureus resistente a meticilina; SASM: S.aureus sensible a meticilina
Fuente: formulario de recolección de datos.
Al analizar el riesgo de adquirir infección por SARM de acuerdo con diversas variables como pobreza, hacinamiento, asistencia a guardería, antecedentes de infecciones cutáneas previas, comorbilidades hospitalizaciones en el último año, uso de antibióticos no se encontraron diferencias estadísticamente significativas (tabla 3). No se encontraron diferencias en días de hospitalización, indicación de incisión y drenaje ni frecuencia de complicaciones entre ambos grupos (tabla 4).
Tratamiento y evolución
| Variable | SASM n=133 (%) | SARM n=13 (%) | p |
| Tratamiento discordante | 6 (4,6) | 9 (69,2) | < 0,01 |
| Cambio de tratamiento | 36 (27,4) | 7 (53,9) | 0,06 |
| Días de hospitalización±DS | 11,7 (9,7) | 15,1 (16,8) | 0,5 |
| Tratamiento quirúrgico | 84 (63,1) | 6 (61,5) | 1 |
| Complicaciones | 0,4 | ||
| Shock séptico | 18 | 3 | |
| Efusión pleural | 6 | 1 | |
| Infección nosocomial | 4 | 0 | |
| Artritis séptica | 5 | 1 | |
| Endocarditis | 0 | 1 | |
| Otras | 2 | 0 | |
| Muerte | 1 | 0 | |
SARM: Staphylococcus aureus resistente a meticilina; SASM: S.aureus sensible a meticilina
Fuente: formulario de recolección de datos
Factores de riesgo asociados a infección por SARM
| Variable | SARM (%) n=13 | SASM (%) n=133 | OR (IC del 95%) | p |
| Pobreza | 7 (53,9) | 97 (72,9) | 0,53 (0,14-2,09) | 0,32 |
| Hacinamiento | 4 (30,8) | 65 (48,9) | 0,53 (0,13-2,07) | 0,47 |
| Asistencia a guardería | 1 (7,7) | 4 (3) | 2,44 (0,2-8,72) | 0,4 |
| Edad menor de 2 años | 5 (38,5) | 46 (34,6) | 1,18 (0,31-4,3) | 0,76 |
| Uso de antibióticos en los últimos 6 meses | 4 (30,8) | 42 (31,6) | 1,1 (0,26-4,32) | 1 |
| Hospitalizaciones en el último año | 3 (23,1) | 43 (32,3) | 0,71 (0,14-3,05) | 0,75 |
| Infecciones cutáneas previas | 2 (15,4) | 12 (9) | 2,03 (0,27-11,9) | 0,32 |
| Enfermedades crónicas | 3 (23,1) | 27 (29,3) | 1,18 (0,24-5,12) | 0,7 |
| Uso de catéteres | 2 (15,4) | 6 (4,5) | 3,85 (0,47-25,58) | 0,15 |
| Contacto intradomiciliario trabajador de salud | 1 (7,7) | 5 (3,8) | 2,13 (0,2-19,7) | 0,4 |
| Contacto intradomiciliario con enfermedades crónicas | 3 (23,1) | 24 (18) | 1,35 (0,27-5,93) | 0,7 |
| Contacto intradomiciliario hospitalizado en el último año | 2 (15,4) | 16 (12) | 1,27 (0-7,02) | 0,67 |
| Contacto domiciliario con uso de antibióticos en los últimos 6 meses | 4 (30,8) | 20 (15) | 2,38 (0,55-9,67) | 0,23 |
| Contacto domiciliario con infecciones cutáneas | 2 (15,4) | 24 (18) | 0,78 (0,11-4,13) | 1 |
SARM: Staphylococcus aureus resistente a meticilina; SASM: S.aureus sensible a meticilina
Fuente: formulario de recolección de datos.
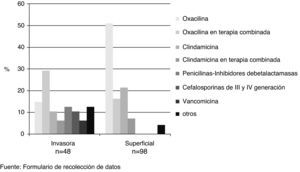
De los 146 pacientes incluidos en el estudio, un paciente fue manejado exclusivamente con incisión, drenaje y curaciones. La oxacilina sola o en terapia combinada, fue el antibiótico empírico de elección en el Hospital del Niño en 59,3% (86/145), seguido de la clindamicina con 26,2% (38/145). La vancomicina fue el agente de elección en 9 pacientes, todos estos con enfermedad invasora (fig. 2) En el 29,6% (43/145) de los casos se realizó modificación del esquema inicial.
El 10,3% (15/145) de los pacientes recibieron tratamiento discordante; 9 de ellos con cepas resistente a meticilina (tabla 4). A 4/9 de los sujetos con infecciones por SARM con tratamiento discordante no se les indicó un segundo esquema de antibiótico una vez obtenido el resultado del antibiograma, 3 con diagnóstico de infecciones de tejidos blandos, con incisión y drenaje con notable mejoría por lo que no se indicó modificación del esquema empírico a pesar del resultado del antibiograma y un sujeto con neumonía no complicada, a quien se le dio de alta antes de tener el resultado del hemocultivo y antibiograma. Todos los pacientes presentaron buena evolución clínica.
Se realizó la prueba de resistencia a eritromicina en 143 aislamientos; el 11,6% (17/143) fueron resistentes. La prueba de D-test fue positiva en el 41,2% (7/17). El porcentaje de resistencia a eritromicina fue del 15,4% (2/13) y el 11,5% (15/130) para SARM y SASM, respectivamente. La resistencia a clindamicina fue del 8,9% (13/146), 6 constitutivas y 7 con fenotipo de resistencia inducible. Las cepas resistentes a meticilina mostraron un 15,4% (2/13) de resistencia a clindamicina comparado con un 8,3%, (11/133) en las sensibles a meticilina. Del total de 146 aislamientos de S. aureus, únicamente 2 mostraron resistencia al TMP/SMX, ambas cepas sensibles a meticilina. No se encontró ninguna cepa con resistencia o con resistencia intermedia a vancomicina.
Un 19% (24/124) de los sujetos fueron portadores nasales de S. aureus, el 8,3% (2/24) colonizados por cepas resistentes a meticilina. Ambos portadores de SARM tenían factores de riesgo, el primero con antecedente de enfermedad crónica, consultas ambulatorias frecuentes, hospitalización prolongada, inmunosupresión y uso de catéteres venosos centrales, y el segundo, con conviviente trabajador de la salud, conviviente hospitalizado en el último año, con enfermedad crónica y uso de antibióticos. Ambos sujetos presentaron infecciones invasoras por SARM. Los patrones de susceptibilidad de las cepas aisladas en sangre y fosas nasales fueron similares.
DiscusiónLas infecciones por SARM constituyen un serio problema de salud pública y son una importante causa de morbimortalidad en el área hospitalaria y en la comunidad6.
Diversos estudios en Latinoamérica indican que la prevalencia de cepas resistentes a meticilina hospitalarias es del 6 al 80%7. Panamá reportó el 28% de cepas resistentes a meticilina hospitalarias en el año 20047.
El Hospital del Niño es un hospital de III nivel de atención y el más importante centro de referencia pediátrica a nivel nacional, cuenta con 461 camas y recibe un promedio de 19.000 pacientes/año. Durante el período estudiado la tasa de infecciones nosocomiales por S. aureus fue del 6,6% (24/361), el 25% (6/24) con resistencia a meticilina. Consideramos que las políticas de restricción de antibióticos aplicadas en el Hospital del Niño pueden ser un factor contribuyente a la reducida prevalencia de infecciones nosocomiales por S. aureus y de cepas resistentes, como plantean diversos estudios en los cuales el uso apropiado de cefalosporinas de tercera generación y la restricción del uso de quinolonas y clindamicina se asocian a una menor prevalencia de infecciones por SARM8–10.
Desde los primeros reportes de cepas resistentes a meticilina resistente adquiridas en la comunidad su incidencia se ha incrementado. Está demostrado que estas cepas, particularmente los clones USA 300, son transmitidas más fácilmente, tienen mejor capacidad para colonizar mucosas y son más virulentas comparadas con las cepas sensibles a meticilina11. Las primeras descripciones de cepas de S. aureus adquiridas en la comunidad en Latinoamérica fueron reportadas en el año 2001 en Uruguay y en Brasil; desde entonces se han descrito en otros países de la región12. En el año 2005 un estudio en Argentina reportó una prevalencia del 42% y posteriormente en el año 2006, del 51%. En Colombia, se describe una prevalencia de cepas resistentes a meticilina del orden del 26,8%, con un 3,2% de origen comunitario5. En nuestro estudio el 8,2% de los aislamientos de S. aureus mostraron resistencia a meticilina; cerca del 40% fueron adquiridas en la comunidad.
Los factores de riesgo que han sido asociados a infecciones por SARM son enfermedades crónicas, exposición a antibióticos, colonización por SARM, infecciones previas por SARM, antecedente de cirugías y hospitalizaciones, realización de deportes de contacto y asistencia a guarderías. Múltiples estudios describen infecciones adquiridas en la comunidad en sujetos sin ningún factor de riesgo conocido3,13–15. En esta investigación se evaluaron factores de riesgo asociados con mayor frecuencia a infecciones por SARM; sin embargo, no se encontraron diferencias estadísticamente significativas entre infecciones por SASM y SARM, resultados que pudieran estar relacionados con el tamaño muestral.
Según el Centro para el Control y la Prevención de enfermedades (CDC), las cepas de SARM se clasifican en grupos mutuamente excluyentes así: asociados a la comunidad y relacionados a asistencia médica y nosocomiales. Estas diferencias tienen significación clínica dado que aquellas cepas de origen hospitalario suelen ser multirresistentes, a diferencia de las cepas de origen comunitario, que suelen ser susceptibles a múltiples antimicrobianos no betalactámico. A diferencia de los datos descritos en la literatura, en nuestra serie las cepas de SARM de origen nosocomial fueron sensibles a eritromicina, clindamicina y TMP/SMX. Sin embargo, no forma parte de los procedimientos estándares de microbiología de nuestra institución realizar pruebas de susceptibilidad a otros antimicrobianos, como aminoglucósidos, quinolonas, rifampicina, tetraciclinas ni linezolid.
El nivel de resistencia a clindamicina de los aislamientos por SARM en nuestro estudio fue del 15,4%, semejante a otras regiones de Latinoamérica, que también señalan tasas mayores de 15%. De acuerdo con las recomendaciones de expertos, no debe indicarse clindamicina como terapia empírica en aquellas áreas que comuniquen tasas de resistencias mayores al 15%16. Debido al escaso número de casos con infecciones por SARM, no podemos desaconsejar el uso de clindamicina en el Hospital del Niño, al contrario, insistimos en la necesidad de una vigilancia estrecha y permanente de los perfiles de resistencia locales a fin de poder hacer recomendaciones basadas en criterios epidemiológicos precisos.
La utilidad del TMP/SMX en el tratamiento de infecciones de tejidos blandos por SARM-AC es aún cuestionable debido a la ausencia de estudios de eficacia. Un estudio reciente encontró que no había diferencia en reconsultas, complicaciones o recurrencias entre sujetos hospitalizados que a su egreso fueron tratados con clindamicina versus TMP/SMX17; sin embargo, el estudio de Elliot et al18 que evaluó a niños con infección de tejidos blandos manejados ambulatoriamente encontró un mayor riesgo de falla terapéutica en la cohorte de niños tratados con TMP/SMX en los que no se realizó incisión y drenaje. Considerando la baja tasa de resistencia a TMP/SMX encontrada en nuestro estudio (1,5%), y con el nivel de evidencia actual, sugerimos el uso de TMP/SMX como alternativa en casos de infecciones de tejidos blandos por cepas resistentes a meticilina siempre que se realice incisión y drenaje.
Tres casos con infecciones de tejidos blandos por SARM y tratamiento discordante cursaron con buena evolución, secundaria al procedimiento de incisión y drenaje al que fueron sometidos, como fuera descrito por el estudio de Lee et al19, y posteriormente por Johnson et al20, quienes concluyen que la incisión y el drenaje sin el uso de antimicrobianos o a pesar de un tratamiento discordante es efectiva en el tratamiento de infecciones de piel y tejidos blandos en pacientes inmunocompetentes. En el caso de infecciones invasoras, el retardo en el tratamiento apropiado se asocia a mayor riesgo de mortalidad, tanto con la administración de tratamiento inapropiado para cepas resistentes a meticilina, como con el uso de tratamiento subóptimo (vancomicina) en cepas sensibles a meticilina. A pesar del reducido número de cepas resistentes a meticilina aisladas en el estudio, podría sugerirse como terapia empírica en enfermedades invasoras o nosocomiales el uso de terapia combinada de clindamicina más oxacilina o TMP/SMX en sujetos con factores de riesgo para infecciones por SARM. Algunos expertos sugieren asociar un betalactámico o un agente contra la síntesis de proteínas a vancomicina hasta obtener los resultados del antibiograma21,22.
Una revisión sistemática demostró un aumento del riesgo de infecciones en sujetos colonizados por SARM comparados con aquellos colonizados por SASM23. Encontramos un 8,3% de colonización por SARM, series en niños reportan prevalencias entre el 0,8 a 9,2% de colonización por SARM. Estudios en hospitales con prevalencias elevadas de SARM han mostrado asociación entre el uso de vigilancia activa, tamizaje y aislamiento de pacientes colonizados y el control de la transmisión y/o infecciones por este agente24–26; sin embargo, otros estudios no han tenido resultados similares27,28. Dadas las evidencias actuales, es recomendable que cada institución establezca, de acuerdo a criterios epidemiológicos locales, las políticas de control de infecciones hospitalarias apropiadas y de mayor coste-beneficio.
Debemos mencionar como el mayor limitante del estudio el escaso número de cepas aisladas, que se relaciona a un elevado número de casos (236/605) con infecciones de probable etiología estafilocócica a los que no se les realizó cultivos, además de la escasa captación de sujetos manejados de forma ambulatoria y, que por tanto, puede limitar nuestros resultados y conclusiones. Al momento de esta investigación, no se disponía con la prueba de reacción en cadena de la polimerasa, considerado como el método de elección para la detección de resistencia mediada por el gen meccA, ni con pruebas de genotipo para confirmar el origen comunitario de las cepas aisladas. En las pruebas de susceptibilidad no se incluyeron otras familias de antimicrobianos como quinolonas, tetraciclinas, rifampicina ni linezolid.
En conclusión, el SARM causa un espectro variado de infecciones, desde infecciones superficiales de tejidos blandos hasta infecciones invasoras y graves. Si bien la incidencia en niños atendidos en el Hospital del Niño es baja comparada con la reportada en otras latitudes, la vigilancia epidemiológica es primordial para establecer normas institucionales de prevención y tratamiento.
Conflicto de interesesLos autore s declaran no tener ningún conflicto de intereses.
A Lic. Rosina de Espino, Lic. Ismael Vaca, Lic. Julio Nieto de la Sección de Microbiología del Laboratorio Clínico del Hospital del Niño, Lic. José Moreno y Lic. Marlenys Fernández, del Instituto Conmemorativo Gorgas de Estudios de la Salud, por su colaboración en el procesamiento de las muestras. A la Dra. Elizabeth Castaño, Dra. Amalia Ayechú, Dr. Javier Perona, Virginia Ramos, Ana Lavilla y Mar Junco por su gran colaboración en el reclutamiento de la cohorte.