Evaluar la fuerza muscular a través de la fuerza prensil manual en niños y adolescentes con obesidad y comparar los resultados con valores de referencia. Analizar su relación con el estudio de composición corporal mediante bioimpedanciometría y su asociación con variables clínicas y bioquímicas.
Material y métodosEstudio observacional retrospectivo tipo cohorte de pacientes pediátricos con obesidad. Se recopilaron parámetros de actividad física, antropométricos, bioquímicos, ecográficos, bioimpedanciometría y dinamometría.
ResultadosSe incluyeron 125 pacientes (media 12,06 años, 50,4% mujeres, Z-score índice de masa corporal [IMC]: 3,87 ±1,46 desviación estándar [DE]). Los varones presentaban una obesidad menos grave y una mejor composición corporal. Los prepúberes realizaban menos actividad física y tenían más porcentaje de masa grasa. La presencia de comorbilidades metabólicas, como hiperuricemia e insulinorresistencia, aumentó con el grado de obesidad. Los niños con obesidad presentaron un Z-score medio de fuerza muscular de +0,71 en la mano dominante. Un 4,8% presentaba dinamopenia, más frecuente en prepúberes. La fuerza muscular se correlacionó positivamente con actividad física, masa libre de grasa y ángulo de fase (PA) y negativamente con porcentaje de masa grasa, siendo la masa libre de grasa el predictor más fuerte.
ConclusionesLa fuerza muscular en nuestra muestra de niños con obesidad no se encuentra disminuida respecto a la población de referencia. La masa libre de grasa es el factor predictor más fuerte de la fuerza muscular. Se destaca la influencia positiva de la actividad física y la masa magra en la fuerza de los niños y adolescentes con obesidad.
To evaluate muscle strength based on grip strength in children and adolescents with obesity and comparing it with reference values. To analyse the association with body composition findings obtained by bioelectrical impedance analysis as well as clinical and biochemical variables.
Material and methodsRetrospective observational cohort study in pediatric patients with obesity (6-16 years) followed up in an outpatient clinic in a tertiary care hospital. We collected data on physical activity and anthropometric, biochemical, sonographic, bioimpedance and dynamometry parameters.
ResultsThe sample included 125 patients (mean age, 12.06 years; 50.4% female; body mass index [BMI] Z-score, 3.87 [SD, 1.46]). Male participants were less severely obese and had a healthier body composition. Prepubertal patients were less physically active and had a higher fat mass (FM) percentage. The prevalence of metabolic comorbidities, such as hyperuricemia and insulin resistance, increased with the degree of obesity. Children with obesity had a mean muscle strength Z-score of +0.71 in the dominant hand, with differences based on sex and stage of pubertal development. We found dynapenia in 4.8%, with a greater prevalence in prepubertal children. Muscle strength was positively correlated to physical activity, fat-free mass and phase angle and negatively correlated to FM percentage. Fat-free mass was the strongest predictor of muscle strength.
ConclusionsIn this sample of children with obesity, muscle strength was not decreased compared to the healthy reference population. Fat-free mass is the strongest predictor of muscle strength. The findings highlight the positive influence of physical activity and the amount of lean mass on strength in children and adolescents with obesity.
La Organización Mundial de la Salud (OMS) define la obesidad como una enfermedad crónica caracterizada por la acumulación excesiva o anormal de grasa corporal que puede ser perjudicial para la salud, considerándose una forma de malnutrición por exceso y un problema de salud pública mundial, al ser la enfermedad crónica no transmisible más frecuente en la infancia y adolescencia, conocida como «la epidemia del siglo XXI»1. En 2022, el 43% de la población presentaba sobrepeso, frente al 25% en 19902. Según el estudio Aladino 2023, más de un tercio de los niños entre seis y nueve años en España padecen exceso de peso, aunque ha habido un descenso global del 4,5% en los últimos cuatro años3,4.
La obesidad infantil constituye un factor de riesgo para diversas complicaciones tanto a nivel físico como psicosocial e implica un riesgo de progresión y cronificación en la adolescencia y edad adulta1,5. Clásicamente la antropometría ha sido la forma más utilizada para clasificar y diagnosticar la obesidad, mediante el uso de índice de masa corporal (IMC), índice de masa triponderal (IMT), perímetro de cintura, índice cintura/altura y pliegues cutáneos5,6.
Recientemente han adquirido relevancia otras técnicas más precisas para el estudio de la composición corporal. La bioimpedancia eléctrica (BIA) es dentro de ellas la más utilizada, por tratarse de una técnica sencilla, barata, no invasiva, portátil, que permite valorar la composición corporal, y por tanto el estado nutricional y de hidratación del individuo de una manera rápida y sencilla que nos permite, a través de valoraciones seriadas, ver la evolución nutricional de una manera más completa7. De forma añadida aporta el dato de ángulo de fase (PA), que es un indicador fiable del nivel de integridad y vitalidad de las membranas celulares, habiendo demostrado su valor pronóstico en diversas enfermedades y como predictor de morbilidad y mortalidad en población pediátrica8.
Con el fin de determinar la masa muscular esquelética y su funcionalidad a través de la medición de la cantidad de músculo y la fuerza muscular, se precisa una combinación de técnicas diagnósticas, que pueden ser de tipo cuantitativo o cualitativo9. Una de las técnicas más empleadas a nivel cuantitativo es la dinamometría de prensión manual, una prueba rápida, sencilla y no invasiva que mide la fuerza muscular estática máxima. En nuestro medio, contamos con valores de referencia ajustados por edad y sexo10. Por otro lado, diversos estudios sugieren la necesidad de ajustar la fuerza de prensión manual a la masa corporal11. En este sentido, el ratio fuerza prensil manual-IMC se puede emplear como herramienta adicional para determinar la masa grasa corporal ya que una mayor masa grasa se asocia con menor fuerza de prensión relativa12 resultando útil en el estudio y cribado de la obesidad sarcopénica en niños13.
La sarcopenia es un síndrome definido como una disminución en la masa muscular esquelética asociada a una baja función muscular14. Es un proceso complejo y multifactorial, relacionado con la edad, estilo de vida, dieta, inflamación, resistencia a la insulina o estrés oxidativo. Puede ser primaria (edad avanzada) o secundaria (enfermedades crónicas)9. La dinamopenia, por otro lado, hace referencia a la baja fuerza prensil manual determinada mediante dinamometría (menor a -2 desviaciones estándar para edad y sexo según estándares de referencia)10 y puede estar asociada a baja masa muscular.
Obesidad y sarcopenia pueden solaparse en lo que se denomina obesidad sarcopénica, descrita originalmente en población anciana15. Su interacción es bidireccional y sinérgica, aumentando el riesgo de enfermedad metabólica y afectación funcional más que cada una por separado16.
Existen pocos estudios sobre sarcopenia como comorbilidad en jóvenes, aunque se sabe que los niños con enfermedades crónicas presentan una alta prevalencia de disminución de la masa magra muscular en comparación con población sana17. La obesidad sarcopénica en la infancia se asocia a mayor riesgo de enfermedades metabólicas y discapacidad en la vida adulta18. Sin embargo, dado que aún no se ha estudiado en profundidad, el objetivo del presente trabajo es evaluar la fuerza muscular mediante dinamometría de prensión manual en una cohorte de pacientes pediátricos con obesidad.
Material y métodosDiseño del estudioSe realizó un estudio de cohortes descriptivo retrospectivo en el que se incluyeron pacientes remitidos a consulta de nutrición pediátrica con edad entre seis y 16 años, con diagnóstico de obesidad (Z-score IMC ≥ 2 desviación estándar [DE] según)19, con fecha de primera valoración entre el 01/08/2023 y el 31/12/2024. Se registraron datos epidemiológicos (edad, sexo biológico, realización de actividad física extraescolar e intensidad de la misma [tipo de actividad y número de horas semanales, recogido a partir de la anamnesis]), cuantificada en Metabolic Equivalent of Task/semana (METs), antropométricos (peso, talla, IMC absoluto y Z-score según)19, IMT (absoluto y Z-score según)19, perímetro de cintura (valor absoluto y Z-score según)20 e índice cintura/altura, bioquímicos, ecográficos (presencia o ausencia de esteatosis hepática), parámetros del análisis de BIA (bioimpedanciómetro Akern 101), y de dinamometría de prensión manual realizada con dinamómetro de mano mecánico (Takei TKK 5001 Grip-A). Para la realización de la BIA se colocó al paciente en decúbito supino en reposo durante al menos 2 minutos, con brazos y piernas en posición de abducción, formando una angulación de 30-45° respectivamente con respecto al tronco, colocando cuatro electrodos en el hemicuerpo derecho sobre las superficies dorsales de la muñeca y el tobillo a 4-5cm de separación entre sí. Las mediciones se tomaron en consulta ambulatoria sin tener en cuenta estado de ayuno, hidratación o ejercicio previo. Para la dinamometría, se colocó al paciente en bipedestación, con el brazo extendido y paralelo al tronco, sujetando el aparato y ejerciendo la fuerza máxima con ambas manos.
Aspectos éticosEl estudio se realizó en conformidad con los principios éticos, leyes y reglamentos vigentes en Europa y España. Fue evaluado y aprobado por el Comité de Ética de la Investigación con Medicamentos de nuestro centro. Se obtuvo autorización por parte del mismo para la exención del consentimiento informado dadas las características del estudio.
Análisis estadísticoPara el análisis bivariante, la comparación entre grupos independientes se realizó utilizando la prueba t de Student para las variables continuas, y con la X2 para las categóricas, aplicando la prueba exacta de Fisher cuando fue necesario. Asimismo, para establecer la asociación bivariada entre dos variables continuas, se calculó el coeficiente de correlación de Pearson.
Se desarrollaron modelos de regresión múltiple para evaluar por bloques de variables la asociación de la dinamometría en la mano dominante (variable dependiente) con variables demográficas, antropométricas y de bioimpedancia. Se evaluó la multicolinealidad entre las variables independientes. Para cada modelo, se calcularon y reportaron los coeficientes Beta, sus intervalos de confianza al 95%, el error estándar (EE), el estadístico t, y el valor p para determinar la significación estadística de cada predictor. Los modelos finales seleccionados fueron aquellos que presentaron el mayor coeficiente de determinación (R2).
Los análisis se realizaron con el paquete estadístico SPSS v.21, y se consideró un valor p significativo si<0,05.
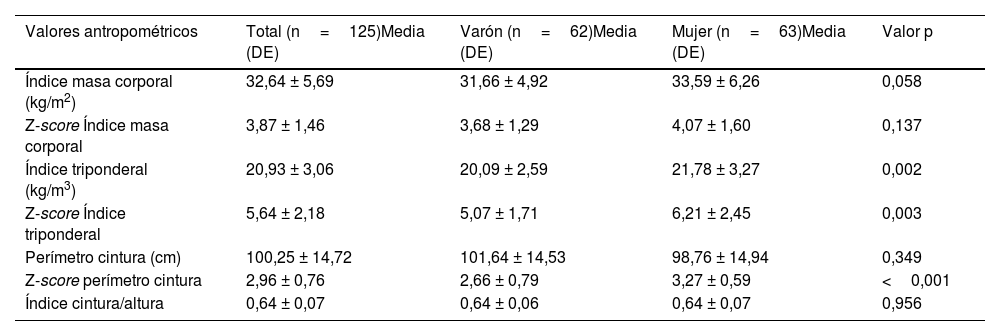
ResultadosSe incluyeron 125 sujetos con un rango de edad entre 6,01 y 16,43 años (12,06 ± 2,64). El 50,4% de los pacientes eran mujeres, las cuales presentaban mayor Z-score de IMT (6,21 ±2,45 vs. 5,07 ±1,7, p=0,002) y perímetro de cintura (3,27 ± 0,59 vs. 2,66 ± 0,79, p <0,001).
Del total de los pacientes, 41 eran prepuberales con una edad media de 9,16 ± 1,97 años y 84 puberales (13,48 ± 1,53 años). El grupo prepuberal mostraba un Z-score del IMT inferior (5,06 ± 1,69kg/m3 vs. 5,93 ± 2,34kg/m3, p=0,037), sin diferencias significativas en el Z-score de IMC y perímetro de cintura.
Los datos antropométricos del total de la muestra se reflejan en la tabla 1.
Parámetros antropométricos de la muestra
| Valores antropométricos | Total (n=125)Media (DE) | Varón (n=62)Media (DE) | Mujer (n=63)Media (DE) | Valor p |
|---|---|---|---|---|
| Índice masa corporal (kg/m2) | 32,64 ± 5,69 | 31,66 ± 4,92 | 33,59 ± 6,26 | 0,058 |
| Z-score Índice masa corporal | 3,87 ± 1,46 | 3,68 ± 1,29 | 4,07 ± 1,60 | 0,137 |
| Índice triponderal (kg/m3) | 20,93 ± 3,06 | 20,09 ± 2,59 | 21,78 ± 3,27 | 0,002 |
| Z-score Índice triponderal | 5,64 ± 2,18 | 5,07 ± 1,71 | 6,21 ± 2,45 | 0,003 |
| Perímetro cintura (cm) | 100,25 ± 14,72 | 101,64 ± 14,53 | 98,76 ± 14,94 | 0,349 |
| Z-score perímetro cintura | 2,96 ± 0,76 | 2,66 ± 0,79 | 3,27 ± 0,59 | <0,001 |
| Índice cintura/altura | 0,64 ± 0,07 | 0,64 ± 0,06 | 0,64 ± 0,07 | 0,956 |
El 67,2% de la muestra realizaba actividad física extraescolar, con una media de 27,64 ± 13,47 MET/semana con diferencias significativas según el sexo, siendo la media en varones 31,56 ± 14,44 MET/semana y en mujeres 23,23 ± 10,85 MET/semana (p=0,003). También se encontraron diferencias según el desarrollo puberal (prepuberales: 24,19 ± 9,92 MET/semana, puberales: 29,72 ± 14,92 MET/semana (p=0,044).
Las alteraciones bioquímicas más frecuentes fueron insulinorresistencia (60,76%) y elevación de la HbA1c (17,07%), seguidas de déficit de vitamina D (15,38%), hiperuricemia (11,32%), hipertirotropinemia eutiroidea (11,11%) y dislipemia (10,43%).
Los pacientes con hiperuricemia presentaban una obesidad más grave, con mayor Z-score de IMC (5,55 ± 2,2 vs. 3,69 ± 1,17, p=0,014), y de perímetro de cintura (3,55 ± 0,87 vs. 2,88 ± 0,75, p=0,017), y mayor porcentaje de masa grasa (39,15 ± 9,41 vs. 33,77 ± 6,18%, p=0,009). Los pacientes con insulinorresistencia presentaban también mayor Z-score de IMT (6,59 ± 2,23 vs. 5,05 ± 1,7) (p=0,002), de IMC (4,47 ± 1,58 vs. 3,4 ± 1,04) (p=0,001), de perímetro de cintura (3,2 ± 0,59 vs. 2,69 ± 0,58) (p=0,003), y de índice cintura/altura (0,67 ± 0,07 vs. 0,62 ± 0,05) (p=0,009) y masa grasa total (32,58 ± 9,45 vs. 25,21 ± 8,2kg, p <0,001).
El 57,47% de los pacientes presentaba datos sugestivos de esteatosis hepática. En conjunto, un 82,8% de los pacientes presentaba alguna comorbilidad metabólica (bioquímica o ecográfica). En los prepuberales este porcentaje era del 69% mientras que en los puberales del 88,6% (p=0,034).
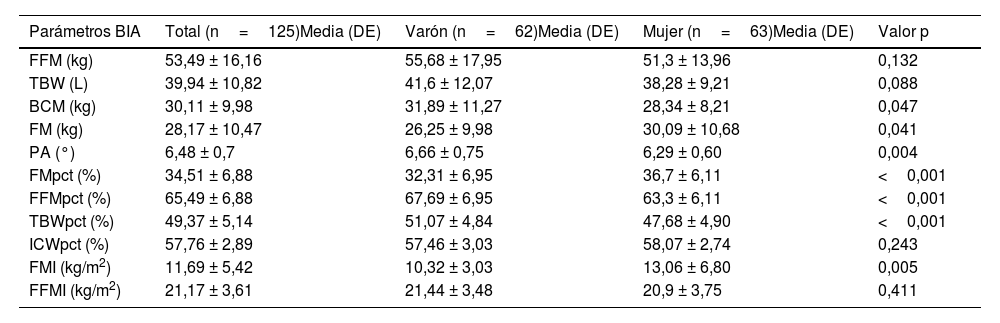
Los resultados del estudio de bioimpedanciometría en el total de la muestra, así como las diferencias según el sexo de muestran en la tabla 2. Existían diferencias en la masa grasa según la realización de actividad física: 31,42 ± 13,15kg en aquellos que realizaban actividad física y 26,62 ± 8,59kg en los que no (p=0,040).
Características del estudio de bioimpedanciometría
| Parámetros BIA | Total (n=125)Media (DE) | Varón (n=62)Media (DE) | Mujer (n=63)Media (DE) | Valor p |
|---|---|---|---|---|
| FFM (kg) | 53,49 ± 16,16 | 55,68 ± 17,95 | 51,3 ± 13,96 | 0,132 |
| TBW (L) | 39,94 ± 10,82 | 41,6 ± 12,07 | 38,28 ± 9,21 | 0,088 |
| BCM (kg) | 30,11 ± 9,98 | 31,89 ± 11,27 | 28,34 ± 8,21 | 0,047 |
| FM (kg) | 28,17 ± 10,47 | 26,25 ± 9,98 | 30,09 ± 10,68 | 0,041 |
| PA (°) | 6,48 ± 0,7 | 6,66 ± 0,75 | 6,29 ± 0,60 | 0,004 |
| FMpct (%) | 34,51 ± 6,88 | 32,31 ± 6,95 | 36,7 ± 6,11 | <0,001 |
| FFMpct (%) | 65,49 ± 6,88 | 67,69 ± 6,95 | 63,3 ± 6,11 | <0,001 |
| TBWpct (%) | 49,37 ± 5,14 | 51,07 ± 4,84 | 47,68 ± 4,90 | <0,001 |
| ICWpct (%) | 57,76 ± 2,89 | 57,46 ± 3,03 | 58,07 ± 2,74 | 0,243 |
| FMI (kg/m2) | 11,69 ± 5,42 | 10,32 ± 3,03 | 13,06 ± 6,80 | 0,005 |
| FFMI (kg/m2) | 21,17 ± 3,61 | 21,44 ± 3,48 | 20,9 ± 3,75 | 0,411 |
FFM: fat free mass (masa libre de grasa); TBW: total body water (agua corporal total); BCM: body cell mass (masa celular corporal); FM: fat mass (masa grasa); PA: phase angle (ángulo de fase); FMpct: fat mass percentage (porcentaje de masa grasa); FFMpct: fat free mass percentage (porcentaje de masa libre de grasa); TBWpct: total body water percentage (porcentaje de agua corporal total); ICWpct: intracellular water percentage (porcentaje de agua intracelular); FMI: fat mass index (índice de masa grasa); FFMI: fat-free mass index (índice de masa libre de grasa); DE: desviación estándar.
Por otro lado, los pacientes puberales tenían significativamente menos porcentaje de masa grasa (p=0,024) y más índice de masa libre de grasa (p <0,001).
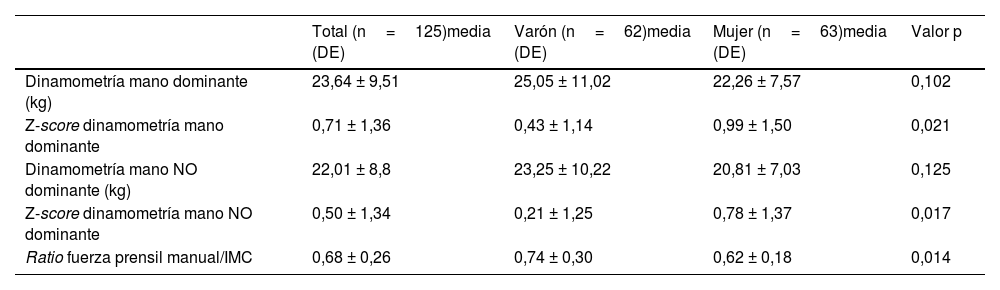
Los resultados del estudio de dinamometría en el total de la muestra, así como las diferencias según el sexo de muestran en la tabla 3. Se obtuvo un valor medio en la dinamometría de la mano dominante (derecha en el 91,07% de los pacientes) de 23,64 ± 9,51kg con un Z-score respecto a los valores de referencia de 0,71 ± 1,36. Únicamente seis pacientes presentaron dinamopenia (4,8%), siendo cuatro de ellos varones.
Características del estudio de dinamometría
| Total (n=125)media (DE) | Varón (n=62)media (DE) | Mujer (n=63)media (DE) | Valor p | |
|---|---|---|---|---|
| Dinamometría mano dominante (kg) | 23,64 ± 9,51 | 25,05 ± 11,02 | 22,26 ± 7,57 | 0,102 |
| Z-score dinamometría mano dominante | 0,71 ± 1,36 | 0,43 ± 1,14 | 0,99 ± 1,50 | 0,021 |
| Dinamometría mano NO dominante (kg) | 22,01 ± 8,8 | 23,25 ± 10,22 | 20,81 ± 7,03 | 0,125 |
| Z-score dinamometría mano NO dominante | 0,50 ± 1,34 | 0,21 ± 1,25 | 0,78 ± 1,37 | 0,017 |
| Ratio fuerza prensil manual/IMC | 0,68 ± 0,26 | 0,74 ± 0,30 | 0,62 ± 0,18 | 0,014 |
DE: desviación estándar.
No se objetivaron diferencias significativas en el Z-score de la fuerza de la mano dominante según la presencia de desarrollo puberal. El ratio fuerza prensil/IMC sí fue significativamente menor en prepúberes (0,46± 0,16 vs. 0,78 ± 0,23, p <0,001). Cabe destacar que, cinco de los seis pacientes que presentaban dinamopenia se encontraban en fase prepuberal (p=0,014).
No se encontraron diferencias estadísticamente significativas en los valores de la dinamometría según la realización o no de actividad física. No obstante, la frecuencia e intensidad de la actividad (METs) sí se correlacionó positivamente con el valor del ratio fuerza prensil manual/ IMC siendo el coeficiente de correlación lineal de Pearson (r)=0,241 (p=0,027) y con la dinamometría de la mano dominante (r=0,217; p=0,046).
El estudio de fuerza muscular no mostró diferencias según la presencia de comorbilidades bioquímicas. Todos los niños con dinamopenia (n=6) presentaban datos ecográficos sugestivos de esteatosis hepática
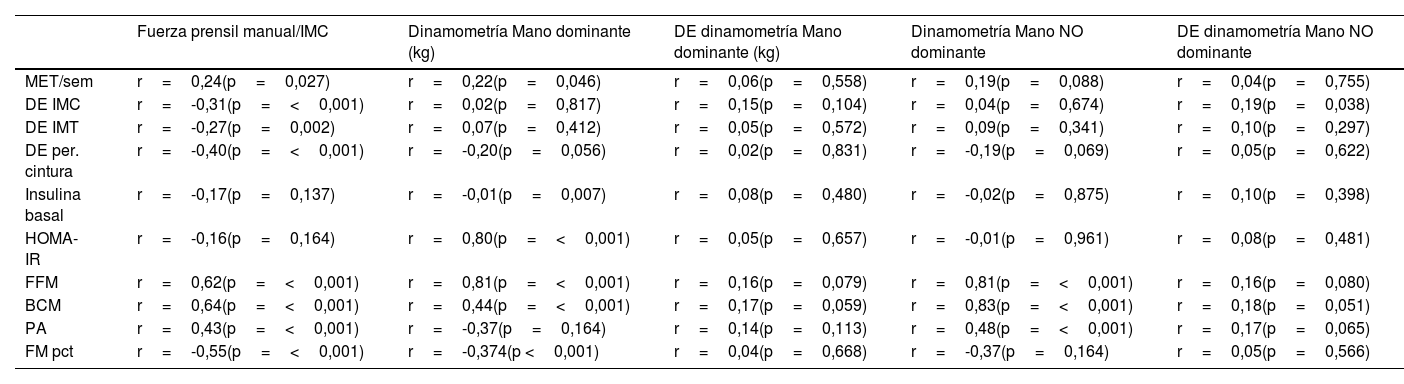
En la tabla 4 se muestran las correlaciones entre las medidas de dinamometría, antropometría y metabólicas del total de la muestra.
Correlación entre las medidas de dinamometría, antropométricas y metabólicas
| Fuerza prensil manual/IMC | Dinamometría Mano dominante (kg) | DE dinamometría Mano dominante (kg) | Dinamometría Mano NO dominante | DE dinamometría Mano NO dominante | |
|---|---|---|---|---|---|
| MET/sem | r=0,24(p=0,027) | r=0,22(p=0,046) | r=0,06(p=0,558) | r=0,19(p=0,088) | r=0,04(p=0,755) |
| DE IMC | r=-0,31(p=<0,001) | r=0,02(p=0,817) | r=0,15(p=0,104) | r=0,04(p=0,674) | r=0,19(p=0,038) |
| DE IMT | r=-0,27(p=0,002) | r=0,07(p=0,412) | r=0,05(p=0,572) | r=0,09(p=0,341) | r=0,10(p=0,297) |
| DE per. cintura | r=-0,40(p=<0,001) | r=-0,20(p=0,056) | r=0,02(p=0,831) | r=-0,19(p=0,069) | r=0,05(p=0,622) |
| Insulina basal | r=-0,17(p=0,137) | r=-0,01(p=0,007) | r=0,08(p=0,480) | r=-0,02(p=0,875) | r=0,10(p=0,398) |
| HOMA-IR | r=-0,16(p=0,164) | r=0,80(p=<0,001) | r=0,05(p=0,657) | r=-0,01(p=0,961) | r=0,08(p=0,481) |
| FFM | r=0,62(p=<0,001) | r=0,81(p=<0,001) | r=0,16(p=0,079) | r=0,81(p=<0,001) | r=0,16(p=0,080) |
| BCM | r=0,64(p=<0,001) | r=0,44(p=<0,001) | r=0,17(p=0,059) | r=0,83(p=<0,001) | r=0,18(p=0,051) |
| PA | r=0,43(p=<0,001) | r=-0,37(p=0,164) | r=0,14(p=0,113) | r=0,48(p=<0,001) | r=0,17(p=0,065) |
| FM pct | r=-0,55(p=<0,001) | r=-0,374(p <0,001) | r=0,04(p=0,668) | r=-0,37(p=0,164) | r=0,05(p=0,566) |
MET: metabolic equivalent of task; IMC: índice de masa corporal; IMT: índice de masa triponderal; r: correlación de Pearson; p: sig. (bilateral); HOMA: homeostasis model assessment (evaluación del modelo de homeostasis); FFM: fat free mass (masa libre de grasa); BCM: body cell mass (masa celular corporal); PA: phase angle (ángulo de fase); FMpct: fat mass percentage (porcentaje de masa grasa); DE: desviación estándar; p: valor p.
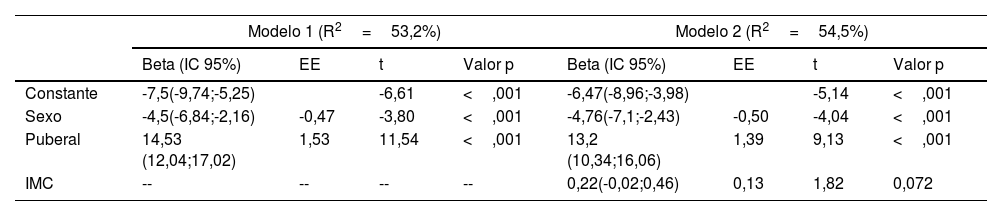
Al estudiar la asociación de la fuerza muscular en la mano dominante (tabla 5) observamos en el modelo 1 que solo el sexo y el desarrollo puberal explican conjuntamente más de la mitad de su varianza (R2=53,2%). Al incluir el IMC en el modelo 2, se observó un pequeño incremento marginal de la varianza explicada (R2=54,5%, ΔR2=1,3%), aunque el coeficiente del IMC no alcanzó la significación estadística (p=0,072). La masa libre de grasa es la variable que se asocia con mayor intensidad a la fuerza muscular (modelo 3), ambas variables correlacionan de manera bivariada en un 80% (p <0,001) y su inclusión en el modelo incrementa sustancialmente el R2 (R2=69,6%) y modifica la dirección del efecto del IMC que pasa a tener un coeficiente negativo y significativo (Beta=-0,33, p=0,007). Este hallazgo sugiere que, una vez controlada la masa magra, el IMC refleja predominantemente el efecto de la masa grasa, la cual ejerce una influencia negativa sobre la fuerza muscular. Finalmente, en el modelo 4 se evaluó la contribución del ángulo fase en vez de la FFM. La asociación con la fuerza muscular del ángulo fase es positiva y significativa, no obstante, este modelo explicó una menor proporción de la varianza (R2=57,2%)
Modelos de regresión multivariante para el estudio de fuerza muscular (variable dependiente: dinamometría de la mano dominante en kg)
| Modelo 1 (R2=53,2%) | Modelo 2 (R2=54,5%) | |||||||
|---|---|---|---|---|---|---|---|---|
| Beta (IC 95%) | EE | t | Valor p | Beta (IC 95%) | EE | t | Valor p | |
| Constante | -7,5(-9,74;-5,25) | -6,61 | <,001 | -6,47(-8,96;-3,98) | -5,14 | <,001 | ||
| Sexo | -4,5(-6,84;-2,16) | -0,47 | -3,80 | <,001 | -4,76(-7,1;-2,43) | -0,50 | -4,04 | <,001 |
| Puberal | 14,53 (12,04;17,02) | 1,53 | 11,54 | <,001 | 13,2 (10,34;16,06) | 1,39 | 9,13 | <,001 |
| IMC | -- | -- | -- | -- | 0,22(-0,02;0,46) | 0,13 | 1,82 | 0,072 |
| Modelo 3 (R2=69,6%) | Modelo 4 (R2=57,2%) | |||||||
|---|---|---|---|---|---|---|---|---|
| Beta (IC 95%) | EE | t | Valor p | Beta (IC 95%) | EE | t | Valor p | |
| Constante | -3,03(-5,28;-0,78) | -2,67 | 0,009 | -6,3(-8,74;-3,86) | -5,12 | <,001 | ||
| Sexo | -0,76(-2,94;1,42) | -0,08 | -0,689 | 0,492 | -3,6(-6,01;-1,19) | -0,37 | -2,96 | 0,004 |
| Puberal | 5,14 (1,97;8,31) | 0,54 | 3.212 | 0,002 | 12,15 (9,23;15,06) | 1,27 | 8,25 | <,001 |
| IMC | -0,33(-0,58;-0,09) | -0,20 | -2.721 | 0,007 | 0,19(-0,04;0,43) | 0,11 | 1,64 | 0,104 |
| FFM | 0,44 (0,33;0,55) | 0,74 | 7,64 | <,001 | -- | -- | -- | -- |
| PA | -- | -- | -- | -- | 2,49(0,71;4,26) | 0,18 | 2,77 | 0,006 |
EE: error estándar; t: estadístico t de Student; Valor p: sig. (bilateral); FFM: fat free mass (masa libre de grasa); IMC: índice de masa corporal; PA: phase angle (ángulo de fase); FMpct: fat mass percentage (porcentaje de masa grasa).
Cabe mencionar que la masa grasa no se incluyó directamente en los modelos junto con el IMC debido a problemas de multicolinealidad. Sin embargo, los análisis de correlación bivariada (tabla 4) revelan una asociación negativa de la masa grasa y el perímetro de cintura con la fuerza muscular.
DiscusiónLa obesidad puede relacionarse con diversas patologías o comorbilidades, entre ellas la sarcopenia. La fuerza muscular ha demostrado en estudios previos una capacidad discriminatoria alta para el riesgo cardiometabólico/síndrome metabólico, el riesgo de obesidad sarcopénica y la salud ósea en niños y jóvenes de cinco a 17 años21.
La mayoría de nuestros pacientes presentaba obesidad grave, y hasta un 82% de ellos mostraba ya alguna comorbilidad metabólica. Sin embargo, de forma global nuestra muestra presentaba unos valores de fuerza muscular estandarizados por encima de la media respecto a la población control10 y únicamente un 4,8% presentaba dinamopenia. Este porcentaje de dinamopenia es ligeramente inferior a la prevalencia encontrada en otros estudios sobre fuerza muscular en obesidad infantil22,23.
Con respecto a las diferencias entre sexos, en nuestra muestra el grupo masculino realizaba más actividad física, en consonancia con datos publicados a nivel nacional3 y presentaba un menor grado de obesidad, así como una composición corporal más favorable reflejada en los resultados de la BIA. Sin embargo, al analizar los resultados de la dinamometría, los varones presentan paradójicamente un menor Z-score de fuerza prensil, si bien esta aparente menor fuerza muscular se anula al introducir el grado de obesidad, dado que presentan un ratio fuerza prensil manual/ IMC mayor. En diversos estudios se establecen diferentes puntos de corte de este ratio para identificar niños y niñas en riesgo de padecer obesidad sarcopénica13,23,24. A pesar de ello, la evidencia existente indica que los niños suelen tener un mayor ratio que las niñas25. Adicionalmente, los estudios previos sobre la influencia del sexo en el desarrollo de obesidad sarcopénica infantil, presentan resultados dispares24,26,27.
Atendiendo al desarrollo puberal, constatamos diversas diferencias entre los dos grupos, tanto a nivel de actividad física (los prepuberales realizan menos actividad física) como en composición corporal (los puberales Z-score de IMT superior, pero con menor porcentaje de masa grasa). En cuanto a la fuerza muscular, no se observan diferencias en el Z-score entre ambos grupos, pero el ratio fuerza prensil manual-IMC se encuentra disminuído en los prepúberes, además de presentar una mayor tasa de dinamopenia, lo cual podría guardar relación con los datos reseñados previamente. Sin embargo, en cuanto al diagnóstico de dinamopenia en niños de menor edad habría que considerar una posible sobreestimación, debido a una colaboración parcial al realizar la dinamometría.
En nuestra población, la mayoría de los niños no realiza ningún tipo de actividad deportiva extraescolar (67%), en contraste con los datos recogidos en el estudio Aladino de 2023, mucho más optimistas (12% de sedentarismo). Hay que indicar que el rango de edad de nuestro estudio es más amplio y se compone solo de niños con obesidad, lo que podría ser tanto causa como consecuencia de ello. La correlación positiva demostrada en nuestro estudio entre la actividad física con fuerza de la mano dominante y el ratio fuerza prensil/IMC confirman la importante relación entre el sedentarismo, que conlleva una menor masa y fuerza muscular, y su efecto deletéreo en la génesis y mantenimiento de la obesidad22,24,28.
Con respecto a las comorbilidades metabólicas, cabe destacar que nuestros pacientes con hiperuricemia o resistencia insulínica presentan significativamente mayor grado de obesidad, además de tener mayor cantidad de masa grasa. En estudios previos se encontró que el aumento de ácido úrico podría servir como marcador cardiometabólico asociado a una disminución de fuerza prensil manual29. Por otro lado, se ha constatado que la insulina juega un papel importante en el riesgo de desarrollar diabetes mellitus tipo 230, enfermedad cardiovascular9 y síndrome metabólico, así como obesidad sarcopénica en la edad adulta29,31. No obstante, en nuestro estudio no se encontró una asociación entre la presencia de estas alteraciones y la fuerza de prensión manual.
Pese al bajo número total de niños con dinamopenia, todos ellos presentaron datos de esteatosis hepática. Estos resultados son congruentes con datos previos descritos en adultos, en los que se demuestra que una baja fuerza muscular está relacionada con un mayor contenido de grasa hepática y un mayor riesgo de esteatosis hepática32.
Hemos podido demostrar que existe una correlación positiva entre fuerza muscular y la realización de actividad física, así como con la masa magra, masa celular y PA. Además, hemos objetivado que, si bien el sexo y el desarrollo puberal son factores importantes a la hora de explicar la fuerza muscular, el factor más determinante que la condiciona es la masa libre de grasa, mientras que la masa grasa tiene un efecto negativo.
En resumen, en nuestra población pediátrica con alta prevalencia de obesidad grave y sedentarismo, el estudio de la composición corporal junto con la valoración de la fuerza muscular ha aportado datos relevantes que resaltan la importancia de incorporar nuevas herramientas diagnósticas que permitan una evaluación más completa, con el fin de predecir complicaciones metabólicas y guiar estrategias terapéuticas individualizadas.
Las limitaciones o áreas de mejora principales en nuestro trabajo, al tratarse de un estudio retrospectivo, tienen relación principalmente con la estandarización en cuanto a la solicitud de pruebas complementarias o la valoración de los pacientes.
En futuras investigaciones podrían añadirse estudios complementarios como la ecografía muscular y test dinámicos que ayuden a determinar la funcionalidad muscular, así como avanzar en la elaboración de un consenso sobre la definición de obesidad sarcopénica pediátrica, con métodos de evaluación estandarizados y puntos de corte definidos según edad y sexo.
ConclusionesLos niños con obesidad en nuestra muestra no presentan una menor fuerza muscular respecto a la población control, y el porcentaje de dinamopenia encontrado es bajo. Los varones realizan más actividad física y presentan una mejor condición física según su antropometría y composición corporal, y los pacientes prepúberes realizan menos actividad física, tienen más porcentaje de masa grasa y mayor incidencia de dinamopenia. La fuerza muscular se correlaciona con la realización de actividad física, así como con la masa magra, masa celular y el PA, siendo la masa magra el factor predictor más fuerte de la misma, mientras que la masa grasa se correlaciona negativamente con la fuerza muscular.
Conflicto de interesesMercedes Murray Hurtado y Álvaro Martín Rivada han recibido apoyo económico en los últimos cinco años para desplazamiento, alojamiento y matriculación para asistir a cursos y congresos, así como pagos por su participación como docente, por parte de Nestlé Health Science, Abbott, Nutricia, Fresenius Kabi, Mead & Johnson y Casen Recordati; si bien niegan conflicto de intereses que pudieran interferir con los resultados de esta investigación. Yolanda Ramallo Quintero y Elena Sánchez Camacho niegan tener conflicto de intereses.
Agradecemos al Colegio Oficial de Médicos de Tenerife por su asesoría metodológica y estadística para la realización de este trabajo.