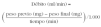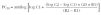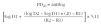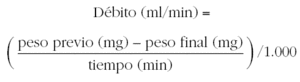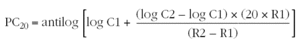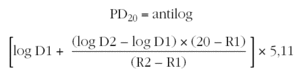Introducción
El estudio de la función pulmonar y de la respuesta de ésta a diferentes estímulos, proporciona instrumentos de crucial importancia en el análisis del niño con problemas respiratorios. Tras un primer artículo donde se establecían las recomendaciones sobre la práctica del estudio de la función pulmonar básica (espirometría y prueba broncodilatadora), en este segundo el grupo de trabajo de técnicas de la Sociedad Española de Neumología Pediátrica, pretende exponer una guía sencilla y clara para la correcta realización de las pruebas de provocación bronquial inespecífica mediante estímulos físicos y farmacológicos.
Entendemos por hiperrespuesta bronquial un aumento en el grado de obstrucción de las vías aéreas en respuesta a estímulos broncoconstrictores in vivo. Su medición se efectúa mediante la práctica de una prueba de provocación, usualmente mediante el método dosis-respuesta, exponiendo al sujeto a dosis crecientes de un estímulo broncoconstrictor mientras se mide un índice de función pulmonar.
La hiperrespuesta bronquial (HRB) es una de las características que acompaña al asma. Más del 80 % de los pacientes con historia de asma y el 98-100 % de los que presentan asma sintomática presentan HRB. La demostración de un grado intenso de HRB sugiere enormemente la existencia de asma, aunque ni su simple demostración ni su ausencia, permiten asegurar ni descartar el diagnóstico. También se observa HRB, aunque en general en grado leve, en otros procesos como la fibrosis quística, bronquiectasias, infecciones virales, displasia broncopulmonar, rinitis alérgica.
Clasificación de la hiperrespuesta bronquial
Según la naturaleza del estímulo broncoconstrictor se puede clasificar en específica e inespecífica.
La hiperrespuesta bronquial específica es la respuesta de las vías aéreas frente a sustancias sensibilizantes específicas (alérgenos). Afecta sólo a un grupo de sujetos sensibilizados a un determinado alérgeno. Su medición se realiza mediante la inhalación del antígeno específico relacionándose la intensidad de la HRB con la gravedad del asma provocada por dicha sustancia.
La hiperrespuesta bronquial inespecífica expresa la tendencia de las vías aéreas a reaccionar ante una serie de estímulos físicos, químicos o farmacológicos. Los estímulos son inespecíficos en el sentido de que afectan a la mayoría de sujetos hiperreactivos e incluso a las personas normales si se utiliza una dosis suficiente del estímulo1,2.
Medida de la hiperrespuesta bronquial
>La HRB se mide mediante pruebas de broncoprovocación. Para ello se emplean estímulos bronconstrictores que actúan a través de diversos mecanismos. La respuesta que hay que medir es la obstrucción al flujo aéreo que puede ser objetivada mediante la realización de pruebas de función pulmonar.
Los estímulos broncoconstrictores se clasifican en3:
1. Estímulos directos: actúan sobre los receptores del músculo liso bronquial (metacolina, carbacol, histamina, prostaglandina D2 y cisteinil-leucotrienos).
2. Estímulos indirectos: actúan en células distintas a la musculatura lisa (células inflamatorias, células epiteliales y neuronas) estimulando la liberación de mediadores celulares o neurotransmisores que provocan la contracción del músculo liso3. Puede tratarse de estímulos físicos (ejercicio, soluciones hipoosmolares o hiperosmolares, hiperventilación con aire frío, manitol) o farmacológicos (adenosina).
En los pacientes con asma la reactividad bronquial a un estímulo indirecto estaría más relacionada con la inflamación bronquial que la reactividad a un estímulo directo4. Por ello, las pruebas con estímulos indirectos podrían ser más específicas del asma.
Indicaciones
Estaría indicada la práctica de un test de provocación bronquial para detectar la presencia de hiperrespuesta en:
1. Diagnóstico de pacientes con historia clínica de asma y cuya espirometría basal y prueba broncodilatadora son normales. Un test de provocación bronquial normal con metacolina, dada su alta sensibilidad y elevado valor predictivo negativo, nos es más útil para descartar que para confirmar el asma. En cambio, el test de esfuerzo es bastante específico de asma.
2. Valorar la presencia y intensidad del broncospasmo inducido por el ejercicio (test de esfuerzo).
3. Valoración de la eficacia de medidas preventivas y/o terapéuticas.
4. Valoración evolutiva del proceso que condiciona la hiperrespuesta.
5. Estudios epidemiológicos sobre el asma e hiperrespuesta.
6. Valorar el estado físico de deportistas y profesionales de riesgo5.
Contraindicaciones
En pediatría, las absolutas son poco frecuentes de observar.
Absolutas
Limitación grave al flujo aéreo (volumen espiratorio forzado en el primer segundo [FEV1] < 40 % respecto al valor teórico).
Cardiopatía isquémica o accidente vascular cerebral menor de 3 meses, arritmia grave.
Hipersensibilidad a los fármacos utilizados.
Relativas
Limitación moderada al flujo aéreo FEV1 < 60 %.
Agudización del asma.
Infección respiratoria reciente 4-6 semanas.
Limitación para el ejercicio.
Pruebas de provocación bronquial inespecífica mediante estímulos físicos
Prueba de broncoprovocación con esfuerzo submáximo (test de esfuerzo)
El ejercicio actúa como estímulo de la limitación al flujo aéreo en pacientes con hiperrespuesta bronquial y es uno de los principales desencadenantes de asma.
Un porcentaje elevado de niños asmáticos sufre broncoconstricción inducida por el ejercicio, ya sea sola o asociada a otros estímulos.
El test de esfuerzo es una prueba de provocación bronquial inespecífica que utiliza estímulos físicos. A pesar de algunas limitaciones: la falta de reproducibilidad, la dificultad de valorar el efecto dosis-respuesta y la influencia de otros factores ambientales en el resultado, especialmente en el test de carrera libre, es una de las pruebas que más se utilizan en pediatría. Su sencillez, seguridad, especificidad para el asma y ser la que mejor reproduce la vida real de un niño, la han llevado a ser una de las más empleadas.
Factores que influyen o modifican la respuesta al ejercicio
Las principales variables que determinan la magnitud de la broncoconstricción tras el esfuerzo son el volumen minuto conseguido, la humedad del aire inspirado y su temperatura. Para un nivel de volumen minuto fijo, un aire húmedo y templado produce menos broncoconstricción, ya que el estímulo inicial para la obstrucción es el enfriamiento y pérdida de humedad de las vías aéreas intratorácicas6,7.
En relación con ello, influyen los siguientes factores:
1. Respiración nasal o bucal. La ventilación nasal proporciona un mejor acondicionamiento de temperatura y humedad del aire que la bucal, por lo que es mejor realizar la prueba con pinzas nasales, obligando al paciente a respirar por la boca.
2. Intensidad y duración del ejercicio. Ejercicios intensos y de corta duración suelen ser mejor tolerados y no desencadenan tan fácilmente broncoconstricción. Un ejercicio de 6-8 min alcanzando el 60-80 % del volumen minuto (VE) teórico máximo será más productor de broncoconstricción.
3. Intervalo en que se repite el ejercicio-período refractario. Cuando se repiten varios tests de ejercicio, la intensidad de la broncoconstricción va disminuyendo, especialmente si es dentro de las primeras 2 h.
4. Premedicación. Diferentes fármacos pueden modificar la respuesta al ejercicio, por lo que se deben asegurar los tiempos mínimos de eliminación del fármaco8,9 (tabla 1).
5. Entrenamiento previo.
6. Para poder valorar adecuadamente la prueba se deben evitar también: la exposición al tabaco 2 h antes, las infecciones respiratorias en las 3-6 semanas previas y la exposición importante a contaminantes atmosféricos una semana antes.
Material necesario y condiciones previas
Para la práctica de la prueba se necesita un espirómetro, un sistema de medición de la frecuencia cardíaca y un dispositivo para la realización del ejercicio (tapiz rodante o bicicleta ergométrica), o bien un espacio para realizar la carrera libre. De forma opcional se puede monitorizar durante la prueba la saturación de hemoglobina, el electrocardiograma y la presión arterial10. El ejercicio debe ser supervisado y además de revisar la no administración de fármacos que puedan interferir con la prueba, las condiciones previas deben contemplar:
Ausencia de síntomas clínicos de asma en el momento de la prueba.
• Exploración cardiorrespiratoria basal dentro de la normalidad.
• Cifras basales de capacidad vital forzada (FVC) y FEV1 ≥ 80 % del valor teórico.
• Ir adecuadamente preparado para realizar el ejercicio sin presencia de limitaciones físicas y no haber realizado ningún otro ejercicio ese mismo día.
Protocolos y métodos para la realización de la prueba
Carrera libre. Se considera el modo más fisiológico de inducir el broncospasmo y el que más induce el asma. Es un método sencillo, que no necesita equipamiento sofisticado, y que consiste en realizar una carrera libre durante 6-8 min. La intensidad del esfuerzo debe ser suficiente para alcanzar y mantener una frecuencia cardíaca del 80-90 % del valor máximo teórico (220 edad), pudiéndose aceptar en niños una cifra de 175 latidos por minuto [lat./min])11,12.
Si se realiza en interior, se debería realizar en un área tranquila con la temperatura entre los 20-25 °C y una humedad relativa del 50 %. Tiene la dificultad si es exterior de no poder controlar la temperatura ni la presencia de alérgenos ambientales. En ambas situaciones no se tiene control electrocardiográfico ni sobre la intensidad del trabajo realizado, aunque se puede controlar la frecuencia cardíaca por telemetría.
La metodología de la prueba es la siguiente:
1. Inicialmente se registrarán las condiciones ambientales y las constantes del paciente.
2. Realización de espirometría basal.
3. Carrera libre de 6-8 min. Inicio y cese del ejercicio brusco.
4. Exploración física inmediata tras el ejercicio. Valoración de la intensidad del ejercicio. Si la frecuencia cardíaca es adecuada y/o se observan síntomas o signos de obstrucción del flujo aéreo, se considera que el esfuerzo ha sido adecuado.
5. Espirometría postesfuerzo a los 5-10-15 y opcionalmente a los 20-30 min.
6. Valorar criterios de positividad.
7. Si el paciente presenta disnea o no recupera su FEV1 basal a los 30 min, se debe administrar un β2-adrenérgico de acción corta inhalado, controlando la respuesta broncodilatadora.
Test de esfuerzo en el laboratorio de función pulmonar. La realización de actividad física requiere el concurso y la integración de distintos mecanismos fisiológicos de adaptación que soporten el aumento de la demanda metabólica. Existen diferentes tipos de tests para evaluar la tolerancia al ejercicio en el laboratorio de función pulmonar: la prueba de esfuerzo máximo cardiopulmonar en la que se evalúa el funcionamiento y la adecuada integración del sistema respiratorio, cardiovascular y muscular13, y la prueba de broncoprovocación con esfuerzo a la que nos estamos refiriendo.
Dado que tanto la temperatura como la humedad del aire pueden modificar la respuesta al ejercicio, deben registrarse ambos parámetros al realizar la prueba, recomendándose que se inspire aire a menos de 25 °C y que el contenido en agua sea inferior a 10 mg/l, lo que puede obtenerse realizando la prueba en una habitación con aire acondicionado regulando la temperatura entre 20-25 °C y la humedad relativa del 50 % o inferior. Así mismo el paciente debe llevar una pinza nasal para disminuir la humidificación del aire inspirado10. Durante la realización del esfuerzo se monitoriza la frecuencia cardíaca por registro electrocardiográfico, por pulsioximetría o con un pulsómetro, con el fin de asegurar que se alcanza el nivel de esfuerzo requerido y por la seguridad del paciente durante el desarrollo de la prueba.
Método. La prueba se puede realizar en tapiz rodante o en bicicleta ergométrica. Las diferencias de respuesta entre ambas son pequeñas y sin mucha importancia clínica. En adultos se usa con más frecuencia la bicicleta por la mayor facilidad de mantenimiento, menor movimiento corporal, aunque el tapiz rodante o l a carrera libre son un estímulo broncoconstrictor más poderoso y, sobre todo, más fácil de usar con niños.
Tapiz rodante. Se escoge la velocidad e inclinación necesarias para una duración total de ejercicio de 6-8 min y para mantener durante 4-6 min el esfuerzo deseado, lo que se consigue habitualmente al alcanzar una frecuencia cardíaca del 80-90 % de la máxima (220 edad en años) o una ventilación del 40-60 % de la ventilación máxima estimada (FEV1 x 35), aunque este último es un sistema poco utilizado en niños, ya que requiere un equipamiento más especializado. Dado que los niños generalmente alcanzan antes el esfuerzo máximo que los adultos, la duración de la prueba puede ser de 6 min.
El protocolo de realización propuesto es el siguiente:
• Control de condiciones ambientales.
• Obtención de las constantes del paciente y realización de espirometría forzada basal.
• Inicio de la prueba con inclinación del tapiz del 10 %, incremento de la velocidad de 0 a 6 km/h (5 km/h en los más pequeños) en los 2 min iniciales hasta alcanzar una frecuencia cardíaca del 80-90 % de la máxima teórica.
• Se mantiene la velocidad hasta completar los 6 min de la prueba.
• Paro progresivo en 30 s.
• Realizar espirometrías seriadas: inmediata, a los 5, 10, 15, y opcionalmente 20 y 30 min.
Bicicleta ergométrica. La metódica de la prueba con la bicicleta ergométrica es similar a la referida con el tapiz rodante.
Es necesario obtener el esfuerzo máximo en los primeros 4 min y su mantenimiento total durante 6 min, ya que la prolongación de la prueba implica una mayor pérdida de agua, que modifica la respuesta inducida por el ejercicio, pudiendo aparecer períodos refractarios por la realización de esfuerzos submáximos prolongados. Es importante que la intensidad del ejercicio sea tal que el niño no pueda seguir más de 6 o 8 min ya que si puede es poco probable que la intensidad del ejercicio haya sido suficiente para inducir broncospasmo.
En la bicicleta ergométrica se puede calcular la carga de trabajo diana con la siguiente ecuación: watt = (FEV1 medido x 53,76) 2 11,07.
La carga de trabajo inicial es del 60 % de la carga diana en el primer minuto, 75 % en el segundo minuto, 90 % en el tercer minuto y 100 % en el cuarto minuto, manteniéndolo durante 4 min.
Puede resultar difícil su ejecución en niños por la dificultad para mantener una velocidad de pedaleo constante.
Expresión de los resultados
La variable principal a valorar es el FEV1, realizándose la espirometría tanto basal como las seriadas tras la realización del ejercicio a los 5, 10, 15 y, opcionalmente, 20 y 30 min. Algunos autores recomiendan introducir determinaciones precoces (1 y 3 min tras el ejercicio) para detectar casos graves de broncospasmo inducido por el ejercicio. En cada determinación se recomienda obtener al menos dos, y preferiblemente tres, determinaciones validas teniendo como punto de referencia que los valores del FEV1 mayor y el siguiente no varíen en más de 0,2 l, escogiéndose el mayor de los FEV1 aceptable como el representativo del intervalo para su posterior comparación14.
El FEV1 alcanza generalmente su valor mínimo en los primeros 10 min tras el cese del ejercicio, no finalizando la prueba hasta obtenerse el valle, que puede establecerse cuando en los siguientes dos intervalos de determinaciones el FEV1 presenta valores mayores, por lo que si el FEV1 recuper a el valor basal o superior tras obtenerse el valle, la prueba se puede finalizar tras constatarse la mejoría del FEV1 a los 10 y 15 min si el valle se obtiene a los 5 min.
Si el FEV1 no se recupera hasta un intervalo del 10 % del basal tras 30 min o el paciente presenta disnea en cualquier momento de la prueba se administrará un β -agonista.
Cuando se detecta un descenso del 10 % del FEV1 basal tras el ejercicio, se considera una respuesta anormal, si bien para el diagnóstico de broncospasmo inducido por el ejercicio en pediatría es más específico el descenso del 15 % del FEV1.También se pueden valorar el descenso del 25 % del flujo espiratorio forzado en el 25-75 % de la capacidad forzada (FEF25-75 %) y del 30 % del pico de flujo espiratorio (PEF).
Falsos positivos y negativos. La realización de esfuerzos subóptimos durante tiempo prolongado o la realización de ejercicio físico previo a la realización del test, pueden condicionar la aparición de un período refractario de una duración de 1 a 2 h en el 50 % de los casos, que puede condicionar una prueba como falso negativo.
Patologías de la vía aérea superior como disfunción de cuerdas vocales o la motilidad anómala de los cartílagos aritenoides (prolapso) pueden originar también disnea con el ejercicio, diferenciándose al examinar las curvas flujo-volumen completas con rama inspiratoria y espiratoria.
La realización de inspiraciones poco completas durante la espirometría puede dar valores disminuidos de FEV1 que ocasionarían falsos positivos.
Hiperventilación voluntaria isocápnica simple con aire seco/aire frío
El aumento de la ventilación por sí solo provoca broncoconstricción, siendo ésta más intensa cuanto mayor es la VE. A este aumento de la ventilación se asocian modificaciones en la temperatura y humedad del aire inspirado, y la respuesta muestra una relación proporcional entre la cantidad de calor y humedad pérdida en la vía aérea y el grado de obstrucción1,15. La secuencia sería: aumento de la ventilación, sobrecarga térmica sobre la glotis, descenso de la temperatura de la mucosa, transferencia del calor y humedad al aire, liberación de mediadores y obstrucción proporcional al intercambio de calor y humedad. Estudios recientes parecen demostrar que la broncoconstricción sería debida a la hiperemia y edema de pared de la vía aérea que provocaría en el paciente asmático el aumento rápido de flujo sanguíneo en los bronquios por el gradiente térmico originado y un aumento de la reactividad vascular.
Método
En función de la colaboración del niño, se mide de forma basal la resistencia específica de la vía aérea (sRaw) o se realiza una espirometría con el paciente sentado frente al neumotacógrafo, con la nariz tapada, respiración bucal normal durante 2 min, para posteriormente realizar una hiperventilación de una ventilación minuto del 60-80 % de la teórica. (FEV1 x 35). Se debe estimular verbalmente o mediante incentivos visuales (siguiendo la visualización de su VE), a mantener la misma durante el período de estudio.
Para inducir la hiperventilación existen comercialmente intercambiadores de calor que permiten la realización de pruebas por medio de aire frío a 15 °C con una concentración de CO2 del 5 % o aire seco enriquecido también con CO2 al 5 % (hiperventilación isocápnica).
El período de hiperventilación debe durar 4 min, para la prueba con aire frío y 6 min con el aire seco. Una vez acabada esta fase el paciente permanece con respiración normal durante 3 min como período de recuperación.
A los 5 min de haber acabado la hiperventilación se realiza una nueva medición de la resistencia específica de la vía aérea o espirometría pudiéndose repetir para valorar la respuesta a los 15, 30 y 60 min.
La provocación con aire frío es más corta y supera a la de aire seco en la magnitud de la respuesta, siendo capaz de provocar un período refractario, probablemente explicado por el estímulo adicional del enfriamiento de la vía aérea, por lo que es un buen test para el estudio de hiperreactividad bronquial en niños pequeños con asma16-19.
Inhalación de soluciones osmóticas. suero salino hipertónico
El suero salino hipertónico es un estímulo indirecto que produce broncoconstricción, presumiblemente por la liberación de mediadores inflamatorios de las células intermediarias.
Hay evidencias que sugieren que en los niños con asma la presencia de hiperrespuesta al suero salino hipertónico está más relacionada con la inflamación subyacente de las vías aéreas, que la hiperrespuesta a los estímulos directos como la metacolina o la histamina.
La prueba de broncoprovocación con suero salino hipertónico es muy utilizada especialmente en los estudios epidemiológicos, ya que es la prueba recomendada en el International Study of Asthma and Allergies in Childhood (ISAAC).
La presencia de hiperrespuesta al suero salino hipertónico tiene una especificidad de hasta el 92 % para la presencia de síntomas de asma en los últimos 12 meses20,21. La prueba de broncoprovocación con suero salino hipertónico puede ser también una alternativa a la prueba de esfuerzo en las personas con asma inducida por el ejercicio22.
Método
Se pueden realizar con diferentes soluciones, aunque en general se suele utilizar la del 4,5 %. El sujeto inhala habitualmente durante 5-10 min la mezcla escogida en forma de aerosol ultrasónico que se administra a un flujo alto no menor de 1,5 ml/min con mascarilla facial.
Se realiza una espirometría basal y a continuación se nebuliza el suero hipertónico en períodos sucesivos de 0, 5, 1, 2, 4 y 8 min (tiempo total 15,5 min). Después de cada inhalación (1 min después), se realiza una espirometría y se valoran 2 determinaciones reproducibles (con una diferencia inferior al 5 %) de FEV1 de la que se selecciona la mayor. Si se produce un descenso del FEV1 entre el 10 y el 15 % en relación al FEV1 basal, se repite de nuevo el mismo tiempo. La prueba finaliza después de un tiempo total de inhalación de 15,5 min, o si el FEV1 cae ≥ 15 % en relación al basal23-25.
El nebulizador se pesa al inicio y al final de la prueba para comprobar la cantidad de suero salino nebulizado.
Valoración de los resultados
En el momento actual no existe un parámetro que cumpla todas las expectativas exigibles, por ello la elección va a estar condicionada por el objetivo de la prueba y por la disponibilidad de cada laboratorio.
Se considera una prueba positiva tras la inhalación de suero salino hipertónico si se produce una caída igual o superior al 15 % del FEV1 tras la inhalación de una dosis de provocación (PD) ≤ 23 g de suero salino hipertónico (PD15 ≤ 23 g) que es la dosis acumulada después de 15,5 min de inhalación con un flujo mínimo de 1,5 ml/min24,25.
Caídas del FEV1 del 20 %, del FEF25-75 % o del PEF del 25 %, de un 30 % del flujo espiratorio máximo medio (MEF50) se consideran como positivas. Así mismo aumentos del 25 % de capacidad residual funcional (FRC) y del 35 % de conductancia específica de la vía aérea (sGaw) se consideran cambios significativos.
El FEV1 es una medida muy reproducible, de fácil realización y que no requiere un equipo complejo. Posee elevada especificidad. Como inconvenientes es que es el parámetro menos sensible y requiere maniobras forzadas.
El PEF, MEF50 también son fáciles de realizar con aparatos de bajo coste y portátiles. Tienen menor especificidad y mayor coeficiente de variación. Proporcionan información de la vía aérea pequeña y son dependientes del volumen y del esfuerzo.
La resistencia específica de la vía aérea (sRaw) y sGaw, miden los cambios de la vía aérea de gran calibre y no precisan de maniobras forzadas para su realización. Son muy sensibles. Como inconvenientes estaría su menor reproducibilidad y requieren una instrumentación más cara y compleja.10
Además del cálculo de la PD15, es posible calcular una curva dosis-respuesta que se relaciona con la gravedad de los síntomas del asma.
Pruebas de provocación bronquial inespecífica mediante estímulos farmacológicos directos o indirectos: metacolina y adenosina
Prueba de provocación bronquial con metacolina
La metacolina es un derivado sintético de la acetilcolina que es la sustancia broncoconstrictora natural. La acetilcolina no es adecuada para la prueba porque se degrada muy rápidamente por la acetilcolinesterasa y otras colinesterasas inespecíficas. La metacolina se degrada de forma tres veces más lenta por la acetilcolinesterasa y es resistente a las colinesterasas inespecíficas, por lo que su efecto más prolongado proporciona tiempo suficiente para medir la respuesta21. La función pulmonar vuelve a sus valores basales a los 30-45 min de inhalar la metacolina.
Indicaciones
Desde el punto de vista clínico tiene interés para apoyar el diagnóstico de asma en:
1. Pacientes con historia sugestiva de asma que están en fase asintomática y en los que no se ha podido constatar obstrucción reversible al flujo aéreo o variabilidad en el mismo.
2. Pacientes con sintomatología atípica o monosintomáticos, como tos crónica, opresión torácica o tos y/o disnea de esfuerzo. amond" SIZE=2>El valor predictivo negativo es mayor que su valor predictivo positivo. En general, una prueba negativa excluye el diagnóstico de asma en razón de la alta especificidad de la prueba. Sin el diagnóstico de asma deberá además apoyarse en la evolución clínica y en la respuesta al tratamiento asmático.
Algunos autores22 han demostrado la eficacia de un programa de tratamiento del asma basado en la medida de la hiperrespuesta bronquial.
La principal aplicación hoy día de las pruebas de HRB está en la investigación ya sea epidemiológica o farmacoterapéutica.
Contraindicaciones
Son contraindicaciones absolutas la presencia de una obstrucción grave de las vías aéreas (FEV1 < 50 % del teórico), y la existencia de problemas cardiovasculares (insuficiencia cardíaca, hipertensión arterial no controlada)14.
La presencia de una obstrucción moderada de la vía aérea (FEV1 < 60 % del teórico) se considera una contraindicación relativa24, aunque este límite no está bien definido. Muchos autores no realizan la prueba si el FEV1 basal no es superior al 70 % y algunos si no es superior al 80 %25. También el embarazo es una contraindicación relativa, ya que no se conocen los posibles efectos de la metacolina sobre el feto.
Seguridad
Puesto que la metacolina produce broncoconstricción se debe disponer de oxígeno, un pulsioxímetro y un esfingomanómetro y de personal y medicación adecuada para tratar el broncospasmo. Aunque muchos pacientes no experimentan ningún síntoma con la realización de la prueba, los que tienen una respuesta positiva pueden presentar síntomas transitorios como disnea, opresión torácica, tos y sibilancias, que ceden en pocos minutos. No se conocen reacciones tardías a la metacolina con las dosis usadas habitualmente en la clínica. No se han descrito reacciones adversas graves14.
Por otro lado, es necesario minimizar la exposición de los técnicos que realizan la prueba a la metacolina, mediante la ventilación adecuada de la sala de pruebas funcionales, y la posible utilización de filtros espiratorios. La exposición ambiental es menor cuando la prueba se realiza con dosímetro que cuando se utiliza un nebulizador14.
Preparación del paciente
Es necesario explicar la prueba al niño y a sus padres y es conveniente solicitar consentimiento informado para la prueba.
Después de pasar una infección respiratoria viral puede haber una hiperrespuesta bronquial transitoria, por lo que al menos deben haber pasado 3 semanas desde la misma. Se debe suspender la medicación antiasmática según lo expuesto en la tabla 114.
No es necesario suspender rutinariamente los corticoides orales o inhalados, aunque hay que tener en cuenta en la interpretación de la prueba que su efecto antiinflamatorio disminuye la hiperrespuesta bronquial.
Preparación de la solución de metacolina
Para la práctica de la prueba se utiliza cloruro de metacolina, que está disponible como un polvo seco cristalino. Existe una preparación aprobada para uso humano por la Food and Drug Administration (FDA), que se puede adquirir como medicamento extranjero (Provocholine®; Metapharm, Brantford, ON, Canada). Está disponible en viales de 100 y de 1.280 mg.
Para la dilución de la metacolina se utiliza suero salino estéril (cloruro sódico 0,9 %), no siendo necesario el empleo de conservantes ni tampones14.
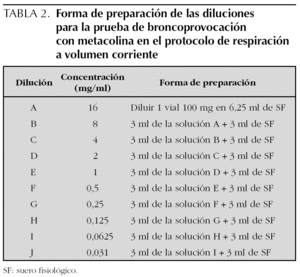
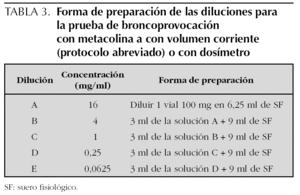
Las soluciones preparadas de metacolina se guardan en el frigorífico a 4 °C, del que se deben sacar 30 min antes de realizar la prueba, para utilizarla a temperatura ambiente. Las soluciones con concentraciones de 0,125 mg/ml o superiores, son estables durante 3 meses a 4 °C. La forma de preparar las diluciones se expresa en las tablas 2 y 3.
Protocolos de realización
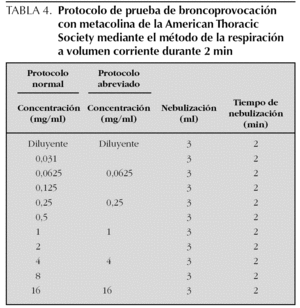
Existen diferentes protocolos de realización de la prueba con diferentes concentraciones de metacolina y con la utilización de un dosímetro o de un nebulizador. La American Thoracic Society (ATS) recomienda la utilización del protocolo de la respiración a volumen corriente durante 2 min o del protocolo de las 5 inhalaciones con dosímetro. Aunque con el protocolo de la respiración a volumen corriente se deposita probablemente una mayor cantidad de metacolina debajo de las cuerdas vocales (0,089 ml) que con el método de las 5 inhalaciones con dosímetro (0,032 ml), ambos métodos parecen proporcionar resultados equivalentes, probablemente debido a un mayor depósito de partículas en los alvéolos y a una ligera pérdida del efecto de la metacolina, en el momento de realizar las espirometrías, con el primer método14.
Protocolo de la respiración a volumen corriente durante 2 min. En esta técnica el aerosol se genera con un nebulizador de flujo continuo, que el niño inhala respirando a volumen corriente. Se ponen 3 ml de solución y se nebulizan durante 2 min.
Se preparan 10 soluciones de metacolina en concentración doble una de la otra desde 0,031 hasta 16 mg/ml. Con ello resultan incluyendo la administración del disolvente (opcional) un total de 11 nebulizaciones (tabla 4). Dada la dificultad práctica de utilizar este número elevado de nebulizaciones en los niños, se pueden utilizar protocolos abreviados en los que se pueden saltar las concentraciones inferiores de metacolina en los niños con menos riesgo de presentar una respuesta positiva (p. ej., empezando con concentraciones de 1 mg/ml en niños con asma asintomáticos con función pulmonar normal y que no toman medicación antiinflamatoria) o bien cuadriplicando la dosis en lugar de duplicarla, utilizando en este caso concentraciones de metacolina de 0,0625, 0,25, 1, 4 y 16 mg/ml. En general se considera seguro cuadriplicar la dosis si la caída en el FEV1 con una dosis determinada ha sido menor al 5 %14.
Las diferentes soluciones de cloruro sódico y de metacolina se administran con un nebulizador tipo jet, empleando como fuente de nebulización una botella de aire comprimido trabajando a 15 psi de presión (1 barr).
El nebulizador debe proporcionar un diámetro de masa media aerodinámico entre 1 y 3,6 μm, y se debe calibrar para calcular el flujo de aire comprimido necesario para proporcionar un débito de 0,13 ml/min ± 10 %. El débito del aerosol indica la cantidad de aerosol disponible por unidad de tiempo para ser inhalado. Para calcular el débito del nebulizador se realiza el siguiente procedimiento14:
1. Introducción de 3 ml de suero salino fisiológico en el nebulizador.
2. Pesar el nebulizador usando una balanza de precisión (peso previo).
3. Ajustar el flujo a 7 l/min y nebulizar exactamente 2 min.
4. Pesar de nuevo el nebulizador (pospeso) y vaciarlo.
5. Repetir los pasos previos para flujos de 8 y 9 l (o 3, 4, 5 y 6 l/min, en otros modelos de nebulizador).
6. Calcular el débito del nebulizador para cada uno de los flujos, asumiendo que 1 ml de suero fisiológico, pesa 1.000 mg:
7. Por interpolación se determina el flujo que produzca un débito de 0,13 ml/min.
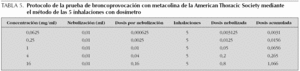
Protocolo de las 5 inhalaciones con dosímetro. En este protocolo se utiliza un dosímetro que permite administrar una dosis conocida de metacolina y posteriormente calcular la dosis acumulada de metacolina a la que se obtiene una respuesta.
Se recomienda utilizar las siguientes concentraciones: 0,0625, 0,25, 1, 4 y 16 mg/ml (dosis opcional 32 mg/ml, en estudios de investigación y epidemiológicos). La dosis acumulada final de metacolina con este método es de 1 mg (tabla 5).
Se deben realizar 5 inspiraciones de cada concentración de metacolina, en un tiempo no superior a 2 min.
El procedimiento para la administración de cada dosis nebulizada es el siguiente:
El paciente mantiene el nebulizador con la pieza bucal en su boca y con unas pinzas en la nariz. Al final de una espiración (capacidad residual funcional), debe inhalar lento y profundo del nebulizador hasta capacidad pulmonar total en unos 5 s, manteniendo la respiración a capacidad pulmonar total durante otros 5 s. Se disparará el dosímetro justo después de iniciada la inspiración.
Los nebulizadores utilizados para este método deben proporcionar, según las recomendaciones de la ATS, 0,009 ml (9 ml) ± 10 % en cada 0,6 s de activación del dosímetro.
El dosímetro Mefar MB3 (MeFar, Brescia, Italia), habitual en nuestro medio, con una presión generada ajustada a 180 kPa, y nebulizadores tipo jet cumple con estos requisitos, pudiendo utilizarse otros nebulizadores con características equivalentes.
Se deben calibrar los nebulizadores cada 20 usos con el siguiente procedimiento: se pesará el nebulizador conteniendo 2 ml de suero fisiológico estéril antes y después de realizar 10 inhalaciones por un técnico simulando la prueba. El débito buscado es de 90 μl ± 10 % (0,09 ml [90 mg] ± 10 %) para las 10 inhalaciones.
Realización de la prueba y valoración de la respuesta
El parámetro más utilizado para valorar la respuesta a la metacolina es la determinación del FEV1 mediante la práctica de una espirometría.
La primera nebulización se realizará con el diluyente. El valor de FEV1 obtenido tras la misma se utilizará como referencia, no debiendo ser inferior en más del 10 % al valor basal.
Al acabar cada nebulización se determina el FEV1 a los 30 y 90 s. En cada determinación se pueden realizar varios intentos (hasta 3 o 4), para obtener una espirometría de buena calidad. Se considera necesario obtener 2 espirometrías reproducibles en las que el FEV1 no difiera más del 5 %. Los intentos sucesivos de espirometrías no deben ocupar más de 3 min, ya que para mantener el efecto acumulativo de la metacolina, el intervalo de tiempo entre el inicio de la nebulización de 2 concentraciones sucesivas de metacolina debe ser de alrededor de 5 min14.
Si el FEV1 no disminuye un 20 % o más respecto al valor inicial se continúa el procedimiento de forma sucesiva hasta llegar hasta la máxima concentración. Si no cae con ésta, la prueba se considera negativa. La prueba se interrumpe si tras alguna de las nebulizaciones el descenso del FEV1 es > 20 %, en cuyo caso se administra salbutamol inhalado, y se repite la espirometría 10 min después. Hay que confirmar que se alcanza un valor del FEV1 superior al 90 % del valor inicial antes de que el paciente abandone el laboratorio. Posteriormente se calcula la concentración (o la dosis acumulada) de metacolina que produce un descenso del 20 % o más del FEV1 (PC20 y PD20)26,27.
Además del FEV1 se han utilizado otros parámetros para valorar la respuesta a la metacolina. Así, se ha utilizado la medida de las resistencias de la vía aérea, valoradas mediante pletismografía, oclusión simple, o técnicas de oscilación forzada. En general se requiere con estas técnicas un aumento de las resistencias superior al 45 %, para considerarla positivas.
En los niños no colaboradores se han empleado técnicas de función pulmonar complejas con necesidad de sedación como la determinación del flujo máximo a volumen corriente (VmáxFRC) mediante el método de la compresión torácica rápida.
Con la finalidad de poder realizar la prueba de metacolina en niños no colaboradores sin necesidad de sedar a los niños se han propuesto 2 parámetros: la presión transcutánea de oxígeno31 y la auscultación de sibilantes en la tráquea y campos pulmonares32-35. Con la utilización de este método se denomina PCwheeze a la concentración de metacolina en la que se auscultan sibilantes claros en tráquea y campos pulmonares. También se considera positiva la prueba si se produce un descenso de la saturación de oxígeno superior al 5 % de la basal, o si aumenta la frecuencia respiratoria un 50 % respecto al valor basal33. Un estudio reciente demuestra que la presión transcutánea de oxígeno es la medida más sensible para detectar hiperrespuesta bronquial en niños pequeños36.
Presentación e interpretación de los resultados
El valor de la concentración de metacolina que produce un descenso del FEV1 del 20 % (PC20) se calcula mediante la siguiente fórmula14,26:
C1: concentración de metacolina de la penúltima inhalación.
C2: concentración de metacolina de la última inhalación.
R1: porcentaje de descenso del FEV1 con la concentración C1.
R2: porcentaje de descenso del FEV1 con la concentración C2.
Se utiliza esta misma fórmula utilizando la última y la penúltima dosis acumulada de metacolina para calcular la dosis acumulada de metacolina que produce una disminución del 20 % del FEV1 (PD20). La PD20 se suele expresar en micromoles de metacolina. Para realizar el cálculo es necesario conocer que 1 mg de cloruro de metacolina equivale a 5,11 μmol (peso molecular del cloruro de metacolina 195,69). Por tanto la fórmula quedaría de la siguiente manera:
D1: dosis acumulada de metacolina en la penúltima inhalación.
D2: dosis acumulada de metacolina en la última inhalación.
R1: porcentaje de descenso del FEV1 con la concentración C1.
R2: porcentaje de descenso del FEV1 con la concentración C2.
A partir de los estudios epidemiológicos se suele considerar que es normal una PC20 > 8 mg/ml o una PD20 > 7,8 mmol. Una PC20 < 1 mg/ml en personas con síntomas de asma se valora como diagnóstica de asma. La ATS considera que una PC20 entre 4 y 16 mg/ml puede considerarse como una zona intermedia de hiperrespuesta bronquial "límite", una PC20 entre 1 y 4 mg/ml hiperrespuesta bronquial leve y una PC20 < 1 mg/ml hiperrespuesta bronquial moderada a grave14.
Prueba de broncoprovocación con adenosina
La adenosina es un nucleósido del tipo de las purinas con capacidad para desencadenar varias respuestas celulares importantes en el asma a través de la interacción con receptores específicos de la superficie celular37. El mecanismo de la broncoconstricción inducida por la adenosina37 sería a través de la estimulación de los receptores A2B de los mastocitos, que movilizaría los depósitos intracelulares de calcio e induciría la liberación de histamina y otros mediadores preformados, como cisteinil-leucotrienos, prostaglandinas e interleucina 8. Este efecto sería mayor en la atopia y en otras situaciones en que los mastocitos están sensibilizados para la liberación de mediadores. La administración de antihistamínicos H1 potentes, inhibe la broncoconstricción inducida por la adenosina y la de montelukast la atenúa.
El monofosfato de adenosina (AMP) es más soluble en solución acuosa que el difosfato de adenosina (ADP) lo que permite que se puedan proporcionar concentraciones más elevadas para la nebulización, por lo que es la sustancia usada con más frecuencia en las pruebas de broncoprovocación37.
Significado clínico de la hiperrespuesta a la adenosina
Se ha comprobado que la respuesta a la adenosina podría ser un marcador más sensible y específico del asma bronquial que la respuesta a la metacolina, tanto en niños mayores y adolescentes, como en preescolares38,39. La prueba suele ser negativa en niños con otras patologías obstructivas bronquiales crónicas tales como la fibrosis quística, bronquiolitis obliterante, discinesia ciliar y bronquiectasias, en las que la prueba de metacolina es positiva con frecuencia. La adenosina distingue el asma de los controles sanos con una sensibilidad y especificidad del 98 % y el asma de otras enfermedades obstructivas pediátricas con una sensibilidad y especificidad del 90 %39.
La atopia parece uno de los determinantes más importantes de la respuesta a la adenosina. La broncoprovocación con adenosina podría ser un marcador mejor de actividad de la inflamación de las vías aéreas, que otros estímulos no específicos como la metacolina o la histamina. El tratamiento con corticoides inhalados resulta en una mayor atenuación de la respuesta al AMP que a la metacolina42.
Protocolos de realización de la prueba
La European Respiratory Society (ERS) ha publicado recientemente unas recomendaciones para la práctica de la prueba de broncoprovocación con adenosina mediante el método de inhalación intermitente con dosímetro, o mediante el método de la respiración a volumen corriente3. La ERS favorece el método con dosímetro por su menor consumo de tiempo, aunque el método de la respiración a volumen corriente ha sido utilizado tanto en niños38,39 como en adultos43.
Requisitos para la realización de la prueba. Los períodos de exclusión de medicamentos antes de la realización de la prueba son algo diferentes de los requeridos para la prueba de la metacolina43.
Los pacientes no deben haber inhalado β2-agonistas de acción corta (salbutamol, terbutalina) y bromuro de ipratropio en las 12 h previas a la prueba, β2-agonistas de acción prolongada (salmeterol, formoterol) o tiotropio en las 48 h previas, cromonas (cromoglicato, nedocromil) en las 72 h previas. Los antihistamínicos se deben suspender de la siguiente manera: terfenadina, cetirizina y loratadina 5 días antes, astemizol 30 días antes, y el resto de anti-H1 3 días antes.
Los pacientes no deben haber padecido infecciones virales respiratorias en las últimas 6 semanas, ni haber recibido en este período vacunas con virus atenuados ni la vacunación antigripal43.
Preparación de la soluciones de adenosina. Se utiliza la sal sódica monofosfato de adenosina (AMP) (Sigma-Aldrich, product no. A1752), para la preparación de la solución madre. El preparado en polvo de AMP se mantiene almacenado en frigorífico, con un desecante.
Se prepara la solución madre con el polvo de AMP y una solución de cloruro sódico al 0,9 % estéril, obteniendo una concentración de AMP de 800 mg/ml. Esta solución es estable durante 25 semanas mantenida a 4 °C.
A partir de esta solución madre se prepararán las diferentes concentraciones de AMP. Las recomendadas por la ERS son 3,125, 6,25, 12,5, 25, 50, 100, 200 y 400 mg/ml3. Otros autores utilizan concentraciones ligeramente diferentes entre 0,03 y 256 mg/ml.
Una vez preparadas las diluciones se mantienen en frigorífico hasta 30 min antes de su utilización, en que se sacarán para que se calienten a temperatura ambiente.
Procedimiento de realización de la prueba y valoración de la respuesta
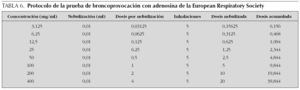
El procedimiento para la realización de la prueba, el tipo de nebulizadores recomendados y la valoración de la respuesta, tanto si se utiliza la técnica de respiración a volumen corriente 2 min, como la técnica de las 5 respiraciones con dosímetro, son similares a los descritos para la metacolina (tabla 6). La única diferencia que se observa en el protocolo descrito por la ERS es que se recomienda la realización de la espirometría después de cada nebulización a los 60 y 180 s de la nebulización, en lugar de a los 30 y 90 s, lo que se basa en el tiempo de actuación de la adenosina.
Algunos autores han utilizado protocolos abreviados utilizando dosis cuádruples en vez de dobles, para hacer más corta la prueba y facilitar su empleo en los estudios poblacionales.
Grupo de Técnicas de la Sociedad Española de Neumología Pediátrica
D. Álvarez Gil (Hospital Infanta Margarita, Cabra, Córdoba), V. Alzina de Aguilar (Clínica Universitaria de Navarra, Pamplona), A. Andrés Martín (Hospital Universitario de Valme, Sevilla), C. Antelo Landeira (Hospital Infantil La Paz, Madrid), O. Asensio de la Cruz, (Corporació Sanitaria Parc Taul í, Sabadell, Barcelona), M.I. Barrio Gómez de Agüero (Hospital La Paz, Madrid), J. Blanco González (Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid), M. Bermejo Pastor (Hospital Materno-Infantil Badajoz), A. Bonillo Perales (Hospital Torrecárdenas, Almería), M. Bosque García (Corporació Sanitaria Parc Taulí, Sabadell, Barcelona), G. Cabrera Roca (Hospital Universitario Materno-Infantil, Las Palmas de Gran Canaria), M. Carrasco Zalvide (Hospital Juan Ramón Jiménez, Huelva), A. Cordón Martínez (Hospital Universitario Carlos Haya Materno-Infantil, Málaga), I. Cortell Aznar (Hospital Universitario La Fe, Valencia), J. Elorz Lambarri (Hospital de Cruces, Baracaldo, Bilbao), A. Escribano Montaner (Hospital Clínico Universitario, Valencia), J. Figuerola Mulet (Hospital Son Dureta, Palma de Mallorca), D. Gómez-Pastrana Durán (Hospital de Jerez de la Frontera, Cádiz), M.D. Gutiérrez Guerra (Hospital Juan Ramón Jiménez, Huelva), C. Landaluce Ugarte (Hospital de Txagorritxu, Vitoria), S. Liñán Cortés (Hospital Materno-Infantil Vall d'Hebron, Barcelona), C. Luna Paredes (Hospital Universitario 12 de Octubre, Madrid), M. Machuca Contreras (Hospital Virgen del Rocío Sevilla), C. Martínez Carrasco (Hospital Infantil la Paz, Madrid), A. Martínez Jimeno (Hospital Universitario 12 de Octubre, Madrid), A. Moreno Galdó (Hospital Materno-Infantil Vall d'Hebron, Barcelona), C. Oliva Hernández (Hospital Nuestra Señora de la Candelaria, Santa Cruz de Tenerife), B. Osona Rodríguez de Torres (Hospital Son Dureta, Palma de Mallorca), T. Pascual Sánchez (Hospital de San Joan, Reus, Tarragona), L. Pardos Rocamora (CAP Balaguer, Lleida), J. Pérez Frías (Hospital Universitario Carlos Haya Materno-Infantil, Málaga), G. Pérez Pérez (Hospital Universitario Virgen Macarena, Sevilla), E. Pérez Ruiz (Hospital Universitario Carlos Haya Materno-Infantil, Málaga), S. Pérez Tarazona (Hospital de la Rivera. Alzira Valencia), C. Reverté Bover (CAP Amposta, Tarragona), A. Salcedo Posadas (Hospital Universitario del Niño Jesús, Madrid), J. Sánchez Jiménez (Hospital de San Jaume, Calella, Barcelona), E. Sánchez Sánchez (CAP Premià del Mar, Barcelona), L. Sanz Borrell (Hospital de San Joan, Reus, Tarragona), A. Sequeiros González (Hospital Universitario Niño Jesús, Madrid), J. Sirvent Gómez (Complejo Hospitalario Juan Canalejo, A Coruña), J.M. Tabarés Lezcano (Hospital Cristal-Piñor, Orense), J.M. Torres Simón (Hospital de Palamós, Girona), M.I. Úbeda Sansano (CAP Godella, Valencia), J.R. Villa Asensi (Hospital Universitario del Niño Jesús, Madrid).
Correspondencia: Dr. O. Asensio de la Cruz.
Corporació Sanitaria Parc Taulí.
Parc Taulí, s/n. 08208 Sabadell. España.
Correo electrónico: 16333oac@comb.es
Recibido en enero de 2007.
Aceptado para su publicación en enero de 2007.