El síndrome de obstrucción sinusoidal (SOS), denominado también enfermedad venooclusiva hepática (EVOH), es una complicación grave del trasplante de progenitores hematopoyéticos (TPH) que se presenta con elevación de la bilirrubina, hepatomegalia dolorosa y retención hídrica. Su causa es el daño agudo en el endotelio sinusoidal hepático, que a su vez da lugar a daño en los hepatocitos y fallo hepático. Corbacioglu et al.1 identificaron factores de riesgo clásicos y emergentes para el SOS, incluyendo nuevos fármacos y biomarcadores genéticos.
Se analizó la incidencia de SOS moderado a grave en una cohorte de 159 pacientes con neoplasias hematológicas sometidos a TPH haploidéntico con depleción de linfocitos T entre 2005 y 2020. Se seleccionó el TPH haploidéntico para el estudio porque representa el 60% de los trasplantes alogénicos en nuestro centro y centrarse en estos casos permitió que la cohorte fuera homogénea en cuanto al tipo de donante y la fuente de progenitores hematopoyéticos. Se obtuvo el consentimiento informado en todos los casos.
La edad mediana fue de nueve años (1-19), y 106 pacientes eran varones. Ochenta pacientes tenían diagnóstico de leucemia linfoblástica aguda (LLA) y 79 pacientes de leucemia mieloblástica aguda (LMA). Cuarenta y ocho se encontraban en primera remisión completa (RC1), 55 en segunda remisión (RC2) y 56 en estadios más avanzados de enfermedad. La edad mediana de los donantes fue de 40 (2-54) años, con predominio del sexo femenino (95). El haplotipo de los receptores de tipo killer-cell immunoglobulin-like receptor (KIR) fue de tipo B en 133 donantes y de tipo A en los 26 restantes.
Ninguno de los pacientes padecía una enfermedad hepática preexistente ni había sido tratado con inotuzumab o gemtuzumab ozogamicina antes del TPH. En los últimos años, ha habido un aumento de pacientes latinoamericanos en nuestra unidad, por lo que 45 niños del estudio eran hispanos/latinos (no caucásicos).
Se administró un régimen de acondicionamiento mieloablativo consistente en fludarabina (30mg/m2/día desde el día−6 al −2), busulfán intravenoso una vez al día del día −7 al −4 (dosis ajustada por peso, inicialmente según la ficha técnica y más adelante de acuerdo con las guías de Bartelink et al.2: <9kg, 1mg/kg/dosis; 9-16kg, 1,2mg/kg/dosis; 16-23kg, 1,1mg/kg/dosis; 23-34kg, 0,95mg/kg/dosis; y >34kg, 0,8mg/kg/dosis), y tiotepa (5mg/kg/día desde el día −3 hasta el −2). No se realizó monitorización farmacocinética y farmacodinámica con ajuste de los niveles de busulfán. La depleción de linfocitos consistió en depleción de linfocitos CD3+/CD19+ en 79 casos y TCRαβ+/CD19+ en 80. Para la profilaxis de la enfermedad injerto contra receptor (EICR) se utilizó ciclosporina A.
El diagnóstico de SOS se basó en los criterios de Seattle modificados3 hasta el año 2018 y en los criterios de la European Society for Blood and Marrow Transplantation (EBMT) a partir de ese momento4. En todos los casos, el diagnóstico se validó de manera retrospectiva aplicando estos últimos criterios. Se analizaron las siguientes variables como posibles factores de riesgo: edad, sexo, etnia (caucásica vs. hispana/latina), diagnóstico, estadio de enfermedad, trasplante previo, índice de comorbilidad específico del TPH (HCT-CI) y características del donante (edad, sexo y haplotipo KIR).
Se ha tenido en cuenta el origen étnico porque los factores genéticos pueden influir en la toxicidad asociada al trasplante5,6, por lo que cabría esperar diferencias entre pacientes caucásicos y no caucásicos.
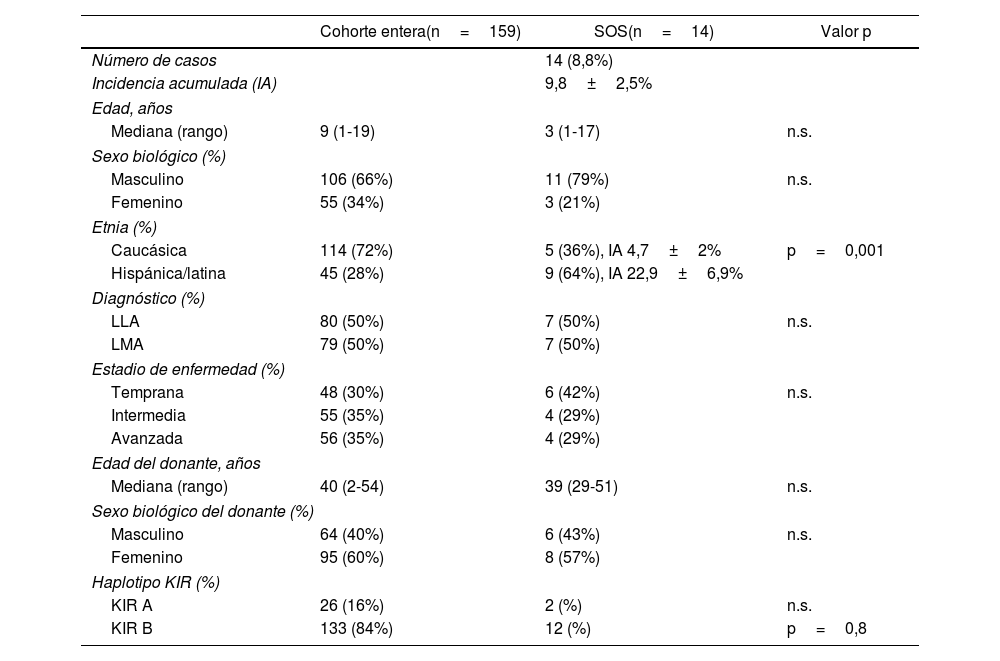
Catorce pacientes desarrollaron SOS, con una incidencia acumulada del 9,8±2,5% y una mediana del tiempo transcurrido desde el TPH hasta su aparición de 26 días (2-212). La tabla 1 resume sus características. El tratamiento consistió en defibrótido en dosis de 6,25mg/kg cada seis horas durante un mínimo de 21 días, manteniéndose hasta la resolución de los síntomas. No se observaron acontecimientos adversos relacionados con el tratamiento.
Análisis descriptivo del síndrome de obstrucción sinusoidal (SOS) en el TPH haploidéntico con depleción de linfocitos (n=159)
| Cohorte entera(n=159) | SOS(n=14) | Valor p | |
|---|---|---|---|
| Número de casos | 14 (8,8%) | ||
| Incidencia acumulada (IA) | 9,8±2,5% | ||
| Edad, años | |||
| Mediana (rango) | 9 (1-19) | 3 (1-17) | n.s. |
| Sexo biológico (%) | |||
| Masculino | 106 (66%) | 11 (79%) | n.s. |
| Femenino | 55 (34%) | 3 (21%) | |
| Etnia (%) | |||
| Caucásica | 114 (72%) | 5 (36%), IA 4,7±2% | p=0,001 |
| Hispánica/latina | 45 (28%) | 9 (64%), IA 22,9±6,9% | |
| Diagnóstico (%) | |||
| LLA | 80 (50%) | 7 (50%) | n.s. |
| LMA | 79 (50%) | 7 (50%) | |
| Estadio de enfermedad (%) | |||
| Temprana | 48 (30%) | 6 (42%) | n.s. |
| Intermedia | 55 (35%) | 4 (29%) | |
| Avanzada | 56 (35%) | 4 (29%) | |
| Edad del donante, años | |||
| Mediana (rango) | 40 (2-54) | 39 (29-51) | n.s. |
| Sexo biológico del donante (%) | |||
| Masculino | 64 (40%) | 6 (43%) | n.s. |
| Femenino | 95 (60%) | 8 (57%) | |
| Haplotipo KIR (%) | |||
| KIR A | 26 (16%) | 2 (%) | n.s. |
| KIR B | 133 (84%) | 12 (%) | p=0,8 |
IA: incidencia acumulada; KIR: killer-cell immunoglobulin-like receptor; LLA: leucemia linfoblástica aguda; LMA: leucemia mieloblástica aguda; n.s.: no significativo; SOS: síndrome de obstrucción sinusoidal.
El análisis univariante reveló que el SOS se asociaba a la edad del paciente (25% en ≤ 2 años vs. 6% en> 2 años; p = 0,01) y al origen hispano/latino (64% vs. 36% en pacientes caucásicos; p=0,02). El análisis de regresión logística confirmó que ambas variables se asociaban a un riesgo mayor de SOS: la edad ≤2 años (Hazard Ratio [HR]: 3,8; IC 95%: 1-13,8; p=0,03) y la etnia hispana/latina (HR: 4,5; IC 95%: 1,6-12,8; p=0,002).
La incidencia acumulada de SOS en pacientes hispanos/latinos fue del 22,9±6,9%, en comparación con 4,7±2% en pacientes caucásicos, diferencia que fue estadísticamente significativa (p=0,001). Ambos grupos eran comparables en términos de la edad mediana, la proporción de pacientes menores de dos años y otras variables clínicas relacionadas con la toxicidad asociada al trasplante. Estos hallazgos sugieren que el origen hispano/latino puede incrementar casi 5 veces el riesgo de SOS. Hasta donde conocemos, este factor de riesgo no se había descrito anteriormente en la literatura.
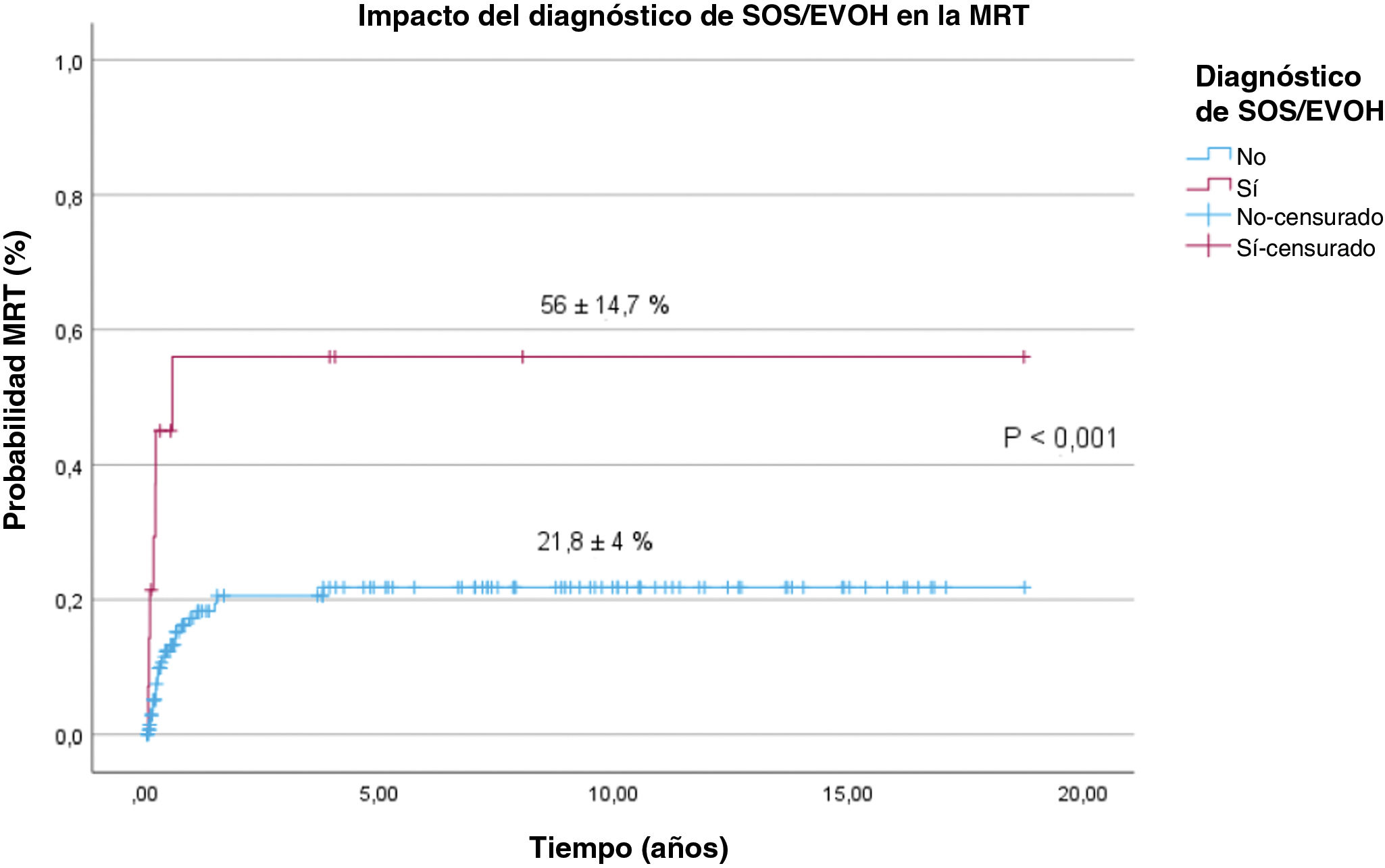
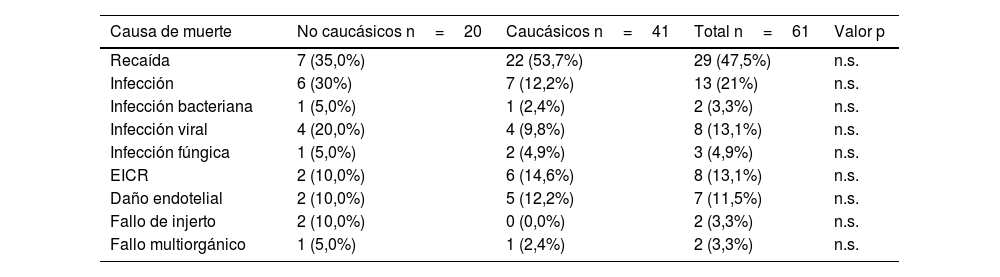
La mortalidad relacionada con el trasplante en el total de la cohorte fue de 24,8±4%, con una mediana de seguimiento de 7,2 años (1-11,12) y una mortalidad mayor en los pacientes que desarrollaron SOS (56±14,7% vs. 21,8±4%; p <0,001) (fig. 1) y en pacientes no caucásicos en comparación con pacientes caucásicos/indoeuropeos (33,6±7,7% vs. 21,3±4,5%; p=0,05). La tabla 2 presenta las causas de muerte desglosadas por origen étnico.
Distribución de las causas de muerte. Comparación de pacientes caucásicos y no caucásicos
| Causa de muerte | No caucásicos n=20 | Caucásicos n=41 | Total n=61 | Valor p |
|---|---|---|---|---|
| Recaída | 7 (35,0%) | 22 (53,7%) | 29 (47,5%) | n.s. |
| Infección | 6 (30%) | 7 (12,2%) | 13 (21%) | n.s. |
| Infección bacteriana | 1 (5,0%) | 1 (2,4%) | 2 (3,3%) | n.s. |
| Infección viral | 4 (20,0%) | 4 (9,8%) | 8 (13,1%) | n.s. |
| Infección fúngica | 1 (5,0%) | 2 (4,9%) | 3 (4,9%) | n.s. |
| EICR | 2 (10,0%) | 6 (14,6%) | 8 (13,1%) | n.s. |
| Daño endotelial | 2 (10,0%) | 5 (12,2%) | 7 (11,5%) | n.s. |
| Fallo de injerto | 2 (10,0%) | 0 (0,0%) | 2 (3,3%) | n.s. |
| Fallo multiorgánico | 1 (5,0%) | 1 (2,4%) | 2 (3,3%) | n.s. |
EICR: enfermedad injerto contra receptor; n.s.: no significativo.
La supervivencia global fue del 55,9±4% en la cohorte completa, con una supervivencia del 31,4±12% en pacientes con SOS en comparación con 58,3±4,5% en pacientes sin SOS. (p=0,004). Las diferencias en la supervivencia global entre los dos grupos étnicos no fueron estadísticamente significativas (58,3±5% en caucásicos vs. 49,8±8% en no caucásicos; p=0,1).
El SOS es una causa importante de mortalidad postrasplante y, teniendo en cuenta la disponibilidad de tratamiento efectivo con defibrótido, la detección e intervención tempranas son esenciales. Se ha descrito que la variabilidad étnica en los polimorfismos genéticos de las vías enzimáticas metabólicas hepáticas influye en las toxicidades asociadas al TPH.
Franca et al.7 revisaron el papel de la farmacogenética en los resultados del TPH, estudiando la asociación entre el SOS y grupos de genes como la del citocromo P450 (CYP450) o la de las glutatión-S transferasas (GST). La supervivencia era menor en pacientes con al menos un alelo normal del CYP2B6 en comparación con aquellos con función disminuida en ambos cromosomas (40% vs. 100%; p=0,0001). En el análisis bivariante, CYP2B6*6 se asoció con una mayor incidencia de SOS si tanto el donante como el receptor eran de tipo wild-type.
Rocha et al.5 analizaron el metabolismo de fármacos y sus polimorfismos tanto en donantes como en receptores. Los polimorfismos en genes CYP2B6 que interfieren con el metabolismo de la ciclofosfamida se asocian con la incidencia de SOS (donante CYP2B6*6; p = 0,03). En lo referente a la expresión de CYP2B6, se observaron diferencias significativas entre grupos étnicos: la actividad de CYP2B6 era de 3,6 a 5,0 veces mayor en las mujeres hispánicas que en las caucásicas (p=0,022). Otro estudio encontró una prevalencia mayor de los polimorfismos CYP2C93, CYP2C19*4 y UGT2B7 IVS1+985 A>G en poblaciones hispánicas en comparación con las no hispánicas en EE. UU.8 Esta variación interétnica en la frecuencia de polimorfismos genéticos en las enzimas implicadas en el metabolismo de fármacos puede influir en las toxicidades relacionadas con el trasplante, como el SOS. Este estudio tiene limitaciones asociadas a su naturaleza retrospectiva, aunque probablemente esta era la única estrategia factible para estudiar el SOS, especialmente en pacientes pediátricos y en contexto de TPH haploidéntico con depleción de linfocitos T. También cabe mencionar que sería interesante conocer los polimorfismos de las enzimas metabolizadoras de fármacos en este grupo de pacientes, ya que creemos que podría ayudar a identificar a los pacientes con riesgo de SOS.
En conclusión, en nuestra cohorte, la etnia hispana/latinoamericana se identificó como un factor de riesgo relevante para el SOS, asociación que no se había descrito anteriormente. Se requieren más estudios para confirmar estos hallazgos e incluir poblaciones no caucásicas en estudios farmacogenéticos, en los cuales no tienen representación.
FinanciaciónNo ha habido financiación para el desarrollo del trabajo ni pública ni privada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.