El monitor NIPE (Newborn Infant Parasympathetic Evaluation) es una herramienta rápida, continua y objetiva de evaluación del disconfort neonatal. Los objetivos fueron describir los cambios del NIPE tras una extracción sanguínea y los factores implicados en su variación.
Material y métodosEstudio observacional analítico con recogida de datos prospectiva. Se incluyeron los recién nacidos ingresados en cuidados intensivos entre junio y diciembre de 2021 a quienes se les realizó extracción sanguínea. Se recogieron variables demográficas, las relacionadas con la realización del procedimiento, la puntuación NIPE, la frecuencia cardiaca previa y en los minutos 1, 2, 3, 4, 5, 10 y 15 posteriores.
ResultadosSe incluyeron 86 registros de 49 pacientes. Durante los primeros cuatro minutos tras el procedimiento hubo un descenso significativo en la puntuación NIPE, siendo el descenso máximo de un 22,8% respecto al valor basal, produciéndose el nadir a los 2,79 minutos. El mayor descenso del NIPE ocurrió en pacientes prematuros, varones, con menor Apgar a los cinco minutos, en procedimientos ya realizados previamente, tras cesárea y en horario matutino. No hubo diferencias con la realización en canguro. La correlación entre NIPE y frecuencia cardíaca fue débil.
ConclusionesTras un procedimiento doloroso, como una extracción sanguínea, el monitor NIPE mostró un descenso significativo los primeros cuatro minutos, agudizándose el descenso con la prematuridad, la reiteración de procedimientos o el nacimiento tras cesárea. El monitor NIPE puede ayudar a identificar eficazmente a aquellos neonatos que sufren dolor agudo tras un procedimiento, complementándose con las escalas de valoración clínica.
The Newborn Infant Parasympathetic Evaluation (NIPE) index is an instrument that enables continuous, fast and objective assessment of neonatal discomfort. The aim of the study was to analyse changes in NIPE values after performance of blood draws and the factors involved in this variation.
Material and methodsWe conducted a prospective observational study. We included infants admitted to the neonatal intensive care unit between June and December 2021 who underwent blood draws. We recorded demographic data, aspects related to the procedure, the NIPE index and the heart rate at baseline and 1, 2, 3, 4, 5, 10 and 15min after the procedure.
ResultsThe study included 86 records for 49 patients. In the first 4min after the procedure, there was a significant decrease in the NIPE index, with a maximum decrease of 22.8% relative to baseline and the nadir at 2.79min. The decrease in NIPE values was greater in infants born preterm, male, with lower 5-min Apgar scores and following procedures that had been performed previously, after caesarean section or in the morning. There were no differences when the blood draw was obtained during kangaroo care. The correlation between the NIPE index and the heart rate was weak.
ConclusionsAfter a painful procedure, such as a blood draw, the NIPE monitor showed a significant decrease in the first 4min, which was more pronounced in preterm infants, in repeated procedures or after caesarean delivery. The NIPE index could help identify infants experiencing acute procedural pain, complementing clinical rating scales.
Hasta la década de 1980, se menospreció la percepción del dolor neonatal, tanto por desconocimiento como por la incapacidad verbal de los pacientes para transmitir dicho dolor, un error que se ha ido subsanando desde entonces con el apoyo del principio ético de no maleficiencia y los avances científicos1. Desde entonces, numerosa bibliografía evidencia la respuesta de los recién nacidos a estímulos nociceptivos con cambios autonómicos, hormonales y/o gestuales desde la semana 22 de gestación, así como los beneficios a corto y largo plazo de reducir al mínimo los estímulos dolorosos y tratarlos precozmente en caso de producirse1–3. Conseguir evaluar eficazmente este dolor es complejo por la falta de un estándar de oro que sirva como referencia y sigue siendo uno de los retos más pujantes a los que se enfrenta la neonatología para poder asegurar su adecuado manejo posterior4–6.
Uno de los momentos en los que los neonatos sufren más dolor es durante los procedimientos de extracción sanguínea, llegando a ser reiterativas en pacientes con ingresos de larga duración, como los recién nacidos prematuros o de muy bajo peso7,8. El padecimiento de estímulos dolorosos o estresantes durante el periodo perinatal altera el neurodesarrollo y afecta negativamente al eje hipotálamo-adrenal, provocando en el adulto respuestas alteradas al estrés, con aumento del riesgo de enfermedad cardiovascular9,10.
Las escalas clínicas utilizadas para valorar el dolor neonatal se emplean de forma intermitente, tienen un componente subjetivo, dependiente del observador y no son específicas de dolor, ya que pueden reflejar también angustia o agitación5,7. En una encuesta española sobre la valoración del dolor, la escala CRIES era la más empleada, destacando que dos terceras partes de las unidades no realizaban evaluación del dolor con escalas11; por todo ello puede ser interesante implantar nuevas modalidades más objetivas que complementen las escalas multimodales existentes para un abordaje más completo.
El monitor NIPE® (Newborn Infant Parasympathetic Evaluation) surgió del índice ANI (Analgesia Nociception Index) desarrollado para valorar la anestesia quirúrgica en adultos mediantes el análisis de la variabilidad de la frecuencia cardiaca (FC), adaptándolo al paciente neonatal12. El análisis de la variabilidad de la FC permite evaluar la actividad del sistema nervioso autónomo, directamente relacionada con el grado de bienestar del paciente13,14. De ello se obtiene un valor absoluto entre 0 y 100: cuanto más alto, indicará que el paciente está más confortable. Se trata de una medición objetiva, presente de forma continua, con facilidad de interpretación, no dependiente del observador, no invasiva y con posibilidad de evaluación del sistema parasimpático, tanto en situaciones agudas con el NIPE instantáneo, como prolongadas mediante el NIPE promediado. Aún existe escasa evidencia científica de su aplicación en la práctica clínica, habiéndose estudiado más su aplicación en unidades de cuidados intensivos pediátricos o durante intervenciones quirúrgicas que en neonatos durante su ingreso en la Unidad de Cuidados Intensivos Neonatales (UCIN)15–17.
El principal objetivo del estudio fue describir los cambios del valor NIPE tras un procedimiento de extracción sanguínea. Como objetivos secundarios se investigaron los factores implicados en la variación del NIPE, como características perinatales, número de repeticiones, tipo de procedimiento, realización en canguro o incubadora, tipo de analítica y horario de realización.
Material y métodosMuestraSe incluyeron a todos los recién nacidos ingresados en UCIN en el periodo comprendido entre el mes de junio de 2021 y diciembre de 2021, ambos incluidos, cuyos padres firmaron el consentimiento informado para la inclusión en el estudio. Los criterios de exclusión fueron los siguientes: malformaciones congénitas mayores, lesiones cerebrales (hemorragia grado II-III o lesiones de sustancia blanca), convulsiones, enfermedades neuromusculares, alteraciones genéticas, arritmias cardiacas, administración de fármacos antiarrítmicos o aquellos fármacos con efecto sobre el nodo sinusal (incluidas adrenalina, dobutamina y citrato de cafeína administrados en las seis horas previas), registros interrumpidos durante al menos un minuto por mala calidad de la señal y manipulación del neonato durante los siguientes 15 minutos tras la extracción. Ninguna extracción sanguínea de urgencia fue retrasada si previamente no tenía colocado el monitor NIPE.
El estudio se realizó en una unidad neonatal española con nivel de complejidad III–A con 995 nacimientos y 103 ingresos durante el periodo de estudio.
Para el cálculo del tamaño muestral necesario se tomaron como referencia los estudios de Walas et al.18 y Gendras et al.19, con el objetivo de encontrar diferencias en la puntuación NIPE en los diferentes momentos del estudio, con una potencia del 90% y un nivel de significación de 0,05.
Diseño del estudioEstudio observacional analítico con recogida de datos prospectiva. El estudio fue aprobado por el Comité de Ética e Investigación Clínica de nuestro centro, con número de referencia CEIC: 21-PI082.
Instrumentos: monitor NIPEEl monitor NIPE refleja en tiempo real la actividad parasimpática del sistema nervioso autónomo mediante análisis de la variabilidad de la FC de los últimos 64 segundos, proporcionado cada segundo un valor numérico. Mediante el registro del electrocardiograma se analiza el tiempo transcurrido entre cada onda R del electrocardiograma y, a partir de un análisis espectral, clasifica la señal RR en un componente de baja frecuencia (entre 0,04-0,15Hz) influenciado principalmente por la actividad simpática y otro componente de alta frecuencia (>0,15Hz) dirigido por el sistema parasimpático.
La puntuación obtenida se sitúa entre 0 y 100, correspondiendo los valores más elevados a un predominio de actividad parasimpática que representa el bienestar del paciente. El monitor NIPE obtiene dos valores: NIPE promediado, que es la media calculada del NIPE en los últimos 20 minutos, y NIPE instantáneo, que refleja el valor medio de los últimos tres minutos, indicado para estrés agudo, siendo este último el utilizado en nuestro estudio.
ProcedimientoEl monitor NIPE (MDoloris Medical Systems, Loos, Francia) fue empleado mediante conexión al monitor de constantes cardiorrespiratorias (modelo GE Solar® 8000i), tras lo que se obtuvo el valor absoluto de NIPE instantáneo.
Se registraron el valor NIPE y la FC en diferentes momentos: basal antes de la manipulación, justo antes de realizar la extracción sanguínea, y a los 1, 2, 3, 4, 5, 10 y 15 minutos tras la realización de la misma. Se define el estado basal a la situación del paciente cuando está dormido o en alerta tranquila, sin datos sugerentes de padecer estrés en ese momento. También se recogieron características perinatales de cada paciente, así como la forma y momento de realización de cada extracción.
El tipo de extracción sanguínea pudo ser: glucemia capilar, gasometría/bioquímica capilar, bioquímica/hemograma venoso. En todas las extracciones se siguió el protocolo de sedoanalgesia no farmacológica de nuestra unidad, proporcionando medidas de contención y administración de gotas de lactancia materna o solución de sacarosa oral dos minutos antes del procedimiento. La analítica era el último procedimiento a realizar durante la manipulación del neonato, permaneciendo al menos los siguientes 15 minutos sin ninguna manipulación.
Se definió el tipo de día como laborable o festivo y el horario como mañana (08:00-15:00h), tarde (15:00-22:00h) y noche (22:00-08:00h). El lugar de realización pudo ser en incubadora o en canguro con uno de los padres.
Se describió la variación de los valores del NIPE y FC al realizar la extracción sanguínea. Asimismo, se comparó el cambio de puntuación del NIPE según las características perinatales, tipo de procedimiento, repetición, horario y realización en canguro o en incubadora. Se estudió la correlación entre la variación de la FC y la puntuación del NIPE.
Análisis estadísticosLos datos numéricos han sido expresados mediante media con intervalo de confianza (IC) al 95%. Se comprobó la normalidad de las variables mediante test de Kolmogorov-Smirnov, siendo la puntuación del NIPE la única variable sin distribución normal, utilizando la prueba de Wilcoxon para su análisis mediante medianas y rangos intercuartílicos. Para el estudio de la correlación entre el NIPE y la FC se utilizó el coeficiente de correlación de Spearman. Se consideró diferencia significativa p<0,05.
Todos los análisis estadísticos y gráficos fueron realizados con el programa estadístico SPSS en su versión 22 (IBM SPSS Statistics Versión 22).
ResultadosTras aplicar los criterios de inclusión y exclusión, quedaron incluidos 86 registros de 49 pacientes diferentes.
Las características perinatales de la población estudiada y los datos descriptivos de las extracciones sanguíneas realizadas se resumen en la tabla 1.
Características clínicas de la población estudiada
| Edad gestacional (semanas) | 33 (31-37) |
|---|---|
| Días de vida | 3 (1–5) |
| Peso al nacimiento (gramos) | 2.065 (1.557–2.590) |
| Tipo de parto | Eutócico: 40,7%Instrumental: 26,8%Cesárea: 32,5% |
| Apgar a los cinco minutos | 9 (7–10) |
| Lugar de realización | Incubadora: 84,8%En canguro: 15,2% |
| Horario | Mañana: 37,2%Tarde: 45%Noche: 17,8% |
| Festivo | Día de diario: 70,9%Día festivo: 29,1% |
| Tipo de extracción | Gasometría capilar: 66,2%Glucemia capilar: 22,09%Extracción venosa: 11,6% |
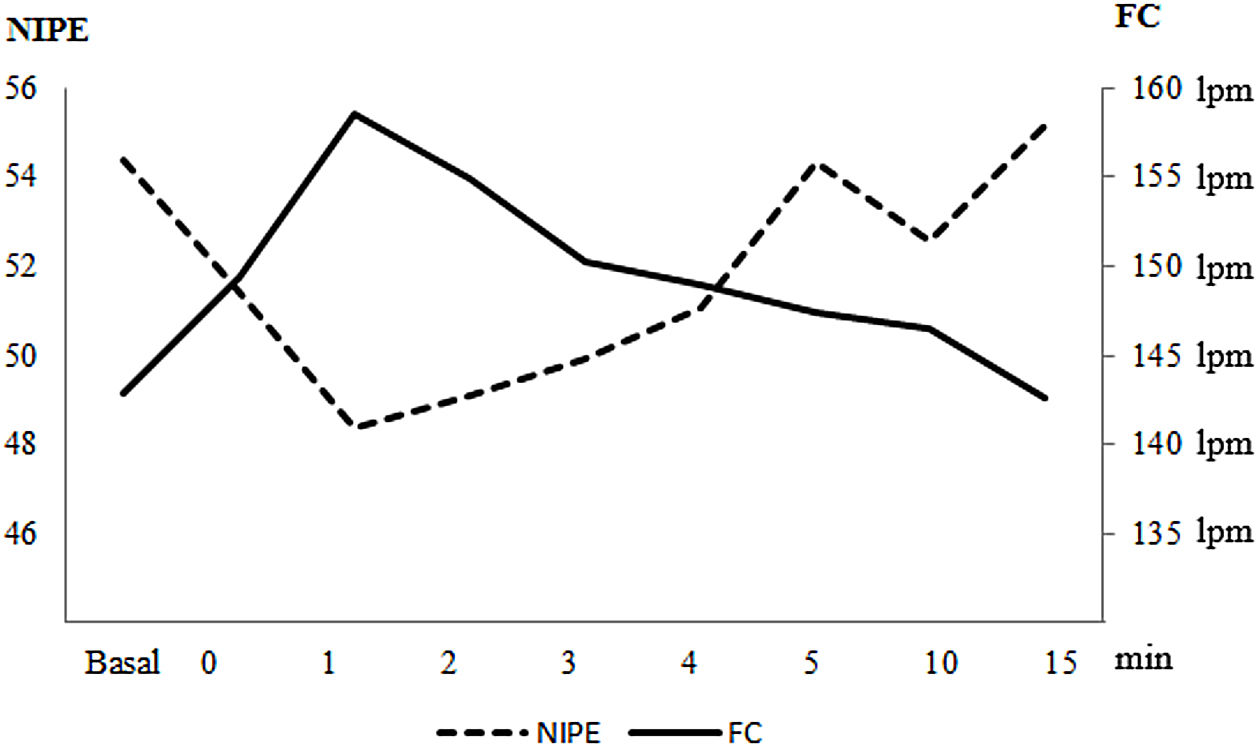
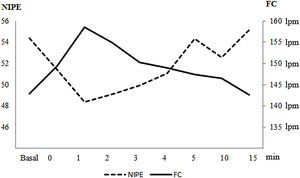
En la tabla 2 y en la figura 1 se muestra la variación de la puntuación NIPE y de la FC en el momento basal, al inicio del procedimiento y en los minutos 1, 2, 3, 4, 5, 10, 15 tras el mismo.
Comparación de valores medios de NIPE y frecuencia cardiaca en el momento basal y tras la extracción analítica
| NIPE | FC (lpm) | |
|---|---|---|
| Basal | 54,37±8,33 | 142,93±16,29 |
| 0 min | 51,45±10,11 | 149,33±16,55 |
| 1 min | 48,39±10,04 | 158,52±19,81 |
| 2 min | 49,10±10,04 | 154,85±19,69 |
| 3 min | 49,92±10,33 | 150,20±20,49 |
| 4 min | 51,06±9,00 | 148,95±19,66 |
| 5 min | 54,35±9,71 | 147,40±17,47 |
| 10 min | 52,55±8,43 | 146,50±16,56 |
| 15 min | 55,18±7,71 | 142,62±18,48 |
FC: frecuencia cardiaca; Min: minutos; lpm: latidos por minuto.
Representación gráfica de la evaluación temporal de los valores medios de NIPE y frecuencia cardíaca (FC).
Eje horizontal: representación del tiempo en minutos. Eje vertical izquierdo: Valores de NIPE. Eje vertical derecho: Valores de frecuencia cardiaca.
FC: frecuencia cardiaca; Min: minutos.
La puntuación NIPE expresada en mediana y rango intercuartílico en los diferentes momentos del estudio se expresa en la tabla 3, junto con la significación estadística del cambio respecto al valor previo y al basal.
Valor del NIPE expresado como mediana y rango intercuartílico en los diferentes momentos del estudio
| Mediana (rango intercuartílico) | Significación estadística respecto al valor anterior | Significación estadística respecto al valor basal | |
|---|---|---|---|
| NIPE basal | 54,5 (48,0-59,75) | - | - |
| NIPE 0 | 50,5 (44,0-57,75) | p<0,01 | p<0,01 |
| NIPE 1 min | 48,5 (42,25-54,5) | p<0,05 | p<0,01 |
| NIPE 2 min | 49,5 (44,25-57,75) | p=0,41 | p<0,01 |
| NIPE 3 min | 49,0 (43,25-56,75) | p=0,83 | p<0,02 |
| NIPE 4 min | 52,0 (45,5–55,0) | p=0,30 | p<0,04 |
| NIPE 5 min | 54,5 (49,25–60,0) | p<0,01 | p=0,64 |
| NIPE 10 min | 53,0 (46,0–58,75) | p=0,07 | p=0,22 |
| NIPE 15 min | 56,5 (49,5–60,0) | p<0,01 | p=0,21 |
En la tercera columna se expresa la significación estadística del cambio entre el valor de esa fila y el valor previo. En la cuarta columna se expresa la significación estadística de la variación entre el NIPE basal y el NIPE de ese momento.
De media, el descenso máximo del NIPE fue 12,8±7,07 puntos respecto al valor basal que supone porcentualmente 22,8±14,0%, produciéndose dicho descenso máximo a los 2,79±1,19 minutos. La comparativa según características perinatales, momento y lugar de realización del procedimiento, así como el tipo de analítica (glucemia capilar frente al resto de muestras capilares y venopunción), se exponen en la tabla 4.
Variación porcentual máxima de la puntuación NIPE desde la extracción analítica y minutos que transcurren hasta dicho cambio máximo, según las características clínicas de la población
| Descenso máximo de puntuación NIPE (%) | p | Tiempo hasta descenso máximo (minutos) | p | ||
|---|---|---|---|---|---|
| Edad gestacional | ≤32 semanas(n=32) | 26,67±15,30 | <0,05 | 2,87±1,10 | 0,87 |
| >32 semanas(n=54) | 20,63±11,97 | 2,84±1,20 | |||
| Peso al nacimiento | ≤1.500 gramos(n=25) | 24,79±13,74 | <0,05 | 2,75±1,23 | 0,65 |
| >1.500 gramos(n=61) | 18,48±9,61 | 2,88±1,14 | |||
| Sexo | Hombre(n=50) | 25,38±14,60 | <0,04 | 3,06±1,17 | <0,05 |
| Mujer(n=36) | 18,56±8,20 | 2,51±1,12 | |||
| Apgar 5 minutos | ≤7(n=28) | 26,85±11,74 | <0,05 | 3,21±1,22 | <0,04 |
| >8(n=58) | 20,75±14,49 | 2,65±1,08 | |||
| Días de vida | ≤2 días(n=36) | 21,57±13,45 | 0,34 | 2,94±1,39 | 0,44 |
| >2 días(n=50) | 23,94±14,59 | 2,77±0,91 | |||
| Horario | Mañana(n=32) | 26,51±13,58 | <0,05 | 3,22±1,24 | <0,05 |
| Tarde-Noche(n=54) | 20,59±13,41 | 2,69±1,03 | |||
| Día | Laborable(n=61) | 23,26±14,44 | 0,73 | 2,96±1,12 | <0,04 |
| Festivo(n=25) | 22,26±13,93 | 2,36±1,00 | |||
| Tipo de analítica | Glucemia capilar(n=19) | 13,81±9,40 | <0,01 | 2,14±1,40 | <0,02 |
| Resto(n=67) | 24,80±14,17 | 3,00±1,05 | |||
| Lugar | Incubadora(n=73) | 22,89±14,62 | 0,94 | 2,88±1,14 | 0,37 |
| Canguro(n=13) | 22,75±10,81 | 2,67±1,30 |
Se valora la significación estadística según el valor de p tras realizar análisis mediante la prueba «t» de Student.
Se encontraron diferencias significativas en la puntuación NIPE en las primeras 48 horas de vida entre parto vaginal (n=14) o cesárea (n=22) en el porcentaje de descenso máximo (19,84±11,20 y 25,01±2,76, respectivamente, p<0,05) y en los minutos transcurridos hasta dicho descenso máximo (2,67±1,41 y 3,50±1,14, respectivamente, p<0,05).
Con respecto a la repetición de analíticas, el descenso medio porcentual del NIPE tras la primera analítica (n=56) fue 19,9% respecto a 28,3% en las veces posteriores (n=29), siendo la diferencia media de 8,4 (IC 95% 0,8-17,9; p<0,05). No hubo diferencias significativas respecto al tiempo transcurrido hasta el valor nadir del NIPE la primera vez que se realiza el procedimiento o las siguientes (2,86 y 2,69 minutos, respectivamente, p=0,19) en el total de la muestra.
La correlación entre la variación de la puntuación del NIPE y el cambio de FC tras la extracción tuvo un coeficiente de correlación de -0,24 estadísticamente significativo.
DiscusiónEl monitor NIPE, recientemente introducido en la práctica clínica, permite una valoración rápida y objetiva del confort neonatal. Tras un proceso doloroso agudo, como una extracción sanguínea, hay un cambio significativo del valor NIPE instantáneo en los primeros cuatro minutos tras el procedimiento, siendo el descenso máximo a los 2,79 minutos. Los factores que provocan un mayor descenso de la puntuación son la prematuridad, sexo masculino, nacimiento por cesárea, menor Apgar a los cinco minutos, procedimientos de gasometría capilar o muestra venosa, horario matutino y la repetición de procedimientos. Se trata del primer estudio en habla hispana y uno de los primeros del ámbito internacional que evalúa el NIPE tras un procedimiento doloroso en UCIN, no encontrando bibliografía sobre la repetición de procedimientos dolorosos o tipo de parto y variación del NIPE.
Según nuestros resultados, el monitor NIPE puede ser una herramienta capaz de detectar eficazmente el disconfort neonatal en los primeros minutos posteriores a la realización del estímulo doloroso más frecuente en UCIN, las extracciones sanguíneas, no habiendo encontrado literatura concluyente previa. Por una parte, existen estudios que muestran su eficacia, como los de Walas et al.18 (pese a que su tamaño muestral es reducido y solo evalúan los primeros tres minutos tras la prueba) y Gendras et al.19, si bien ambos describen baja especificidad si se toma como referencia las escalas de valoración de dolor neonatal como PIPP (Premature Infant Pain Profile), su versión revisada PIPP-R o FLACC (Face, Legs, Activity, Cry, Consolability scale). Mientras que Cremillieux et al.20 no encuentran diferencias entre el NIPE basal y a los tres minutos de la extracción, ni correlación con PIPP-R, concluyendo que no es una herramienta fiable; sin embargo, vemos que en nuestro estudio la mayor diferencia entre medianas se produce en los primeros dos minutos. El nadir alcanzado en el descenso del valor NIPE muestra concordancia con los estudios de Gendras et al. y Walas et al., situándose entre ambos. Según los estudios publicados, no parece que haya una correlación fiable entre el valor NIPE y la puntuación de escalas clínicas. Una hipótesis sería que el comportamiento o gestos faciales reflejan la activación cerebral subcortical, mientras que muchos procesos dolorosos son procesados a nivel cortical sin cambios gestuales5,21; otra opción es que, bajo situaciones de estrés, como un ingreso prolongado en UCIN, aumenta la amplitud de la respuesta cortical a estímulos dolorosos, sin correlación con el comportamiento22.
En cuanto a las diferencias según la edad gestacional, destaca el mayor descenso del NIPE en prematuros, posiblemente por la falta de desarrollo de su sistema nervioso autónomo, especialmente el componente parasimpático, ya que la mielinización del nervio vago comienza en la semana 2523,24. En los primeros días de vida hay un predominio de la actividad del sistema simpático, especialmente en prematuros que tienen escasas ondas de alta frecuencia (determinadas por el parasimpático). Posteriormente, conforme va madurando el sistema nervioso autónomo, el parasimpático lo hace de forma más lenta que el simpático, tardando más semanas en alcanzar el tono de los niños a término, habiéndose detectado diferencias significativas al menos hasta la semana 46 postconcepcional25,26. Los neonatos con menor Apgar tienen mayor descenso del valor NIPE tras la extracción, algo no estudiado específicamente antes y de lo que se pueden sacar pocas conclusiones debido al limitado volumen muestral, habiendo recibido solo uno de los pacientes diagnóstico de encefalopatía hipóxico-isquémica moderada. En estos casos sí se ha descrito la variabilidad de la FC como un marcador de mal pronóstico en caso de predominio de actividad parasimpática27,28.
Con respecto a las diferencias observadas según el sexo, es bien conocida la maduración adelantada de las nacidas con sexo femenino respecto al masculino y la mayor predisposición en varones a alteraciones en el neurodesarrollo, por diversas causas genéticas, hormonales y ambientales29. Mediante neuroimagen se aprecia mayor desarrollo en varones de regiones como la amígdala e hipocampo, relacionadas con la integración de emociones, su recuerdo y respuesta a ellas, mientras que en niñas se aprecia mayor desarrollo de las conexiones cortico-subcorticales30. Funcionalmente se ha descrito cómo desde la etapa fetal las niñas muestran más capacidad de respuesta a situaciones estresantes y mejor adaptación a ellas, con niveles de catecolaminas en sangre más elevados, todo ello por una mayor activación del sistema nervioso autónomo ante una posible situación estresante31,32.
En nuestra muestra no observamos diferencias entre la realización de las pruebas en canguro a hacerlo en incubadora, pudiendo achacarse al escaso tamaño muestral del subgrupo de canguro. En otros estudios sí detectan el beneficio del canguro, como el de Choudhary et al.33 que aprecian menor tiempo de llanto tras analítica y mejor recuperación posterior si se efectúa en canguro, mientras que Butruille et al.34 aprecian valores basales de NIPE más elevados en el grupo de canguro tanto en niños como en sus madres, reduciendo la ansiedad maternal.
La repetición de estímulos dolorosos provoca un mayor descenso del NIPE, un hecho más estudiado en animales donde se ha demostrado una relación directa entre el número de estímulos dolorosos y la apoptosis neuronal, y ya demostrado también en humanos con un menor volumen del tálamo en la zona encargada de procesar estímulos somatosensoriales35,36. Gokulu et al.37 son los que más se han aproximado a valorarlo clínicamente en neonatos a término, encontrando mayor puntuación en la escala de valoración del dolor tras la reiteración de estímulos dolorosos. En cuanto a otras variables, destaca el menor descenso del NIPE en turnos de tarde y noche, probablemente relacionado con la menor presencia de ruidos e intervenciones de las UCIN durante este horario; no obstante, en la literatura se ha descrito menor uso de sedoanalgesia en horario nocturno38. Respecto al mayor descenso del NIPE tras cesárea, en el estudio más similar utilizan el análisis de variabilidad de FC que revela igualmente más porcentaje de actividad parasimpática en partos vaginales39; curiosamente utilizando escalas clínicas la conclusión es la contraria, posiblemente por lo expuesto antes sobre las vías neuroanatómicas relacionadas con las escalas clínicas5,40. Finalmente, las diferencias encontradas según el tipo de analítica se explican fácilmente por el menor volumen de sangre necesario en la glucemia capilar, por tanto la lanceta que atraviesa la piel es de menor tamaño y la manipulación más breve.
Entre las limitaciones de nuestro estudio está la falta de comparación con escalas de valoración clínica, lo que no permite graduar la intensidad del dolor; no obstante, en los estudios publicados hasta ahora no se ha encontrado correlación con los valores del NIPE, asimismo, el tamaño muestral no es excesivamente grande, si bien es mayor que en los estudios de Walas o Cremillieux, y similar al de Gendras18–20. Debe tenerse en consideración que estímulos nociceptivos de mayor entidad que una extracción sanguínea, se verían reflejados con variaciones mayores en el NIPE instantáneo al reflejar el valor medio de los últimos tres minutos. La falta de un estándar de oro en la valoración del dolor neonatal, provoca que no puedan hacerse afirmaciones tajantes sobre cuál método es mejor que otro, siendo la combinación de todos ellos la mejor medida posible para evaluar la quinta constante vital: el dolor.
Como conclusiones, podemos destacar que para la valoración del dolor provocado por una extracción sanguínea en UCIN, el valor instantáneo del NIPE es una herramienta eficaz, encontrando un descenso significativo en los cuatro minutos posteriores al procedimiento, siendo el descenso más acusado en pacientes prematuros, de sexo masculino, nacidos por cesárea, con menor Apgar a los cinco minutos, tras haber requerido una analítica previa y en turno matutino.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado previamente de forma parcial en el XXVIII Congreso de la Sociedad Española de Neonatología, 2021.