Introducción
Una vía clínica es una herramienta que coordina la labor de los profesionales, disminuyendo la variabilidad entre ellos. A nivel de pacientes proporciona una información sistematizada y al tiempo favorece la gestión, ya que la evaluación continuada optimiza el uso de recursos. Así mismo, ofrece la oportunidad de estandarizar el procedimiento diagnóstico/terapéutico, y valorar su eficacia, obteniendo la mejor evidencia posible, tras un tiempo que depende de la frecuencia del proceso en observación. No es un protocolo rígido, ni pretende reemplazar el juicio clínico del médico, el cual puede variar su actuación si así lo considera1,2.
La artritis séptica es una patología candidata a ser abordada con una vía clínica por tener un curso clínico predecible y por la diversidad en su manejo, que depende de la experiencia del primer facultativo consultado3.
El objetivo de este trabajo es evaluar una vía clínica de artritis séptica, en niños ingresados entre el 1 de enero de 2003 y el 31 de enero de 2005 en el Hospital Universitario La Paz, y describir las características de los pacientes incluidos en esos 2 años.
Material y métodos
La vía clínica se desarrolló en etapas sucesivas: revisión bibliográfica, reuniones para decidir el diseño de la documentación escrita y finalmente reunión de todos los profesionales implicados. Se implantó con el consenso de los Servicios de Reumatología, Ortopedia e Infecciosos Pediátricos y la Unidad de Calidad del Servicio de Medicina Preventiva. La coordinación la realizó uno de los autores (RM) y el estudio fue aprobado por el Comité Ético del Hospital.
Documentación de la vía
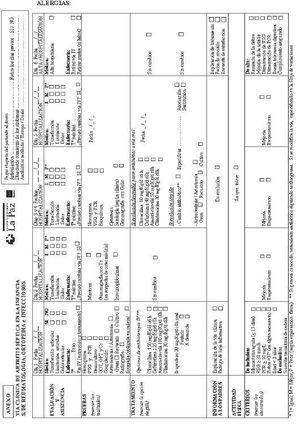
1.Matriz (ver Anexo).
2.Hoja de variaciones.
3.Hoja informativa.
4.Encuesta de satisfacción.
5.Indicadores de evaluación.
Criterios de inclusión
1.Monoartritis aguda (≥ 15 días de evolución) en niños previamente sanos.
2.Velocidad de sedimentación globular (VSG) igual o superior a 30 mm/h.
3.Proteína C reactiva (PCR) ≥ 30 mg/l.
4.Edad inferior a 3 años.
5.Fiebre superior a 37 °C.
Se incluyeron las osteoartritis (osteomielitis intraarticulares que empezaron como artritis).
Criterios de exclusión
1.Sinovitis transitoria de cadera.
2.Monoartritis crónica infecciosa o inflamatoria.
3.Osteomielitis que no empezaron como artritis.
4.Infecciones axiales (sacroileítis y espondilodiscitis).
Criterios de alta hospitalaria
1.Clínicos: remisión de la fiebre, desaparición del dolor y disminución de la tumefacción y/o aumento de la movilidad articular. Además de comprobación de la tolerancia oral del tratamiento antibiótico y garantía del cumplimiento domiciliario.
2.Analíticos: disminución de la VSG y la PCR.
Variables
1.Demográficas: sexo y edad.
2.Clínicas: fechas de comienzo, ingreso y alta, antibiótico previo, temperatura máxima, articulación afectada, artrocentesis y/o artrotomía, datos de laboratorio, células y tinción de Gram en líquido articular, cultivos de sangre y de líquido articular, prueba de tuberculina, inmunoglobulinas séricas y pruebas de imagen (radiología convencional en todos los pacientes y ecografía y gammagrafía isotópica de los que se realizó). También se recogió el motivo de la hospitalización superior a 6 días.
3.Terapéuticas: antibiótico empleado y tiempo de administración intravenosa y oral. La propuesta antibiótica empírica incluía: cloxacilina, amoxicilina-ácido clavulánico, cefuroxima y clindamicina.
4.Los indicadores de evaluación:
a)De cobertura. La relación entre los casos incluidos en la vía y los ingresados por artritis séptica, que cumplieran los criterios establecidos, debía superar el 95 %.
b)De objetivos. La realización de artrocentesis y/o artrotomía debía ser del 100 %, y la obtención de líquido articular antes de la antibioterapia superar el 90 %. Además el 95 % o más de los pacientes debían estar hospitalizados un tiempo igual o inferior a 6 días. Posteriormente se realizaba control ambulatorio hasta el alta definitiva.
c)Del grado de satisfacción. La satisfacción y/o descontento se valoró según las respuestas a 3 bloques de preguntas. Debía superar el 90 % en satisfacción global y hostelería y ser del 100 % respecto a la información recibida.
Análisis estadístico
Los datos se introdujeron en una base de datos y fueron analizados con SPSS 11.0 para Windows, las variables continuas con la U de Mann-Whitney y la diferencia de frecuencias con el test exacto de Fisher.
Resultados
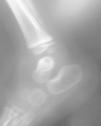
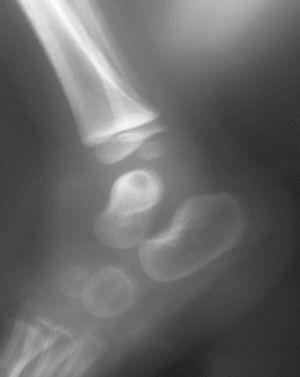
El número total de pacientes fue 35. Se agruparon en: a) artritis séptica segura, casos con confirmación bacteriológica u osteoartritis y b) artritis séptica probable, aquellos otros sin confirmación bacteriológica con buena respuesta a antibióticos. El grupo de artritis séptica segura estuvo constituido por 7 niños, tres con cultivos positivos en líquido articular (dos por Staphylococcus aureus y uno por Kingella kingae) y uno en hemocultivo por Streptococcus pneumoniae y 3 niños con osteoartritis demostrada por radiología convencional un caso (fig. 1) y por gammagrafía ósea con tecnecio99 en dos. El grupo de artritis séptica probable lo constituyeron 28 pacientes.
Figura 1. Osteomielitis del astrágalo.
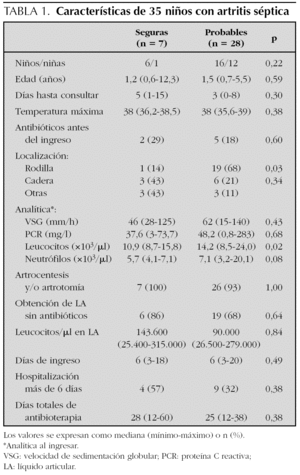
Las características de los 2 grupos se muestran en la tabla 1 y los criterios de inclusión al ingreso en la tabla 2.
La hospitalización fue superior a 6 días en 13 pacientes (37 %), a causa de la artritis en siete de ellos (20 %) y por otras razones en seis (tres gastroenteritis por rotavirus, un exantema medicamentoso, un retraso de artrotomía y un caso para asegurar el cumplimiento del tratamiento).
En cuanto a la articulación, la rodilla se afectó en 20 niños (57 %), la cadera en nueve (26 %), el tobillo en cuatro (11 %) y el carpo y el codo, en un caso cada uno.
El hemocultivo se solicitó en 27 casos y resultó positivo únicamente uno (4 %). Se realizó artrocentesis/artrotomía en 33 pacientes (94,3 %) y se obtuvo líquido articular en 29 (83 %) cuatro de los cuales habían recibido antibiótico previo. En la tinción de Gram no se observaron bacterias en ningún caso y hubo crecimiento bacteriano en el líquido articular en tres (10,3 %). De los 34 pacientes en que se practicó alguna prueba microbiológica, sólo en cuatro de ellos (12 %) los cultivos resultaron positivos.
En 19 de los líquidos (66 %) se realizó recuento de células, obteniendo una media de 116.274 ± 86.669 (25.400-315.000) leucocitos/μl, mediana de 90.000. El porcentaje de polimorfonucleares fue 89,3 ± 4,9 % (80-96), mediana 90 %.
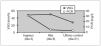
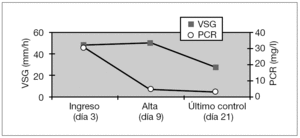
La figura 2 muestra los resultados de la VSG y la PCR al ingreso, al alta hospitalaria y al alta definitiva, correspondientes a los 3, 9 y 21 días de mediana desde el comienzo de los síntomas. La primera determinación se hizo en todos los pacientes, la segunda en 18 (51 %) y la última en 34. Por tanto, una variación frecuente en la vía clínica fue la de no practicar analítica a la salida del hospital, 49 % de los casos.
Figura 2. Velocidad de sedimentación globular (VSG) y proteína C reactiva (PCR) a los 3, 9 y 21 días de mediana desde el comienzo de los síntomas.
La prueba de tuberculina realizada en 31 niños resultó siempre de 0 mm y la concentración de inmunoglobulinas séricas en 19 de ellos fue normal.
Se trataron con cefuroxima 20 casos (seis de las artritis sépticas seguras y 14 de las probables), 13 con amoxicilina-ácido clavulánico del grupo de las probables y otros dos con cloxacilina y clindamicina, respectivamente. Se prescribió más de un antibiótico intravenoso a 7 pacientes y por vía oral a tres. La elección de uno u otro antimicrobiano dependió de la experiencia del facultativo responsable. El tratamiento intravenoso se mantuvo un día menos que la estancia hospitalaria; el alta se daba tras comprobar que el medicamento era bien tolerado por vía oral. La duración total de la antibioterapia se especifica en la tabla 1.
La evolución clínica ha sido buena. Un paciente continúa en seguimiento por tener el núcleo de osificación femoral del lado afectado más pequeño, aunque sin limitación de la movilidad articular.
En la tabla 3 se exponen los indicadores de evaluación conseguidos, los más alejados del estándar fueron la hospitalización superior a 6 días y la obtención de líquido articular sin antibioterapia.
Discusión
La incidencia de artritis séptica en los países desarrollados se estima en 6 de cada 100.000 individuos al año, de los que aproximadamente la mitad son niños; no es por tanto una patología muy frecuente. La mayoría de los estudios realizados son retrospectivos, lo que representa un sesgo que a veces impide extraer conclusiones relevantes para la práctica diaria.
Las vías clínicas se han utilizado en enfermedades muy frecuentes, y en aquéllas con un riesgo alto o un coste elevado, pero también cuando es necesaria la colaboración de múltiples profesionales. Esta última razón justifica una vía clínica de artritis séptica que además ofrece como ventajas añadidas mejorar la gestión y la información al paciente.
El objetivo del estudio es evaluar los primeros 2 años de funcionamiento de una vía clínica, en la que hasta ese momento se habían incluido 35 pacientes, cuyas características son similares a las referidas en la literatura especializada4,5. Se trataba fundamentalmente de varones (63 %), menores de 3 años (80 %) y la artritis se localizaba sobre todo en miembros inferiores (94 %). Al ingresar 25 casos (71 %) reunían 4 o 5 de los criterios de inclusión que habían sido propuestos.
Aunque el diagnóstico de artritis séptica depende de la sospecha clínica, sólo es definitivo cuando existe crecimiento bacteriano. En estudios recientes el germen se identificó entre el 29 y el 52 % de los casos6-8. Nuestro rendimiento bacteriológico fue bajo (12 %) lo que se puede atribuir a diversos factores: a) antibioterapia previa en 7 pacientes (20 %) y en cuatro de los líquidos cultivados (14 %); b) no recogida de muestras en seis (17 %); c) las técnicas de cultivo, o d) un diagnóstico erróneo. En relación con los métodos de cultivo, el servicio de microbiología trabaja con protocolos normalizados. La posibilidad del error diagnóstico no puede ser rechazada de forma absoluta, a pesar de que se excluyeron específicamente artritis crónicas inflamatorias e infecciosas, osteomielitis que no empezaron como artritis, infecciones esqueléticas axiales, artritis virales y reactivas, sinovitis sin aumento de reactantes de fase aguda9, celulitis y bursitis, así como la enfermedad de Perthes, la epifisiólisis y otros procesos ortopédicos. También fueron excluidas las artritis sépticas que consultaron después de 15 días del inicio de los síntomas o aquellas en que el paciente presentaba una enfermedad de base, por juzgarlas potencialmente más complejas.
Hay autores que observan diferencias entre artritis sépticas con cultivo positivo y negativo10 mientras otros no11. Nosotros no las encontramos, aunque los tests estadísticos discriminan mal en una muestra pequeña de pacientes.
En este estudio las osteoartritis se clasificaron como artritis sépticas seguras. Caksen et al12 no encontraron diferencias entre artritis sépticas con o sin osteomielitis, a pesar de que en la literatura médica con frecuencia se señala el peor pronóstico de las artritis asociadas a osteomielitis13.
Hay acuerdo en que la antibioterapia empírica se dirija contra S. aureus14,15, el microorganismo más frecuente, seguido de Streptococcus pyogenes y S. pneumoniae. Cloxacilina, un antiestafilocócico habitual, en este grupo de pacientes sólo se utilizó en una ocasión, porque su administración prolongada por vía oral no es cómoda (cada 6 h y con estómago vacío). Haemophilus influenzae prácticamente ha desaparecido en los niños vacunados, mientras el impacto de la vacuna heptavalente frente al neumococo parece ser limitado16,17. Sin embargo K. kingae gana protagonismo en Estados Unidos18 y en Europa19. En España se especula con que este gramnegativo, de crecimiento lento y exigente, sea el responsable de la excesiva frecuencia de cultivos negativos20.
En cuanto a los resultados de los indicadores de evaluación de la vía clínica, los de cobertura y de satisfacción se acercaron al estándar, sin embargo los de objetivos estuvieron más alejados. En el 77 % de los pacientes se logró una estancia hospitalaria igual o inferior a 6 días, frente al más del 95 % propuesto. Reducir el tiempo de ingreso beneficia al paciente, siempre que la evolución clínica lo permita, y al mismo tiempo disminuye el gasto. Respecto a la obtención de líquido articular antes de administrar antibióticos se consiguió en el 76 % de los casos, frente al más del 90 % proyectado. La aspiración con aguja es una técnica simple, que a veces no se efectúa y sin embargo el diagnóstico de artritis séptica es altamente sugestivo, aún con cultivo negativo, cuando el recuento celular supera los 50.000 leucocitos y más del 90 % son polimorfonucleares3.
Tras esta primera evaluación de la vía clínica se han introducido algunas modificaciones. Una variación frecuente fue no realizar control analítico a la salida del hospital, 49 % de los casos. En tanto que la experiencia de los 18 pacientes en que se practicó, demuestra el hecho conocido de que la mejoría de la artritis séptica coincide con la práctica normalidad de la PCR, mientras que la VSG está incluso más elevada y tarda en normalizarse unas 4 semanas21. Por lo que se puede evitar esa extracción de sangre y decidir el alta hospitalaria siguiendo únicamente los criterios clínicos de mejoría.
Por otra parte, pruebas como la de la tuberculina que resultó siempre de 0 mm y las inmunoglobulinas que nunca estuvieron disminuidas, nos llevan a plantearnos el dejar de practicarlas de forma rutinaria, realizándolas cuando se consideren necesarias por razones epidemiológicas o evolutivas.
Nuestros retos inmediatos son conseguir una estancia hospitalaria máxima de 6 días, que puede parecer ambiciosa, aunque existen guías clínicas que manejan estancias inferiores22 y realizar el aspirado de líquido articular antes de comenzar el tratamiento antibiótico, enviando la muestra para recuento de células, tinción de Gram y cultivo en sistemas automatizados23.
El patrón de presentación de las artritis sépticas infantiles va cambiando hacia un cuadro menos florido, en el que los pacientes conservan buen estado general, la fiebre mantenida está ausente y existe poca leucocitosis24, quizá por el escaso tiempo transcurrido hasta la consulta, que en tres de nuestros casos era sólo de horas. De cualquier modo, en todo niño con una articulación tumefacta y/o limitada por dolor, máxime si tiene menos de 3 años, la artritis séptica debe ser considerada, para evitar el retraso diagnóstico que acaba por ensombrecer el pronóstico.
En resumen, la vía clínica de artritis séptica ha sido útil para estandarizar el proceso de diagnóstico y tratamiento, que siguen dependiendo de la experiencia clínica. De hecho, gran parte de la vía descansa en la exploración física y requiere un control sistemático y riguroso. Así mismo, ha resultado aplicable y permite decidir el alta hospitalaria, siguiendo sólo los criterios clínicos de mejoría, sin que por ello empeore el pronóstico funcional de los pacientes.
Correspondencia: Dra. R. Merino Muñoz.
Sección de Reumatología Pediátrica. Hospital Universitario La Paz.
P.º de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: rmerino.hulp@salud.madrid.org
Recibido en octubre de 2006.
Aceptado para su publicación en marzo de 2007.