La encefalomielitis aguda desmielinizante (EMAD) es una enfermedad inflamatoria mutifocal y monofásica del sistema nervioso central (SNC) que afecta a la sustancia blanca. La evolución suele ser favorable. Presentamos nuestra experiencia en el manejo de la EMAD de curso clínico hiperagudo.
Pacientes y métodosRevisión de 5 casos de EMAD que se encontraban en coma en el momento del ingreso en la Unidad de Cuidados Intensivos Pediátricos (UCIP). Se describen los resultados epidemiológicos, clínicos, microbiológicos y los hallazgos de resonancia magnética (RM), así como el tratamiento y la evolución de dichos pacientes.
ResultadosLa edad media fue de 5,2 años (100% varones). Ningún caso presentó criterios de leucoencefalitis aguda hemorrágica. Todos los pacientes ingresaron en coma y precisaron ventilación mecánica controlada. Todos presentaron fiebre previamente al ingreso. El intervalo entre el primer síntoma de afectación neurológica y el coma fue ≤ 24 h. En 3 casos se objetivó alteración bioquímica del LCR. El estudio inmunológico del LCR detectó bandas oligoclonales en un paciente. En la primera RM, la sustancia blanca supratentorial y núcleos basales se mostraron afectados en todos los casos y 3 presentaron afectación medular. Todos recibieron tratamiento con metilprednisolona a dosis altas. Cuatro recibieron tratamiento con inmunoglobulina G a dosis altas y uno, plasmaféresis. Dos pacientes fallecieron durante su estancia en UCIP. Las lesiones radiológicas de sustancia blanca persistieron al alta. A los 9 meses, los 3 supervivientes presentaban un Glasgow Outcome Scale de 5 puntos y no habían presentado recaídas.
ConclusionesExisten formas hiperagudas de EMAD que se acompañan de una mortalidad elevada. A corto plazo, la mejoría clínica no se acompaña de una regresión paralela de las lesiones detectables en la RM.
Acute disseminated encephalomyelitis (ADEM) is an inflammatory disease that damages the white matter of the central nervous system. Its clinical course is monophasic and multifocal. The outcome is usually favourable. We report our experience in the management of the hyperacute form of ADEM.
Patients and methodsA retrospective chart review was performed on five patients admitted in coma with a diagnosis of ADEM in the Paediatric Intensive Care Unit (PICU). We describe their epidemiological, clinical, microbiological, magnetic resonance imaging features and their treatment and outcomes.
ResultsThe mean age was 5.2 years and all were male. None of them fulfilled radiologic criteria for acute haemorrhagic leukoencephalitis. At admission all patients were in a coma, and all were on controlled mechanical ventilation support. Before their admission all patients had fever. In all cases the time between the first neurological symptom and coma was ≤ 24hours. The cerebrospinal fluid examination was abnormal in three patients, and in one case, oligoclonal bands were detected. The first brain magnetic resonance imaging (MRI) showed white matter and basal ganglia lesions in all patients, and in three cases the spinal medulla was affected by demyelination. All patients were treated with a course of high-dose methylprednisolone. Four patients were also treated with high-dose immunoglobulins, and one of them received plasmapheresis. Two patients died, and one patient had severe sequelae at discharge from the PICU. At discharge the lesions in the white matter were still present in the MRI. After nine months the three survivors had a Glasgow Outcome Scale score of five and no one relapsed.
ConclusionsThere is a hyperacute clinical form of ADEM which has a high mortality rate. In the short term, the clinical improvement of hyperacute ADEM is not accompanied by a decrease of severity of the brain MRI.
La encefalomielitis aguda desmielinizante (EMAD) es una enfermedad inflamatoria del sistema nervioso central (SNC) que cursa con alteración de la consciencia y con afectación neurológica típicamente multifocal y monofásica1-3. Produce lesiones desmielinizantes que predominan en la sustancia blanca subcortical del encéfalo y en ocasiones afecta a la médula espinal. También pueden afectarse la sustancia gris cortical y los núcleos basales4,5.
Su origen está probablemente relacionado con un trastorno autoinmunitario que, precedido por una vacunación o un proceso infeccioso, destruye la mielina. Es más frecuente en niños mayores de 3 años y adultos jóvenes. Su incidencia se estima en unos 0,6-0,8 casos/100.000 pacientes/año1,3. Se considera que su mortalidad global en la población pediátrica no supera el 5%6 y que se produce una resolución completa de las lesiones hasta en el 90% de los pacientes7, pero se han establecido 4 grupos clínicos3 que poseen niveles de gravedad y pronóstico diferentes en relación con la extensión y la localización de las lesiones en el SNC.
A pesar de que se trata de una enfermedad bien conocida1,3,6,8, la información disponible acerca de la forma de presentación y la evolución clínica de los diferentes grupos clínicos de EMAD es reducida, lo que hace difícil predecir el riesgo de evolución desfavorable en cada caso. Para conocer las características clínicas y el pronóstico de los pacientes con las formas más graves de EMAD, presentamos nuestra experiencia en el manejo de 5 pacientes diagnosticados de esta enfermedad desmielinizante, cuyo curso clínico fue hiperagudo.
Pacientes y métodosHemos revisado retrospectivamente las historias clínicas de todos los pacientes ingresados consecutivamente en nuestra Unidad de Cuidados Intensivos Pediátricos (UCIP) con el diagnóstico de EMAD grave entre enero del 2005 y octubre del 2011. Los criterios de selección para el diagnóstico de EMAD incluyeron la aparición de un proceso inflamatorio desmielinizante del SNC de presentación aguda, con afectación multifocal, encefalopatía y afectación neurológica polisintomática, sin antecedentes de crisis de desmielinización previa3. Además, los pacientes tenían que presentar alteraciones de la sustancia blanca en el examen mediante resonancia magnética (RM) del SNC (craneal y medular), sin evidencia radiológica de un proceso destructivo previo de la sustancia blanca.
Se seleccionó para su inclusión en este estudio a los que se encontraban en coma o presentaban estupor asociado a depresión respiratoria.
Se clasificó a los pacientes según los hallazgos de la RM en 4 grupos, según los criterios de Tennenbaum et al.3 (tabla 1).
Clasificación de los pacientes en función de los hallazgos en la primera RM
| Grupo EMAD | Descripción de las lesiones en la RM inicial |
| Grupo A | Lesiones desmielinizantes de diámetro < 5 mm |
| Grupo B | Grandes lesiones que confluyen en la sustancia blanca |
| Grupo C | Adicionalmente, grandes lesiones con lesiones bitalámicas simétricas |
| Grupo D | Hemorragia en el interior de las lesiones desmielinizantes |
Se investigó en todos los casos la existencia de alguna enfermedad prodrómica y se analizaron sus manifestaciones clínicas. Asimismo se recogieron de la historia clínica los datos clínicos relativos a su situación clínica al ingresar y los resultados del examen bioquímico e inmunológico del LCR, así como la información serológica y bacteriológica relativa a cada caso.
Se extrajo la información contenida en los informes del examen electroencefalográfico (EEG) y mediante potenciales evocados (PE) de cada paciente.
Se examinaron los resultados de la RM cerebral y medular de todos los casos al ingresar y evolutivamente. En cada examen se valoró:
- –
El número y el tamaño de las lesiones y su localización en las áreas de la sustancia blanca y de la sustancia gris encefálica (hemisferios, núcleos basales, tálamo), del cuerpo calloso y de la médula espinal, incluyendo el patrón de distribución de las lesiones, si estas producían efecto masa y su respuesta a la administración de gadolinio.
- –
En los pacientes que sobrevivieron a la enfermedad, al alta de la unidad y transcurridos 9 meses, se valoró, mediante el examen de su historia clínica, su situación funcional, que se clasificó mediante el Glasgow Outcome Score9 y la eventual existencia de recaídas.
De los 9 casos diagnosticados de EMAD durante el período de estudio, se seleccionó a 5 niños (los 5 de sexo masculino) de edades comprendidas entre 1 y 12 años (edad media: 5,2 años). Todos pertenecían al grupo C de la clasificación de Tennenbaum (tabla 1)3. Ninguno presentó criterios sugestivos de leucoencefalitis aguda hemorrágica (LAH), que en la clasificación mencionada se equipara al grupo D.
Todos los pacientes de nuestra serie presentaron una enfermedad prodrómica que se acompañó de fiebre y que en 4 de ellos se manifestó con síntomas respiratorios (tos y expectoración). En un caso la fiebre solo se acompañó de vómitos. La enfermedad precedió a la aparición del primer síntoma neurológico con un intervalo entre 2 y 10 días (valor medio 5,8 días). Ninguno había sido vacunado recientemente. La evolución clínica de la EMAD se consideró en todos casos hiperaguda porque la duración del intervalo entre la aparición del primer síntoma de afectación neurológica y el coma fue ≤ 24 h.
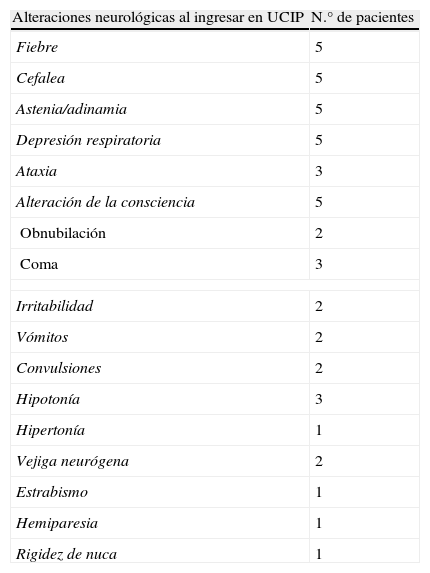
Las manifestaciones neurológicas de los 5 pacientes se describen en la tabla 2.
Descripción de la sintomatología inicial. En la columna de la derecha figura el número de pacientes que presentó los diferentes signos y síntomas de EMAD
| Alteraciones neurológicas al ingresar en UCIP | N.° de pacientes |
| Fiebre | 5 |
| Cefalea | 5 |
| Astenia/adinamia | 5 |
| Depresión respiratoria | 5 |
| Ataxia | 3 |
| Alteración de la consciencia | 5 |
| Obnubilación | 2 |
| Coma | 3 |
| Irritabilidad | 2 |
| Vómitos | 2 |
| Convulsiones | 2 |
| Hipotonía | 3 |
| Hipertonía | 1 |
| Vejiga neurógena | 2 |
| Estrabismo | 1 |
| Hemiparesia | 1 |
| Rigidez de nuca | 1 |
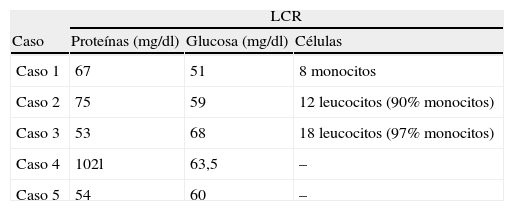
A todos los pacientes se le practicó a su ingreso, o se les había realizado inmediatamente antes, una punción lumbar. Los resultados del examen bioquímico del LCR figuran en la tabla 3. La glucorraquia fue normal en todos los casos, en 3 se encontraron las proteínas moderadamente elevadas (entre 67 y 102mg/dl; valor normal 15-40mg/dl) y en 3 se encontraron en la muestra de LCR leucocitos, que fueron de predominio monocítico.
El estudio inmunológico del LCR en todos los pacientes incluyó la investigación de bandas oligoclonales y de proteína básica de la mielina en LCR. Con excepción del hallazgo de bandas oligoclonales patológicas en el paciente n.° 4, el resto de los resultados fue normal.
El examen microbiológico del LCR mediante reacción en cadena de la polimerasa fue negativo para virus del herpes, varicela zóster y enterovirus. Además, en todos los casos los cultivos de LCR para Mycobacterias y Listeria monocitogenes también resultaron negativos, así como la serología para virus neurotropos y para Mycoplasma pneumoniae.
Estudios neurofisiológicosEl examen EEG realizado en la fase precoz de la enfermedad mostró en los 3 casos en que se llevó a cabo una acusada lentificación y una actividad global desestructurada indicativa de afectación encefálica grave.
En la fase avanzada de la enfermedad, se realizaron PE multimodales en los pacientes (números 1, 2 y 4), que mostraron mala evolución clínica. En los 3 se objetivó alargamiento de los tiempos de conducción. En el paciente que falleció de muerte encefálica, la abolición de los potenciales de córtex primarios precedió a la ausencia de actividad eléctrica cerebral.
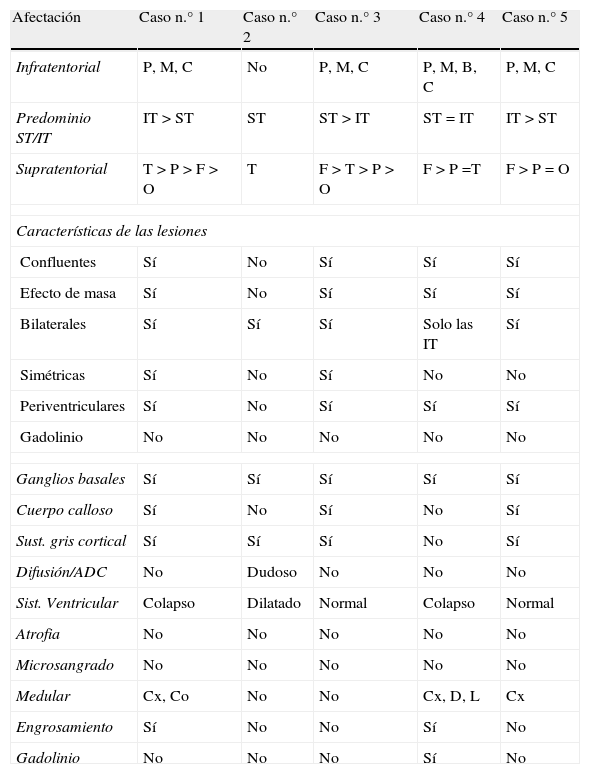
Hallazgos en la resonancia magnética cerebralLos hallazgos en la RM cerebral realizada al ingreso se resumen en la tabla 4.
Descripción de la RM inicial de cada caso
| Afectación | Caso n.° 1 | Caso n.° 2 | Caso n.° 3 | Caso n.° 4 | Caso n.° 5 |
| Infratentorial | P, M, C | No | P, M, C | P, M, B, C | P, M, C |
| Predominio ST/IT | IT > ST | ST | ST > IT | ST = IT | IT > ST |
| Supratentorial | T > P > F > O | T | F > T > P > O | F > P =T | F > P = O |
| Características de las lesiones | |||||
| Confluentes | Sí | No | Sí | Sí | Sí |
| Efecto de masa | Sí | No | Sí | Sí | Sí |
| Bilaterales | Sí | Sí | Sí | Solo las IT | Sí |
| Simétricas | Sí | No | Sí | No | No |
| Periventriculares | Sí | No | Sí | Sí | Sí |
| Gadolinio | No | No | No | No | No |
| Ganglios basales | Sí | Sí | Sí | Sí | Sí |
| Cuerpo calloso | Sí | No | Sí | No | Sí |
| Sust. gris cortical | Sí | Sí | Sí | No | Sí |
| Difusión/ADC | No | Dudoso | No | No | No |
| Sist. Ventricular | Colapso | Dilatado | Normal | Colapso | Normal |
| Atrofia | No | No | No | No | No |
| Microsangrado | No | No | No | No | No |
| Medular | Cx, Co | No | No | Cx, D, L | Cx |
| Engrosamiento | Sí | No | No | Sí | No |
| Gadolinio | No | No | No | Sí | No |
ADC: coeficiente de difusión aparente; B: bulbo; C: cerebelo; Co: cono medular; Cx: cervical; D: dorsal; L: lumbar; M: mesencéfalo; P: protuberancia; IT: infratentorial; ST: supratentorial.
En la primera RM (efectuada al ingresar cada paciente en la UCIP), la sustancia blanca supratentorial se mostró afectada de forma bilateral en todos los casos. Todos los pacientes presentaron más de 6 lesiones de diámetro superior a 5mm. Su distribución, características y el comportamiento tras la administración de gadolinio figuran en la tabla 4.
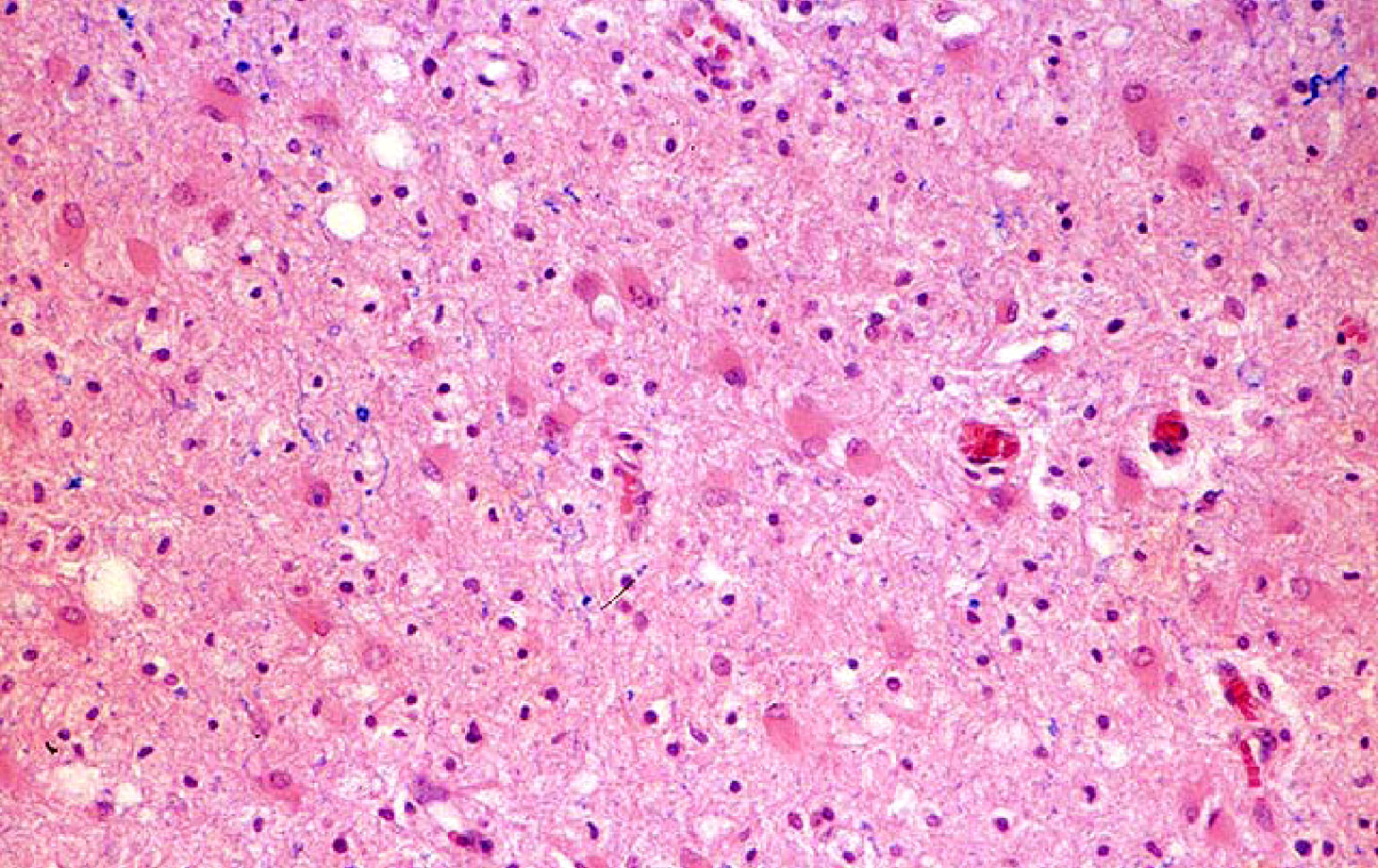
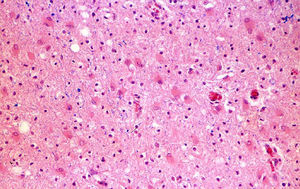
Biopsia cerebralSolamente se llevó a cabo en el caso n.° 4, a partir de la lesión supratentorial más accesible (fig. 1). El resultado confirmó el diagnóstico clínico de EMAD.
Tratamiento y evolución clínicaEl bajo nivel de consciencia obligó en todos los casos a su tratamiento con ventilación mecánica controlada desde su ingreso. La sospecha de hipertensión intracraneal motivó la monitorización de la presión intracraneal (PIC) en 4 pacientes.
Desde su ingreso en la UCIP y hasta que se descartó mediante pruebas microbiológicas un origen bacteriano del proceso inflamatorio del SNC, todos los pacientes recibieron tratamiento antibiótico por vía intravenosa (cefotaxima, que en 3 pacientes se asoció con claritromicina). Asimismo, a todos se les administró aciclovir por vía intravenosa durante 7 días.
Todos los pacientes recibieron desde que se realizó el diagnóstico de EMAD tratamiento con metilprednisolona por vía intravenosa a unas dosis entre 20 y 30mg/kg/día durante 5 días, seguido por un ciclo de metilprednisolona a 1mg/kg/día durante 7 días.
Cuatro pacientes recibieron tratamiento con concentrados de inmunoglobulina G por vía intravenosa a dosis altas (2 g/kg/día) durante 4 a 6 días. El paciente n.° 2 recibió 2 ciclos de este tratamiento.
Ante la ausencia de respuesta clínica favorable con corticoides e inmunoglobulinas, un paciente fue tratado con plasmaféresis, recibiendo 6 sesiones de intercambio.
Situación funcional tras el altaDe los 3 pacientes que fueron dados de alta de la UCIP (tabla 5), los casos n.° 5 y 3 no presentaban secuelas neurológicas. El caso n.° 1 sobrevivió con secuelas graves del SNC y sin contenido aparente de consciencia. Sus PE mostraban afectación hemisférica con enlentecimiento del potencial de N 20 bilateral. Tras recibir el alta de la UCIP, empezó en planta de hospitalización un proceso de recuperación progresivo. Después de 9 meses presentaba un nivel de consciencia apropiado, con un retraso psicomotor leve y con cierta espasticidad que no le impedía deambular con ayuda. Ninguno de los 3 supervivientes ha presentado nuevas crisis de desmielinización.
DiscusiónLas enfermedades inflamatorias y desmielinizantes del SNC en la infancia representan un espectro de trastornos que se pueden diferenciar por su curso clínico y su gravedad, y por la distribución de las lesiones que provocan en el SNC10. En ausencia de un biomarcador específico, al diagnóstico de EMAD se llega por la sospecha clínica y por un conjunto de hallazgos radiológicos indicativos11-13. El estudio retrospectivo de estos 5 casos permite comprobar que, además de presentar las características lesiones parcheadas de desmielinización de la sustancia blanca, todos compartían la asociación de encefalopatía grave con un deterioro neurológico multifocal rápidamente progresivo14. Destacan en nuestros casos el antecedente de una enfermedad infecciosa y el contraste entre la gravedad del cuadro clínico y la poca expresividad de las alteraciones del LCR, un hallazgo descrito previamente6,15. El diagnóstico de EMAD incluye la exclusión de otros procesos con curso clínico parecido, como la encefalitis vírica y la esclerosis múltiple (EM)6.
Considerando la alta prevalencia de las encefalitis infecciosas en la edad pediátrica y su curso clínico indistinguible del curso de la EMAD, la prioridad diagnóstica en nuestros casos fue descartar que el trastorno tuviera un origen infeccioso. Desde su ingreso, todos recibieron tratamiento con antibióticos y aciclovir hasta que se descartó un origen bacteriano o vírico.
Además, todos presentaron desde la primera RM múltiples lesiones desmielinizantes de bordes mal definidos, sin evidencia de lesiones destructivas previas del SNC. A diferencia de lo que ocurre en la EM16, las lesiones eran bilaterales, de bordes mal definidos y se manifestaban (sobre todo en secuencias FLAIR y T2) especialmente en la sustancia blanca corticosubcortical y también en el tálamo y los núcleos basales. En 3 casos (números 1, 4 y 5), también existía afectación medular (tabla 4). Como es característico en la EMAD, la sintomatología neurológica estuvo precedida en todos los casos por una enfermedad de origen infeccioso. El estudio inmunológico del LCR fue normal con excepción del hallazgo de bandas oligoclonales en el paciente n.° 4. Las bandas oligoclonales son más frecuentes en la EM que en la EMAD pero en ocasiones pueden estar presentes14. La ausencia de bandas oligoclonales también favorece el diagnóstico de EMAD frente al de EM3.
Aunque existen formas de EMAD recurrentes y polifásicas, entre las enfermedades desmielinizantes de la sustancia blanca solo la EMAD y la LAH son rápidamente progresivas y tienen una afectación extensa del SNC. Además, en la mayoría de los casos tienen un curso monofásico. La LAH es una desmielinización aguda, hemorrágica y necrotizante del SNC que se considera un subgrupo de presentación fulminante y rápidamente progresivo de la EMAD3,12,17-19 y que, por su mal pronóstico, conviene identificar precozmente.
Por su alta sensibilidad para detectar las lesiones de la sustancia blanca, el diagnóstico de EMAD se establece siempre con el apoyo de la RM11,12,14,20. De acuerdo con los hallazgos presentes en la neuroimagen, se ha propuesto una clasificación de la EMAD en 4 grupos (tabla 1), a los que se atribuye un porcentaje de recuperación diferente4,17. La afectación bitalámica presente en nuestros casos permite incluir a todos ellos en el grupo C, cuya recuperación sin secuelas se considera del 80%3.
Se considera que en la LAH (grupo D de Tennenbaum) la evolución hacia el coma es más rápida que en la EMAD y que se asocia a una mortalidad mayor6,17. Los hallazgos clínicos en los pacientes con LAH a menudo sugieren la presencia de una lesión con efecto masa con signos focales rápidamente progresivos y con hipertensión intracraneal21,22, que no estuvo presente en ninguno de nuestros casos. La elevación de la PIC en el caso n.° 2 se justifica por la hidrocefalia comunicante que presentó el paciente y que se resolvió cuando se instauró una derivación externa de LCR.
La RM permitió incluir a nuestros pacientes en el grupo C de la clasificación de Tennenbaum3 y descartar que presentaran LAH18, cuya mortalidad se aproxima al 70%6. En ningún caso se evidenció en nuestros pacientes hemorragia petequial en la primera RM, aunque la evolución clínica fue en todos muy rápida y progresiva. Únicamente en un caso se detectó hemorragia en la RM, pero esta no apareció hasta el duodécimo día de evolución. Además, la LAH se caracteriza por la presencia en el LCR de pleocitosis polimorfonuclear18, a diferencia del predominio de los mononucleares, que se suelen encontrar en la EMAD23 y que se produjo en nuestros casos. En el caso n.° 4 se realizó una biopsia que mostró los signos característicos de la EMAD (fig. 1). La localización predominante de las lesiones supratentoriales en la unión de la sustancia gris cortical y la sustancia blanca subcortical, su apariencia «parcheada» y el que fueran más visibles en T2 son características de la EMAD5,16. Lesiones como las de los ganglios basales, el tálamo y el troncoencéfalo y la médula (tabla 4) refuerzan el diagnóstico5 y estuvieron presentes en todos nuestros casos. Dado que ninguno de nuestros pacientes mostró signos compatibles con LAH, creemos que fueron factores como el tamaño de las lesiones, su carácter múltiple y su extensión simultánea a los compartimentos supra e infratentorial lo que justifica la gravedad inicial en todos ellos y la evolución de los casos 1, 2 y 4 (tabla 5).
Los pacientes que presentamos mostraban desde su ingreso una forma de EMAD de carácter hiperagudo diferente de la forma clínica conocida como LAH, pero no menos grave que esta.
A pesar de que no existe un tratamiento universalmente aceptado para la EMAD17, todas las series publicadas hasta la fecha describen una buena respuesta al tratamiento inmunomodulador que empieza con corticoides24 seguido, en los casos refractarios, por la perfusión de inmunoglobulinas a dosis altas. En casos aislados se ha comprobado la recuperación clínica con plasmaféresis6,25.. Estos resultados han llevado a considerar a la EMAD como un proceso inflamatorio desmielinizante de curso favorable11,26, con una supervivencia sin secuelas entre el 70 y 90%7. Sin embargo, a pesar de que en nuestros pacientes el intervalo entre la primera manifestación de afectación neurológica y la administración de corticoides fue inferior a 3 días, el tratamiento con metilprednisolona a dosis altas durante 5 días solo fue aparentemente eficaz en 2 pacientes que se recuperaron sin secuelas (tabla 5). Otros 2 fallecieron a pesar de recibir tratamiento suplementario con inmunoglobulinas a dosis altas. Otro paciente (el caso n.° 1) también recibió 6 sesiones de plasmaféresis, a pesar de lo cual fue dado de alta con graves secuelas neurológicas de las que tardó en recuperarse 9 meses. Se ha sugerido27 que la plasmaféresis es eficaz en las enfermedades desmielinizantes agudas del SNC como la EMAD, pero en nuestro caso no parece haber ejercido ningún efecto beneficioso.
Nuestros resultados parecen indicar que existen casos de EMAD de curso hiperagudo y sin lesiones hemorrágicas en la sustancia blanca, en los que aun con el tratamiento apropiado y precoz se produce una evolución fatal o la supervivencia con secuelas graves. Teniendo en cuenta que en los casos que tuvieron evolución favorable (tablas 4 y 6) las lesiones de la sustancia blanca presentes al ingreso persistían prácticamente inmodificadas en la RM previa al alta, siendo sin embargo en ese momento el nivel de consciencia normal, cabe establecer la hipótesis de que en los casos de buena evolución el corticoide a dosis altas fue capaz de controlar el proceso inflamatorio que es causa de las lesiones y que está en el origen del coma. Por el contrario, en los casos de EMAD con evolución desfavorable, el mal pronóstico vendría condicionado porque las lesiones ya se habían establecido sobre estructuras vitales del SNC.
Descripción de la última RM hecha antes del alta de UCIP
| Afectación | Caso n.° 1 | Caso n.° 2 | Caso n.° 3 | Caso n.° 4 | Caso n.° 5 |
| Infratentorial | No | C, M | No | P, M, B, C | P, M, C |
| Predominio ST/IT | ST | ST = IT | ST | ST = IT | IT = ST |
| Supratentorial | F > P > T > O | F > T | F > T > P > O | F > P =T | F > P = O > T |
| Características de las lesiones | |||||
| Confluentes | Sí | Sí | Sí | Sí | Sí |
| Efecto de masa | No | Sí | No | Sí | Sí |
| Bilaterales | Sí | Sí | Sí | Solo las IT | Sí |
| Simétricas | Sí | No | Sí | No | No |
| Periventriculares | Sí | Sí | Sí | Sí | Sí |
| Gadolinio | No | No | No | No | No |
| Ganglios basales | Sí | Sí | Sí | Sí | Sí |
| Cuerpo calloso | Sí | No | No | No | Sí |
| Sust. gris cortical | Sí | Sí | Sí | No | Sí |
| Difusión/ADC | No | Dudoso | No | No | No |
| Sist. ventricular | Dilatado | Dilatado | Dilatación leve | Colapso | Normal |
| Atrofia | Sí | No | No | No | No |
| Microsangrado | No | Sí | No | No | No |
| Medular | No | No | No | Cx, D, L | No |
| Engrosamiento | No | No | No | Sí | No |
| Gadolinio | No | No | No | Sí | No |
ADC: coeficiente de difusión aparente; B: bulbo; C: cerebelo; Co: cono medular; Cx: cervical; D: dorsal; FMO: fallo múltiple de órganos; L: lumbar; M: mesencéfalo; P: protuberancia; IT: infratentorial; ST: supratentorial.
El sistema de clasificación propuesto por Tennenbaum3 ha sido una herramienta eficaz para estratificar en nuestros casos la gravedad y el pronóstico. Existen formas de EMAD diferentes de la LAH (o síndrome de Weston Hurst), con presentación fulminante, que se manifiestan con una gravedad extrema desde los primeros síntomas de la enfermedad y que producen una morbilidad y mortalidad elevadas. En los pacientes tratados, la mejoría clínica no parece acompañarse de una regresión paralela, a corto plazo, de las lesiones detectables en la RM.
El reducido número de casos y su carácter retrospectivo son limitaciones que impiden generalizar las conclusiones de este estudio pero que permiten poner de relieve la necesidad de considerar la existencia de formas graves de EMAD con una presentación hiperaguda y un nivel de gravedad extremo. La buena respuesta a largo plazo de algunos casos de EMAD con presentación fulminante, cuando en su tratamiento se incluyen medidas de soporte vital y corticoides a dosis muy elevadas, refuerza la importancia de su diagnóstico precoz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.