Los resultados de los pacientes con diagnóstico de leucemia linfoblástica aguda con cromosoma de Philadelphia (LLA-Ph) continúan siendo desfavorables comparados con los otros tipos de leucemias linfoblásticas agudas, pese a las mejoras en los tratamientos farmacológicos y los avances del trasplante de progenitores hematopoyéticos (TPH).
Pacientes y métodosSe ha analizado el papel del TPH alogénico en pacientes diagnosticados de LLA-Ph mediante un estudio multicéntrico donde se recogen datos pertenecientes a 70 pacientes reportados por el Grupo Español de Trasplante Hematopoyético (GETH), diagnosticados de esta enfermedad trasplantados en distintos hospitales españoles entre los años 1998 y 2014.
ResultadosLa realización del TPH a partir del año 2004, en primera remisión completa (RC) y con el empleo de timoglobulina (ATG) como parte del acondicionamiento, impactó favorablemente en la supervivencia global (SG). El TPH a partir del año 2004 en primera RC, así como el tratamiento con ATG y el desarrollo de enfermedad de injerto contra receptor aguda (EICRa), aumentaron la supervivencia libre de eventos (SLE). La administración de imatinib, así como la ausencia de enfermedad mínima residual previas al TPH, junto con la EICRa redujeron la probabilidad de recaída. La edad del paciente inferior a 10 años, el estado de primera RC y el empleo de ATG en el acondicionamiento disminuyeron la mortalidad relacionada con el TPH.
ConclusionesLos pacientes en primera RC que han recibido ATG durante el acondicionamiento presentan mayores SG y SLE. La indicación de TPH debería considerarse en estas situaciones.
Outcomes in patients diagnosed of acute lymphoblastic leukemia with Philadelphia chromosome (Ph-ALL) remains unfavourable compared to other subtypes of acute lymphoblastic leukemia despite improvements in drug treatments as well as advances in hematopoietic stem cell transplantation (HSCT).
Patients and methodsThe role of allogeneic HSCT in Ph-ALL patients has been analysed through a multicentric study where data belonging to 70 patients diagnosed of this entity in different center that received HSCT between years 1998 and 2014, were reported by the Grupo Español de Trasplante Hematopoyético (GETH).
ResultsThe performance of HSCT from year 2004, in first complete remission (CR) status with thymoglobulin (ATG) based conditioning had a favorable impact on overall survival (OS). HSTC performance from year 2004, in first CR with ATG-based conditioning in addition to acute graft versus host disease (aGvHD) development, increased event free survival (EFS). Treatment with imatinib as well as undetectable minimal residual disease (MRD) prior to HSCT, combined with aGvHD, reduced risk of relapse (RR). Patient age less than 10 years when HSCT, first CR and ATG-based conditioning were associated to a lower transplant related mortality (TRM).
ConclusionsPatients that could achieve first CR that also received ATG-based conditioning had a better OS and EFS, so HSCT should be considered for this group of patients.
El cáncer infantil supone la primera causa de muerte por enfermedad desde el primer año de vida hasta la adolescencia. La leucemia linfoblástica aguda (LLA) es la neoplasia más frecuente1. La mortalidad debida a esta enfermedad ha disminuido notablemente en los últimos años, llegando a tasas de supervivencia global (SG) a los 5 años superiores al 90%2. Sin embargo, la presencia de alteraciones genéticas como la translocación (9;22), encontrada entre el 2 y el 4% de los pacientes pediátricos con LLA se asocia a un mayor riesgo de refractariedad y de recaída3.
El cromosoma resultante de la translocación (9;22) (q34;q11) es conocido con el nombre de cromosoma de Philadelphia. Fue descrito por primera vez en 1960 por Nowell y Hungerford4 en pacientes adultos con leucemia mieloide crónica, y posteriormente se asoció con la patogenia de algunos tipos de leucemia mieloide aguda, LLA y leucemias de linaje ambiguo. La translocación (9;22) del gen codificante para la tirosín-cinasa ABL1 (cromosoma 9) y el promotor BCR (cromosoma 22) genera el gen de fusión BCR-ABL1, que codifica a su vez una proteína con actividad tirosín-cinasa constitucional5. Este hecho confiere en los precursores hematopoyéticos una activación permanente de vías de proliferación celular, favoreciendo la patogenia de la enfermedad mediante la inhibición de vías de diferenciación y la dotación de resistencia a los tratamientos habituales6.
Los pacientes con diagnóstico de LLA con cromosoma de Philadelphia (LLA-Ph) han sido considerados tradicionalmente de alto riesgo y de pronóstico desfavorable. El trasplante alogénico de progenitores hematopoyéticos (TPH) ha mejorado la supervivencia de manera significativa en este tipo de enfermedad, frente al empleo exclusivo de quimioterapia7,8.
La incorporación de fármacos inhibidores de la tirosín-cinasa (ITK) al tratamiento quimioterápico estándar ha supuesto una mejoría considerable en el pronóstico de la LLA-Ph, alcanzando supervivencias libres de eventos a los 5 años en torno al 70%9,10, aunque aún inferior al resto de los pacientes pediátricos con LLA no Ph11.
El imatinib es un ITK que ejerce su acción biológica al interaccionar con ABL, inhibiendo su fosforilación y, por tanto, la activación de cascadas de señalización intracelular relacionadas con proliferación. Además, favorece la apoptosis celular12-14. En combinación con quimioterapia intensiva seguida de TPH, ha demostrado mayores tasas de supervivencia15-18. Sin embargo, en monoterapia no ha demostrado efectividad debido al desarrollo de resistencias11.
La respuesta precoz al tratamiento determinada por la cuantificación de la enfermedad mínima residual (EMR) mediante técnicas inmunofenotípicas o moleculares, como la reacción en cadena de polimerasa cuantitativa (qPCR), constituye un factor pronóstico de gran relevancia en la LLA, obteniéndose mejores resultados en aquellos pacientes que consiguen negativizarla10,19-21.
Los pacientes tratados con quimioterapia convencional e imatinib que al finalizar la inducción alcanzan remisión completa (RC) con EMR negativa son considerados de bajo riesgo. En este grupo de pacientes, los resultados en cuanto a supervivencia no son inferiores a aquellos que además reciben TPH. Sin embargo, aquellos pacientes que al finalizar la inducción presentan EMR positiva, considerados en este caso de alto riesgo, sí que obtendrían mejores tasas de supervivencia con la realización de TPH9,15,22.
Actualmente, en nuestro país los pacientes pediátricos con diagnóstico de LLA-Ph reciben tratamiento quimioterápico según el protocolo de la Sociedad Española de Hemato-Oncología Pediátrica (SEHOP) y el Programa Español de Tratamientos en Hematología (PETHEMA) versión 2013, dentro del grupo de pacientes de alto riesgo, asociando imatinib desde el día 15 de la inducción al tratamiento quimioterápico convencional.
El objetivo principal de este estudio es analizar el impacto clínico del TPH en nuestro medio en los pacientes pediátricos con diagnóstico de LLA-Ph, analizando la serie histórica reportada por el Grupo Español de Trasplante de Médula en Niños (GETMON) junto con el Grupo Español de Trasplante Hematopoyético (GETH).
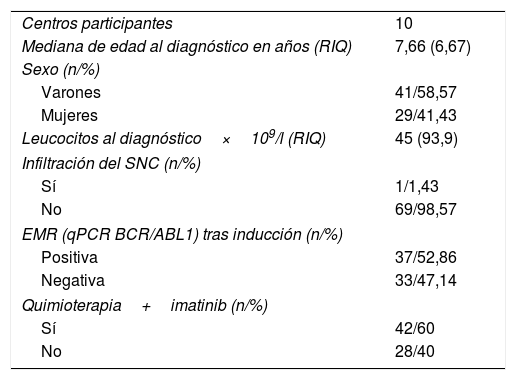
Pacientes y métodosPacientesSe ha realizado un estudio observacional, multicéntrico y de carácter retrospectivo, durante los años 1998-2014 en el que se ha incluido a 70 pacientes con diagnóstico de LLA-Ph que recibieron TPH pertenecientes a 10 hospitales españoles. La mediana de edad al diagnóstico de la enfermedad fue de 7,66 años (rango intercuartílico [RIQ] 6,67). Las características clínicas de los pacientes y la enfermedad al diagnóstico se muestran en la tabla 1.
Características de los pacientes al diagnóstico de la LLA-Ph (n=70)
| Centros participantes | 10 |
| Mediana de edad al diagnóstico en años (RIQ) | 7,66 (6,67) |
| Sexo (n/%) | |
| Varones | 41/58,57 |
| Mujeres | 29/41,43 |
| Leucocitos al diagnóstico×109/l (RIQ) | 45 (93,9) |
| Infiltración del SNC (n/%) | |
| Sí | 1/1,43 |
| No | 69/98,57 |
| EMR (qPCR BCR/ABL1) tras inducción (n/%) | |
| Positiva | 37/52,86 |
| Negativa | 33/47,14 |
| Quimioterapia+imatinib (n/%) | |
| Sí | 42/60 |
| No | 28/40 |
EMR: enfermedad mínima residual; qPCR: reacción en cadena de polimerasa cuantitativa; RIQ: rango intercualtílico; SNC: sistema nervioso central.
Los pacientes fueron tratados de acuerdo con los protocolos de la SEHOP y el PETHEMA, y el protocolo Berlín-Frankfurt-Münster (BFM).
El estudio ha sido realizado sin modificar ningún dato de los sistemas de información y sin mantener contacto directo con los pacientes. Los datos han sido codificados asignando un número de caso a cada paciente e incluyendo los datos demográficos estrictamente necesarios para el análisis de los resultados. El estudio ha sido aprobado por el Comité de Ética de Investigación Clínica del Hospital Universitario La Paz.
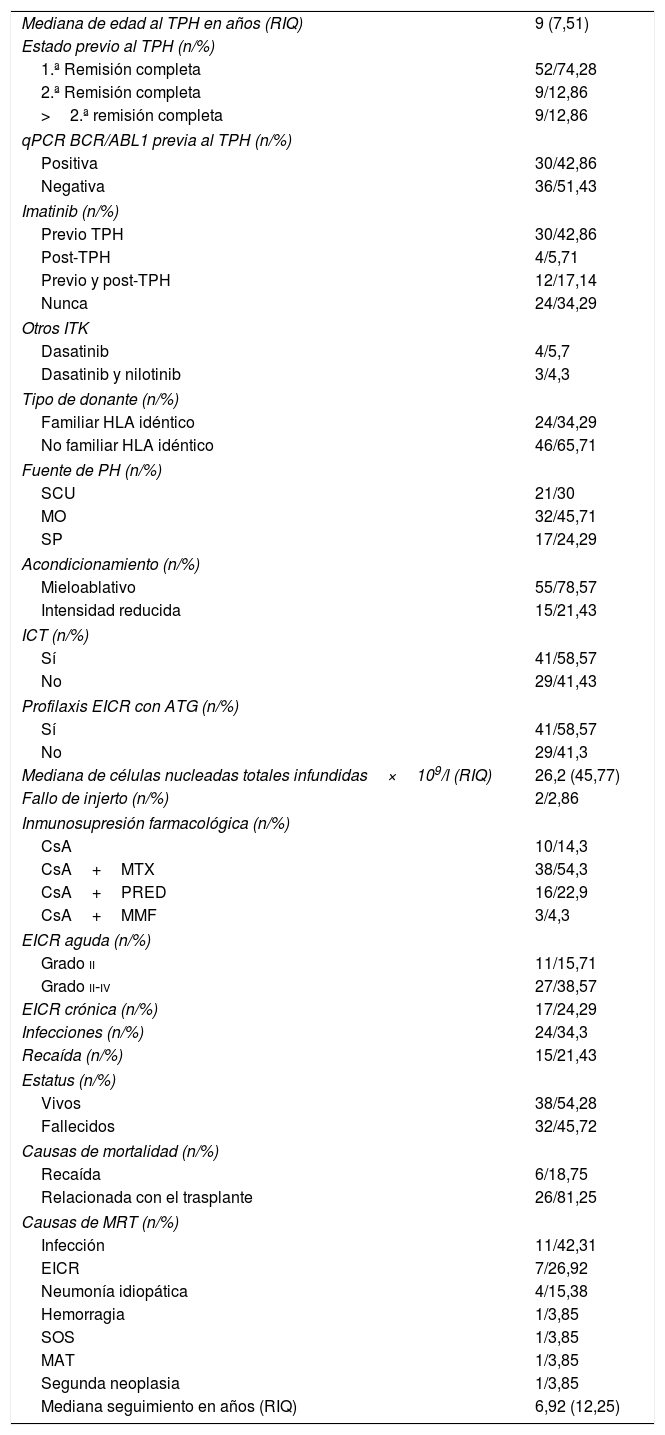
Situación clínica en el momento del TPHSe incluyó a pacientes en primera, segunda o posteriores remisiones completas. La medición de la EMR se realizó mediante el inmunofenotipo o mediante qPCR del gen BCR/ABL1. Un total de 46 pacientes (65,72%) recibieron tratamiento con imatinib: 30 pacientes lo recibieron exclusivamente previo al TPH, 4 de manera posterior y 12 pacientes lo recibieron antes y después del TPH. Otros ITK, además de imatinib, fueron empleados en determinados pacientes (tabla 2).
Características del TPH
| Mediana de edad al TPH en años (RIQ) | 9 (7,51) |
| Estado previo al TPH (n/%) | |
| 1.ª Remisión completa | 52/74,28 |
| 2.ª Remisión completa | 9/12,86 |
| >2.ª remisión completa | 9/12,86 |
| qPCR BCR/ABL1 previa al TPH (n/%) | |
| Positiva | 30/42,86 |
| Negativa | 36/51,43 |
| Imatinib (n/%) | |
| Previo TPH | 30/42,86 |
| Post-TPH | 4/5,71 |
| Previo y post-TPH | 12/17,14 |
| Nunca | 24/34,29 |
| Otros ITK | |
| Dasatinib | 4/5,7 |
| Dasatinib y nilotinib | 3/4,3 |
| Tipo de donante (n/%) | |
| Familiar HLA idéntico | 24/34,29 |
| No familiar HLA idéntico | 46/65,71 |
| Fuente de PH (n/%) | |
| SCU | 21/30 |
| MO | 32/45,71 |
| SP | 17/24,29 |
| Acondicionamiento (n/%) | |
| Mieloablativo | 55/78,57 |
| Intensidad reducida | 15/21,43 |
| ICT (n/%) | |
| Sí | 41/58,57 |
| No | 29/41,43 |
| Profilaxis EICR con ATG (n/%) | |
| Sí | 41/58,57 |
| No | 29/41,3 |
| Mediana de células nucleadas totales infundidas×109/l (RIQ) | 26,2 (45,77) |
| Fallo de injerto (n/%) | 2/2,86 |
| Inmunosupresión farmacológica (n/%) | |
| CsA | 10/14,3 |
| CsA+MTX | 38/54,3 |
| CsA+PRED | 16/22,9 |
| CsA+MMF | 3/4,3 |
| EICR aguda (n/%) | |
| Grado ii | 11/15,71 |
| Grado ii-iv | 27/38,57 |
| EICR crónica (n/%) | 17/24,29 |
| Infecciones (n/%) | 24/34,3 |
| Recaída (n/%) | 15/21,43 |
| Estatus (n/%) | |
| Vivos | 38/54,28 |
| Fallecidos | 32/45,72 |
| Causas de mortalidad (n/%) | |
| Recaída | 6/18,75 |
| Relacionada con el trasplante | 26/81,25 |
| Causas de MRT (n/%) | |
| Infección | 11/42,31 |
| EICR | 7/26,92 |
| Neumonía idiopática | 4/15,38 |
| Hemorragia | 1/3,85 |
| SOS | 1/3,85 |
| MAT | 1/3,85 |
| Segunda neoplasia | 1/3,85 |
| Mediana seguimiento en años (RIQ) | 6,92 (12,25) |
ATG: timoglobulina; CsA: ciclosporina A; EICR: enfermedad de injerto contra receptor; ICT: irradiación corporal total; ITK: inhibidores tirosín-cinasa; MAT: microangiopatía trombótica postrasplante; MMF: micofenolato mofetil; MO: médula ósea; MRT: mortalidad relacionada con el TPH; MTX: metotrexato; PH: progenitores hematopoyéticos; PRED: prednisona; RIQ: rango intercuartílico; SCU: sangre de cordón umbilical; SOS: síndrome de obstrucción sinusoidal; SP: sangre periférica; TPH: trasplante de progenitores hematopoyético.
Los donantes fueron familiares o no emparentados HLA idénticos en todos los casos. Las fuentes de progenitores hematopoyéticos posibles fueron sangre de cordón umbilical, médula ósea o sangre periférica. Se consideró acondicionamiento mieloablativo aquel que incluía irradiación corporal total (ICT) o busulfán a altas dosis, y acondicionamiento de intensidad reducida aquel que combinaba fludarabina con agentes alquilantes. Tanto el tratamiento inmunosupresor postrasplante como su duración se realizaron según criterios de cada centro. Se consideró como variable para el estudio el haber recibido tratamiento con timoglobulina (ATG) como profilaxis frente a la enfermedad de injerto contra receptor (EICR). El resto de las variables relacionadas con el TPH se recogen la tabla 2.
Complicaciones postrasplanteSe contabilizaron los fallos de injerto (tanto primarios como secundarios) en una única categoría. La EICR se ha recogido acorde con los criterios del National Institutes of Health (NIH)23,24. En el estudio se ha considerado EICR aguda leve en grado i y moderada-grave en grados ii-iv. Se recogieron las infecciones que a juicio de cada centro fueron consideradas graves por precisar ingreso hospitalario u otro tipo de intervención.
Recaída, estatus al final del seguimiento y mortalidad relacionada con el trasplanteSe recoge la frecuencia de pacientes que presentan cualquier tipo de recaída (medular, extramedular o combinada) a lo largo del seguimiento, así como el estatus (vivo o fallecido) al finalizar el periodo de reclutamiento. El seguimiento de los pacientes fue llevado a cabo hasta su fallecimiento o en su defecto, hasta noviembre del 2020.
Definimos muerte relacionada con el TPH (mortalidad relacionada con el trasplante [MRT]) como cualquier causa de muerte no relacionada con la recaída leucémica. Las causas de MRT se recogen en la tabla 2.
Análisis estadísticoPara el análisis estadístico de los datos se ha empleado el programa Statistical Package for the Social Sciences (SPSS) versión 26.0 (SPSS Inc., Chicago, IL, EE. UU.). Las variables cualitativas se han reportado empleando frecuencias absolutas y relativas. Las variables cuantitativas empleando como medida de centralización la mediana y el RIQ como medida de dispersión. Para la comparación de variables cualitativas se ha empleado la prueba de la chi al cuadrado. En el análisis de supervivencia, la SG, supervivencia libre de eventos (SLE), probabilidad de recaída (PR) y la MRT se han realizado mediante el método de Kaplan-Meier. Su comparación se ha llevado a cabo mediante el test de Log-Rank, expresándose mediante el porcentaje y el intervalo de confianza del 95%, o su desviación estándar (DE). Las diferentes variables descritas se analizaron para su asociación con la SG, SLE, PR y MRT. Se realizó un estudio univariante de las diferentes variables mediante el método proporcional de Cox, cociente de riesgos instantáneos. Las variables con significación estadística (p<0,1) se incluyeron posteriormente en un análisis multivariante de Cox con el modelo avanzar por pasos. Un valor de p ≤ 0,05ha sido considerado estadísticamente significativo.
ResultadosEl TPH se realizó en 52 (74,28%) pacientes en primera RC, en 9 (12,86%) pacientes en segunda RC y en 9 (12.86%) pacientes en remisiones posteriores. En 36 (51,4%) pacientes la EMR fue negativa antes del TPH.
La fuente de progenitores hematopoyéticos fue médula ósea en 32 (45,7%) pacientes, siendo 13 (18,57%) de ellos donantes familiares idénticos; sangre de cordón umbilical en 21 (30%), uno de ellos donante familiar idéntico, y sangre periférica movilizada en 17 (24,3%) pacientes, siendo 10 (14,28%) de ellos donantes familiares idénticos.
El acondicionamiento fue mieloablativo en 55 (78,57%) de los TPH e incluyó ICT en 41 (58,57%). Un total de 41 (58,57%) pacientes incluyeron ATG en el acondicionamiento. Todos los pacientes recibieron ciclosporina en monoterapia o con algún otro inmunosupresor postrasplante (tabla 2).
Un total de 2 (2,86%) pacientes presentaron fallo de injerto. La complicación más frecuente postrasplante fue la EICR, que se manifestó en 38 pacientes (54,3%) de forma aguda y en 17 pacientes (24,3%) de forma crónica.
Entre los enfermos que presentaron EICR aguda, 11 pacientes (28,9%) presentaron grado leve, mientras que 27 (71,1%), grado moderado-grave. Las complicaciones infecciosas aparecieron en 24 pacientes (34,3%), suponiendo la segunda complicación más frecuente.
Recayeron un total de 15 pacientes (21,43%). Se contabilizó un total de 32 fallecidos (45,72%): 6 (18,75%) fallecimientos por recaída y 26 (81,25%) por causas relacionadas por el trasplante (tabla 2).
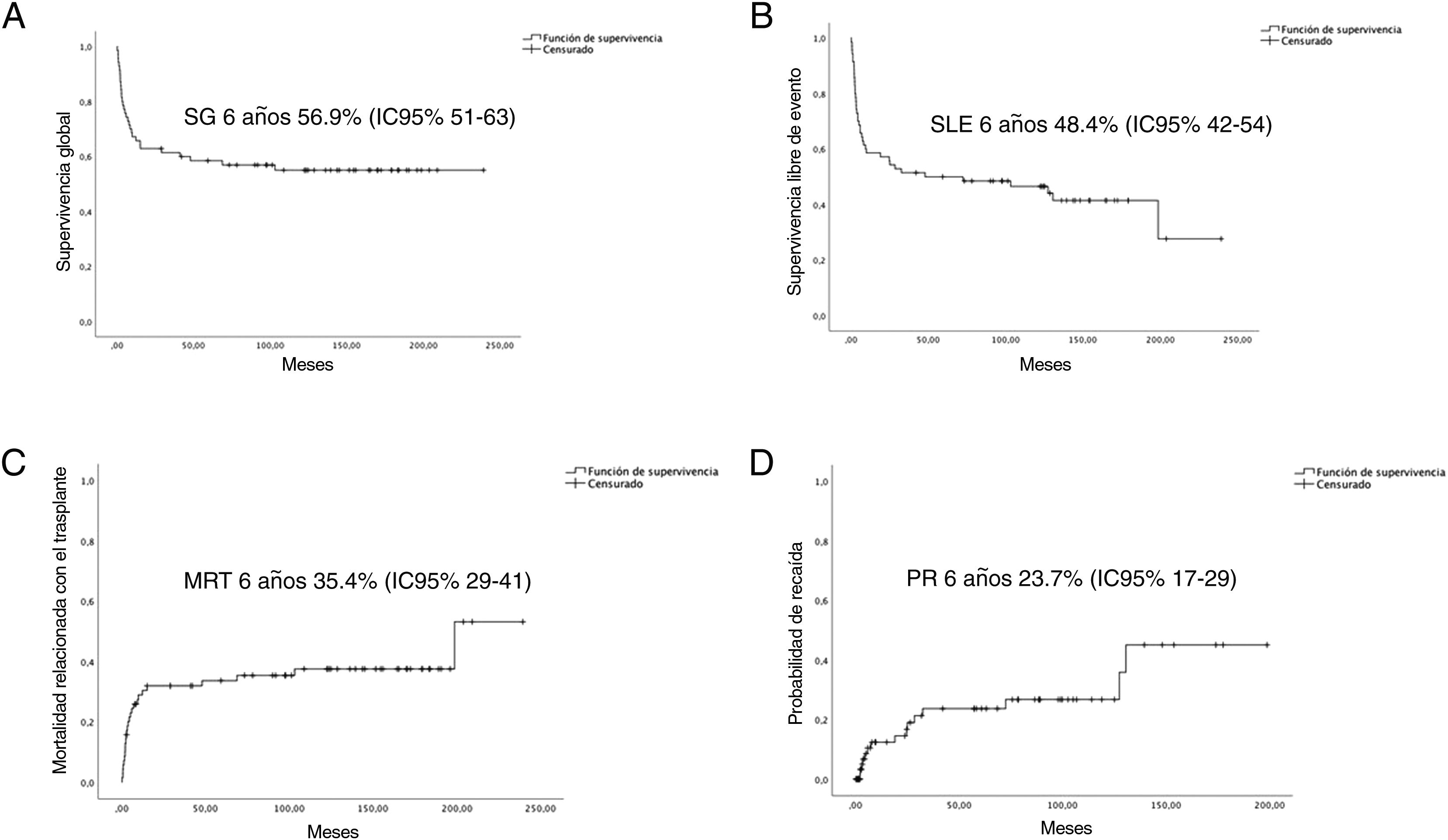
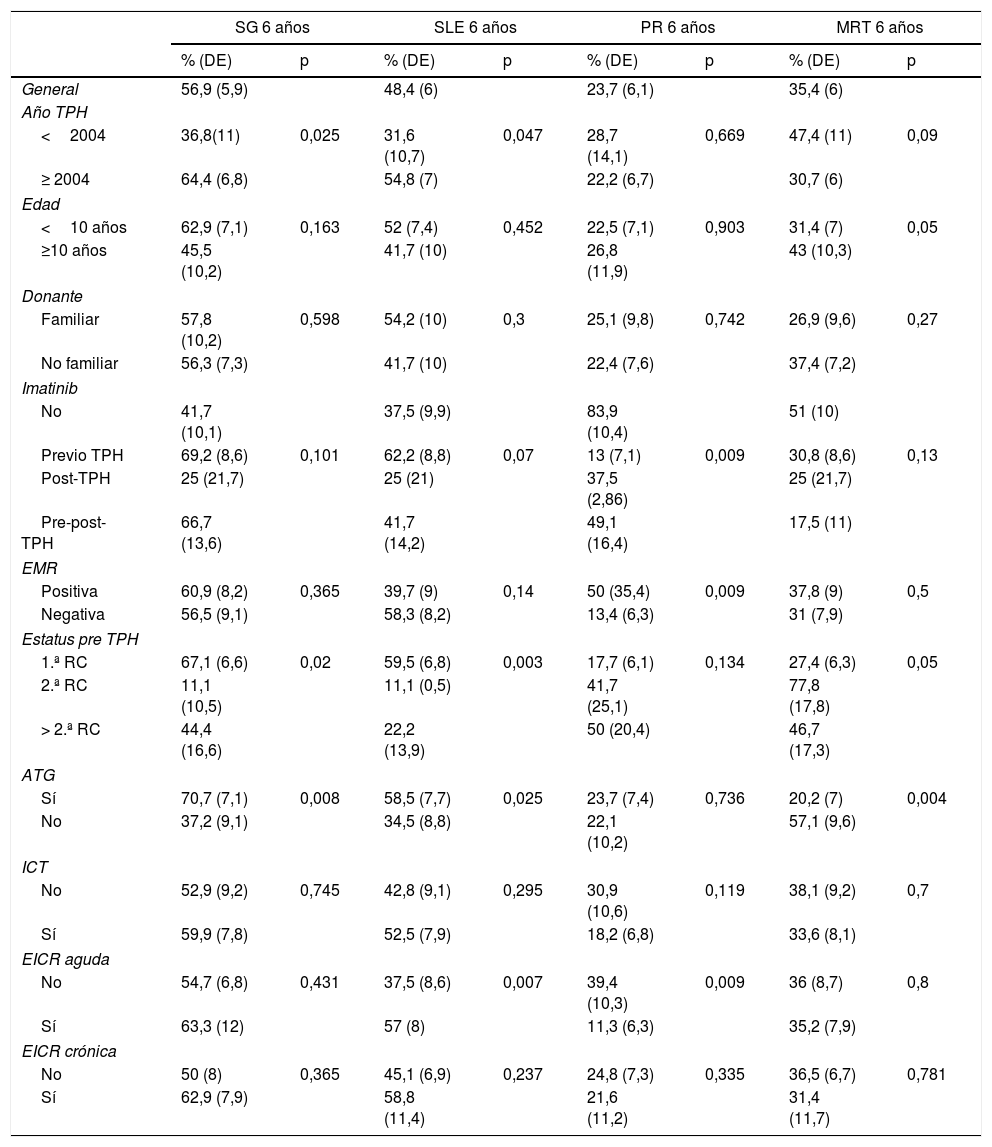
La mediana de seguimiento de la cohorte fue de 6,92 años (RIQ 12,25). La SG y la SLE a los 6 años fue del 56,9% (DE 5,9%) y del 48,4% (DE 6%), respectivamente. La PR y la MRT a los 6 años fueron del 23,7% (DE 6,1%) y del 35,7% (DE 6%), respectivamente (fig. 1).
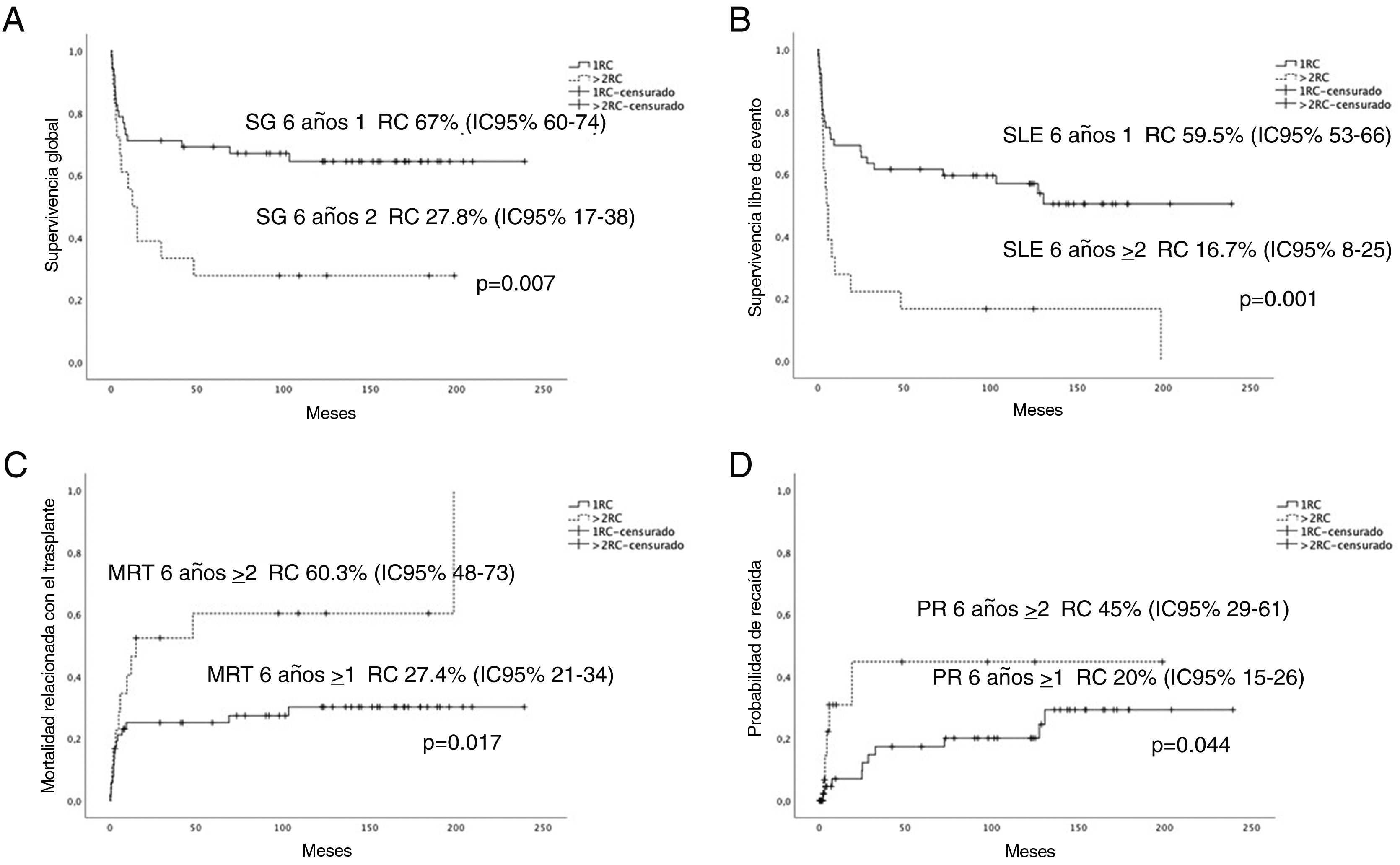
En la figura 2 se representa el aumento estadísticamente significativo de la SG, la SLE, la PR y la MRT de aquellos pacientes trasplantados en primera RC.
A) Curvas de supervivencia global (SG). B) Supervivencia libre de eventos (SLE). C) Mortalidad relacionada con el TPH (MRT). D) Probabilidad de recaída (PR) a los 6 años.
IC del 95%: intervalo de confianza del 95%; 1RC: primera remisión completa; >2RC: segunda o posterior remisión completa.
El empleo de imatinib fue significativamente mayor a partir del año 2004. Además, en el grupo de pacientes que recibieron tratamiento con imatinib de forma exclusiva previo al TPH se obtuvieron los menores porcentajes de recidiva (10%, p=0,006), en comparación con aquellos pacientes que no recibieron imatinib, que lo hicieron conjuntamente pre y post-TPH, o únicamente post-TPH (tabla 3).
Distribución de frecuencias según el momento en el que se administra imatinib
| Variable | No imatinib | Imatinib pre | Imatinib post | Imatinib pre+post | Global | p |
|---|---|---|---|---|---|---|
| (N = 24) | (N = 30) | (N = 4) | (N = 12) | (N = 70) | ||
| Año TPH | ||||||
| <2004 | 17 (70,8%) | 0 (0%) | 2 (50%) | 0 (0%) | 19 (27,1%) | 0,000 |
| >2004 | 7 (29,2%) | 30 (100%) | 2 (50%) | 12 (100%) | 51 (72,9%) | |
| Recidiva | 4 (16,7%) | 3 (10%) | 3 (75%) | 5 (41,7%) | 15 (21,4%) | 0,006 |
| Fallecimiento | 15 (62,5%) | 10 (33,3%) | 3 (75%) | 4 (33,3%) | 32 (45,71%) | 0,08 |
EMR: enfermedad mínima residual; RC: remisión completa; TPH: trasplante de progenitores hematopoyéticos.
La realización del TPH a partir de 2004, la enfermedad en primera RC y la administración de ATG durante el acondicionamiento impactaron favorablemente en la SG. La realización del TPH a partir de 2004, la enfermedad en primera RC, el empleo de ATG en el acondicionamiento y el desarrollo de EICR aguda mejoraron la SLE. Con respecto a la PR, las variables tratamiento con imatinib, la ausencia de EMR, así como el desarrollo de EICR aguda, ejercieron un efecto protector. En el análisis de la MRT, las variables límite de edad de 10 años, enfermedad en primera RC y empleo de ATG como parte del acondicionamiento ejercieron un impacto favorable (tabla 4).
Análisis univariante de la Supervivencia Global (SG), Supervivencia Libre de Eventos (SLE), Probabilidad de Recaída (PR) y Muerte Relacionada con el TPH (MRT)
| SG 6 años | SLE 6 años | PR 6 años | MRT 6 años | |||||
|---|---|---|---|---|---|---|---|---|
| % (DE) | p | % (DE) | p | % (DE) | p | % (DE) | p | |
| General | 56,9 (5,9) | 48,4 (6) | 23,7 (6,1) | 35,4 (6) | ||||
| Año TPH | ||||||||
| <2004 | 36,8(11) | 0,025 | 31,6 (10,7) | 0,047 | 28,7 (14,1) | 0,669 | 47,4 (11) | 0,09 |
| ≥ 2004 | 64,4 (6,8) | 54,8 (7) | 22,2 (6,7) | 30,7 (6) | ||||
| Edad | ||||||||
| <10 años | 62,9 (7,1) | 0,163 | 52 (7,4) | 0,452 | 22,5 (7,1) | 0,903 | 31,4 (7) | 0,05 |
| ≥10 años | 45,5 (10,2) | 41,7 (10) | 26,8 (11,9) | 43 (10,3) | ||||
| Donante | ||||||||
| Familiar | 57,8 (10,2) | 0,598 | 54,2 (10) | 0,3 | 25,1 (9,8) | 0,742 | 26,9 (9,6) | 0,27 |
| No familiar | 56,3 (7,3) | 41,7 (10) | 22,4 (7,6) | 37,4 (7,2) | ||||
| Imatinib | ||||||||
| No | 41,7 (10,1) | 37,5 (9,9) | 83,9 (10,4) | 51 (10) | ||||
| Previo TPH | 69,2 (8,6) | 0,101 | 62,2 (8,8) | 0,07 | 13 (7,1) | 0,009 | 30,8 (8,6) | 0,13 |
| Post-TPH | 25 (21,7) | 25 (21) | 37,5 (2,86) | 25 (21,7) | ||||
| Pre-post-TPH | 66,7 (13,6) | 41,7 (14,2) | 49,1 (16,4) | 17,5 (11) | ||||
| EMR | ||||||||
| Positiva | 60,9 (8,2) | 0,365 | 39,7 (9) | 0,14 | 50 (35,4) | 0,009 | 37,8 (9) | 0,5 |
| Negativa | 56,5 (9,1) | 58,3 (8,2) | 13,4 (6,3) | 31 (7,9) | ||||
| Estatus pre TPH | ||||||||
| 1.ª RC | 67,1 (6,6) | 0,02 | 59,5 (6,8) | 0,003 | 17,7 (6,1) | 0,134 | 27,4 (6,3) | 0,05 |
| 2.ª RC | 11,1 (10,5) | 11,1 (0,5) | 41,7 (25,1) | 77,8 (17,8) | ||||
| > 2.ª RC | 44,4 (16,6) | 22,2 (13,9) | 50 (20,4) | 46,7 (17,3) | ||||
| ATG | ||||||||
| Sí | 70,7 (7,1) | 0,008 | 58,5 (7,7) | 0,025 | 23,7 (7,4) | 0,736 | 20,2 (7) | 0,004 |
| No | 37,2 (9,1) | 34,5 (8,8) | 22,1 (10,2) | 57,1 (9,6) | ||||
| ICT | ||||||||
| No | 52,9 (9,2) | 0,745 | 42,8 (9,1) | 0,295 | 30,9 (10,6) | 0,119 | 38,1 (9,2) | 0,7 |
| Sí | 59,9 (7,8) | 52,5 (7,9) | 18,2 (6,8) | 33,6 (8,1) | ||||
| EICR aguda | ||||||||
| No | 54,7 (6,8) | 0,431 | 37,5 (8,6) | 0,007 | 39,4 (10,3) | 0,009 | 36 (8,7) | 0,8 |
| Sí | 63,3 (12) | 57 (8) | 11,3 (6,3) | 35,2 (7,9) | ||||
| EICR crónica | ||||||||
| No | 50 (8) | 0,365 | 45,1 (6,9) | 0,237 | 24,8 (7,3) | 0,335 | 36,5 (6,7) | 0,781 |
| Sí | 62,9 (7,9) | 58,8 (11,4) | 21,6 (11,2) | 31,4 (11,7) | ||||
ATG: timoglobulina; EICR: enfermedad de injerto contra receptor; EMR: enfermedad mínima residual; RC: remisión completa; TPH: trasplante de progenitores hematopoyéticos.
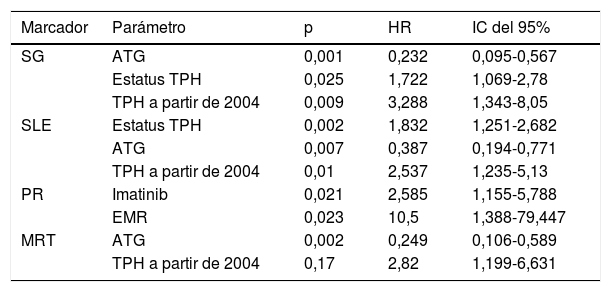
El empleo de ATG en el acondicionamiento, la realización del TPH en primera RC, además de la realización del mismo a partir del año 2004, ejercieron un efecto favorable en la SG. La realización del TPH en primera RC, el empleo de ATG y la realización del mismo a partir del año 2004 aumentaron la SLE. La administración de imatinib junto a la EMR indetectable previa al TPH disminuyeron la PR. Por último, el empleo de ATG en el acondicionamiento, así como la realización del TPH a partir del año 2004, disminuyeron la MRT (tabla 5).
Análisis multivariante de supervivencia global (SG), supervivencia libre de eventos (SLE), probabilidad de recaída (PR) y mortalidad relacionada con el trasplante (MRT)
| Marcador | Parámetro | p | HR | IC del 95% |
|---|---|---|---|---|
| SG | ATG | 0,001 | 0,232 | 0,095-0,567 |
| Estatus TPH | 0,025 | 1,722 | 1,069-2,78 | |
| TPH a partir de 2004 | 0,009 | 3,288 | 1,343-8,05 | |
| SLE | Estatus TPH | 0,002 | 1,832 | 1,251-2,682 |
| ATG | 0,007 | 0,387 | 0,194-0,771 | |
| TPH a partir de 2004 | 0,01 | 2,537 | 1,235-5,13 | |
| PR | Imatinib | 0,021 | 2,585 | 1,155-5,788 |
| EMR | 0,023 | 10,5 | 1,388-79,447 | |
| MRT | ATG | 0,002 | 0,249 | 0,106-0,589 |
| TPH a partir de 2004 | 0,17 | 2,82 | 1,199-6,631 |
ATG: timoglobulina; EMR: enfermedad mínima residual; HR: hazar ratio; IC del 95%: interval de confianza del 95%; TPH: trasplante de progenitores hematopoyéticos.
Este trabajo recoge la experiencia nacional del TPH pediátrico en la LLA-Ph, una enfermedad poco frecuente y de mal pronóstico, en un periodo prolongado de 22 años.
Los datos presentados reflejan un papel relevante del uso del imatinib previo al TPH, impactando de manera notable en la PR. Este hecho va en consonancia con lo reportado en estudios previos9,25,26. Sin embargo, cabe mencionar que algunos autores cuestionan el papel del imatinib en el aumento de las tasas de superviencia27,28.
De manera general, se refleja la experimentación de una mejora progresiva en los resultados del TPH. Este hecho se manifiesta significativamente en las mayores SG y SLE, así como en la menor MRT observadas en los procedimientos realizados a partir del año 2004. Tanto el aumento de la experiencia acumulada, como la optimización respecto a la selección de donantes, junto a las estrategias de acondicionamiento, los avances en la terapia inmunosupresora y las adecuadas profilaxis podrían explicar este punto de inflexión29.
En la misma línea resulta importante el estado de la enfermedad previa al TPH. Aquellos pacientes tratados mediante TPH en primera RC presentan mejores SG y SLE, con menor MRT. La ausencia de EMR, por otro lado, se relaciona con una menor PR. En el análisis univariante, la edad del paciente en el momento del trasplante parece tratarse de un factor importante, hecho que se constata debido a que son los pacientes menores de 10 años son los que menor tasa de MRT presentan26.
El aumento de supervivencia en pacientes tratados con quimioterapia e ITK plantea la posibilidad de que no todos los pacientes con LLA-Ph sean tratados mediante TPH en primera RC. El estudio COG-AALL0031 mostró que los pacientes tratados con quimioterapia asociada a imatinib que no habían recibido TPH presentaban una SLE a los 5 años del 70 (12%), sin mostrar diferencias significativas en comparación con los pacientes trasplantados de donante familiar, 65 (11%), o no emparentado, 59 (15%)10. En el estudio EsPhALL2010, los pacientes fueron tratados con imatinib y quimioterapia. El TPH se realizó en pacientes de alto riesgo y en pacientes de bajo riesgo que dispusieran de donante HLA idéntico. La SLE a los 5 años en pacientes de bajo riesgo fue de 62,7% (IC95% 52-71,6) y del 46,3% (IC 95% 32,3-59,2) en pacientes de riesgo alto. Se encontró un aumento significativo de SLE en pacientes de bajo riesgo tratados con quimioterapia e imatinib sobre los que además recibieron TPH en primera RC9,26.
De este modo, la opción de TPH debería contemplarse en aquellos pacientes que no consigan negativización de EMR al final de la inducción y no de manera rutinaria, debido a los buenos resultados obtenidos con el tratamiento quimioterápico junto a los ITK en pacientes de bajo riesgo. En el presente estudio, el empleo de imatinib impactó de manera significativa en la mejor evolución de los TPH a partir del año 2004, disminuyendo las cifras de recidiva. Sin embargo, existen algunos resultados controvertidos en cuanto a los pacientes tratados con ITK25,26,30.
En la serie se puede observar un número importante de pacientes que desarrollan EICR, tanto en su forma aguda como crónica, pero sin llegar a observarse un impacto negativo sobre la supervivencia. Esta observación ya ha sido descrita previamente27. Más aún, es llamativo cómo los pacientes que desarrollan EICR aguda presentan mejor SLE y menor PR en el análisis univariante. Esto podría explicarse por el «graft versus leukemia effect» asociado a la EICR. Otros estudios han relacionado el desarrollo de EICR crónica con una menor incidencia de recaída, actuando de este modo como factor protector31.
El tratamiento con ATG como parte del acondicionamiento impactó favorablemente en la SG y la SLE. Al disminuir la MRT, actúa a modo de factor protector sobre la aparición de formas graves de EICR, tal como otros estudios han reportado32-34.
El empleo de la ICT en la infancia es cuestionado en la actualidad debido a sus importantes efectos secundarios tardíos35. Un estudio reciente36 no relaciona la ICT con variaciones en cuanto a supervivencia y PR en niños que reciben ICT previa al TPH, haciéndolo en cambio con la aparición de EICR. En este estudio retrospectivo, nuestros hallazgos son similares.
Como se citó previamente, en nuestro trabajo la EMR negativa impacta fundamentalmente disminuyendo la PR. Sin embargo, los datos aportados en nuestro estudio no logran discernir cuál de las diferentes técnicas empleadas para su cuantificación (citométricas o moleculares) son las más apropiadas para ello36.
En relación con trabajos previos, no se han observado diferencias entre los pacientes que recibieron el TPH de donante idéntico familiar y aquellos que lo hicieron de un donante idéntico no familiar8,37. Este dato es de gran relevancia, ya que la mayoría de los pacientes no dispondrá de donante familiar idéntico.
Es por lo anteriormente expuesto por lo que consideramos importante comunicar los resultados de nuestro trabajo, más aún dado el papel tan relevante que el tratamiento con células CAR-T en leucemias agudas linfoblásticas de precursores B presenta en la actualidad. Sin embargo, es necesario recordar que las indicaciones para terapia celular CAR-T en LLA-Ph quedan reservadas para casos de intolerancia o refractariedad a 2ITK, o en casos en que estos fármacos se encuentren contraindicados. A pesar de ello, se han reportado resultados favorables con el empleo de estas terapias38-40.
El estudio presenta algunas limitaciones, fundamentalmente derivadas de ser un estudio retrospectivo de carácter multicéntrico y en un intervalo prolongado.
ConclusionesExiste un efecto beneficioso del imatinib sobre el estado de la enfermedad previo al trasplante, favoreciendo tanto la RC como la negativización de la EMR, y disminuyendo de este modo la PR.
Los pacientes en primera RC que han recibido ATG como parte del acondicionamiento, presentan mayores SG y SLE, por lo que la opción terapéutica del TPH debería ser considerada en estas situaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nuestro agradecimiento a los Fondos FEDER (FIS) PI18/01301, así como al Instituto de Salud Carlos III y a la Fundación Cris contra el Cáncer (http://criscancer.org), por su apoyo.