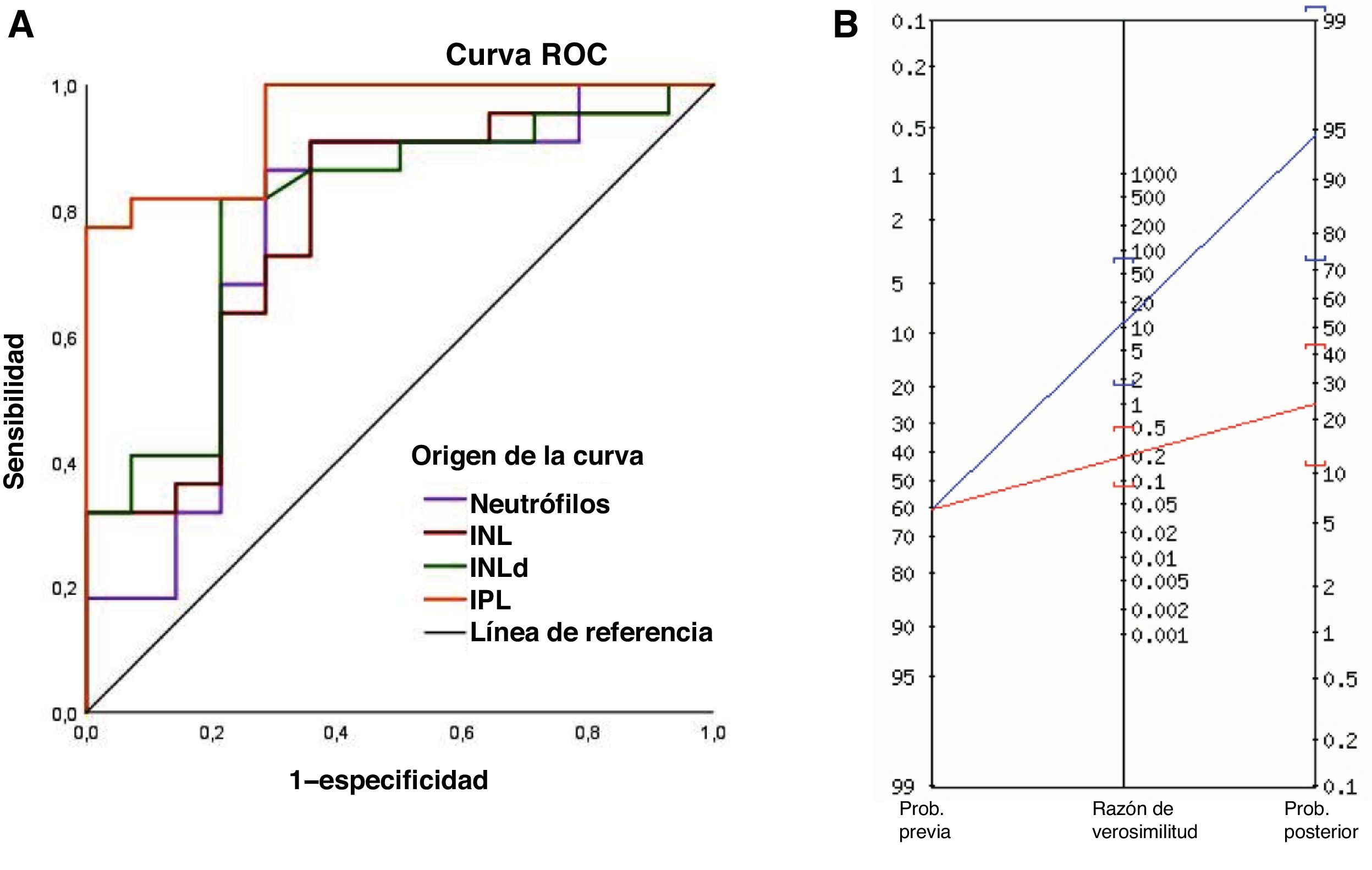
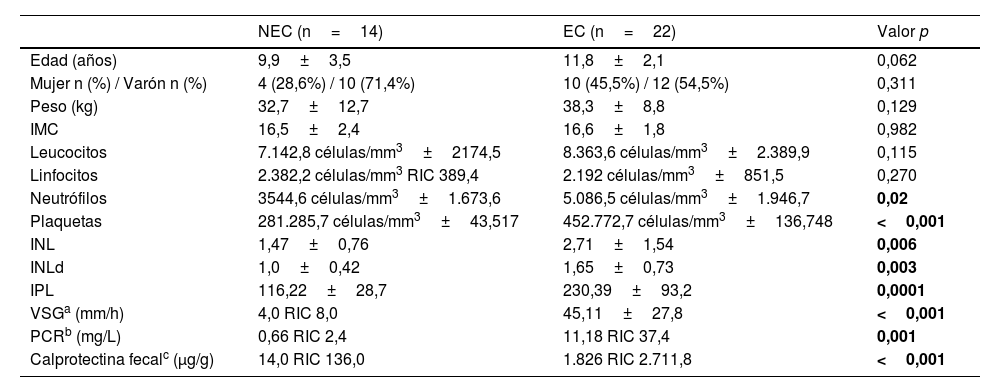
La enfermedad de Crohn (EC) es una enfermedad inflamatoria intestinal (EII) con una incidencia creciente de 0,1-13,9/100.000 en la población pediátrica1. Su patogénesis es multifactorial y su diagnóstico en niños plantea un reto debido a la duración usualmente prolongada de los síntomas antes de su confirmación. La endoscopia con biopsias es el método de elección para su diagnóstico, aunque los biomarcadores serológicos no invasivos también pueden desempeñar un papel esencial. Los índices celulares derivados de hemogramas rutinarios han demostrado su utilidad en la EII; no obstante, este es el primer estudio que compara la utilidad diagnóstica del índice neutrófilo-linfocito derivado (INLd), el índice plaqueta-linfocito (IPL) y el índice neutrófilo-linfocito (INL) en la EC pediátrica2. Se llevó a cabo un estudio diagnóstico retrospectivo (IRB No. 3318-0000206) de los pacientes de 0 a 15 años sometidos a endoscopia y biopsia por sospecha de EII en un hospital pediátrico entre 2015 y 2022. Los criterios de exclusión fueron el diagnóstico de colitis ulcerosa, los procedimientos endoscópicos terapéuticos y la falta de muestras de biopsia o hemogramas. Se analizaron variables demográficas y analíticas como la proteína C reactiva (PCR), la calprotectina fecal (CF) y el hemograma. Las muestras de sangre se procesaron con un analizador hematológico automatizado (DxH 900, Beckman Coulter) y el INL y el IPL se calcularon dividiendo el número absoluto de neutrófilos o de plaquetas, respectivamente, entre el de linfocitos. El INLd se calculó como el cociente entre el número de neutrófilos y la diferencia entre el número de leucocitos y el de neutrófilos. Los análisis estadísticos se realizaron con el paquete IBM SPSS Statistics 25.0. La precisión diagnóstica se evaluó por medio de curvas ROC y el índice de Youden. Se calculó la sensibilidad, especificidad y los valores predictivos estableciendo la significación estadística como un valor de p<0,05. Entre 2015 y 2022 se llevaron a cabo 502 endoscopias pediátricas. Tras las exclusiones pertinentes, se analizó a 36 pacientes: 22 con enfermedad de Crohn (grupo EC) y 14 con biopsia normal (grupo no EC [NEC]). El grupo NEC comprendía aquellos pacientes sometidos a endoscopia y colonoscopia diagnóstica por sospecha de EII con hallazgos histopatológicos normales o no inflamatorios. La edad media fue de 9,9 años en el grupo NEC en comparación con 11,8 años en el grupo EC (p=0,062), con predominancia de pacientes varones en ambos grupos (71% vs. 54; p=0,311). El número de neutrófilos, INL, INLd e IPL fueron significativamente mayores en los pacientes con EC (p<0,05). El número de leucocitos fue superior en el grupo EC (p=0,115), mientras que el de linfocitos fue más elevado en el grupo NEC (p=0,270). La sensibilidad, especificidad y valor predictivo positivo (VPP) para diagnosticar la EC fueron del 86%, 71% y 82%, respectivamente, para el número absoluto de neutrófilos, 91%, 64% y 80% para el INL, 81%, 78% y 85% para el INLd y 81%, 92% y 94% para el IPL (tabla 1). El marcador de mayor precisión diagnóstica fue el IPL, con un punto de corte de 155,3, un área bajo la curva (AUC) de 0,945 y un odds ratio de 58,5 (p=0,0005) (fig. 1A). Superado este umbral del IPL, la probabilidad de EC aumentaba del 61 al 95% (fig. 1B).
Variables demográficas y analíticas de la población estudiada. Rendimiento diagnóstico de los marcadores inflamatorios analizados
| NEC (n=14) | EC (n=22) | Valor p | |
|---|---|---|---|
| Edad (años) | 9,9±3,5 | 11,8±2,1 | 0,062 |
| Mujer n (%) / Varón n (%) | 4 (28,6%) / 10 (71,4%) | 10 (45,5%) / 12 (54,5%) | 0,311 |
| Peso (kg) | 32,7±12,7 | 38,3±8,8 | 0,129 |
| IMC | 16,5±2,4 | 16,6±1,8 | 0,982 |
| Leucocitos | 7.142,8 células/mm3±2174,5 | 8.363,6 células/mm3±2.389,9 | 0,115 |
| Linfocitos | 2.382,2 células/mm3 RIC 389,4 | 2.192 células/mm3±851,5 | 0,270 |
| Neutrófilos | 3544,6 células/mm3±1.673,6 | 5.086,5 células/mm3±1.946,7 | 0,02 |
| Plaquetas | 281.285,7 células/mm3±43,517 | 452.772,7 células/mm3±136,748 | <0,001 |
| INL | 1,47±0,76 | 2,71±1,54 | 0,006 |
| INLd | 1,0±0,42 | 1,65±0,73 | 0,003 |
| IPL | 116,22±28,7 | 230,39±93,2 | 0,0001 |
| VSGa (mm/h) | 4,0 RIC 8,0 | 45,11±27,8 | <0,001 |
| PCRb (mg/L) | 0,66 RIC 2,4 | 11,18 RIC 37,4 | 0,001 |
| Calprotectina fecalc (μg/g) | 14,0 RIC 136,0 | 1.826 RIC 2.711,8 | <0,001 |
| Neutrófilos | INL | INLd | IPL | |
|---|---|---|---|---|
| AUC ROC (IC 95%) | 0,763 (0,587-0,939) | 0,773 (0,610-0,935) | 0,794 (0,639-0,949) | 0,945 (0,877-1,0) |
| Punto de corte | 3.362,6 células/mm3 | 1,39 | 1,13 | 155,3 |
| Sensibilidad (IC 95%) | 86,3% (65-97) | 90,9% (70,8-98,8) | 81,8% (59,7-94,8) | 81,8% (59,7-94,8) |
| Especificidad (IC 95%) | 71,4% (41,9-91,6) | 64,2% (35,1-87,2) | 78,5% (49,2-95,3) | 92,8% (66,1-99,8) |
| VPP (IC 95%) | 82,6% (67,1-91,7) | 80% (66,1-89,1) | 85,7% (63,8-94,3) | 94,7% (72,9-99,1) |
| VPN (IC 95%) | 76,9% (52,5-90,9) | 81,8% (53,1-94,6) | 73,3% (52,1-87,4) | 76,4% (56,9-88,8) |
| Probabilidad pre-test | 61% | |||
| PTP(+) | 83% (67-92) | 80% (66-89) | 86% (68-95) | 95% (73-99) |
| PTP(−) | 23% (9-48) | 18% (6-47) | 27% (12-48) | 24% (11-43) |
| OR (IC 95%) | 15,8 (2,94-85,0) | 18 (2,92-110,9) | 16,5 (3,09-88,0) | 58,5 (5,83-586,1) |
| Valor p | 0,0001 | 0,0001 | 0,0001 | 0,0005 |
AUC ROC: área bajo la curva ROC; EC: enfermedad de Crohn; IC: intervalo de confianza; IMC: índice de masa corporal; INL: índice neutrófilo-linfocito; INLd:, índice neutrófilo-linfocito derivado; IPL: índice plaqueta-linfocito; NEC: no EC (biopsia normal); OR: odds ratio; PCR: proteína C reactiva; PTP(−): probabilidad postest de resultado negativo; PTP(+): probabilidad postest de resultado positivo; RIC: rango intercuartílico; VPN: valor predictivo negativo; VPP: valor predictivo positivo; VSG: velocidad de sedimentación globular.
Los valores en negrita representan significancia estadística y/o clínica.
(A) Curva ROC de los neutrófilos, índice neutrófilo-linfocito (INL), índice neutrófilo-linfocito derivado (INLd) e índice plaqueta-linfocito (IPL) en el diagnóstico de la EC. (B) El nomograma de Fagan muestra que cuando los pacientes tenían un IPL por encima del punto de corte (>155,3), la probabilidad de que tuvieran EC aumentaba del 61% al 95% (línea azul). Por el contrario, cuando el IPL no alcanzaba el umbral, la probabilidad descendía del 61% al 24% (línea roja). Así, 1 de cada 1,1 pacientes con un resultado positivo en el IPL (>155,3) fue finalmente diagnosticado de EC.
El punto de corte del INL descrito previamente para diferenciar a los pacientes con EC de controles sanos oscila entre 2,13 y 2,853. En nuestro estudio, el punto de corte fue inferior (1,39), lo que puede explicarse por el mayor número de linfocitos en niños en comparación con adultos. En un estudio realizado en más de 200 sujetos, el INL dio lugar a un AUC de 0,74 con una sensibilidad del 68%, una especificidad del 76% y un valor predictivo negativo (VPN) del 70% para diagnosticar la EC4. El rendimiento del INL fue superior en nuestro estudio (AUC: 0,77; sensibilidad: 91%; especificidad: 64%; VPN, 82%). De manera similar, el IPL fue el parámetro diagnóstico más preciso en nuestro estudio, con un AUC de 0,945, un punto de corte de 155,3, una sensibilidad del 81%, una especificidad del 92% y un VPP del 94%. Estos resultados fueron superiores a los reportados por Feng et al., que encontraron una correlación positiva entre el IPL y el valor de PCR en pacientes con EC (r=0,29; p<0,01), con un AUC de 0,860, un punto de corte de 132,8, una sensibilidad del 76% y una especificidad del 84%. En su estudio, como en el nuestro, el IPL fue más preciso que el INL4. Los valores de calprotectina se han correlacionado con el grado de actividad de la enfermedad tanto en la EC como en la colitis ulcerosa5. En nuestra cohorte, los valores medianos de calprotectina fueron significativamente mayores en pacientes con EC (1826μg/g) en comparación con el grupo NEC (14μg/g); no obstante, no se pudo determinar su utilidad diagnóstica debido a una falta de datos significativa, lo que supone una limitación metodológica. En líneas similares, la falta de valores de PCR y de la velocidad de sedimentación globular es un obstáculo que restringe la comparabilidad de estos biomarcadores noveles con los marcadores convencionales utilizados de manera rutinaria en la práctica clínica. Asimismo, aunque sería interesante explorar los índices celulares en controles sanos, el análisis de una población posiblemente enferma supone un escenario más real y tiene la ventaja de que los resultados podrían llegar a aplicarse en la práctica clínica en la evaluación inicial de pacientes con sospecha de EII. Nuestro estudio subraya el potencial del IPL como herramienta de cribado preliminar con objeto de priorizar los procedimientos diagnósticos invasivos en pacientes con valores superiores a 155,3 y considerar pruebas menos invasivas en la evaluación inicial de pacientes con IPL inferiores o iguales a 155,3. La comparación con biomarcadores como la calprotectina fecal reforzaría la evaluación de la utilidad diagnóstica de los índices celulares. La variabilidad en la localización de la enfermedad, la duración de los síntomas y el tratamiento dificultan el establecimiento de puntos de corte universales. Por lo tanto, sería conveniente que estudios futuros explorasen el uso de paneles de biomarcadores para mejorar la precisión diagnóstica y el papel de los índices celulares para diferenciar la EC y la colitis ulcerosa, monitorizar el grado de actividad de la enfermedad y guiar el tratamiento. Se necesitan estudios prospectivos de validación en muestras de mayor tamaño para confirmar la utilidad de los índices celulares como marcadores no invasivos para vigilar la progresión de la enfermedad y optimizar el tratamiento de la EC pediátrica.