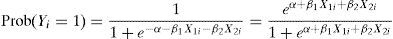La ventilación con alta frecuencia (VAFO) puede reducir el gasto cardíaco. Analizamos su repercusión hemodinámica e identificamos factores pronósticos de mortalidad.
Pacientes y métodosEntre enero del 2003 y diciembre del 2010, incluimos a 48 niños con fallo respiratorio sometidos a VAFO. El diseño del estudio fue prospectivo, observacional y descriptivo. Los criterios de inclusión se basaron en la existencia de hipoxemia. Las variables estudiadas fueron: presiones arterial y venosa central, pH arterial, saturación venosa e índice de extracción de oxígeno; haciéndose determinaciones previas a la VAFO, durante y antes de pasar a convencional. Se identificaron factores pronósticos mediante un análisis bivariante y determinamos un modelo predictivo de mortalidad.
ResultadosLa edad fue de 21 (4-72) meses. Al ingreso, las escalas de PRISM y Murray fueron de 33 y de 2,8, la PaO2/FiO2 de 61 y el índice de oxigenación de 35. Tras la VAFO, se obtuvo un aumento del pH (p>0,001), de la presión arterial media (p<0,001) y de la saturación venosa, y un descenso de la presión venosa y de la extracción de O2 (p < 0,001). Los factores pronósticos de mortalidad a las 24 h de iniciar la VAFO fueron: FiO2, PaO2/FiO2, índice de oxigenación, shunt, pH, presiones venosa central y arterial media, saturación venosa y extracción de O2. El modelo creado a las 12 h, compuesto por la SvcO2 y el ETO2, fue capaz de pronosticar la muerte con una probabilidad del 92,3%.
ConclusionesLa VAFO mejora la hemodinámica. El modelo a las 12 h es el que mejor nos predice la muerte.
The high frequency oscillatory ventilation (HFOV) may reduce cardiac output. The haemodynamics were analysed and predictors of mortality identified.
Patients and methodsA total of 48 children with respiratory failure undergoing HFOV between January 2003 and December 2010 were included. The study design was prospective, observational, and descriptive. Inclusion criteria were based on the existence of hypoxemia. The variables studied were: arterial and central venous pressure, arterial pH, venous saturation and oxygen extraction ratio, with determinations performed prior to HFOV, during, and before turning to conventional ventilation. Prognostic factors were identified by bivariate analysis and a predictive model of mortality was developed.
ResultsThe mean age was 21 [4 to 72] months. On admission, PRISM scales and Murray were 33 and 2.8, PaO2/FiO2 of 61 and oxygenation index of 35. After HFOV an increase in pH (P<.001), mean arterial pressure (P<.001) and venous saturation, and decreased venous pressure and O2 extraction (P<.001), was obtained. The prognostic factors of mortality at 24hours after starting HFOV were: FiO2, PaO2/FiO2, oxygenation index, shunt, pH, central venous pressure and mean arterial pressure, venous saturation, and O2 extraction. The model developed at 12hours, consisting of EtO2 and SvcO2 was able to predict death with a probability of 92.3%.
ConclusionsHFOV improves haemodynamics. The model at 12hours is the best predictor of death.
El fallo respiratorio agudo (FRA) es una de las enfermedades de mayor gravedad en los pacientes ingresados en las unidades de cuidados intensivos pediátricos (UCIP). La mortalidad continua siendo elevada; actualmente es del 30%. El descenso producido en los últimos años ha estado determinado por la implantación de técnicas de ventilación con criterios de protección pulmonar1,2 y por la utilización de la ventilación con alta frecuencia oscilatoria (VAFO).
En nuestro hospital, se implantó el uso de la VAFO en el año 2003 y la experiencia ha sido positiva3. Su utilidad ha sido demostrada recientemente en un metaanálisis que incluye 8 ensayos clínicos con 419 pacientes entre niños y adultos, donde se ha constatado que reduce significativamente la mortalidad4.
El principal inconveniente de la VAFO es que puede alterar el estado hemodinámico por el uso de presiones medias elevadas en la vía aérea (Pwa), aunque revisando la literatura se han encontrado opiniones contradictorias. Los objetivos de este estudio han sido analizar los cambios hemodinámicos producidos al hacer la transición de una ventilación mecánica convencional (VMC) a una VAFO e identificar factores pronósticos de mortalidad.
Pacientes y métodosDiseñoEl diseño del estudio fue de carácter prospectivo, observacional, y descriptivo de niños con FRA sometidos a VAFO que no respondieron a la VMC. Fue aprobado por el comité de ética e investigación del hospital, obteniéndose el consentimiento informado de los padres.
Población, ámbito y periodo de estudioEn el periodo comprendido entre enero del 2003 y diciembre del 2010, se incluyó a 48 niños ingresados en la UCIP de un hospital de tercer nivel. En 3 se utilizó la técnica en 2 periodos independientes en el mismo ingreso, contabilizándose para el análisis 51 cursos de VAFO. Las causas del FRA fueron muy diversas, incluyéndose en la serie 19 pacientes inmunodeprimidos por enfermedades oncológicas o hematológicas. Los criterios de inclusión para el FRA fueron los aceptados internacionalmente5. Todos los niños precisaron inicialmente VMC durante un tiempo variable, pero debido a una falta de respuesta, puesta de manifiesto por una Pwa de 26 cmH2O, una presión pico inspiratoria de 41 cmH2O, una presión al final de la espiración (PEEP) de 10 cmH2O, y una fracción inspiratoria de oxígeno (FiO2) del 100%, se decidió pasar a VAFO. Para reducir el consumo de oxígeno, todos los pacientes estaban sedados, analgesiados y paralizados.
Valoración de la gravedadAl ingreso, se realizaron las escalas de PRISM (Pediatric Risk of Mortality)6, como indicador general de mortalidad; y de Murray7, para valorar el grado de afectación pulmonar.
Variables analizadas- 1.
Parámetros de VMC: FiO2, Pwa, presiones pico inspiratorias (Ppi) y PEEP.
- 2.
Parámetros de VAFO: FiO2 y Pwa.
- 3.
Variables hemodinámicas de presión: la medición de la presión arterial media (PAM) se hizo mediante un catéter situado en la arteria radial o en la arteria cubital; y la presión venosa central (PVC), a través de un catéter colocado en la vena cava superior. La monitorización fue continua y se realizó mediante un sistema Modular Agilent.
- 4.
Variables gasométricas: con la realización de gasometrías arteriales y venosas mediante el analizador Radiometer ABL 725, se determinaron los parámetros e índices fisiológicos expuestos a continuación:
- –
Variables de oxigenación: presión parcial arterial de oxígeno (paO2), saturación arterial de oxígeno (SaO2), cociente paO2/FiO2 e índice de oxigenación (IO).
- –
Variables de ventilación: presión parcial arterial de dióxido de carbono y shunt intrapulmonar (Qp/Qs).
- –
Variables hemodinámicas: saturación venosa central de oxígeno (SvcO2) e índice de extracción tisular de O2 (ETO2).
- –
El IO relaciona la paO2 con la Pwa y la FiO2, y se calcula según la fórmula: IO=FiO2×Pwa/paO2, siendo su valor normal ≤ 5. Valora la oxigenación en relación con el grado de asistencia respiratoria.
El Qp/Qs se determina mediante la fórmula: Qp/Qs=1 – SaO2/1 – SvcO2, considerándose valores patológicos los ≥ 10%8. Refleja la fracción del gasto cardiaco que ingresa en el hemicorazón izquierdo sin realizar un intercambio gaseoso.
La SvcO2 muestra el valor de oxígeno residual que llega al corazón tras la extracción por los tejidos, su valor normal es del 70%. Está determinada por el equilibrio entre el aporte y el consumo de oxígeno tisular, siendo su disminución una manifestación de un aumento en la extracción de oxígeno por los tejidos, determinado probablemente por un descenso del gasto cardiaco.
El ETO2 calcula el porcentaje de oxígeno extraído por los tejidos, pues relaciona el aporte arterial (SaO2) con el consumo (SaO2–SvcO2). Este parámetro, junto con la SvcO2 y el lactato, son los que mejor estiman el gasto cardiaco. El ETO2 se calcula mediante la fórmula: ETO2=(SaO2–SvcO2)/SaO29. Los valores normales oscilan entre 0,24 y 0,2810, considerándose que una cifra ≥ 0,5 posee una alta capacidad predictiva de muerte11.
Determinación secuencial de las variables- 1.
En VMC y antes de VAFO (pre-VAFO).
- 2.
Tras VAFO (post VAFO): a la hora, a las 3h, a las 12h, a las 24h, a las 48h y a las 72h.
- 3.
En VAFO y antes de VMC (pre-VMC) por mejoría clínica.
Con los resultados obtenidos, se realizó un análisis estadístico lineal de las variables. Las hemodinámicas se correlacionaron con las de ventilación y oxigenación. Se determinó el momento en el que las mediciones de las distintas variables presentaron mayor poder predictivo de muerte y esto fue medido por el valor de la «p» y por el área bajo la curva COR de 0,8.
El análisis de las variables tras la instauración de VAFO se llevó a cabo durante un periodo de 48 h, ya que fue durante este tiempo cuando se encontró un mayor número de observaciones; a partir de este momento, se reducía el número de pacientes y la sensibilidad de los tests estadísticos era menor.
Se identificaron factores predictivos de mortalidad mediante un análisis bivariante, considerándose variables con mayor valor pronóstico las que fueran estadísticamente significativas y presentaran un área bajo la curva COR ≥ 0,8. Posteriormente, se hizo un análisis multivariable mediante un test de regresión logística para confeccionar el modelo predictivo de mortalidad.
Criterios de indicación de la ventilación de alta frecuencia oscilatoriaLa VMC se realizó con respiradores volumétricos tipo Servo 900C R, Servo 300 o Servo i, y se basó en una estrategia protectora pulmonar consistente en: volúmenes corrientes bajos (6-8 cc/kg), PEEP altas (≥ 10cmH2O) y FiO2 bajas (< 60%)12. La no respuesta y la indicación de VAFO se basó en los siguientes criterios13: a) un IO ≥ 13, en 2 determinaciones consecutivas en un periodo de 6 horas, y b) evidencia radiográfica de barotrauma incontrolable. Todos los pacientes que alcanzaron determinados niveles de asistencia en VMC pasaron a VAFO; no se excluyó a ninguno.
Manejo clínico de la ventilación de alta frecuencia oscilatoriaAntes de iniciarla y durante su funcionamiento, se hizo una valoración del paciente con el objetivo de optimizar su estado hemodinámico para conseguir una PVC ≥ 10mmHg y una PAM>40mmHg en neonatos,>50mmHg en lactantes y>60mmHg en niños. Para conseguir estos objetivos, se administraron expansores de la volemia, dopamina y/o noradrenalina.
Los niños fueron ventilados con el respirador SensorMedics 3100, modelo A y B (Yorba Linda, EE. UU.). El objetivo inicial fue conseguir un volumen pulmonar óptimo mediante una estrategia de rápido reclutamiento alveolar con Pwa de 6 a 8 cmH2O por encima de la que tenía en VMC13. Si la respuesta era la adecuada, entre las 3 y 6 primeras horas de iniciar la VAFO, procedimos a reducir muy lentamente la Pwa.
Criterios de mejoríaLos niños que soportaron un descenso de la Pwa hasta 15cmH2O, una FiO2 ≤ 50% y una ΔP<40cm H2O fueron pasados nuevamente a VMC para iniciar el destete.
Análisis estadísticoLos datos fueron almacenados en una base en formato SPSS. Una vez finalizada la introducción de información, se procedió a llevar a cabo un análisis de la calidad de los datos.
Para ello, se realizó un análisis de la distribución de frecuencias de todas las variables del estudio, identificando posibles factores atípicos extremos, para la detección de los errores de grabación, de observación y la corrección de dichos errores, sustituyéndolos por el valor correcto, revisando el cuaderno de recogida de datos (CRD) sobre la base de otras variables o la conversión en ausencia de información.
Se realizó un análisis univariante para describir la muestra (media, intervalo de confianza del 95% y percentiles para las variables cuantitativas y frecuencias para las categóricas).
Se llevó a cabo un análisis bivariante para estudiar la asociación entre las variables analizadas y la mortalidad. Se emplearon el test de la chi al cuadrado para las variables dicotómicas, el test de la t de Student para la comparación de medias entre grupos y la regresión logística simple para las numéricas continuas. La asociación estadística se realizó en términos de odds ratio e intervalo de confianza del 95%. Para controlar la confusión e interacción con las variables que alcanzaron significación estadística en el análisis bivariante, se realizó un análisis de regresión logística multivariante (variable dependiente defunción sí/no), por el método paso a paso, con un valor de p < 0,05 para la inclusión y > 0,10 para su exclusión, que nos ha permitido crear modelos predictivos.
Para estudiar la evolución de los diferentes parámetros respiratorios y hemodinámicas se utilizó un modelo de medidas repetidas con factor tiempo (ANOVA de medidas repetidas). Este modelo se analizó de manera general y comparándolo entre supervivientes y fallecidos.
Se realizaron curvas COR para localizar puntos de discriminación de la mortalidad con su sensibilidad y especificidad, y se determinó el área bajo la curva.
El nivel de significación estadística se estableció en p<0,05. La imputación de los datos y el análisis estadístico se realizó con el paquete Stadistical Package for Social Sciences (SPSS Inc., Chicago, EE. UU.) versión 18.0.
ResultadosLa edad media fue de 21 (4–72] meses, el peso de 10 (5,5,8-21] kg, el porcentaje de mujeres del 39,2% y el de hombres del 60,8%. El valor de PRISM fue de 33 (31-35]; esta cifra se corresponde con una probabilidad de fallecer del 88,6%6. La escala de Murray fue de 2,8 (2,4-3), que es la máxima puntuación y lleva implícita una probabilidad de fallecer del 75%7.
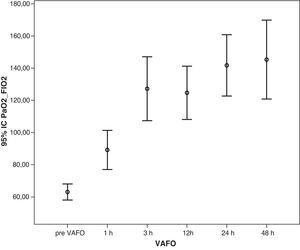
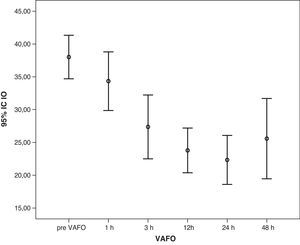
Tras la instauración de la VAFO, se obtuvo un aumento de la paO2/FiO2 y una disminución del IO (figs. 1 y 2). Sin embargo, la Pwa la mantuvimos elevada (25,5 [23,9-27,1] cmH2O), incluso después de haber conseguido una mayor oxigenación.
En relación con las variables hemodinámicas estudiadas, se apreció un aumento progresivo de la PAM y de la SvcO2, y un descenso de la PVC y del ETO2 (tabla 1). Todos estos cambios fueron estadísticamente significativos, excepto el descenso de la PVC.
Análisis lineal de las variables hemodinámicas a lo largo de la secuencia temporal
| PVC | PAM | ETO2 | SvcO2 | |
| Pre-VAFO | 11,1 (10-12) | 47 (43-49) | 0,47 (0,4-0,5) | 48 (46-51) |
| 1 hora | 10,9 (10-12) | 60,6 (58-63) | 0,47 (0,4-0,5) | 56 (53-59) |
| 3 horas | 10,8 (10-11) | 60 (56-63) | 0,45 (0,4-0,5) | 60 (57-64) |
| 12 horas | 10,7 (10-12) | 59,4 (55,8-63) | 0,43 (0,4-0,45) | 62 (58-65) |
| 24 horas | 10,3 (6,9-11) | 62,1 (57,9-66) | 0,41 (0,4-0,44) | 63 (58-67) |
| 48 horas | 9,9 (8,4-11,5) | 62,1 (57-67,2) | 0,40 (0,4-0,43) | 64 (59-69) |
| p | n.s. | < 0,001 | < 0,001 | < 0,001 |
Pre-VAFO: antes de iniciar la VAFO; ETO2: índice de extracción tisular de oxígeno; PAM: presión arterial media; PVC: presión venosa central; SvcO2: saturación venosa de oxígeno.
Los resultados de las variables analizadas son expresados en la tabla por la media y el intervalo de confianza del 95%.
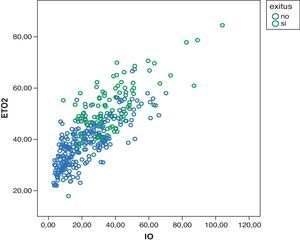
En el estudio de posibles asociaciones estadísticas entre variables respiratorias y hemodinámicas, obtuvimos una correlación inversa entre la Pwa y la SvcO2, y 2 correlaciones directas, una entre la Pwa y el ETO2, y otra entre el IO y el ETO2 (r=742 p<0,001) (fig. 3).
La mortalidad hospitalaria fue del 29,2%, falleciendo 14 niños de los 48. Al analizar la causa de la muerte, se comprobó que todos los pacientes lo hicieron por fallo multiorgánico causado por hipoxemia severa y deterioro hemodinámico. No hubo diferencias significativas en la supervivencia entre pacientes inmunodeprimidos y el resto, aunque hubo mayor mortalidad en el primer grupo. La etiología no se incluyó en el modelo de predicción de mortalidad porque los grupos serían muy reducidos.
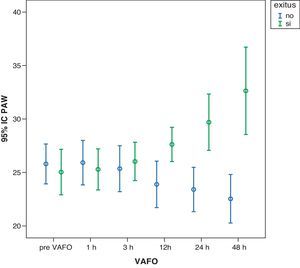
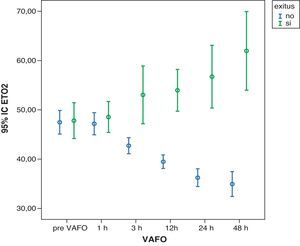
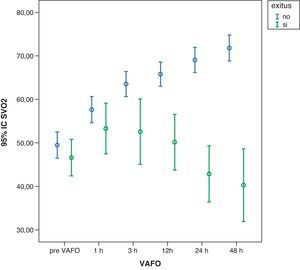
En el análisis realizado entre supervivientes y fallecidos detectamos diferencias en la mayoría de las variables; las más importantes fueron: a) una disminución no significativa de la Pwa en los supervivientes y un aumento en los fallecidos (p<0,001) (fig. 4); b) un descenso de la PVC en los supervivientes (p<0,001) y un aumento en los fallecidos (p<0,001); c) una reducción del ETO2 en los supervivientes (p<0,001) y un incremento del ETO2 en los fallecidos (p<0,05) (fig. 5), y d) un ascenso de la SvcO2 en los supervivientes (p<0,001) y un descenso en los fallecidos (p<0,01) (fig. 6).
Descenso progresivo de la Pwa en los supervivientes en las primeras 48 h de iniciar la VAFO (p=no significativa). Aumento progresivo de la Pwa en los fallecidos en las primeras 48 h de iniciar la VAFO (p<0,001). Pwa: presión media en la vía aérea; VAFO: ventilación con alta frecuencia oscilatoria.
Descenso progresivo del ETO2 en los supervivientes en las primeras 48 h de iniciar la VAFO (p<0,001). Aumento progresivo del ETO2 en los fallecidos en las primeras 48 h de iniciar la VAFO (p<0.05). ETO2: índice de extracción tisular de oxígeno; VAFO: ventilación con alta frecuencia oscilatoria.
Aumento progresivo de la SvcO2 en los supervivientes en las primeras 48 h de iniciar la VAFO (p<0,001). Descenso progresivo de la SvcO2 en los fallecidos en las primeras 48 h de iniciar la VAFO (p<0,001). SvcO2: saturación venosa central de oxígeno; VAFO: ventilación con alta frecuencia oscilatoria.
En el análisis bivariante. el momento en el que las variables presentaban mayor poder predictivo de mortalidad (área bajo la curva COR ≥ 0,8) fue a las 24 h de iniciar la VAFO (tabla 2). El modelo creado a las 12 h, compuesto exclusivamente por las variables hemodinámicas SvcO2 y el ETO2, fue capaz de pronosticar la muerte con una probabilidad del 92,3%. La fórmula del modelo de predicción es la siguiente:
Análisis bivariante. Factores predictivos de mortalidad a las 24 horas de haber iniciado la VAFO
| ABC | OR | IC del 95% | p | P. corte | Sensibilidad | Especificidad | |
| FiO2 | 0,8 | 1,06 | 0,6–0,9 | < 0,05 | ≥ 87,5 | 72% | 85% |
| PaO2/FiO2 | 0,8 | 0,97 | 0,6-0,9 | < 0,05 | ≤ 129 | 91% | 62% |
| IO | 0,85 | 1,17 | 0,7-0,9 | < 0,001 | ≥ 22 | 82% | 65% |
| Shunt | 0,85 | 30557 | 0,7-0,1 | 0,001 | ≥ 0,21 | 82% | 59% |
| PVC | 0,91 | 1,9 | 0,8-0,1 | < 0,001 | ≥ 12,5 | 82% | 85% |
| PAM | 0,85 | 0,93 | 0,7-0,1 | < 0,001 | ≤ 55 | 82% | 70% |
| SvcO2 | 0,99 | 0,83 | 0,97-1 | < 0,001 | ≤ 50 | 100% | 97% |
| ETO2 | 1 | 1,38 | 1-1 | < 0,001 | ≥ 0,49 | 82% | 100% |
ABC: área bajo la curva COR; ETO2: índice de extracción tisular de oxígeno; FiO2: fracción inspirada de oxígeno; IC del 95%: intervalo de confianza del 95%; IO: índice de oxigenación; OR: odds ratio; PAM: presión arterial media; P. corte: punto de corte en la curva COR; PVC: presión venosa central; SvcO2: saturación venosa central de oxígeno.
La VAFO reúne todos los requisitos de una ventilación protectora, ya que al utilizar volúmenes corrientes bajos hace que las presiones transmitidas al alvéolo sean reducidas, minimizando así la aparición de lesión pulmonar14 por rotura alveolar15. Disminuye la respuesta inflamatoria en la membrana alveolocapilar responsable del edema intersticial16,17, pues reduce la infiltración de neutrófilos y atenúa la activación de los macrófagos18,19.
El principal inconveniente de la VAFO es que requiere Pwa elevadas, que pueden comprometer el gasto cardiaco al dificultar el retorno venoso20,21 y reducir el llenado del ventrículo izquierdo22,23. En la serie que presentamos se mantuvo las primeras 48 h en una media de 25 cmH2O; así aumentamos la oxigenación (figs. 1 y 2) sin producir deterioro hemodinámico (tabla 1).
La SvcO2 se correlaciona de forma directa con la saturación venosa mixta (SvO2)24, por lo tanto, su medida junto al cálculo del ETO2 nos permite estimar de forma indirecta el gasto cardiaco25,26. La SvcO2 aislada no es un buen indicador de gasto cardiaco en pacientes con FRA tratados con VAFO, ya que en ellos el incremento de la SvcO2 puede estar condicionado por el aumento en la SaO2, y no por una mejora en el estado hemodinámico. En estos pacientes, es más fiable para la valoración hemodinámica el cálculo del ETO2, que permite relacionar ambas saturaciones.
El cálculo del ETO2 es muy interesante porque permite conocer el consumo en relación con el aporte de oxígeno (consumo de oxígeno/aporte de oxígeno [VO2/DO2]), según la fórmula: [CaO2–CvO2]/CaO2. En ella, el numerador representa el consumo de oxígeno, obtenido por la diferencia entre los contenidos arterial y venoso de oxígeno, y el denominador, el aporte de oxígeno, calculado mediante la determinación de su contenido en sangre arterial:
En estados de bajo contenido de oxígeno disuelto en sangre, como ocurre en el FRA, se pueden sustituir los contenidos arterial y venoso de oxígeno por la SaO2 y la SvcO2, simplificándose así el cálculo del ETO227. Se ha comprobado que en estos pacientes, el consumo se vuelve patológicamente dependiente del aporte, apareciendo con mayor frecuencia un fallo hemodinámico28.
La correlación directa que se ha obtenido entre el IO y el ETO2 (fig. 3) demuestra que cambios en la ventilación tienen repercusión hemodinámica, en el sentido de que un aumento de los parámetros ventilatorios que hacen aumentar el IO provocan un incremento del ETO2. Algunos autores ponen el límite máximo de la Pwa para reducir del gasto cardiaco en 25 cmH2O20.
El estudio de las variables hemodinámicas realizado demostró una mejoría de todas ellas (tabla 1). Otros autores también han obtenido resultados similares29, no observando deterioro hemodinámico en un amplio rango de Pwa30,31. No obstante, se aconseja utilizar con precaución Pwa elevadas, y si fueran necesarias, hacerlo durante un corto periodo32. Esta mejora en la hemodinámica permite el uso de la VAFO en pacientes con FRA y traumatismo craneoencefálico severo con hipertensión intracraneal, ya que se preserva en ellos la presión de perfusión cerebral33.
La interpretación que hacemos de estos resultados es que el aumento del nivel de oxigenación produce un incremento el aporte de oxígeno a los tejidos (DO2) y esto, junto a la reducción del consumo (VO2) por la sedación, analgesia y parálisis, hace que nos alejemos del punto crítico de ETO2 fijado en 0,5. Conseguimos así que el aporte se haga muy superior al consumo, situación ideal para conseguir un metabolismo aeróbico. Uno de los tejidos más beneficiados de esta situación es el miocardio que con una mayor oferta de oxígeno, aumenta su capacidad contráctil.
El FRA se asocia con frecuencia a fallo multiorgánico y muerte, sobre todo cuando a la hipoxia se añade un síndrome de hipoperfusión tisular. La terapéutica basada en la corrección a valores normales de la SvcO2 y del ETO2, llegando incluso a utilizar técnicas como la oxigenación con membrana extracorpórea, ha mejorado el pronóstico de estos pacientes34. Está demostrado que los pacientes que no responden a la VAFO tienen un riesgo de mortalidad del 82%35.
Limitaciones del estudioEl diseño del estudio ha estado condicionado por el nivel actual de evidencia de la utilidad de la VAFO en el FRA, que nos ha impedido plantearlo como estudio aleatorizado.
Al ser realizado en un único centro hospitalario, el número de pacientes reclutados fue reducido y la potencia de los tests estadísticos, baja. Se necesitarían estudios multicéntricos para corroborar estos hallazgos.
Debido a la variabilidad individual en la evolución clínica de cada niño, no ha sido posible unificar el tratamiento con expansores y fármacos inotrópicos y vasoactivos; esta optimización hemodinámica puede haber influido en los resultados. La no inclusión en el estudio de los valores de CO2 y bicarbonato es otra limitación.
En resumen:
- 1.
La VAFO mejora el nivel de oxigenación y, como consecuencia de ello, el estado hemodinámico de niños con FRA.
- 2.
La SvcO2 y el ETO2, ambas variables que nos informan del estado hemodinámico, son excelentes marcadores pronósticos de mortalidad en niños con FRA.
Los autores declaran no tener ningún conflicto de intereses.
A mis padres, Juan García y Mercedes Hernández, por su inestimable ayuda, y apoyo incondicional.