Validar la determinación de la fracción exhalada de óxido nítrico (FENO) con tiempo de espiración de 6 s con un analizador de quimioluminiscencia estacionario (NIOX®, Aerocrine) y con un analizador electroquímico portátil (NIOX-MINO®, Aerocrine).
Material y métodosDeterminaciones de la FENO en 60 pacientes entre 5 y 17 años. Grupo 1 (n=30, NIOX®): tres medidas válidas para cada tiempo de espiración (10 y 6 s) y cálculo de la media de las tres determinaciones. Grupo 2 (n=30, NIOX-MINO®): una determinación válida con cada tiempo de espiración. Variables: edad, sexo, peso, talla, diagnóstico, tratamiento, FENO y número de intentos con cada tiempo de espiración en cada analizador. Análisis de concordancia y grado de acuerdo entre los valores de FENO obtenidos con cada dispositivo, con tiempos espiratorios de 10 y 6 s mediante el método Bland y Altman y la kappa de Cohen (K).
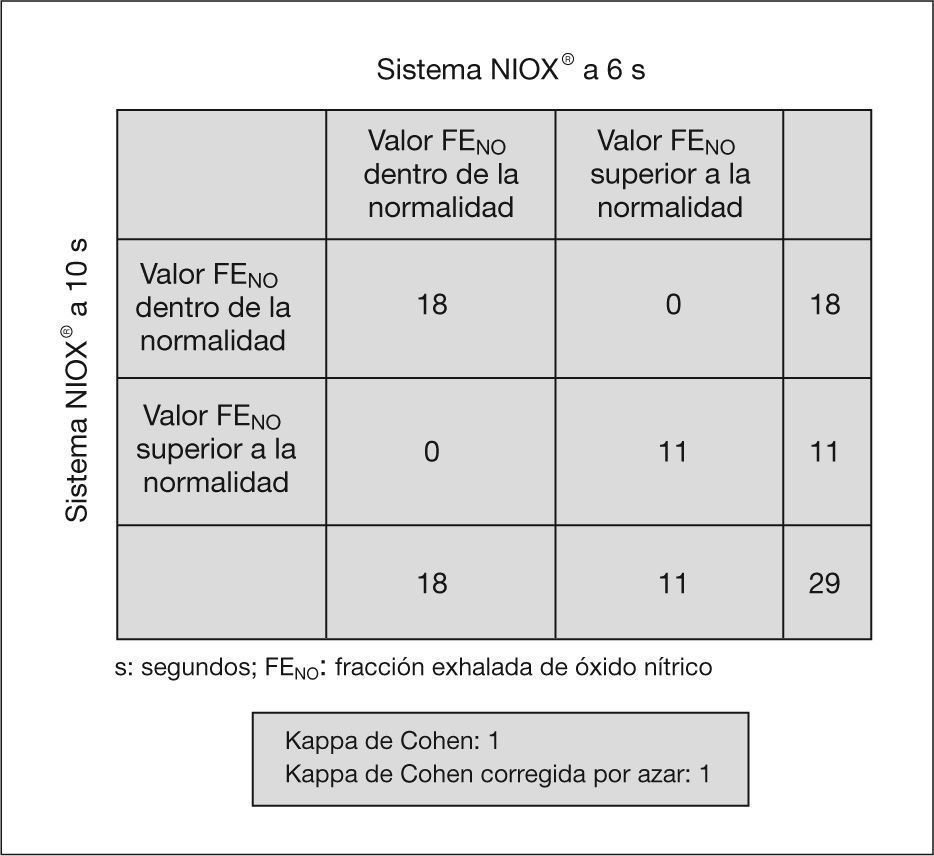
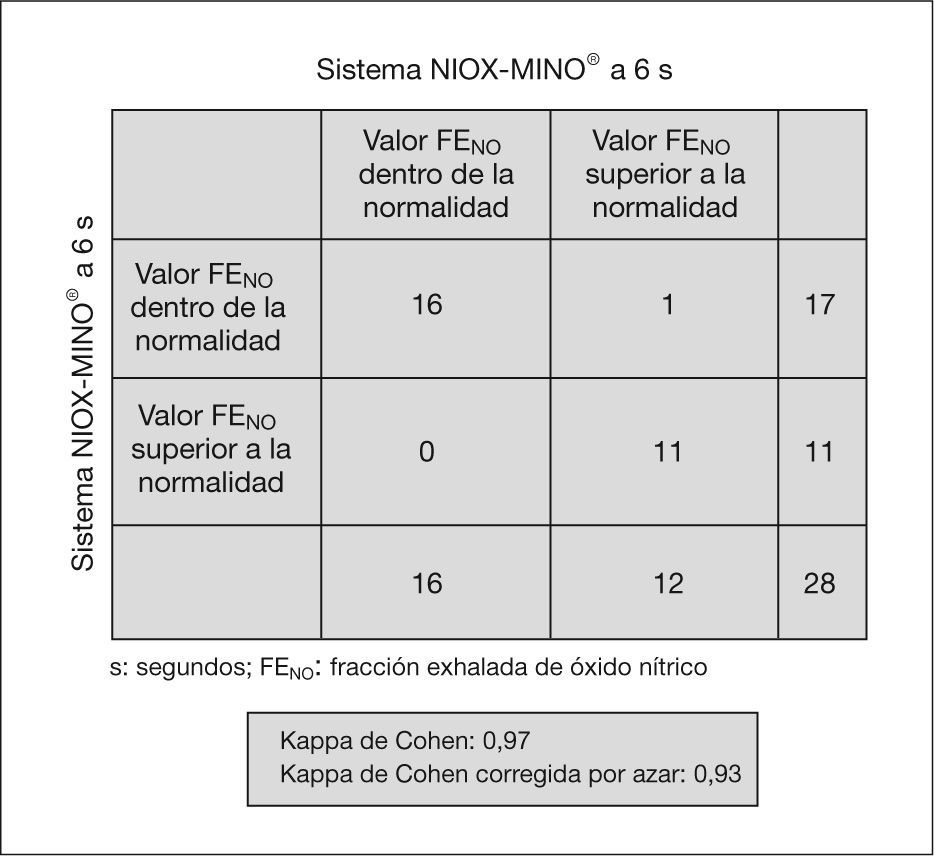
ResultadosGrupo 1 (NIOX®), edad media 10,1±3,07 años. Grupo 2 (NIOX-MINO®), edad media 10,43±2,94 años. Existe una buena concordancia entre los valores obtenidos con NIOX® y con NIOX-MINO® a 10 y 6 s.Hubo un acuerdo sustancial entre los valores obtenidos con NIOX® a 10 y 6 s (K=1) y con NIOX-MINO® a 10 y 6 s (K=0,93).
ConclusionesEl tiempo de espiración de 6 s es válido para la determinación de la FENO con cada uno de los dispositivos de medida en niños mayores de 5 años.
To validate the measurement of fractional exhaled nitric oxide concentration (FENO) using a 6-sec exhalation time in patients aged between 5 and 17 years with a stationary chemiluminescence analyser (NIOX®, Aerocrine) and a portable electrochemical analyser (NIOX-MINO®, Aerocrine).
Material and methodsFENO was assessed in 60 patients randomised into two groups. In Group 1 (n=30, NIOX® analyser), three valid FENO measurements were obtained for two exhalation times (10 sec and 6 sec); the mean of the three measurements was recorded. In Group 2 (n=30, NIOX-MINO®), a single valid measurement of FENO was obtained for each exhalation time. We analysed age, gender, weight, height, diagnosis, treatment, FENO and the number of attempts with both exhalation times in each analyser. Agreement between FENO assessed using 10-sec and 6-sec exhalations was assessed by Bland-Altman analysis and Cohen’s kappa.
ResultsThe mean (SD) age in Group 1 was 10.1 (3.07) years. The mean age in Group 2 was 10.43 (2.94) years. Bland-Altman analysis demonstrated good agreement between FENO values obtained with both exhalation times and with both de-vices. Cohen’s kappa, also demonstrated good agreement (NIOX®, K=1; NIOX-MINO®, K=0.93).
ConclusionsA 6-sec exhalation time is valid for measuring FENO with both analysers in children aged over 5 years.
La fracción exhalada de óxido nítrico (FENO) se considera un buen marcador reproducible y no invasivo de inflamación eosinófila de la vía respiratoria, que resulta de utilidad en el diagnóstico de asma, en el control de la enfermedad y en la monitorización del tratamiento en niños1,2. El NO es un radical libre endógeno simple y difusible, que actúa en el sistema respiratorio como broncodilatador débil, vasodilatador potente y neurotransmisor del sistema no colinérgico y no adrenérgico. Se sintetiza a partir de L-arginina y de tres isoformas del enzima óxido nítrico-sintetasa (NOS), dos constitucionales (neuronal o NOS1 y endotelial o NOS3) y una inducible (iNOS o NOS2).
Existen diferentes formas de medir el NO a nivel bronquial y distintos dispositivos de medida. Actualmente, de acuerdo con las recomendaciones publicadas por la European Respiratory Society (ERS) y la American Thoracic Society (ATS) en 20053 se recomienda, en el niño colaborador, la determinación de FENO mediante registro on-line de respiración única (single-breath on-line measurement, SBOL) con un tiempo de espiración de 10s con analizadores estacionarios de quimioluminiscencia (NIOX®, Aerocrine, Suecia) y electroquímicos portátiles (NIOX-MINO®, Aerocrine, Suecia).
El objetivo de nuestro estudio ha sido validar la determinación de la FENO con tiempo de espiración de 6s frente a 10s, en niños mayores de 5 años, con un analizador de quimioluminiscencia estacionario NIOX® y con un analizador electroquímico portátil NIOX-MINO®.
MATERIAL Y MÉTODOSEstudio observacional y transversal de una muestra obtenida al azar en consultas externas de neumología infantil, de niños entre 5 y 17 años desde marzo de 2006 hasta julio de 2007. Los pacientes fueron distribuidos en dos grupos para la determinación de la FENO con cada uno de los dispositivos de medida, sistema estacionario y sistema portátil. Se ha cuantificado la FENO mediante SBOL y recomendaciones actuales, inhalando aire libre de NO (< 5 partes por billón [ppb]) a través de la boquilla de ambos aparatos durante 2-3s hasta la capacidad pulmonar total, en posición de sedestación sin pinza nasal, con flujo espiratorio constante de 50ml/s, meseta alcanzada durante la exhalación de un tiempo mínimo de 3s y presión durante la exhalación entre 5 y 20 cmH2O. Medición de la FENO directamente del trazador con una variablidad de 3 medidas ≤ 10 %.
En el grupo 1, NIOX®, con tiempo de espiración de 10s, se han obtenido tres medidas válidas de FENO con un máximo de seis intentos, y se ha calculado la media de las tres (valor NIOX® medio); se ha repetido la misma metodología con tiempo de espiración de 6s. En el grupo 2, NIOX-MINO®, se ha establecido la FENO con una única medición válida y con un máximo de seis intentos, con tiempo de espiración de 10 y 6s. A la hora de realizar las mediciones, se fueron alternando las técnicas a 6 y 10s, para evitar el sesgo por aprendizaje de la misma.
Se han analizado las variables cualitativas de sexo, diagnóstico y tratamiento. Las variables cuantitativas han sido la edad, talla, peso, número de intentos con el sistema NIOX® a 10s, FENO con NIOX® a 10s, número de intentos con el sistema NIOX® a 6s, FENO con NIOX® a 6s, número de intentos con el sistema NIOX-MINO® a 10s, FENO con NIOX-MINO® a 10s, número de intentos con NIOX-MINO® a 6s y FENO con NIOX-MINO® a 6s.
Se han considerado puntos de corte de normalidad 20ppb para el analizador NIOX® y 30ppb para el analizador NIOX-MINO® 4,5.
Los datos obtenidos se han descrito mediante los estadísticos más apropiados a la naturaleza y escala de medición de cada variable. Se ha analizado la concordancia entre los dos procedimientos de medida (tiempos espiratorios de 10 y 6s) para cada uno de los dispositivos de medida, mediante el método gráfico de Bland y Altman6,7. Los resultados de la FENO obtenidos a 10 y a 6s con ambos dispositivos de medida se han categorizado en valores normales o anormales en relación con los valores de normalidad publicados en la bibliografía, y se ha analizado el grado de acuerdo entre ambos, mediante el estadístico kappa de Cohen (κ).
Además, se ha estudiado la relación de edad, talla y peso con el valor de FENO obtenida con ambos dispositivos de medida a 10 y 6s mediante análisis de regresión lineal múltiple.
Para conocer si el número de intentos para conseguir mediciones óptimas de FENO con el sistema NIOX® y con el sistema NIOX-MINO® difiere entre los dos procedimientos de medición (10 y 6s) se comparó el número de intentos mediante la prueba de t de Student pareada.
En todos los casos se ha establecido un nivel alfa del 5 %. Se ha empleado el paquete estadístico SYSTAT 9.0.
El protocolo del estudio realizado fue aprobado por el Comité de Ética del hospital y los padres o tutores de los pacientes incluidos firmaron el consentimiento informado.
RESULTADOSSe han estudiado 60 niños distribuidos en dos grupos, grupo 1 (n = 30) y grupo 2 (n = 30) (tabla 1).
Comparación entre dos grupos de individuos en los que se han realizado mediciones de FENO con NIOX® y con NIOX-MINO® a 10 y 6s
| NIOX® (grupo 1) | NIOX-MINO® (grupo 2) | |
| N | 30 | 30 |
| Edad media (años) (DE) | 10,1 (3,07) | 10,4 (2,9) |
| Sexo | ||
| Varones | 17 (56,7 %) | 18 (60 %) |
| Mujeres | 13 (43,3 %) | 12 (40 %) |
| Mediciones con éxito | ||
| a 10 y 6s | 29 (96,7 %) | 28 (93,3 %) |
| Número de intentos (DE) | ||
| A 10s | 4,3 (1,3) | 1,93 (1,6) |
| A 6s | 4,6 (1,6) | 1,67 (1,4) |
| Media FENO (ppb) (DE) | ||
| A 10s | 24,6 (25,2) | 28,3 (26,2) |
| A 6s | 24,9 (25,3) | 29,6 (26,5) |
| Diagnóstico | ||
| Asma episódica ocasional | 7 (23,3 %) | 1 (3,3 %) |
| Asma episódica frecuente | 13 (43,3 %) | 14 (46,7 %) |
| Asma persistente | 7 (23,3 %) | 11 (36,7 %) |
| Sin patología pulmonar | 3 (10 %) | 4 (13,3 %) |
| Tratamiento | ||
| GCI | 16 (53,3 %) | 13 (43,3 %) |
| GCI + LABA | 8 (26,7 %) | 13 (43,3 %) |
| Sin tratamiento | 6 (20 %) | 4 (13,3 %) |
DE: desviación estándar; FENO: fracción exhalada de óxido nítrico; GCI: glucocorticoides inhalados; LABA: agonistas β2 de larga duración; ppb: partes por billón.
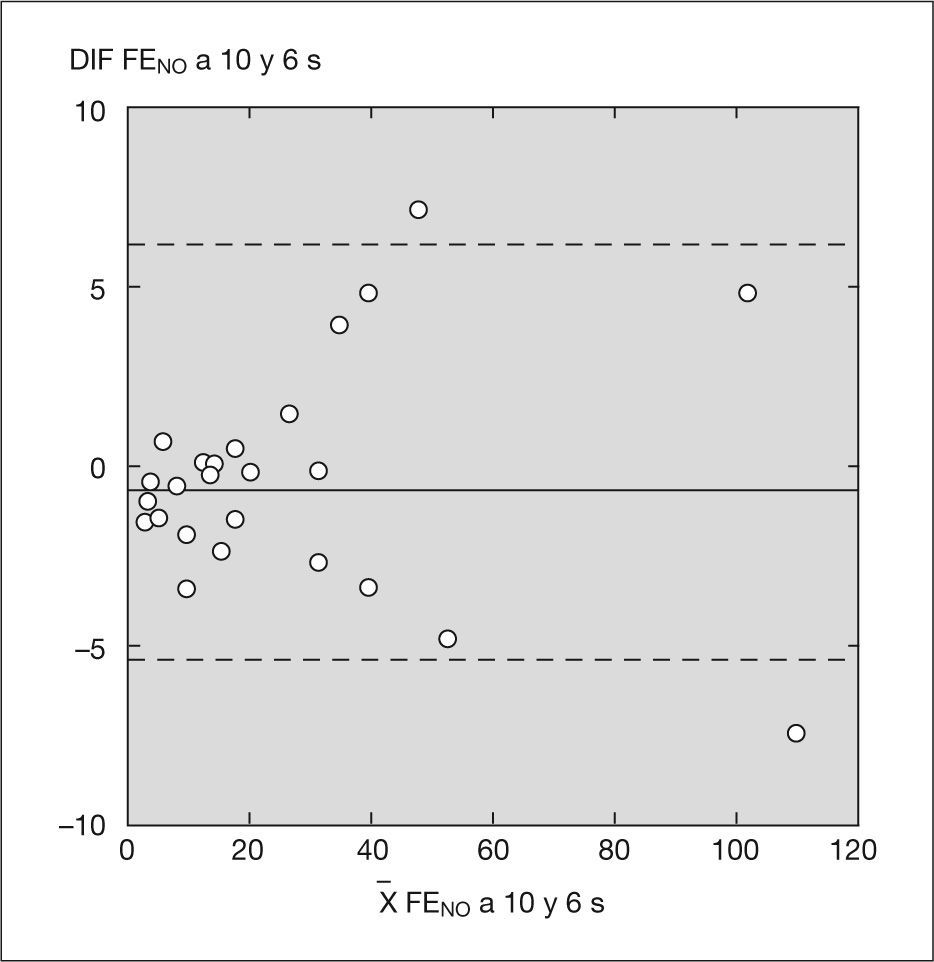
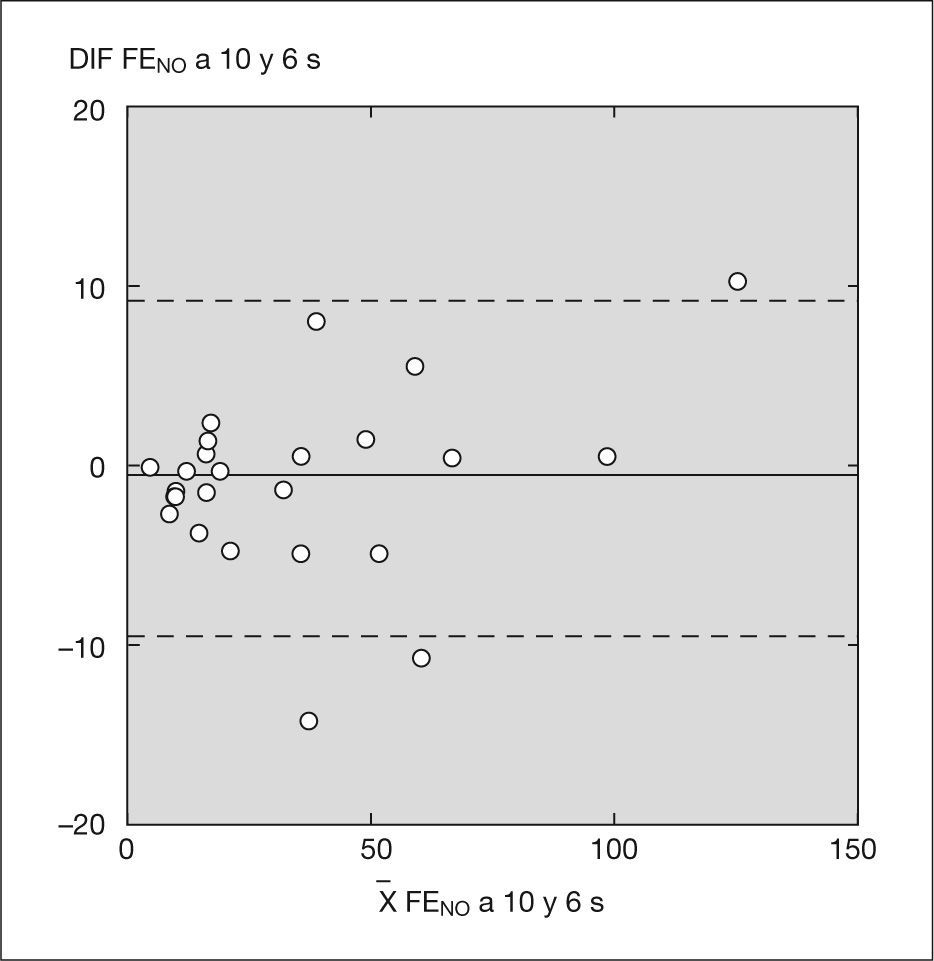
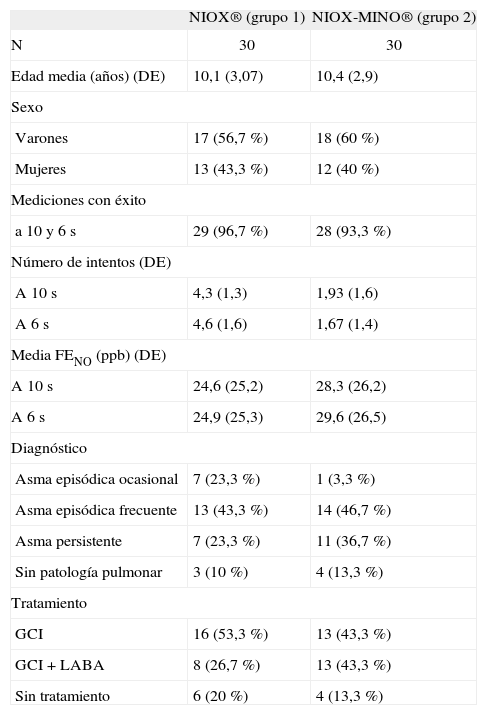
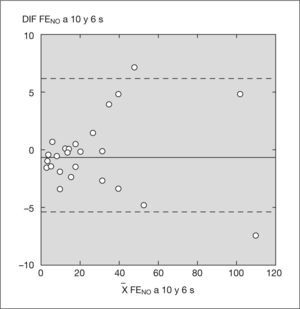
Las diferencias observadas entre los valores de FENO obtenidos con el sistema NIOX® y con el sistema NIOX-MINO® a 10 y a 6s, tanto en valores absolutos como relativos, fueron de escasa magnitud en todo el rango de valores y, por lo tanto, de escasa relevancia clínica (figs. 1 y 2).
Análisis estadístico por el método Bland y Altman con sistema NIOX® a 10 y 6s.
X FENO a 10 y 6s: media de los valores de fracción exhalada de óxido nítrico obtenidos con NIOX® con tiempo de espiración de 10 y 6s; DIF FENO a 10 y 6s: diferencia entre los valores de FENO obtenidos con un tiempo de espiración de 10 y 6s.
Análisis estadístico por el método Bland y Altman con sistema NIOX-MINO® a 10 y 6s.
X FENO a 10 y 6s: media de los valores de fracción exhalada de óxido nítrico obtenidos con NIOX-MINO® con tiempo de espiración de 10 y 6s; DIF FENO a 10 y 6s: diferencia entre los valores de FENO obtenidos con un tiempo de espiración de 10 y 6s.
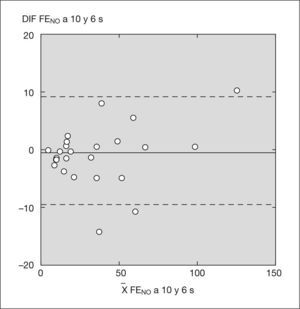
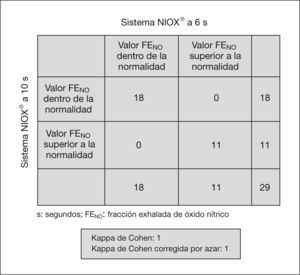
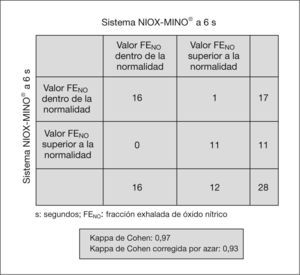
Hubo un acuerdo sustancial entre los valores obtenidos con el analizador NIOX® a 10 y 6s (κ = 1) y con el analizador NIOX-MINO® a 10 y 6s (κ = 0,93) (figs. 3 y 4). No se han encontrado diferencias estadísticamente significativas entre edad, peso, talla y FENO con NIOX® a 10 y 6s, ni con NIOX-MINO® a 10 y 6s (p < 0,05). Tampoco se encontraron diferencias en el número de intentos necesarios para obtener mediciones válidas de la FENO con sistema NIOX® a 10 y 6s (p = 0,51), ni con el sistema NIOX-MINO® a 10 y 6s (p = 0,30).
El NO es un marcador subrogado de inflamación eosinofílica de la vía respiratoria. En diversos estudios se describe un incremento en la FENO en adultos y niños asmáticos, y una correlación positiva con la inflamación eosinofílica medida en la mucosa de la vía respiratoria de dichos pacientes8. Dada su alta capacidad discriminativa, se utiliza como complemento de la función pulmonar en el diagnóstico de la enfermedad9. Asimismo, se ha utilizado en la monitorización del tratamiento con glucocorticoides inhalados (GCI) en niños asmáticos10,11 debido a su gran sensibilidad para detectar cambios en respuesta a las dosis recibidas y para detectar un deterioro de la función pulmonar incluso en ausencia de síntomas respiratorios12,13.
El objetivo del estudio ha sido validar la determinación de la FENO con un tiempo de espiración de 6s en niños mayores de 5 años con el NIOX® y con el NIOX-MINO®. En nuestra muestra, las diferencias observadas entre los valores de FENO obtenidos a 10 y 6s con ambos dispositivos de medida han sido de escasa magnitud en todo el rango de valores y, por lo tanto, de escasa relevancia clínica (figs. 1 y 2). Asimismo, hubo un acuerdo sustancial entre los valores de FENO obtenidos con el analizador NIOX® a 10 y 6s, y con el analizador NIOX-MINO® a 10 y 6s con relación a los valores de normalidad publicados. En consecuencia, ambas técnicas a 10 y 6s resultan válidas para el manejo de los niños en la práctica clínica diaria.
Existen diferentes formas de medir la FENO en pacientes colaboradores y en no colaboradores, mediante análisis on-line y off-line, respectivamente. Los fundamentos teóricos y la metodología se publicaron en la década anterior por la ERS14 y la ATS15. Baraldi et al16 publicaron las recomendaciones para la medición en niños, y recientemente se han publicado los criterios unificados ATS y ERS. El SBOL es la técnica de elección en el niño colaborador. Silkoff et al17 propusieron un sistema de monitorización de la FENO (NIOX®, Aerocrine, Suecia), siguiendo las recomendaciones ATS/ERS y con un desarrollo técnico y metodológico aprobado en el año 2003 por la Food and Drug Administration, para su aplicación en niños asmáticos con inflamación alérgica (fenotipo inflamatorio eosinofílico). Las medidas están basadas en un analizador de quimioluminiscencia estacionario y se considera la técnica de elección para la medición on-line en niños colaboradores18. Se trata de una técnica validada, reproducible y precisa (± 2,5ppb para valores < 50ppb y ± 5 % para valores ≥ 50ppb) en niños con edad igual o superior a 5 y 6 años19. Sin embargo, se trata de una técnica compleja que limita generalmente su uso al ámbito hospitalario. En este contexto se ha propuesto un analizador portátil de FENO, NIOX-MINO®, validado en niños y basado en analizadores electroquímicos, que cumple las recomendaciones ATS/ERS. El sistema portátil analiza la FENO a través de una reacción electroquímica con control de flujo, mediante sensor lumínico y acústico. El tiempo total requerido para la medición es inferior a 2min. Se trata de una técnica menos precisa (± 5ppb para valores < 50ppb y ± 10 % para valores ≥ 50ppb), reproducible y únicamente de representación digital.
Recientemente se ha descrito una excelente concordancia y grado de acuerdo entre los valores de FENO obtenidos con el analizador portátil NIOX-MINO® (una única medición) y con el analizador NIOX® (media entre tres medidas válidas) tanto en niños (edad media: 12 años) como en adultos asmáticos con un tiempo de espiración de 10 s20–22. No obstante, los niños incluidos en los citados estudios generalmente son niños en edad escolar con un rango de edad entre 11 y 14 años.
En general, un tiempo de espiración de 10s, recomendado en adultos por la ATS/ERS, daría lugar a una meseta de FENO con mayor estabilidad. Sin embargo, en comparación con los adultos, los niños tienen una capacidad pulmonar total menor, lo que en ocasiones les podría impedir exhalar de forma correcta durante un tiempo superior a 6s. En este sentido, Menzies et al23 encontraron una excelente correlación entre los valores de FENO obtenidos con un analizador portátil NIOX-MINO® y los obtenidos con un analizador NIOX®, en 101 adultos asmáticos y 50 controles sanos (r = 0,94 y 0,96, respectivamente) con un tiempo de espiración mínimo requerido de 8s. McGill et al estudiaron a 55 niños asmáticos de entre 4 y 15 años (media de edad: 9 años) y observaron una buena correlación y grado de acuerdo entre el analizador NIOX® con tiempo de espiración de 10s y el analizador portátil NIOX-MINO® con un tiempo de espiración de 6s (cociente de correlación: 0,98).
Asimismo, Vahlkvist et al24 estudiaron a 11 niños asmáticos de entre 5 y 15 años (media de edad: 9 años) y encontraron una correlación óptima entre los valores de FENO obtenidos con el sistema portátil NIOX-MINO® y con el sistema NIOX® con un tiempo de espiración de 6s (cociente de correlación: 0,98). Asimismo, y de acuerdo con lo publicado por otros autores, los valores obtenidos con el sistema portátil fueron significativamente superiores a los obtenidos con el sistema de quimioluminiscencia estacionario NIOX®, tanto más cuanto mayor sea el valor de FENO obtenido (p < 0,005).
En nuestra muestra no se han encontrado diferencias estadísticamente significativas entre el número de intentos necesarios para realizar mediciones válidas de FENO con el sistema NIOX® a 10 y 6s ni con el sistema portátil NIOX-MINO® a 10 y 6s. A pesar de que a priori un tiempo de espiración de 6s requeriría menos esfuerzo en los niños más pequeños, en nuestra muestra no se han encontrado diferencias significativas entre las determinaciones realizadas a 10 y 6s. Sin embargo, debemos señalar que la muestra de los pacientes incluidos en el estudio no era demasiado extensa y que se trataba de niños con una edad media de 10 años, y únicamente dos de ellos con edad igual o inferior a 6 años en cada uno de los grupos. Quizá en niños de edades inferiores, la determinación de la FENO resultaría más sencilla con un tiempo de espiración inferior a 10s. Otra de las limitaciones del estudio sería la incapacidad de representar gráficamente la determinación de la FENO obtenida por el sistema portátil NIOX-MINO®. Resultaría de gran interés poder medir, con ambos dispositivos de medida, el tiempo de espiración necesario de cada paciente para obtener una meseta de FENO estable, de al menos 3s según las recomendaciones publicadas en 2005 por la ATS/ERS, y poder determinar así el tiempo de espiración mínimo requerido.
Asimismo, y de acuerdo con otras publicaciones, hemos observado que mientras los niños mayores de 9 años eran capaces de realizar ambas técnicas con garantías, los menores de 9 años obtenían mejores resultados con el sistema NIOX®. De acuerdo con lo comunicado por otros autores, la edad era un factor pronóstico significativo para la FENO (p = 0,014) en niños sanos, quizá por la correlación de la FENO con el volumen de espacio muerto anatómico, que aumenta con la edad en niños sanos (r = 0,68; p < 0,01). Por lo tanto, hay autores que proponen que los valores normales deberían ir en relación con la edad y el peso en niños escolares25. Malmberg et al26 observaron que la FENO se asociaba de forma significativa a la edad, la altura, el peso y el índice de masa corporal (p < 0,0001), siendo la altura el mejor factor pronóstico independiente. No encontraron diferencias en relación con el sexo del paciente (p = 0,42). Asimismo, se ha descrito un incremento significativo de la FENO con relación a la edad en niños asmáticos (p < 0,0001) aunque en menor grado en niños preescolares de entre 2 y 5 años27,28. Sin embargo, en nuestra muestra, y de acuerdo con datos recientes publicados en la bibliografía, no se han encontrado diferencias estadísticamente significativas entre la edad, el peso, la talla y los valores de FENO obtenidos con el analizador NIOX® y con el analizador portátil NIOX-MINO® a los 10 y 6s.
En resumen, nuestros resultados sugieren que la determinación de la FENO con el analizador NIOX® y con el analizador portátil NIOX-MINO® con tiempo de espiración de 6s es igual de válida que la determinación de la FENO obtenida con ambos dispositivos de medida con un tiempo de espiración de 10s, en niños mayores de 5 años.
Declaración de conflicto de interesesEduardo González Pérez-Yarza ha recibido una ayuda de Phadia España para la organización de una jornada científica.
Este trabajo ha sido parcialmente financiado mediante una Beca de Investigación de GlaxoSmithKline España.