El recién nacido (RN) prematuro (RNPT) tiene mayor riesgo de disfunción tiroidea que el recién nacido a término (RNAT). Esta alteración puede pasar desapercibida en el cribado neonatal por una elevación tardía de tirotropina (TSH) en estos pacientes.
ObjetivoEvaluar la función tiroidea en la segunda semana de vida en RNPT menores a 32 semanas de gestación (SG) e identificar factores asociados con la alteración de esta.
Pacientes y métodosEstudio restrospectivo que incluye RNPT de igual o menos de 32 SG, a los que se realizó función tiroidea. Se analizaron los valores de tiroxina (T4L) y TSH y su relación con variables perinatales y de evolución neonatal.
ResultadosSe presentaron 358 pacientes con edad gestacional (EG) mediana de 29,3 semanas y peso al nacimiento (PN) de 1.127 gramos. Se encontró correlación lineal entre T4L y el PN (coeficiente de correlación (R) 0,356; p < 0,001) y la EG (R = 0,442; p < 0,001). Los valores de TSH se asociaron con ser pequeño para la edad gestacional (PEG 5,3 mU/L [1,5 a 37]; no PEG 2,89 mU/L [0,2 a 19,5]; p < 0,001), al soporte inotrópico (Sí 3,98 mU/L [0,6 a 22,9]; No 3,16 mU/L [0,2 a 37]; p = 0,019) y al PN (R = -0,249; p < 0,001). Recibieron tratamiento sustitutivo con levotiroxina nueve pacientes (2,5%), seis de los cuales fueron PEG.
ConclusionesEl análisis de la función tiroidea en la segunda semana de vida permite identificar RNPT asintomáticos con riesgo de presentar alteración de la función tiroidea. Los RN PEG tienen un riesgo más elevado de disfunción tiroidea.
Preterm newborns (PN) have a higher risk of thyroid dysfunction than term newborns (TN). This condition may go unnoticed in neonatal screening due to a late elevation of thyrotropin (TSH) in these patients.
ObjectiveEvaluate thyroid function in the second week of life in PN of < 32 weeks gestation (WG), and to identify factors associated to its alteration.
Patients and methodsA retrospective study was performed in neonates of < 32 weeks gestation (WG), in whom thyroid function was determined. An analysis was performed on thyroxine (T4L) and TSH levels, as well as their association with perinatal and neonatal outcomes.
ResultsThe study included a total of 358 patients with mean gestational age (GA) of 29.3 weeks, and mean birth weight (BW) 1127 grams. A linear correlation was found between T4L and BW (correlation coefficient (R) 0.356; p < 0.001) and GA (R = 0.442; p < 0.001). TSH values were associated with small for gestational age (SGA 5.3 mU/L [1.5-37]; non-SGA 2.89 mU/L [0.2-19.5]; p < 0.001), inotropic support (Yes 3.98 mU/L [0.6-22.9]; No 3.16 mU/L [0.2-37]; p = 0.019) and BW (R = -0.249; p < 0.001). Nine (2.5%) patients were treated with levothyroxine, of whom six were SGA.
ConclusionsThyroid function analysis in the second week of life helps to identify asymptomatic newborns with risk of thyroid dysfunction. SGA newborns are at higher risk of thyroid function alterations.
Las hormonas tiroideas son necesarias para el normal crecimiento y maduración del sistema nervioso central, así como para la maduración ósea, pulmonar y cardiaca a lo largo de la vida fetal y neonatal1–3.
El aumento de la supervivencia de los recién nacidos (RN) prematuros (RNPT) en los últimos años, ha llevado a investigar con más interés determinadas patologías asociadas con la prematuridad, entre ellas las alteraciones de la función tiroidea.
La aparición de disfunción tiroidea en los RNPT es relativamente más frecuente que en el recién nacido a término (RNAT) y presenta mayor incidencia a menor edad gestacional (EG) y peso al nacimiento (PN) y a mayor gravedad de la patología neonatal3–5.
La etiología de la disfunción tiroidea en el RNPT no está clara y podrían contribuir factores como la interrupción del paso transplacentario de tiroxina al feto, la inmadurez del eje hipotálamo-hipofisario-tiroideo y de la síntesis y metabolismo de las hormonas tiroideas, una ingesta insuficiente de yodo a través de la leche materna o de fórmula y una mayor susceptibilidad del prematuro a la sobrecarga yodada6–8. Además, las alteraciones de la función tiroidea se han asociado con el retraso del crecimiento intrauterino (RCIU), con nacer pequeño para la edad gestacional (PEG), con el líquido amniótico meconial, con el sexo masculino y con la administración de fármacos como cafeína, dopamina o glucocorticoides5,9.
Los niveles bajos de hormonas tiroideas, durante un período crítico para el desarrollo del sistema nervioso central (SNC), podrían influir negativamente en la evolución cognitiva y psicomotriz de estos pacientes, ya de por sí en riesgo a causa de la prematuridad y de sus complicaciones asociadas.
Se han descrito diferentes alteraciones de la función tiroidea en el RNPT, como la hipotiroxinemia de la prematuridad (caracterizada por niveles bajos de tiroxina libre (T4L) con hormona estimulante del tiroides o tirotropina (TSH) normal o disminuida), el hipotiroidismo congénito primario (permanente o transitorio) y el hipotiroidismo hipotálamo-hipofisario o central6,10.
El hipotiroidismo congénito transitorio y la hipotiroxinemia de la prematuridad son más frecuentes en el RNPT que en RNAT, mientras que la incidencia de hipotiroidismo congénito permanente y de hipotiroidismo central es similar en ambos grupos4,11–13. Sin embargo, la patología tiroidea puede pasar desapercibida en el cribado neonatal realizado mediante la prueba del talón en el plazo de las 48 a las 72 horas de vida, si se lleva a cabo mediante detección de TSH. Esto es debido a que, en el RNPT, por la inmadurez del eje hipotálamo-hipofisario y la influencia de la patología y sus medidas terapéuticas, la elevación de la TSH puede ser más tardía7,13–15.
Muchos centros y sociedades recomiendan realizar un segundo cribado entre la segunda y cuarta semana de vida, a pesar de obtener una prueba del talón normal, para evitar que estos pacientes queden sin detectar y pierdan la oportunidad de recibir un tratamiento adecuado15–18. Para algunos autores, la utilidad de esta determinación es controvertida, ya que la mayor parte de los pacientes diagnosticados de esta forma presentan un hipotiroidismo leve, que además suele ser transitorio, resolviéndose en pocos meses, por lo que consideran que la necesidad de tratamiento es discutible. Sin embargo, también se han descrito casos de hipotiroidismo congénito permanente en RNPT diagnosticados más tardíamente y con un cribado por prueba del talón normal15,19,20. Por otro lado, para los autores que defienden esta determinación tardía, tampoco están claros ni el momento óptimo de realización, ni el punto de corte de T4 y TSH para decidir el inicio del tratamiento5,7,13–16.
El objetivo del presente trabajo fue valorar la función tiroidea en la segunda semana de vida en nuestra población de RNPT, evaluar la utilidad del cribado e identificar factores asociados con la alteración de la función tiroidea.
Pacientes y métodosSe realizó un estudio retrospectivo observacional, descriptivo y analítico, que incluyó a todos los RNPT de igual o menos de 32 semanas de gestación (SG), ingresados en la unidad de cuidados intensivos neonatales del Hospital Universitario Vall d’Hebron durante un período de tres años. Se ha incluido a prematuros nacidos entre el primero de enero del 2015 y el 31 de diciembre del 2017, para asegurar un seguimiento posterior hasta al menos los dos años de vida.
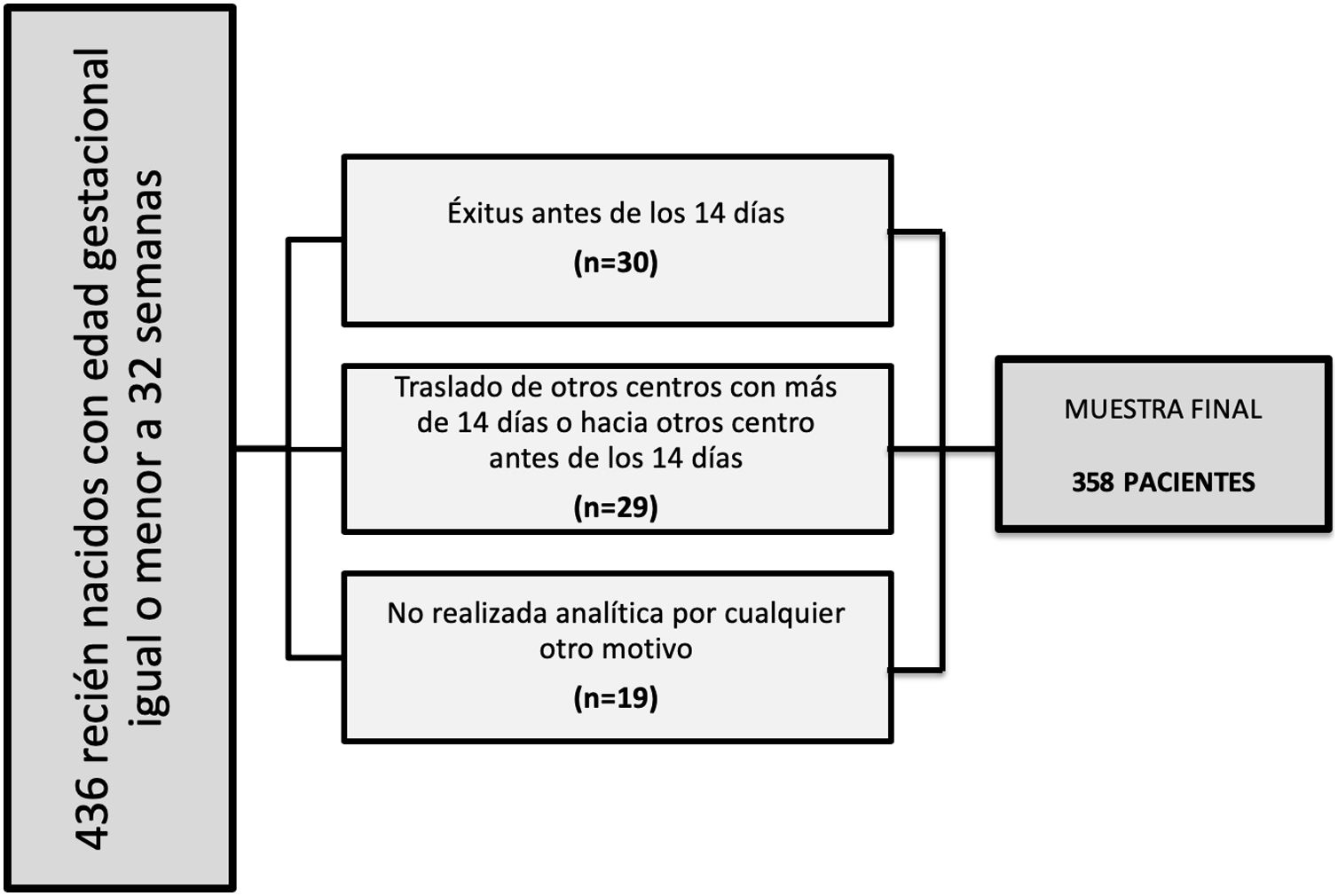
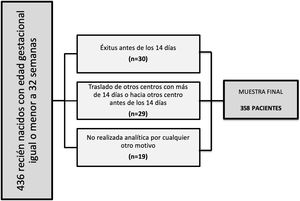
Se excluyó a los pacientes que fallecieron antes de realizar una primera determinación de la función tiroidea, a aquellos que fueron trasladados a nuestra unidad desde otros centros con más de 14 días de vida o desde nuestro centro a otros hospitales con menos de dos semanas y a aquellos a los que, por cualquier motivo, no se les realizara la analítica dentro del período protocolizado (principalmente inestabilidad hemodinámica o insuficiencia respiratoria grave).
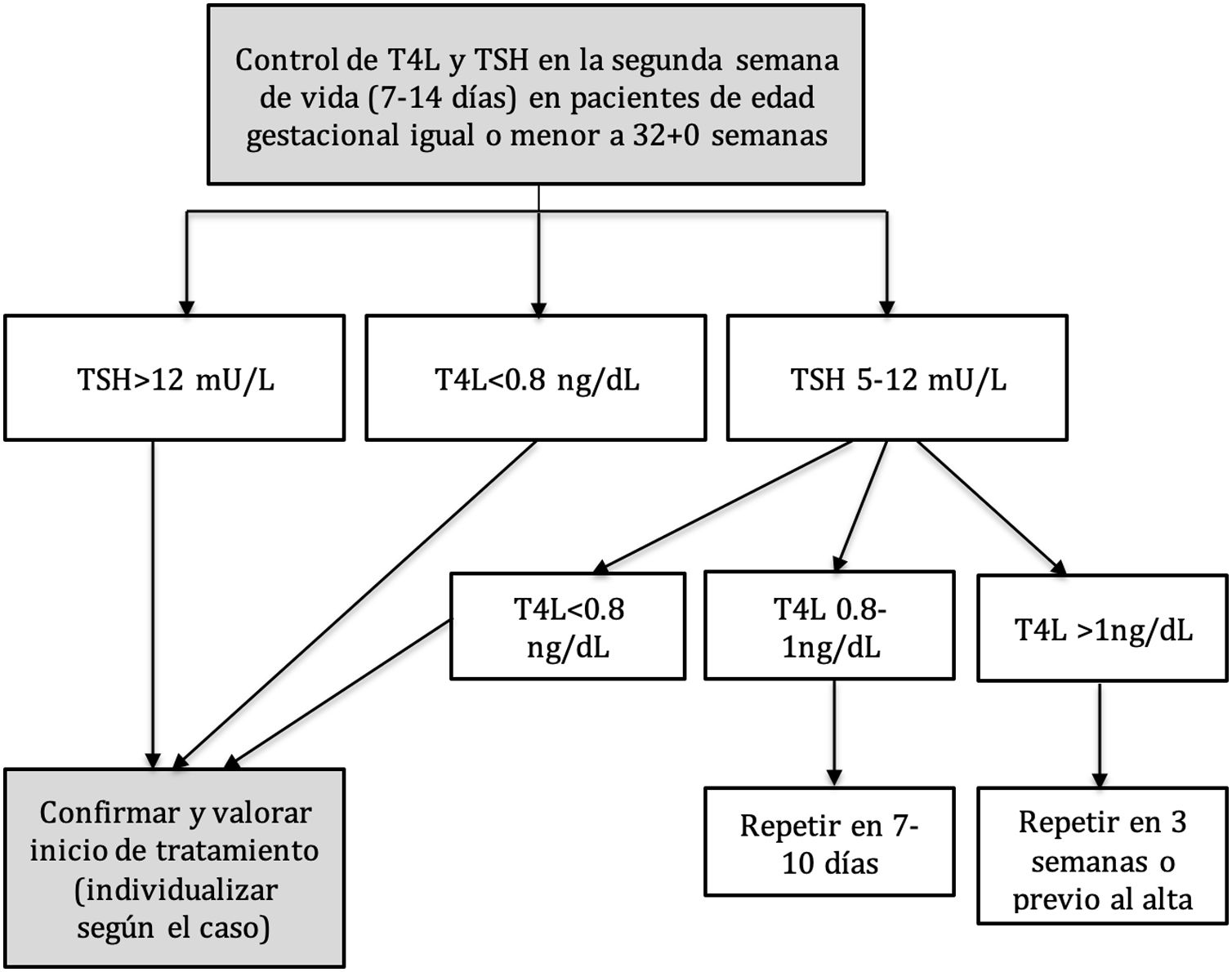
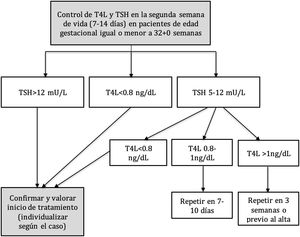
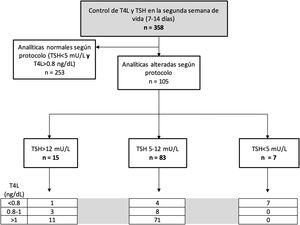
El protocolo de seguimiento de la función tiroidea de nuestro centro incluye la determinación de TSH y T4L en la segunda semana de vida (entre los siete y los 14 días), a todos los pacientes nacidos con 32 + 0 SG o menos, mediante una analítica rutinaria en días laborales por la mañana. Se realizan controles posteriores si esta primera analítica no se considera normal según los valores establecidos por protocolo (fig. 1).
La extracción sanguínea se realiza mediante punción venosa y se procesa en el laboratorio hormonal del centro.
La indicación de tratamiento se realiza, de forma consensuada con la unidad de endocrinología pediátrica, en los pacientes que presentan una elevación persistente de la TSH por encima de 12 mU/L o una T4L inferior a 0,8 ng/dL. El tratamiento consiste en la administración de levotiroxina vía oral (salvo contraindicación absoluta para esta vía) y a una dosis inicial de 4 a 6 mcg/kg/día.
La unidad de endocrinología pediátrica realiza un seguimiento de todos los pacientes que se dan de alta en el tratamiento con levotiroxina, y en función de la evolución clínica y analítica, se valora la duración del mismo y la posibilidad de su retirada ambulatoria.
Para la obtención de los datos se revisaron las historias clínicas informatizadas de los pacientes a través de los programas SAP y Centricity Critical Care.
Se recogieron variables antenatales y del período neonatal inmediato (tipo de embarazo [único o gemelar], sexo, motivo del parto, administración de corticoides prenatales y sulfato de magnesio, edad gestacional, antropometría al nacimiento, test de Apgar, tipo de reanimación en sala de partos y administración de surfactante endotraqueal), variables de evolución neonatal (soporte respiratorio y hemodinámico, hemorragia intraventricular, sepsis precoz y tardía, defunción) y las determinaciones seriadas de hormonas tiroideas (fecha de la analítica, valores de TSH y T4L), así como la indicación de tratamiento con levotiroxina, la fecha de inicio de este y la fecha de suspensión si esta se ha producido.
Se han considerado como PEG a aquellos RN que al nacimiento tuvieron un peso y/o longitud por debajo de -2 desviaciones estándar.
El estudio fue aprobado por el comité de investigación con medicamentos y la comisión de proyectos de investigación del Hospital Universitario Vall d’Hebron.
Análisis estadísticoToda la información se registró en una base de datos con el paquete estadístico SPSS Statistics 25.0 (IBM®) para Mac y fue analizada en la misma.
Se realizó un estudio descriptivo para conocer las frecuencias, las medidas de tendencia central y las medidas de dispersión.
El estudio analítico se realizó mediante la prueba de Kolmogorov-Smirnov y se usó la de Saphiro-Wilk para el análisis de normalidad de las variables cuantitativas, y para la comparación de dichas variables entre los subgrupos se utilizó la prueba t de Student y la de U de Mann-Whitney, según correspondiera para las variables cuantitativas. Para las cualitativas se utilizó X2 o la prueba exacta de Fisher.
ResultadosCaracterísticas de los pacientesEl diagrama de inclusión de los pacientes se muestra en la figura 2. La muestra final fue de 358 pacientes (177 mujeres y 181 varones), con una EG mediana de 29,3 semanas (23,7 a 32) y un PN mediano de 1.127 gramos (380 a 2.650).
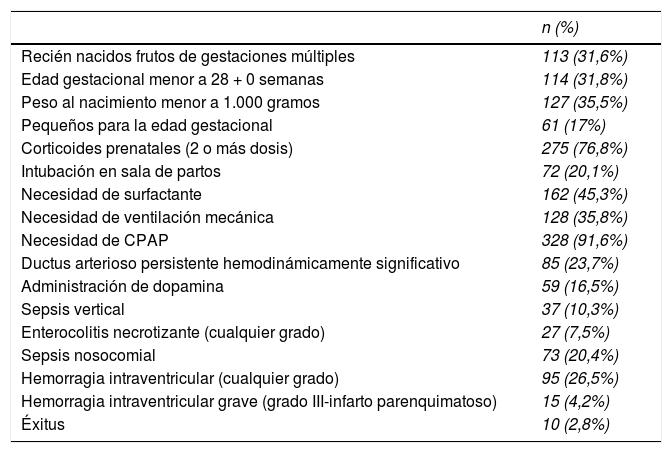
La tabla 1 refleja las características prenatales y de evolución neonatal de la muestra.
Características de la muestra
| n (%) | |
|---|---|
| Recién nacidos frutos de gestaciones múltiples | 113 (31,6%) |
| Edad gestacional menor a 28 + 0 semanas | 114 (31,8%) |
| Peso al nacimiento menor a 1.000 gramos | 127 (35,5%) |
| Pequeños para la edad gestacional | 61 (17%) |
| Corticoides prenatales (2 o más dosis) | 275 (76,8%) |
| Intubación en sala de partos | 72 (20,1%) |
| Necesidad de surfactante | 162 (45,3%) |
| Necesidad de ventilación mecánica | 128 (35,8%) |
| Necesidad de CPAP | 328 (91,6%) |
| Ductus arterioso persistente hemodinámicamente significativo | 85 (23,7%) |
| Administración de dopamina | 59 (16,5%) |
| Sepsis vertical | 37 (10,3%) |
| Enterocolitis necrotizante (cualquier grado) | 27 (7,5%) |
| Sepsis nosocomial | 73 (20,4%) |
| Hemorragia intraventricular (cualquier grado) | 95 (26,5%) |
| Hemorragia intraventricular grave (grado III-infarto parenquimatoso) | 15 (4,2%) |
| Éxitus | 10 (2,8%) |
CPAP: Presión positiva continua en la vía aérea.
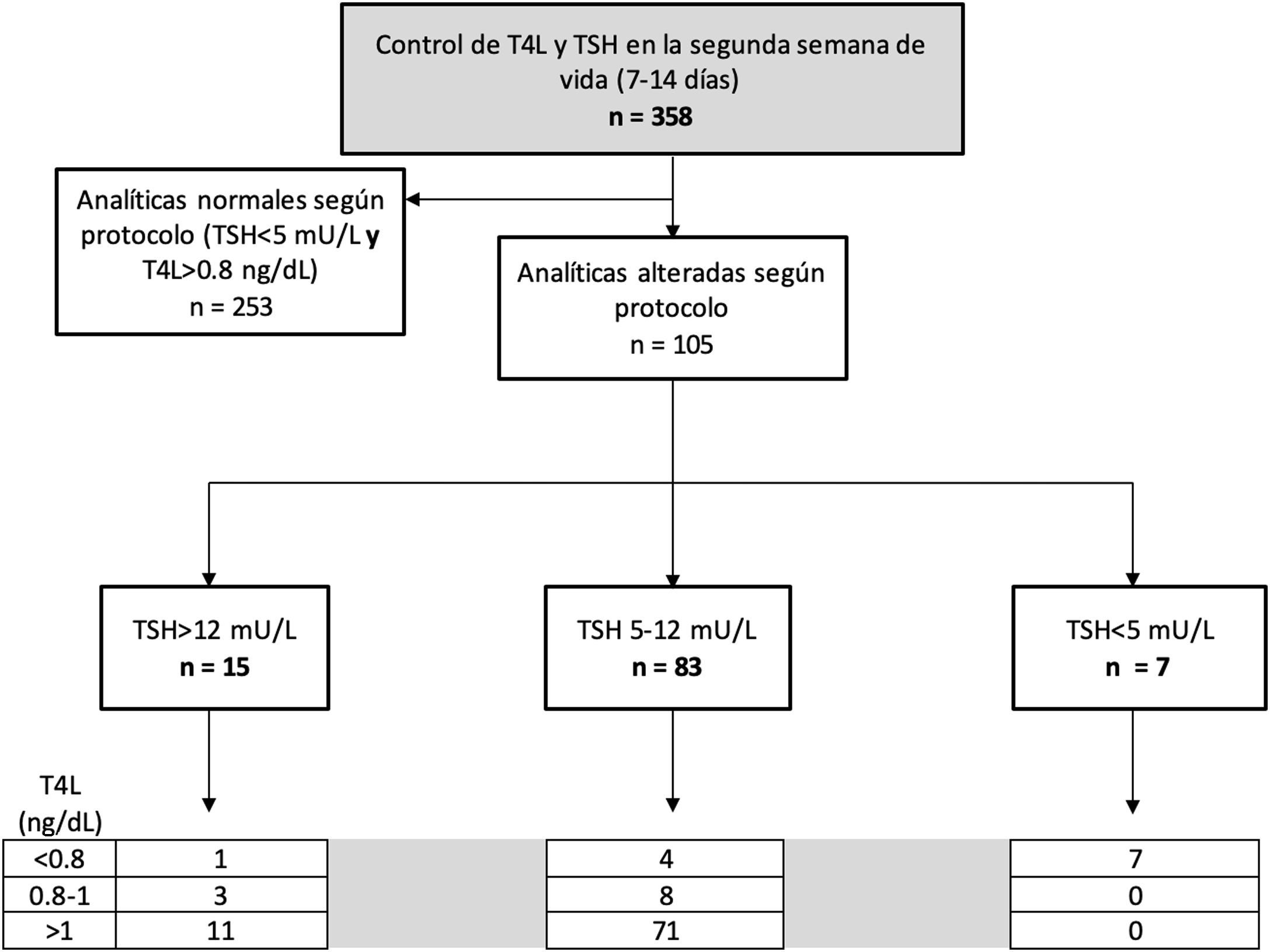
La mediana de TSH en el plazo de 7 a 14 días de vida fue de 3,25 mU/L (0,2 a 37), mientras que la de T4L fue de 1,22 ng/dL (rango 0,51 a 2,2). Según los valores establecidos por el protocolo, se repitió la analítica por alteración de la primera, a 105 pacientes (29,3%). El tiempo transcurrido entre ambas analíticas fue variable en función de la magnitud de la alteración inicial, con una mediana de 15 días (24 horas a 45 días).
La figura 3 muestra la distribución de los pacientes según los rangos establecidos por el protocolo.
Factores que afectan a la función tiroideaSe encontró una asociación estadística entre los valores de T4L y el PN (coeficiente de correlación 0,356; p < 0,001) y la EG (coeficiente de correlación 0,442; p < 0,001). No se encontraron diferencias estadísticamente significativas con el resto de variables estudiadas.
Los valores de TSH se asociaron de forma estadísticamente significativa con el antecedente de PEG (PEG 5,3 mU/L [1,5 a 37]; no PEG 2,89 mU/L [0,2 a 19,5]; p < 0,001); a la necesidad de soporte inotrópico con dopamina (Sí 3,98 mU/L [0,6 a 22,9]; No 3,16 mU/L [0,2 a 37]; p = 0,019) y al PN (coeficiente de correlación -0,249; p < 0,001). No se encontró asociación entre los valores de TSH y el resto de las variables analizadas, incluida la EG.
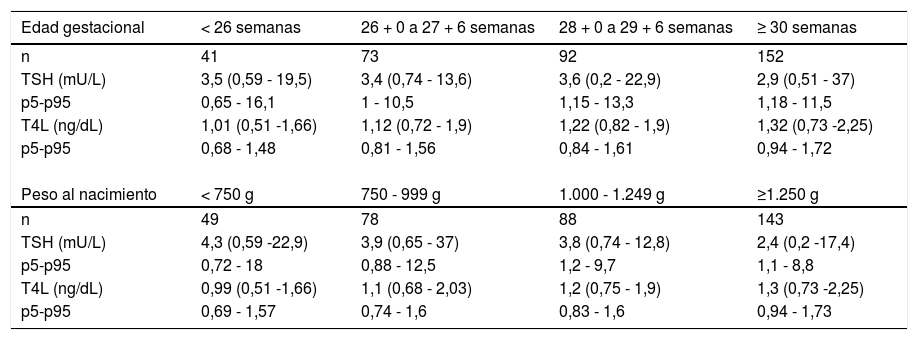
La tabla 2 resume los valores de función tiroidea de nuestros pacientes agrupados por EG y PN.
Valores de TSH y T4L a los 7-14 días de vida en función de la edad gestacional y peso al nacimiento (mediana, [mínimo-máximo])
| Edad gestacional | < 26 semanas | 26 + 0 a 27 + 6 semanas | 28 + 0 a 29 + 6 semanas | ≥ 30 semanas |
|---|---|---|---|---|
| n | 41 | 73 | 92 | 152 |
| TSH (mU/L) | 3,5 (0,59 - 19,5) | 3,4 (0,74 - 13,6) | 3,6 (0,2 - 22,9) | 2,9 (0,51 - 37) |
| p5-p95 | 0,65 - 16,1 | 1 - 10,5 | 1,15 - 13,3 | 1,18 - 11,5 |
| T4L (ng/dL) | 1,01 (0,51 -1,66) | 1,12 (0,72 - 1,9) | 1,22 (0,82 - 1,9) | 1,32 (0,73 -2,25) |
| p5-p95 | 0,68 - 1,48 | 0,81 - 1,56 | 0,84 - 1,61 | 0,94 - 1,72 |
| Peso al nacimiento | < 750 g | 750 - 999 g | 1.000 - 1.249 g | ≥1.250 g |
| n | 49 | 78 | 88 | 143 |
| TSH (mU/L) | 4,3 (0,59 -22,9) | 3,9 (0,65 - 37) | 3,8 (0,74 - 12,8) | 2,4 (0,2 -17,4) |
| p5-p95 | 0,72 - 18 | 0,88 - 12,5 | 1,2 - 9,7 | 1,1 - 8,8 |
| T4L (ng/dL) | 0,99 (0,51 -1,66) | 1,1 (0,68 - 2,03) | 1,2 (0,75 - 1,9) | 1,3 (0,73 -2,25) |
| p5-p95 | 0,69 - 1,57 | 0,74 - 1,6 | 0,83 - 1,6 | 0,94 - 1,73 |
TSH: Hormona estimulante del tiroides; T4L: tiroxina libre.
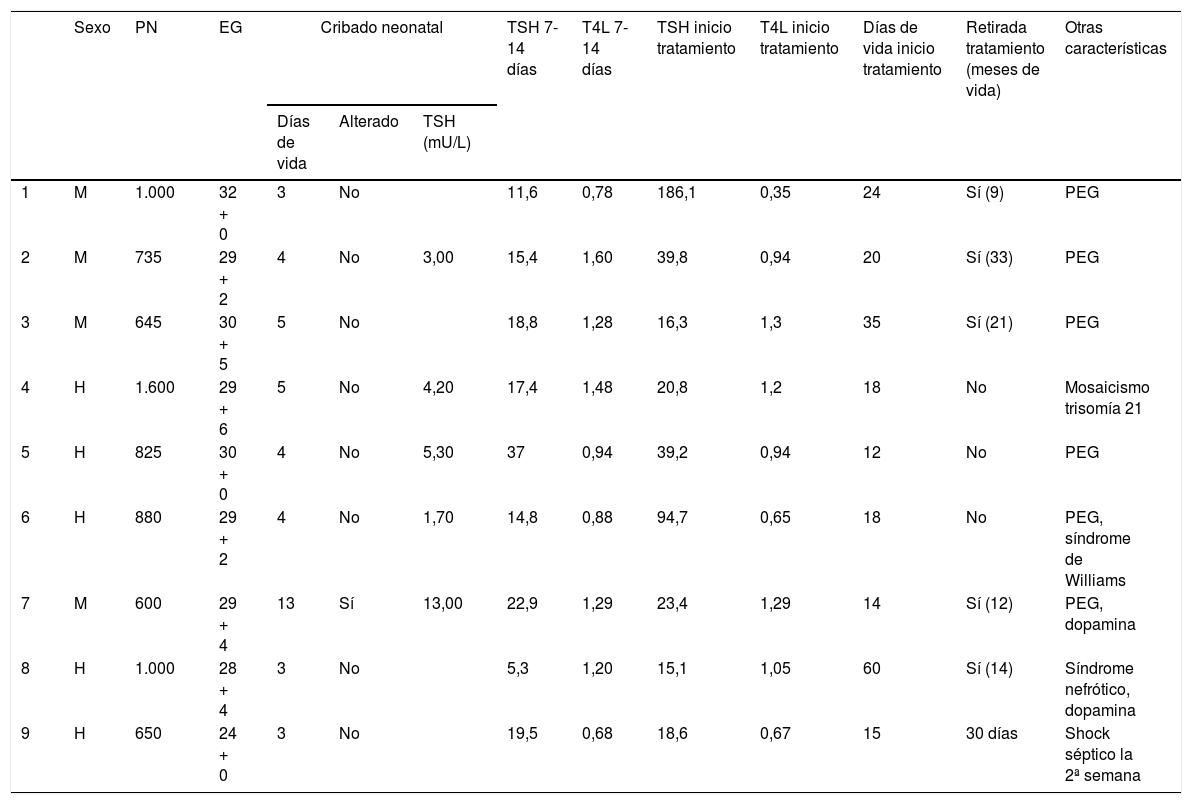
Se indicó el tratamiento con levotiroxina oral en nueve pacientes (2,5%). En tres se inició después de obtener el resultado de la primera analítica y tras la confirmación en un control precoz en un período dentro de las 24 a 48 horas (dos por una TSH por encima de 20 mU/L, a pesar de T4L normal y otro por hipotiroxinemia en contexto de shock séptico). En dos prematuros se comenzó el tratamiento por hipotiroxinemia con elevación marcada de TSH en el segundo control y en tres por TSH persistentemente elevadas a pesar de tener T4L normales en los controles sucesivos. El otro paciente recibió tratamiento a partir de los dos meses de vida, en contexto de un síndrome nefrótico, tras haber presentado una analítica inicial normal.
Las características de los pacientes tratados están reflejadas en la tabla 3.
Características antropométricas y analíticas de los pacientes tratados con levotiroxina
| Sexo | PN | EG | Cribado neonatal | TSH 7-14 días | T4L 7-14 días | TSH inicio tratamiento | T4L inicio tratamiento | Días de vida inicio tratamiento | Retirada tratamiento (meses de vida) | Otras características | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Días de vida | Alterado | TSH (mU/L) | |||||||||||
| 1 | M | 1.000 | 32 + 0 | 3 | No | 11,6 | 0,78 | 186,1 | 0,35 | 24 | Sí (9) | PEG | |
| 2 | M | 735 | 29 + 2 | 4 | No | 3,00 | 15,4 | 1,60 | 39,8 | 0,94 | 20 | Sí (33) | PEG |
| 3 | M | 645 | 30 + 5 | 5 | No | 18,8 | 1,28 | 16,3 | 1,3 | 35 | Sí (21) | PEG | |
| 4 | H | 1.600 | 29 + 6 | 5 | No | 4,20 | 17,4 | 1,48 | 20,8 | 1,2 | 18 | No | Mosaicismo trisomía 21 |
| 5 | H | 825 | 30 + 0 | 4 | No | 5,30 | 37 | 0,94 | 39,2 | 0,94 | 12 | No | PEG |
| 6 | H | 880 | 29 + 2 | 4 | No | 1,70 | 14,8 | 0,88 | 94,7 | 0,65 | 18 | No | PEG, síndrome de Williams |
| 7 | M | 600 | 29 + 4 | 13 | Sí | 13,00 | 22,9 | 1,29 | 23,4 | 1,29 | 14 | Sí (12) | PEG, dopamina |
| 8 | H | 1.000 | 28 + 4 | 3 | No | 5,3 | 1,20 | 15,1 | 1,05 | 60 | Sí (14) | Síndrome nefrótico, dopamina | |
| 9 | H | 650 | 24 + 0 | 3 | No | 19,5 | 0,68 | 18,6 | 0,67 | 15 | 30 días | Shock séptico la 2ª semana | |
EG: edad gestacional (semanas + días); H: hombre; M: mujer; PEG: pequeño para la edad gestacional; PN: peso al nacimiento (en gramos); TSH: tirotropina (mU/L); T4L: tiroxina (ng/dL).
Se encontró una asociación estadísticamente significativa entre la indicación de tratamiento con levotiroxina y el PN (tratamiento: 825 g (600 a 1.600); no tratamiento 1.137 g (380 a 2.650); p = 0,011) y el antecedente de PEG (PEG 11,7% de tratamiento; no PEG 0,7%; p < 0,001). No se encontró relación entre la indicación de tratamiento médico y el resto de las variables estudiadas. Todos los pacientes tratados presentaron una ecografía tiroidea normal.
Durante el ingreso solo se suspendió el tratamiento en el paciente con shock séptico al encontrar una TSH inhibida con T4L elevada. Durante el seguimiento en consultas externas de endocrinología pediátrica, se suspendió la levotiroxina antes de los tres años (mediana 14 meses, rango 9 a 33 meses) en cinco casos. Continúan con tratamiento dos personas: una afectada por una trisomía 21 y otra en la que se confirmó genéticamente un síndrome de Williams tras el alta. Se ha perdido el seguimiento de un paciente al trasladarse de provincia.
DiscusiónEl aumento de la supervivencia de los RNPT ha puesto de manifiesto la existencia de algunas morbilidades menos descritas clásicamente, entre ellas las alteraciones de la función tiroidea7,17,21,22.
Numerosas publicaciones han establecido valores de referencia y han estudiado la función tiroidea en el paciente pediátrico; sin embargo, los valores en el RNPT han sido menos analizados. Nuestra serie es una de las más grandes en las que se ha evaluado la función tiroidea en el RN prematuro extremo en los últimos años18,23,24.
La hipotiroxinemia de la prematuridad, caracterizada por unos niveles disminuidos de T4 sin elevación de la TSH, está definida en la literatura con una frecuencia relativamente alta por debajo de las 32 semanas de gestación, llegando a describirse de hasta el 50% por debajo de las 28 semanas22,25. El punto de corte de T4L establecido por la Sociedad Española de Endocrinología Pediátrica se sitúa en 0,8 ng/dL, mientras que los protocolos internacionales lo establecen en 0,7 ng/dL8,18,25,26. Sin embargo, en nuestra muestra, a diferencia de lo descrito, solo hemos encontrado hipotiroxinemia en un 3,3% de los pacientes, de los cuales todos habían recuperado las cifras de T4L en un segundo control, salvo los tres prematuros tratados por este motivo. No hemos encontrado ningún caso con hipotiroidismo central.
Los pacientes con menor PN y EG tienen valores de T4L más bajos en nuestro estudio, coincidiendo con la bibliografía. El PN también se vinculó con los valores de TSH (aunque con una correlación débil), así como el antecedente de nacer PEG, pero la EG no se relacionó de forma estadísticamente significativa. Analizando más en profundidad este hallazgo, la mayor parte de los pacientes con PN bajos y TSH elevadas, correspondieron a casos con antecedente de PEG y EG más elevadas, lo que podría reflejar una mayor madurez del eje hipotálamo-hipofisario en estos prematuros respecto a aquellos que, con pesos similares, tuvieron una EG menor9,27.
También encontramos en nuestros pacientes una relación entre las cifras de TSH y el antecedente de haber recibido soporte con dopamina. Se han descrito valores de TSH ligeramente elevados a los 14 días de vida en RN recuperados de alguna patología grave durante sus primeros días de vida, y que habían recibido tratamiento inotrópico o corticoideo, lo que podría indicar la recuperación de un hipotiroidismo central transitorio previo3,22.
En nuestra muestra, la mayoría de los pacientes que recibieron tratamiento fueron PEG (EG igual o superior a 28 semanas y PN igual o menor a 1.000 gramos), salvo aquellos con alteraciones genéticas y el prematuro en situación de shock séptico al que se le pudo retirar la levotiroxina tras dos semanas. Igual que en otros estudios previos, hemos confirmado que los RN PEG tienen un riesgo más elevado de disfunción tiroidea, que los que tienen un peso adecuado a la EG.
La incidencia de disfunción tiroidea con indicación de tratamiento en pacientes con peso extremadamente bajo al nacer (4,7% en nuestro grupo) fue similar o algo superior a lo descrito en otras series7,13,17.
De los pacientes que recibieron levotiroxina, salvo una, el resto no presentó alteración en el cribado neonatal, por lo que, de no haber existido este protocolo, la disfunción tiroidea hubiera quedado sin diagnosticar. En la paciente con cribado neonatal alterado, su realización se retrasó a los 13 días de vida, por un shock séptico durante los primeros días, con necesidad de múltiples transfusiones de hemoderivados, por lo que el control analítico en la segunda semana también fue útil para identificar precozmente esta anomalía y ya se encontraba recibiendo tratamiento cuando se comunicó la alteración de la prueba del talón.
Esto nos confirma la importancia de realizar este segundo cribado en el grupo de pacientes con antecedente de prematuridad o con factores de riesgo de hipotiroidismo, ya que permite identificar a los RN con alteración de la función tiroidea que no se detecta mediante el cribado neonatal a las 48 a 72 horas de vida por una elevación más tardía de la TSH16,17.
Existe una amplia controversia sobre las consecuencias tanto a corto como a largo plazo del déficit relativo de hormonas tiroideas en el RNPT, sobre los rangos óptimos para una maduración adecuada y sobre la necesidad de suplementar a estos pacientes2,25,26.
Mientras que algunos autores describen un peor desarrollo neurológico en pacientes con antecedente de prematuridad e hipotiroxinemia durante la etapa neonatal2,28–30; otros han evaluado la evolución psicomotora y cognitiva sin encontrar diferencias respecto a ex-prematuros con función tiroidea normal durante el período neonatal, existiendo algún estudio, como el de Hollanders en 2015, que realiza un seguimiento hasta los 19 años31–34.
Por otro lado, las consecuencias de la suplementación con levotiroxina han sido escasamente estudiadas, hasta el momento, mediante ensayos clínicos o estudios prospectivos. Hay autores que plantean si el hipotiroidismo congénito transitorio o la hipotiroxinemia de la prematuridad deben ser tratados, ya que parece ser leve y transitorio en la mayoría de los pacientes6,15,17,19 y, además, la bibliografía disponible en la actualidad no ha demostrado un beneficio claro en el neurodesarrollo a largo plazo. Sin embargo, todavía no hay suficiente evidencia para determinar si el tratamiento con hormonas tiroideas podría reducir o no las secuelas neurológicas en estos pacientes20,25,35,36.
Ante la importancia de una función tiroidea correcta en un período tan crítico para el desarrollo del sistema nervioso central, parece prudente iniciar un tratamiento en pacientes con una hipotiroxinemia o una hipertirotropinemia persistentes, siempre tras confirmar las cifras, sin tomar la decisión con base en un único valor aislado, y evaluando la retirada del tratamiento antes de los tres años de vida, tal y como describen algunos autores y las últimas guías disponibles18,22,25.
Dentro de nuestro grupo de pacientes, se ha podido suspender el tratamiento antes de los tres años de vida a todos ellos, excepto a los niños afectados de alteraciones genéticas (trisomía 21 y síndrome de Williams) que, sin embargo, no fueron detectados mediante la prueba del talón.
En conclusión, consideramos que la determinación de hormonas tiroideas en la segunda semana de vida permite identificar a RNPT con riesgo de alteración de la función tiroidea, que puede no detectarse mediante el cribado neonatal. Ante la ausencia de un punto de corte definido universalmente para indicar el tratamiento, cada centro debe evaluar sus propios resultados y parece prudente iniciarlo ante alteraciones persistentes y evaluar su retirada en los primeros años de vida, salvo en pacientes con patología específica que conlleve riesgo de hipotiroidismo congénito permanente.
Ante la falta de evidencia clara, se necesitan más ensayos aleatorizados prospectivos, controlados con placebo, con el objetivo de evaluar los beneficios tanto a corto como a largo plazo del tratamiento sustitutivo con levotiroxina en el prematuro con disfunción tiroidea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentaciones a Congresos: Presentado como comunicación oral en el XXVI Congreso de Neonatología y Medicina perinatal de la Sociedad Española de Neonatología (septiembre 2017, Zaragoza).