Conocer las principales características clínicas y epidemiológicas de la gastroenteritis bacteriana pediátrica en nuestro medio.
Pacientes y métodosEstudio observacional en el ámbito de la población española. Recogida de encuestas durante un año de niños con coprocultivo positivo a bacterias. Análisis bivariado y 2 modelos multivariantes (para las variables tratamiento antibiótico, y comparación Campylobacter/Salmonella).
ResultadosUn total de 729 episodios de gastroenteritis bacteriana en las 17 comunidades autónomas (41,2% mujeres y 58,8% varones). La mediana de la edad fue 3,41años (rango intercuartílico 1,55 a 6,72). El 59,9% de los aislamientos fueron Campylobacter, el 31,8% Salmonella no tifoidea, el 2,7% Aeromonas, el 2,5% Yersinia y más de un germen el 1,5%. La mayoría de contagios (70%) son directos, y la intoxicación alimentaria es más improbable (25,9%). Salmonella es significativamente menos frecuente que Campylobacter en menores de 3años (OR ajustada: 0,61; IC95%: 0,43 a 0,86; p=0,005), y Campylobacter es más habitual en el medio rural (OR ajustada 1,48; IC95%: 1,07 a 2,07; p=0,012). Se indicó antibiótico en el 33,2% de los casos, significativamente más si hubo productos patológicos en heces (OR ajustada: 1,53; IC95%: 1,04 a 2,27; p=0,031), duró más de 7 días (OR ajustada: 2,81; IC95%: 2,01 a 3,93; p<0,000), o se hospitalizó (OR ajustada: 1,95; IC95%: 1,08 a 3,52; p=0,027).
ConclusionesLa etiología de la diarrea bacteriana pediátrica es la propia de un país desarrollado. El mecanismo de contagio es principalmente directo, y se tratan con antibióticos más casos de los que parecería recomendable.
To determine the main clinical and epidemiological features of bacterial gastroenteritis in our environment.
Patients and methodsAn observational study of a Spanish population in 17 Autonomous Communities. Questionnaires of children with a stool positive culture to bacteria were collected over a one year period. A bivariate analysis was performed on the variables involved, as well as two multivariate models (for antibiotic treatment variables, and comparison Campylobacter/Salmonella).
ResultsA total of 729 bacterial gastroenteritis episodes were recorded in the 17 Spanish autonomous regions, of which 41.2% were girls and 58.8% boys. The median age was 3.41 years old (interquartile range 1.55 to 6.72). The bacteria isolated were 59.9% Campylobacter, 31.8% non-Typhi Salmonella, 2.7% Aeromonas, 2.4% Yersinia, and 1.5% had more than one strain. Most infections (70%) were direct contacts, and food poisoning was less probable (25.9%). Salmonella is significantly less frequent than Campylobacter in children under the age of 3 years (adjusted OR 0.61; 95%CI: 0.43 to 0.86; P=.005), and Campylobacter is more frequent in rural areas (adjusted OR 1.48; 95%CI: 1.07 to 2.07; P=.012). Antibiotic was prescribed in 33.2% of cases. There was a greater significant difference if stools contained blood or mucus (adjusted OR 1.53; 95%CI: 1.04 to 2.27; P=.031), if the symptoms lasted more than 7days (adjusted OR 2.81; 95%CI: 2.01 to 3.93; P<.000), or if the child was admitted to hospital (adjusted OR 1.95; 95%CI: 1.08 to 3.52; P=.027).
ConclusionsThe aetiology of bacterial diarrhoea in paediatrics is typical of that of a developed country. The transmission mechanism is mainly direct, and more cases than appropriate are treated with antibiotics.
Aunque la diarrea bacteriana ha pasado a ocupar un lugar menor dentro de las infecciones pediátricas en países desarrollados, sigue siendo una causa importante de morbilidad y hospitalización1. Las guías de práctica clínica (GPC) y los protocolos más actuales hacen referencia a la disminución de la etiología bacteriana y el predominio de la etiología vírica entre sus causas, y dan recomendaciones sobre su manejo1-12, pero el abordaje en atención primaria ha sido poco investigado. Según datos de la European Food Safety Authority (EFSA) y el European Centre for Disease Prevention and Control (ECDC) relativos a 2013, con información de 28 países miembros de la Unión Europea y 4 no miembros de la Asociación Europea de Libre Comercio, Campylobacter fue la principal bacteria aislada (214.779 comunicaciones en todo el año), seguida de Salmonella (82.694), y a mucha distancia Yersinia (6.471) y Escherichia coli verotoxigénica (6.043)13. En la infancia las cifras son similares, aunque la incidencia de gastroenteritis aguda (GEA) es muy superior en población preescolar, con 0,5-2 episodios por niño menor de 3años y año en la Unión Europea14.
El último informe del Sistema de Información Microbiológica del Centro Nacional de Epidemiología (SIM), con datos de 201315,16, muestra que en menores de 15años el porcentaje de aislamientos bacterianos con potencialidad de provocar gastroenteritis corresponde en un 62,7% a Campylobacter, en un 34,8% a Salmonella no tifoidea y a un 2,4% a Yersinia. Se conocen, por tanto, datos sobre la etiología y la distribución por edades de la GEA bacteriana, pero se han publicado muy pocos datos actualizados sobre su comportamiento clínico y abordaje terapéutico.
En septiembre de 2013, la Asociación Española de Pediatría de Atención Primaria puso en marcha una Red de Vigilancia Epidemiológica en Pediatría de Atención Primaria (PAPenRED) con el objetivo de llevar a cabo investigaciones sobre aspectos relacionados con la salud infantil en el ámbito del territorio español. A través de dicha red se abordó el siguiente estudio con el objetivo de conocer los aspectos clínicos y epidemiológicos de la GEA bacteriana en nuestro medio en el momento actual, así como los porcentajes de resistencias a antibióticos en los gérmenes más frecuentemente implicados.
Pacientes y métodosPAPenRED cuenta con un tejido de colaboradores centinelas que trabajan en centros públicos o concertados de atención primaria (AP) de todas las comunidades autónomas (CC.AA.) españolas, en distribución proporcional a la de la población. Son 304 pediatras que remiten información mediante encuestas cumplimentadas on-line. Para este estudio se diseñó la encuesta disponible en el enlace http://bitly.com/GEA_PAPenRED, y los pediatras colaboradores remitieron los datos de cada caso de GEA bacteriana diagnosticado en su consulta. Se pidió que incluyeran esos casos, sin seguir ningún criterio especial ni recomendación para solicitar más pruebas que lo que la situación clínica del paciente o la duración del episodio les había llevado a solicitar. El periodo de recogida de encuestas fue del 1 de abril de 2014 al 31 de marzo de 2015.
Los criterios de inclusión fueron: acudir a la consulta de pediatría de AP en el periodo de estudio, edad entre 0 y 14años, padecer clínica de GEA, realización de coprocultivo en algún momento del episodio y disponibilidad de los datos clínicos y epidemiológicos relativos al episodio. Criterios de exclusión fueron: falta de información en la historia clínica o imposibilidad de extraer los datos de la anamnesis, enfermedades intestinales o del sistema inmune que puedan predisponer a este tipo de procesos y pacientes en tratamiento con fármacos inmunosupresores.
Variables principales fueron el tipo de bacteria y haber recibido o no tratamiento antibiótico. Variables secundarias epidemiológicas fueron: edad, sexo, fecha del episodio, escolarización, tenencia de hermanos, nivel de estudios de los padres, posible mecanismo de contagio, medio (rural o urbano) y presencia de casos relacionados. Variables secundarias clínicas y del curso de la enfermedad fueron: existencia de fiebre (>37,5°C axilar), vómitos asociados, características de las heces, necesidad de ingreso hospitalario y periodo hasta la normalización de la diarrea. Se analizaron también los datos obtenidos de los antibiogramas.
Los cultivos de las muestras y los antibiogramas fueron realizados en cada uno de los Servicios de Microbiología de referencia de cada centinela (168 centros).
Para el análisis estadístico se calculó la distribución de frecuencias de los porcentajes de cada categoría para cada variable cualitativa. Las variables cuantitativas fueron exploradas con la prueba de conformidad de Kolmogorov-Smirnov (prueba de bondad de ajuste a una distribución normal) y se calcularon indicadores de tendencia central (media o mediana) y de dispersión (desviación estándar o rango intercuartílico).
En cuanto al análisis bivariado, se calcularon las odds ratio (OR) con su intervalo de confianza del 95% (IC95%) entre las diferentes variables categóricas en relación con las variables primarias. Se completó el análisis con la construcción de 2 modelos de regresión logística, tomando en un caso como variable dependiente la presencia de Salmonella o Campylobacter y en el otro el haber recibido o no tratamiento antimicrobiano. El análisis se realizó mediante el software SPSS, y como nivel de significación se tomó un valor de p<0,05.
El proyecto PAPenRED cuenta con el dictamen favorable del Comité de Ética e Investigación Clínica de Aragón desde su inicio (Dictamen Favorable, Acta n.°19/2013; CP-CI PI13/00154).
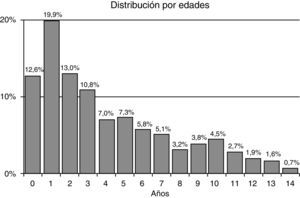
ResultadosSe obtuvieron 729 encuestas (204 centinelas; 11 centinelas notificaron no tener casos en todo el periodo). Correspondieron a 299 niñas (41,2%) y 430 niños (58,8%). El rango de edad fue de 1mes a 14años y 11meses, la mediana de la edad fue de 3,41años y el rango intercuartílico, de 1,55 a 6,72años (distribución no normal, test de Kolmogorov-Smirnov: Dmax=0,152; p<0,000). El 56,3% tenían menos de 4años. La distribución de episodios por edades puede comprobarse en la figura 1.
Sobre 729 aislamientos positivos (11 de ellos coinfecciones), el 59,9% fueron bacterias del género Campylobacter, y el 31,8%, Salmonella no tifoidea (tabla 1). Los casos de coinfección bacteriana lo fueron por Campylobacter asociado a Aeromonas en 7 ocasiones, Campylobacter asociado a Salmonella en 2, Campylobacter y Yersinia en un caso, y Salmonella y Aeromonas en otro caso. En 8 ocasiones se asoció algún virus: 5 rotavirus, 2 adenovirus y un astrovirus.
Solo el 14,8% de episodios sucedieron en invierno. Campylobacter se aisló más frecuentemente en primavera (35,9% de aislamientos de esta bacteria), mientras que Salmonella y Yersinia fueron proporcionalmente más frecuentes en verano (37,5% y 38,9% de cultivos, respectivamente) y Aeromonas en otoño (40% de sus aislamientos).
Del total de pacientes, estaban escolarizados el 72,6%. Para valorar la influencia de la escolarización, se estudió la distribución por gérmenes en los menores de 4años, en los que el grupo de no escolarizados llegaba hasta el 30,3%: la distribución fue similar, aunque entre los pocos casos de Yersinia (n=9) el 88,9% estaban escolarizados.
Fue más probable padecer Salmonella en los que tenían hermanos frente a los que no, aunque la diferencia no fue estadísticamente significativa (35% frente al 28%, respectivamente; OR 1,35 [IC95%: 0,97 a 1,87]; p=0,093).
Por CC.AA., los datos de Cataluña, Baleares y Canarias estuvieron infrarrepresentados en el estudio (aportaron un número de casos inferior a dos terceras partes del reparto proporcional poblacional previsto). Asturias, Castilla-La Mancha y Canarias mostraron mayor porcentaje de salmonelosis que de campilobacteriosis (51,8, 51,3 y 63,6%, respectivamente). Las OR de padecer GEA por Salmonella en niños de estas 3 CC.AA. fue significativamente mayor que en el total nacional: 2,26 (IC95%: 1,04 a 4,88; p=0,040) en Asturias; 2,21 (IC95%: 1,14 a 4,29; p=0,011) en Castilla-La Mancha, y 3,67 (IC95%: 1,06 a 12,65; p=0,012) en Canarias. Significativamente más casos de Campylobacter que la media nacional se observaron en Galicia (OR de padecerla 2,65; IC95%: 1,21 a 5,83; p=0,021).
Más pacientes del medio rural tuvieron Campylobacter (55%) que Salmonella (47,3%) (OR 1,36; IC95%: 0,98 a 1,89). En el caso de Aeromonas, en comparación con el resto, su presencia en medio rural fue significativamente mayor (78,9% frente al 52,8%; OR 3,36; IC95%: 1,10 a 10,22; p=0,040).
Cuando el contagio se pudo sospechar (66%), Salmonella lo hizo significativamente más por intoxicación alimentaria (33% de contagios para esta bacteria) que Campylobacter (23%) (OR 1,66; IC95%: 1,07 a 2,57; p=0,004). En el total de la serie, 70% de casos se transmitieron por contacto persona a persona y 25,9% por intoxicación alimentaria.
Los resultados sobre el posible lugar de contagio en función de cada germen, cuando fue conocido (n=326), se ofrecen en la tabla 2. Entre los casos en que se pudo relacionar con un alimento sospechoso de estar contaminado, Campylobacter procedía mayoritariamente de carne de ave (28%) o de huevos (28%), y menos frecuentemente de otras carnes (19%), mientras que Salmonella lo hacía en un 45% de los casos de huevos, en un 30% de carnes o pescados, y en un 21% de lácteos o repostería.
Lugar probable de contagio en función de la etiología en los casos en que se pudo conocer (n=326), en porcentajes
| Lugar contagio | Campylobacter | Salmonella | Aeromonas | Yersinia | Coinfección |
|---|---|---|---|---|---|
| Domicilio paciente | 37,7% | 43,0% | 14,3% | 11,11% | 60,0% |
| Otro domicilio | 14,1% | 11,4% | 28,6% | 0,0% | 0,0% |
| Guardería/colegio | 32,5% | 24,6% | 42,9% | 66,7% | 40,0% |
| Bares/restaurantes | 7,8% | 14,9% | 0,0% | 11,1% | 0,0% |
| Centros ocio | 7,8% | 6,1% | 14,3% | 11,1% | 0,0% |
Hubo casos relacionados con el índice en el 25% de campilobacteriosis y en el 32% de salmonelosis. Cuando los hubo (n=238), para Campylobacter en el 28,4% se trataba de hermanos, otros familiares en el 51,5% y compañeros de colegio o guardería en el 19,4%; para Salmonella, hermanos en el 38,2%, otro familiar en el 44,9%, y el 15,7% compañeros de escolarización.
En la tabla 3 se resumen los datos clínicos de las principales causas de diarrea. Se describieron productos patológicos en heces (mucosidad, sangre, alimentos mal digeridos) en el 72,9% de los episodios. Campylobacter se asoció a sangre en heces en el 76,6% de los episodios con productos patológicos, y Salmonella en el 69,7%.
Principales síntomas y signos según la etiología (número de casos en que está presente en función del número de casos del germen y porcentaje)
| Síntomas | Campylobacter | Salmonella | Aeromonas | Yersinia | Coinfección |
|---|---|---|---|---|---|
| Fiebre | 316/434 (72,8%) | 170/232 (73,3%) | 10/20 (50%) | 15/18 (83,3%) | 4/11 (36,4%) |
| Vómitos | 169/430 (39,3%) | 102/230 (44,3%) | 7/20 (35%) | 8/18 (44,4%) | 7/11 (63,6%) |
| Productos patológicos en heces | 319/429 (74,4%) | 162/222 (73%) | 13/20 (65%) | 11/15 (73,3%) | 8/11 (72,7%) |
La probabilidad de superar la semana de diarrea fue mayor para los casos de Salmonella que para los de Campylobacter (55% frente al 48%, respectivamente; OR 1,33; IC95%: 0,97 a 1,83). Solo un 25% de casos de Aeromonas se resolvió antes de la semana. Un 5,6% de casos de Yersinia superaron las 4 semanas de diarrea, situación que se dio también en un 3,2% de casos de Campylobacter y en un 2,6% de Salmonella. La probabilidad de ingreso hospitalario es mayor para Salmonella que para Campylobacter (10 y 6%, respectivamente; OR 1,67; IC95%: 0,94 a 2,99). Un 10% de los casos de Aeromonas precisaron ingreso hospitalario. La mediana de días de ingreso para Campylobacter fue de 3días (rango intercuartílico: 2 a 4,25días), y para Salmonella, de 2días (rango intercuartílico: 1 a 3,5días). No hubo ningún fallecimiento en toda la serie de pacientes.
Recibieron tratamiento antibiótico el 33,2% de casos (32% de casos de Campylobacter, 34,5% de Salmonella, 50% de Aeromonas y 33,3% de Yersinia). Para Campylobacter el 74,1% de las prescripciones fueron macrólidos (54,7% azitromicina), 9,3% trimetoprim/sulfametoxazol y 6,5% amoxicilina/ácido clavulánico. Para Salmonella se prescribieron macrólidos en el 48,1% de los casos, trimetoprim/sulfametoxazol en el 22,1%, amoxicilina/ácido clavulánico en el 14,3%, y en un 7,8% asociación de 2 antibióticos. La mayoría (56%) lo justificó por la persistencia de los síntomas en el tiempo o por la gravedad del cuadro clínico (18%), y en menor medida por haber sido pautado en otro estamento (9%), razones epidemiológicas (9%) o infección concomitante (5%).
El análisis multivariante —considerando como variable dependiente la presencia de Campylobacter o Salmonella y como independientes la edad menor de 3años, tenencia de hermanos, escolarización, medio rural o urbano, fiebre, vómitos o productos patológicos en heces, resolución en una semana, ingreso hospitalario o tratamiento antibiótico— solo mostró asociación significativa en la menor presencia de Salmonella frente a Campylobacter en menores de 3años (OR ajustada 0,61; IC95%: 0,43 a 0,86; p=0,005) y en la mayor presencia de Campylobacter en medio rural (OR ajustada 1,48; IC95%: 1,07 a 2,07; p=0,012). Casi significativa fue la diferencia en el tiempo de resolución, menor en Campylobacter que en Salmonella (OR ajustada 1,38; IC95%: 0,99 a 1,92; p=0,052).
Cuando la variable dependiente fue recibir o no tratamiento antibiótico, la regresión logística mostró significativamente más probabilidad de recibirlo cuando hubo productos patológicos en heces (OR ajustada 1,53; IC95%: 1,04 a 2,27; p=0,031), cuando la diarrea duró más de 7días (OR ajustada 2,81; IC95%: 2,01 a 3,93; p<0,000) y cuando hubo ingreso hospitalario (OR ajustada 1,95; IC95%: 1,08 a 3,52; p=0,027).
Por proceder los antibiogramas de diferentes laboratorios de microbiología, el estudio sobre resistencias no es homogéneo. En la tabla 4 se ofrecen los porcentajes de sensibilidad y resistencias a las diferentes bacterias de los principales antibióticos.
Porcentajes de sensibilidades, resistencias totales, e intermedias, a los principales antibióticos según antibiogramas
| Campylobacter (n=303) | Salmonella (n=204) | Aeromonas (n=16) | Yersinia (n=16) | Shigella (n=6) | |
|---|---|---|---|---|---|
| Antibiogramas realizados | 69,3% | 87,9% | 80% | 89,1% | 100% |
| Ampicilina | 40% S 60% R | 42% S 58% R | 100% R | 100% R | 80% S 20% R |
| Amoxicilina/clavulánico | 88% S 9% R 3% I | 87% S 8% R 5% I | 33% S 40% R 27% I | 23% S 77% R | 100% S |
| Cefotaxima | 82% S 18% I | 100% S | 85% S 15% I | 100% S | 100% S |
| Cefuroxima | 50% S 50% R | 73% S 27% R | 100% S | 50% S 50% R | 100% S |
| Ceftazidima | 100% S | 100% S | 100% S | ||
| Eritromicina | 97% S 3% R | 100% Sa | |||
| Azitromicina | 98% S 2% R | 100% Sa | |||
| Trimetoprim/sulfametoxazol | 36% S 62% R 2% I | 95% S 5% R | 95% S 5% R | 87% S 3% R | 17% S 83% R |
| Fosfomicina | 92% S 8% I | 98% S 2% R | 100% S | ||
| Gentamicina | 98% S 2% R | 37% S 62% R 1% I | 100% S | 100% S | 100% S |
| Ciprofloxacino | 8% S 91% R 1% I | 92% S 5% R 3% I | 100% S | 100% S | 83% S 17% R |
I: resistencia intermedia; R: resistencia total; S: sensible.
Por la disminución de la prevalencia de la GEA bacteriana en la infancia, muy pocos estudios recientes han valorado su epidemiología y el abordaje actual en países desarrollados. Este estudio es una aproximación a la realidad y describe el manejo que los pediatras de AP españoles hacen de la entidad. No se pueden extraer conclusiones sobre la incidencia, ya que habitualmente solo se investiga cuando algún dato hace sospechar etiología bacteriana potencialmente tratable, y en general ligado a un peor estado del paciente. Tampoco sobre la realidad y el manejo de esta entidad en niños con enfermedades crónicas, ya que fueron excluidos considerando que requerirían una investigación específica.
Las GPC más recientes indican la necesidad de coprocultivo solo en determinadas situaciones1-7,9-12: patología crónica subyacente (neoplasias, enfermedad inflamatoria intestinal o inmunodeficiencias, por ejemplo), signos o síntomas extremadamente graves, sintomatología prolongada (más de 7días), brotes epidémicos (guarderías, colegios u hospitales), diarrea sanguinolenta grave o historia de viajes a zonas de alto riesgo. En este estudio, la gran mayoría se realiza por la presencia de productos patológicos en heces y/o por la duración de la sintomatología clínica o su gravedad.
La etiología es la propia de los países de nuestro entorno. Los datos facilitados para Europa por EFSA y ECDC, de 2013, son proporcionalmente parecidos a los de esta publicación13. El informe del SIM, sobre muestras de 201315,16 y para menores de 15años, ofrece porcentajes de aislamientos (62,7% Campylobacter, 34,8% Salmonella no tifoidea) muy similares a los expuestos (59,9 y 31,8%, respectivamente). Recientemente, en un entorno similar (Reino Unido), Tam et al.17 muestran que las GEA víricas continúan en aumento, pero aunque disminuyen las salmonelosis, aumenta la GEA por Campylobacter.
En concordancia con lo conocido, han sido más frecuentes en varones y más propias de la etapa preescolar (56,3% de pacientes menores de 4años), aunque existe cierto sesgo, pues se investiga más a los de menor edad, más afectados clínicamente, en general, que los mayores.
Aunque con las limitaciones de una investigación no exhaustiva (de hecho, en uno de cada 3casos no se aportó el dato de mecanismo de sospecha de transmisión), el contagio se declara como de persona a persona en la mayoría (70%). Cuando es alimentario, los productos derivados del pollo (carnes y huevos) siguen siendo las principales fuentes de contagio. Las medidas preventivas habrán de focalizarse, por tanto, en la reducción de posibilidad de contagio ante un caso índice, y en el procesado y manipulado de carnes de ave y huevos. Seguramente las medidas preventivas más efectivas sigan siendo evitar la escolarización del caso y las de higiene (principalmente el lavado de manos) del paciente y su entorno. La gran mayoría de los contagios suceden en el entorno familiar o escolar.
Por CC.AA., y comparativamente con los datos de 2014 del SIM15,16, coinciden los datos relativos a Canarias, con mayor frecuencia de Salmonella no tifoidea. No hay datos completos respecto a Asturias ni Galicia en el SIM, y muestran más aislamientos de Campylobacter que de Salmonella en Castilla-La Mancha, a diferencia de los hallazgos de esta publicación. Datos de otras CC.AA. coinciden con nuestros resultados18,19.
Tradicionalmente se considera que la GEA por Salmonella es de mayor gravedad y afectación clínica que la de Campylobacter. Este estudio confirma más hospitalizaciones por salmonelosis (10% de casos) que campilobacteriosis (6%), aunque los días de estancia son menos en el primer caso que en el segundo, en contraste con el hecho de que en el total de casos la curación clínica sucede antes en las GEA por Campylobacter.
A pesar de la recomendación sobre tratamiento antibiótico de las GPC recientes1-7,9-12 (solo en menores de 3meses, casos con clínica severa, o por motivos epidemiológicos del tipo evitar la extensión de brotes), uno de cada 3casos de Salmonella y Campylobacter lo reciben. Las causas esgrimidas fueron, principalmente, la clínica prolongada (56% de casos tratados) y su gravedad (18%). Las recomendaciones para Salmonella serían utilizar antimicrobianos en pacientes inmunocomprometidos, menores de 3meses (6meses según NICE), o bacteriemia2,7,20, y parece que en atención primaria, si los síntomas se prolongan, aunque la GEA no sea grave, se tiende a tratar. Para Campylobacter, el hecho de que se reconozca la necesidad de tratamiento al inicio para disminuir la contagiosidad justifica ese porcentaje de niños tratados, pero las razones «epidemiológicas» solo son esgrimidas en un 9% de los casos tratados. Se recurre a macrólidos en la gran mayoría de los casos, aunque su sensibilidad a Salmonella no está bien definida, pues no se recomienda testar este grupo de antibióticos en los antibiogramas para esta bacteria21. Las resistencias a antibióticos de las bacterias estudiadas fueron las esperadas, aunque no fue posible la comparación por CC.AA. por falta de uniformidad de criterios entre los 168 laboratorios.
Las limitaciones de este estudio son fundamentalmente las que puedan afectar a la representatividad de los datos en un estudio de una red de investigación de ámbito nacional. Estas se intentan paliar a partir del diseño de la red, que abarca los datos de 288.800 niños (el 4,1% de la población española menor de 15años). El hecho de que de los 304 centinelas colaborasen el 71% puede afectar a la representatividad de la muestra, y más en concreto a las 3 CC.AA. de las que se obtuvieron menos encuestas (Cataluña, Baleares y Canarias). Los sesgos del método por encuesta están en relación con los errores de no cobertura, de no respuesta y los debidos al entrevistador. Para aminorarlos se pilotó la encuesta, y se dieron normas específicas y muy concretas a los centinelas para la inclusión de pacientes y la recogida de los datos.
El valor principal de los resultados obtenidos es aproximarnos a la realidad sobre el abordaje en atención primaria de la GEA por Campylobacter y Salmonella en niños españoles. Las fortalezas principales son el ámbito nacional del estudio y el uso de la red, que permite acumular un número muy significativo de casos.
Podemos concluir que la etiología es la propia de un país desarrollado y que la mayoría de contagios se sospecha que son por contacto directo y no mediante transmisión alimentaria. Además, atendiendo a los resultados expuestos, los pediatras de atención primaria deberían adecuar su práctica a las recomendaciones reduciendo los casos de salmonelosis, principalmente, y de campilobacteriosis tratados con antibióticos y utilizando el antimicrobiano adecuado en este caso para Salmonella.
FinanciaciónEsta investigación ha tenido el soporte de la red de vigilancia epidemiológica en pediatría de atención primaria (PAPenRED), y, sin ningún tipo de financiación, ha dependido de la desinteresada y generosa colaboración de cada uno de sus centinelas, coordinadores autonómicos y coordinadores nacionales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los resultados de esta investigación han sido aceptados para presentación en forma de una comunicación y un póster en el 64 Congreso de la Asociación Española de Pediatría.