Tras la publicación de las recomendaciones, consensuadas por todas las sociedades científicas a través del ILCOR, a finales del año 2020, el GRN-SENeo inició un proceso de análisis y revisión de los principales cambios desde las últimas guías, a los que se añadió un posicionamiento específico de consenso en temas controvertidos, tratando de evitar ambigüedades, y procurando adaptar la evidencia a nuestro medio. El presente texto, resume las principales conclusiones de este trabajo y refleja el posicionamiento de dicho grupo.
After the publication of the recommendations, agreed by all the scientific societies through the ILCOR, at the end of 2020, the GRN-SENeo began a process of analysis and review of the main changes since the last guidelines, to which a specific consensus positioning on controversial issues, trying to avoid ambiguities and trying to adapt the evidence to our environment. This text summarizes the main conclusions of this work and reflects the positioning of that group.
El International Liaison Committee on Resuscitation (ILCOR) revisa y debate, la evidencia actual sobre temas de particular interés en evaluación, estabilización y reanimación cardiopulmonar, para así llegar a unas recomendaciones tipo Consensus on Science and Treatment Recommendations (CoSTR)1. Teniendo en cuenta estas recomendaciones, los diversos consejos o sociedades de reanimación mundiales redactan sus guías dirigidas a un contexto o a un ámbito específico1-4.
El Grupo de Reanimación Neonatal de la Sociedad Española de Neonatología (GRN-SENeo) ha venido publicando desde 20047 en Anales de Pediatríalas recomendaciones nacionales sobre estabilización y soporte vital del recién nacido en sala de partos, con el objetivo de facilitar la incorporación de la mejor evidencia científica a la práctica clínica en nuestro país, y unificar la asistencia de cualquier profesional que intervenga en el nacimiento de los recién nacidos en España.
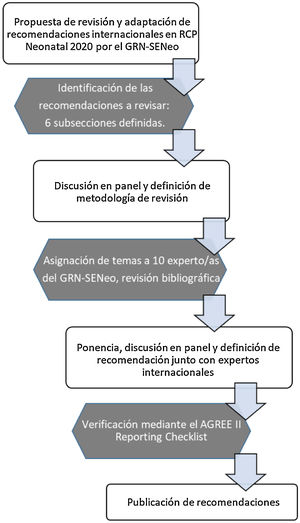
MetodologíaEl GRN-SENeo utilizó las declaraciones de CoSTR como base para elaborar la redacción de las presentes recomendaciones, utilizando una metodología específica de revisión en aquellos temas que se consideraron prioritarios para adaptarlos a nuestro medio. En total, se consideraron prioritarios 6 temas, que se analizaron hasta alcanzar el consenso mediante revisión bibliográfica, exposición y discusión en grupo. Además, se realizó una verificación mediante el AGREE II Reporting Checklist (Disponible en: https://www.agreetrust.org/resource-centre/agree-reporting-checklist/), destinada a asistir y mejorar la integridad y la transparencia de los informes en el desarrollo de las guías de práctica clínica de alta calidad5.
La estructura de la revisión de cada uno de los temas seleccionados siguió un esquema común: antecedentes, resumen de la evidencia científica, recomendaciones de otras guías y posicionamiento del GRN-SENeo. Otros 4 temas se consideraron secundarios y simplemente se consensuó una posición común entre los componentes del GRN-SENeo. Finalmente, tras la aprobación de todos los autores, se redactaron las recomendaciones del presente documento (fig. 1).
Diagrama de flujo de la metodología usada en la revisión y adaptación de las recomendaciones internacionales en RCP neonatal por el GRN-SENeo5.
Tanto la sesión informativa (briefing) como el análisis posterior de la actuación del equipo de reanimación (debriefing) son herramientas potencialmente útiles en reanimación.
¿Qué dice la evidencia?Un ensayo controlado aleatorizado y 3 estudios observacionales aportan una evidencia limitada de que el briefing6 y debriefing (con o sin ayuda de vídeo)6,7 mejoran el rendimiento de la reanimación a corto plazo. No hay datos sobre sus efectos a largo plazo ni sobre su repercusión en la evolución clínica del paciente8.
¿Qué dicen las guías del 2020?El ILCOR concluye que el briefing y el debriefing pueden mejorar los resultados clínicos y de rendimiento a corto plazo. El European Resuscitation Council (ERC) recomienda una sesión informativa con asignación de roles para mejorar el funcionamiento y la dinámica de equipo, además del uso de listas de verificación o «check list» durante estas sesiones para mejorar la comunicación y el funcionamiento del equipo.
¿Qué recomienda el GRN-SENeo?Previo a la reanimación, recomendamos aclarar la asignación de roles, el escalado de actuación, y completar las listas de verificación. También recomendamos la realización de debriefing tras la reanimación, idealmente sesiones cortas pero frecuentes, respaldadas con datos objetivos (anotaciones/vídeos) y guiadas por una persona con experiencia en reanimación neonatal y en debriefing, que asegure un entorno de confianza y seguridad.
Manejo del cordón umbilicalAntecedentesEl pinzamiento tardío del cordón se ha asociado a diversos beneficios clínicos3,9, por lo cual, si bien no existe una definición universal del mismo, está ampliamente recomendado desde hace años para nacimientos no complicados.
El dilema surge en neonatos que requieren reanimación. En un intento de mantener los potenciales beneficios del pinzamiento tardío, se han descrito diversas alternativas: el inicio de la ventilación con el cordón íntegro y su posterior pinzamiento (pinzamiento fisiológico o physiological-based cord clamping [PBCC]), el ordeño del cordón umbilical desde la placenta hacia neonato con el cordón íntegro (milking) o el ordeño del cordón umbilical una vez pinzado (cut-umbilical cord milking o [C-UCM]).
¿Qué dice la evidencia?El ordeño del cordón umbilical se asocia con oscilaciones en el flujo cerebral10, y parece asociarse a una mayor incidencia de hemorragia intraventricular en <28 semanas11. Actualmente, no hay suficiente evidencia para el uso de estrategias alternativas al ordeño como el C-UCM. En cuanto al PBCC, todavía no están claros sus beneficios en los seres humanos, pero algunos datos sugieren que podría ser tan efectivo como el pinzamiento tardío12.
¿Qué dicen las guías del 2020?El manejo del cordón umbilical no ha sido revisado en las últimas recomendaciones ILCOR, aunque muy recientemente se ha publicado un metaanálisis de 41 estudios que concluye que el pinzamiento tardío podría estar asociado a beneficios en <34 semanas13. Las recomendaciones en formato CoSTR están todavía en fase de borrador en la web del ILCOR. En este borrador, dicho comité se posiciona a favor del pinzamiento tardío en neonatos de cualquier edad gestacional que no requieren reanimación y refleja el ordeño como alternativa razonable por encima de las 28 semanas.
Las guías American Heart Association (AHA) 2020 recomiendan retrasar el pinzamiento de cordón más de 30s, mientras se coloca al neonato encima de la madre, se seca y evalúa3. Deja abierta la puerta al pinzamiento tardío mientras se realizan los primeros pasos de la reanimación cuando esta es necesaria y expresamente desaconseja el ordeño del cordón en <28 semanas3. El ERC recomienda el pinzamiento tardío (al menos 60s) en neonatos que no requieren reanimación y plantea considerar el ordeño del cordón en >28 semanas y el pinzamiento fisiológico cuando sea posible hacerlo de forma segura2.
¿Qué recomienda el GRN-SENeo?El pinzamiento tardío del cordón (al menos un minuto) debe ser la estrategia de elección en recién nacidos a término (RNT) y prematuros (RNPT) de cualquier edad gestacional, nacidos por vía vaginal o cesárea, que no requieran reanimación inmediata.
Para la realización del pinzamiento tardío en la práctica clínica, especialmente en aquellas situaciones en las que se anticipa la necesidad de atención médica, como la prematuridad, es importante la elaboración de protocolos de consenso en los que se tenga en cuenta a los equipos de obstetricia, anestesia, matronas y personal auxiliar.
En neonatos que requieren reanimación se debe priorizar el inicio de la ventilación con presión positiva (VPP). Se puede considerar iniciar las maniobras de estimulación con el cordón íntegro en el contexto de un protocolo consensuado a nivel local, o incluso el inicio de las maniobras de ventilación con el cordón íntegro si logísticamente se considera factible y seguro, evaluando el riesgo materno y neonatal, en un contexto donde se recojan los datos (recomendación débil; evidencia muy baja). Un ejemplo sería el uso de cunas de reanimación ubicadas junto a la madre y que permitan iniciar la reanimación. La evidencia para estas estrategias de cordón íntegro es limitada, por lo que deben ser individualizadas e integrarse dentro del concepto del «minuto de oro» de la reanimación.
El ordeño del cordón umbilical no se recomienda actualmente, y se desaconseja expresamente por debajo de las 28 semanas.
Ventilación con presión positivaAntecedentesAnte un recién nacido en situación de apnea y/o bradicardia es prioritario el establecimiento de una ventilación pulmonar adecuada. Las guías ILCOR 2015 objetivan gran variabilidad en cuanto a los parámetros usados.
En las primeras insuflaciones, históricamente la presión inspiratoria pico (PIP) se ha fijado en 20-25cmH20 en RNPT y 25-30cmH20 en RNT. Aunque la PIP está implicada en la aireación inicial, mantener dicha aireación para evitar el colapso alveolar, mejorar el intercambio gaseoso, la distensibilidad y alcanzar una adecuada capacidad residual funcional (CRF), depende en mayor medida de una optimización de la presión positiva al final de la espiración (PEEP)14.
¿Qué dice la evidencia?En cuanto a la PIP óptima inicial, se encuentra evidencia derivada de estudios experimentales con análisis del volutrauma secundario a volumen corriente (Vt) excesivo15–16 y en ensayos clínicos que monitorizan el Vt alcanzado durante los primeros minutos de vida15–17. En estos trabajos se determinaron valores de PIP variables para alcanzar un Vt 4-6ml/kg.
En cuanto a la insuflación sostenida (IS), en los estudios y metaanálisis publicados recientemente no se muestra una evidencia clara en la reducción de mortalidad, displasia broncopulmonar o duración de la hospitalización, y sí un mayor riesgo de mortalidad en las primeras 48h18–19.
¿Qué dicen las guías del 2020?Las recomendaciones internacionales del 2020 difieren en cuanto a la PIP inicial, indicando la AHA y el ILCOR mantenerla en 20-25cmH2O en RNPT y 25cmH2O en RNT, mientras que el ERC indica iniciarla directamente desde 25cmH2O en RNPT y 30cmH2O en RNT1–3. Sobre el uso de IS, ILCOR 2020, al igual que en 2015, no recomienda su uso en RNT y RNPT en paritorio. La AHA especifica más claramente que las insuflaciones deben seguir el patrón convencional con tiempos inspiratorios (Ti) cortos (<1s). La PEEP es beneficiosa en la estabilización respiratoria de los RNPT, pero no se puede definir la PEEP óptima porque todos los estudios en RN son con una PEEP de 5cmH2O. El dispositivo de pieza en T es el que permite una PEEP y PIP controlada, con Vt más consistentes20.
¿Qué recomienda el GRN-SENeo?La VPPI debe administrarse, idealmente, mediante respirador, con mezcla de gases calientes y humidificados y de forma ininterrumpida al menos durante 30s. Se recomienda una frecuencia de 40-60rpm (con Ti iniciales cortos, menores de 1 s), una PEEP de 5-7cmH2O y una PIP de 20-25cmH2O en RNPT y 25-30cmH2O en RNT, ajustando estos parámetros, lo más pronto posible según respuesta de frecuencia cardiaca (FC). La aspiración de secreciones podría ser necesaria si, no se ha logrado la aireación, realizándose bajo visión directa. Hasta que haya una evidencia que justifique la realización de IS, recomendamos evitar esta práctica clínica y centrar la aireación y el reclutamiento pulmonar en optimizar la PIP y la PEEP.
Oxigenoterapia en la sala de partosAntecedentesEn los años 90 aparecen las primeras publicaciones sobre reanimación con aire ambiente que demuestran que es tan eficaz como concentraciones de oxígeno al 100%, además de disminuir la mortalidad y los efectos de la hiperoxia21. En 2010 se produce un cambio en las recomendaciones a favor del uso de aire ambiente en RN≥35 semanas que se mantiene en 2015. Paralelamente, aparecen publicaciones que comparan el uso de fracciones inspiratorias de oxígeno (FiO2) 1 con FiO2 bajas en grandes prematuros sin evidenciarse ningún daño aparente por lo que, en 2015, el ILCOR recomienda iniciar la reanimación en RN<35 semanas con FiO2 bajas (0,21-0,3) y desaconseja FiO2 elevadas (0,65-1).
¿Qué dice la evidencia?Un reciente metaanálisis del ILCOR concluye que la reanimación con fracción inspirada de oxígeno (FiO2) 0,21 frente 1 en ≥35 semanas, se asocia a menor mortalidad sin encontrarse diferencias en la gravedad de la encefalopatía hipóxico-isquémica ni sobre el neurodesarrollo22.
Otro metaanálisis compara la reanimación con FiO2≤0,5 frente >0,5 en <35 semanas23. Concluyen que no hay beneficios ni riesgos en iniciarla con FiO2 bajas. En él, destaca el estudio To2rpido que encuentra un aumento de la mortalidad en <28 semanas reanimados con aire ambiente24. Por otro lado, cuando se valora la evolución de la saturación de oxígeno (SpO2) en <32 semanas encuentran que solo la cuarta parte alcanza la SpO2 objetivo a los 5min y que SpO2<80% a los 5min se asocia con mayor tasa de hemorragia intraventricular grave y aumento de mortalidad25.
El uso de oxígeno durante las compresiones torácicas (CT) no ha sido revisado por el ILCOR. En 2018 se realiza un metaanálisis identificándose 8 estudios en animales, no encontrándose diferencias en la mortalidad, recuperación de la circulación espontánea, daño oxidativo o evolución neurológica con FiO2 0,21 frente a 126.
ILCOR tampoco ha revisado los objetivos de SpO2 por lo que siguen vigentes los publicados por Dawson27. Con la implementación del retraso del pinzamiento de cordón en 2020, un estudio elabora curvas de SpO2 en RNT sanos en los que se realiza pinzamiento tardío28. Comparadas con las curvas de Dawson (pinzamiento precoz) encuentran SpO2 más altas en los primeros 5min de vida.
¿Qué dicen las guías del 2020?En RN≥35 semanas, ILCOR recomienda administrar FiO2 0,21, desaconsejándose 1. En RN<35 semanas, FiO2 iniciales bajas (0,21-0,3). AHA recomienda FiO2 inicial hasta 0,3, mientras que ERC recomienda FiO2 bajas según edad gestacional (0,21 en ≥32 semanas, 0,21-0,3 entre 28-31 semanas y 0,3 en <28 semanas). En caso de CT, tanto AHA como ERC recomiendan FiO2 1. En cuanto a los objetivos de SpO2, ERC utiliza el p25 y AHA unos objetivos alrededor del p25-50 de las gráficas de Dawson27.
¿Qué recomienda el GRN-SENeo?En RN≥35 semanas se recomienda iniciar la reanimación con FiO2 0,21. En RN<35 semanas, se recomienda el inicio de la reanimación con aire ambiente en RN≥30 semanas y <30 semanas sin distrés, iniciando con 0,3 en <30 semanas si presentan distrés. En <28 semanas, se puede considerar FiO2 0,3 e incluso 0,4 en edades más extremas independientemente de la presencia o no de distrés. En el caso de CT, se recomienda aumentar la FiO2 a 1 disminuyéndola posteriormente una vez recuperada la circulación espontánea.
Se utilizará la SpO2 para el ajuste posterior del oxígeno para alcanzar una SpO2>p25, de las gráficas de Dawson45, evitando SpO2>90%. No existe suficiente evidencia en la actualidad para recomendar otro tipo de gráficas, como las relacionadas con el pinzamiento tardío.
Aspectos éticos: humanización y finalización de la reanimaciónAntecedentesTradicionalmente existen dudas sobre cómo puede afectar a los padres su presencia durante la reanimación y si ésta influye en el rendimiento de los profesionales sanitarios. Otro aspecto ético discrepante es sobre el momento de interrumpir la reanimación. Si la FC continuaba indetectable, tras una reanimación completa correctamente realizada, las guías ILCOR 2010 establecieron 10min, mantenidos en las guías ILCOR 2015, aunque indicaban individualizar teniendo en cuenta factores como lugar de nacimiento, recursos materiales, experiencia del equipo, posibilidad de hipotermia inducida y comunicación familiar29. En los últimos años han surgido dudas respecto a la conveniencia de mantener este límite.
¿Qué dice la evidencia?Los padres desean que se les involucre en la toma de decisiones sobre reanimación o retirada del soporte vital30.
Un Apgar de 0 o 1 a los 10min de vida es un fuerte predictor de mortalidad y morbilidad, aunque recientemente se ha documentado evolución favorable en algunos RN reanimados con éxito y tratados con hipotermia terapéutica (20% del total y 37% de los supervivientes sin secuelas moderadas o graves en el neurodesarrollo)31. El tiempo requerido para completar y asegurar todos los escalones de la reanimación es al menos de 20min51, tras el cual la probabilidad de supervivencia con FC indetectable es del 13%32.
¿Qué dicen las guías del 2020?Las guías ERC2 recomiendan la presencia de los padres durante la reanimación del RN en paritorio, pero este aspecto no se menciona por AHA3 ni por ILCOR1.
Para valorar la interrupción de las maniobras de reanimación, ILCOR recomienda un tiempo razonable de 20min1.
¿Qué recomienda el GRN-SENeo?Es recomendable la presencia de los padres durante la reanimación de su recién nacido en paritorio, siempre que sea posible. Se debe informar de las maniobras de reanimación que se han realizado y de su necesidad. Del mismo modo, se deben buscar estrategias de contacto precoz piel con piel o al menos visual o táctil en pacientes que posteriormente serán trasladados a la unidad neonatal supervisados por el equipo neonatal. Si se decide suspender la reanimación, los cuidados deben centrarse en el confort del neonato y bienestar de los padres, permitiendo que estén con su hijo, si así lo desean.
Resulta difícil realizar una recomendación de un tiempo concreto tras el cual interrumpir la reanimación. Si se han completado todos los pasos de la reanimación y la FC se mantiene indetectable (el uso del ECG aumenta la fiabilidad de esta determinación), podría ser razonable debatir con el equipo clínico e informar a la familia de la interrupción de las maniobras de reanimación tras un periodo aproximado de 20min. Es importante individualizar la decisión y tener en cuenta factores como la existencia de patología fetal previa, circunstancias perinatales, edad gestacional (no hay estudios en RN<36 semanas) y disponibilidad de hipotermia terapéutica.
Límites de la viabilidadAntecedentesEn los últimos años, la literatura refleja un aumento en la supervivencia de los prematuros más extremos33. Esta tendencia es más acentuada en aquellos de menor EG (22-23 semanas) dado el cambio hacia una aproximación más proactiva hacia este grupo de recién nacidos en algunos países34,35. Sin embargo, no parece describirse de forma consistente una clara mejoría en el pronóstico a largo plazo en esta población36.
En las últimas recomendaciones del GRN-SENeo29 abogábamos por un manejo activo a partir de las 240/7 semanas de gestación y cuidados paliativos hasta las 226/7. En aquellos recién nacidos en la franja de 230/7 a 236/7, considerada como zona gris, la decisión de actuación activa o no, se basaba en una deliberación conjunta del equipo médico y la familia.
¿Qué dice la evidencia?No existe evidencia al respecto, solo guías o consensos que las sociedades científicas de cada país han publicado37. Destacan dos corrientes: aquellos países en los que se aboga por una aproximación activa en los pacientes de 220/7 semanas, como Reino Unido, EE. UU., Australia y Suecia37-39 (tras una valoración reflexiva de los factores de riesgo y la opinión de los padres) y otros en los que se ofrecen cuidados paliativos (Canadá y Francia)40,41. Casi todos coinciden en una conducta activa a partir de las 230/7 semanas de acuerdo con los deseos familiares.
¿Qué dicen las guías del 2020?Ni ILCOR1 ni ERC2 se posicionan acerca de la actuación en el límite de la viabilidad. ERC hace referencia a que cada centro debe tener sus propias guías para el asesoramiento prenatal ante diferentes situaciones de riesgo como podría ser el nacimiento de un prematuro en el límite de la viabilidad2.
¿Qué recomienda el GRN-SENeo?La determinación del límite de la viabilidad en cada centro debe basarse en una decisión y plan de actuación conjunto de los equipos de obstetricia y neonatología teniendo en cuenta los propios resultados en esta población y la opinión de la familia.
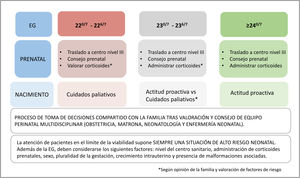
Seguimos recomendando una aproximación activa a partir de las 240/7 semanas posmenstruales. Entre las 230/7 y las 236/7 semanas, recomendamos un consenso con la familia (informada de los riesgos de morbimortalidad) tras la valoración de los factores de riesgo coexistentes alrededor del nacimiento, pero consideramos que en aquellos casos con condiciones perinatales favorables sería aceptable una aproximación proactiva a estos pacientes.
En aquellos partos que acontezcan entre las 220/7-226/7 semanas, mantenemos que una actitud paliativa sería la indicada, aunque se puede plantear una actitud más proactiva en el caso de familias que así lo manifiesten y en gestaciones con condiciones perinatales favorables y más cercanas a las 23 semanas. Consideramos que la administración de corticoides, así como el traslado materno a un centro de 3er nivel, es mandatorio en cualquier amenaza de parto prematuro que se produzca a partir de las 220/7 semanas, con el fin de tener la posibilidad de hacer una adecuada valoración y asesoramiento prenatal por equipos perinatales multidisciplinares expertos; ello facilita que la familia tome una decisión con información contrastada y se pueda elaborar un plan terapéutico en función de la decisión tomada (fig. 2).
Otras controversiasDocumentación durante la reanimaciónLa correcta documentación es una parte importante del proceso de reanimación, pero la calidad de los registros en sala de partos es mejorable42. Siempre que sea posible, debe asignarse el rol de registrar eventos a uno de los miembros del equipo que no participe directamente en la reanimación. Los registros deben incluir los tiempos exactos, las maniobras realizadas, las constantes vitales y los parámetros de asistencia (presiones, FiO2). Entre ellos, el registro de la SpO2 junto con el Apgar a los 5min debido a su elevado valor predictivo en la estabilización. En espera de recomendaciones de consenso, proponemos el uso de plantillas o estándares de registro local, en papel u otros soportes.
Uso de dispositivos de vía aérea supraglótica (mascarilla laríngea)Se puede considerar su uso en RN>34 semanas (>1.500-2.000g) cuando la ventilación con mascarilla facial es ineficaz o la intubación no es posible o no se considera segura debido a una anomalía congénita, falta de equipo o falta de entrenamiento2,43. Se debe fomentar el aprendizaje de su uso, principalmente en personal que no está habituado a la práctica de reanimación neonatal avanzada e intubación.
Sistemas de monitorizaciónEl monitor de función respiratoria (MFR) estima de forma precoz y precisa el Vt, facilitando la toma de decisiones. También el uso de ecografía pulmonar puede mejorar la calidad de la RCP durante la ventilación y detección de FC25. Ambas técnicas podrían ser herramientas útiles durante la reanimación, pero la revisión de la evidencia está pendiente.
Hipotermia inducida en 33-34°C y neuroprotecciónLas guías internacionales de reanimación neonatal, salvo las de AHA3, no especifican la edad gestacional a partir de la cual estaría indicada la hipotermia como neuroprotección. La AHA la indica a partir de las 36 semanas posmenstruales. En nuestro medio, desde 2011, se incluye a los ≥35 semanas44, ampliándose hasta las 34 semanas de EG, en casos individualizados, con la limitación de la evidencia en cuanto a beneficio a largo plazo.
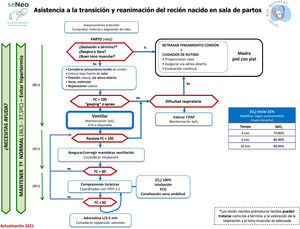
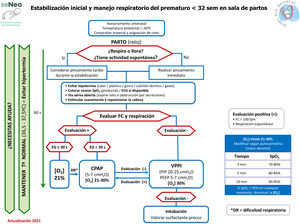
Algoritmo de reanimación neonatalEl algoritmo genérico de reanimación neonatal completa de la SENeo (fig. 3) refleja gráficamente la secuencia de actuación a seguir en la reanimación de un RN en paritorio. A parte del algoritmo genérico, el GRN-SENeo propone una actualización del algoritmo específico para la estabilización y manejo respiratorio de los recién nacidos prematuros menores de 32 semanas posmenstruales (fig. 4).
El ILCOR mantiene revisiones continuas que pueden dar lugar a actualizaciones de diferentes aspectos de la reanimación con publicaciones periódicas posteriores a estas recomendaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Enrique Salguero García; Servicio de Neonatología, Hospital Regional Universitario de Málaga, España.
Miguel Sánchez Mateos; Hospital Universitario Puerta de Hierro-Majadahonda, Madrid, España.
Asunción Pino Vázquez; Hospital Clínico Universitario de Valladolid, España.
Elena García Victori; Servicio de Neonatología, Hospital Universitario Virgen del Rocío, Sevilla, España.
Eva González Colmenero; Hospital Álvaro Cunqueiro, Vigo, España.
Dolores Elorza Fernández; Servicio de Neonatología, Hospital Universitario La Paz de Madrid, España.
Josefa Aguayo Maldonado; Servicio de Neonatología Hospital Universitario Virgen del Rocío de Sevilla, España.
Máximo Vento; Servicio de Neonatología, Hospital Universitario y Politécnico e Instituto de Investigación Sanitaria La Fe, Valencia, España.
Mata Thió Lluch; Newborn Research Centre & Neonatal Services, The Royal Women's Hospital Melbourne, Melbourne, Australia.