Introducción
La hipertensión intracraneal benigna (HIB) es un síndrome clínico descrito por Quincke en 1897 que se caracteriza por el aumento de la presión intracraneal (PIC > 250 mmH2O), en ausencia de lesión ocupante de espacio, obstrucción o deformación del sistema ventricular, con composición del LCR normal 1,2.
La incidencia en el niño es constante en todas las series revisadas, pero es más infrecuente que en el paciente adulto 3. La etiopatogenia es desconocida. En la edad pediátrica se ha relacionado con infecciones, trastornos endocrinológicos, estados nutricionales carenciales y con algunos fármacos 4. La evolución habitualmente es recurrente, y favorable en la mayor parte de los pacientes 5. La morbilidad de la HIB reside en el deterioro de la función visual por atrofia del nervio óptico 6.
Recientemente se han descrito los estados de hipercoagulabilidad como causa de HIB. Los pacientes con trastornos protrombóticos tienen riesgo de desarrollar trombosis de los senos venosos intracraneales por formación de microtrombos en las vellosidades subaracnoideas, dificultando la reabsorción del LCR aumentando por lo tanto la PIC 7.
El factor V de Leiden (FVL) es el trastorno de hipercoagulabilidad más frecuente en la población 8. Se caracteriza por presentar una muy baja sensibilidad a la acción anticoagulante de la proteína C activada y se considera por tanto un factor de riesgo para la trombosis 9.
Comunicamos 2 pacientes con hipertensión intracraneal benigna y FVL, una asociación muy infrecuente en la literatura médica 10.
Observaciones clínicas
Caso 1
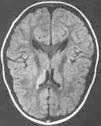
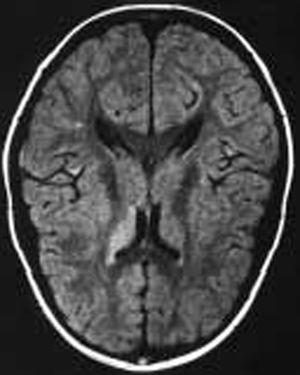
Paciente varón de 11 años de edad sin antecedentes personales de interés remitido desde atención primaria por un cuadro clínico agudo de cefalea y visión borrosa. En el momento de la consulta el paciente se encontraba asintomático. Refería cefalea habitual que en el último mes había aumentado de intensidad y periodicidad, de características pulsátil, localización bitemporal, predominio matutino, que aumentaba con los movimientos de la cabeza y que cedían con analgesia habitual. Se acompañaba de anorexia, pérdida ponderal, labilidad emocional y visión borrosa de manera intermitente. Como antecedentes familiares de interés destacaban numerosos diagnósticos de migraña en la rama materna. La exploración física y neurológica detallada fueron normales. Se le realizó examen de fondo de ojo donde destacaba una discreta palidez de ambas papilas del nervio óptico. Se le practicó una TC, que fue normal, y una punción lumbar que objetivó una presión de apertura de 360 mmH2O, con citoquímica y bioquímica normal. El cultivo y el estudio viral en LCR resultaron estériles. En la RM cerebral se apreciaron pequeñas alteraciones puntiformes de aumento de señal en sustancia blanca subcortical de ambos lóbulos frontales y temporal derecha en densidad protónica y en secuencia T2 (fig. 1). La resonancia por angiografía fue normal. La agudeza visual estaba disminuida (ojo derecho, 0,7, y ojo izquierdo, 0,8) y en la campimetría se apreciaba una pérdida visual bilateral (ojo izquierdo 14/120; ojo derecho 22/120). Los potenciales visuales evocados manifestaban retraso de latencia en la vía óptica, sobre todo izquierda. El estudio de autoinmunidad fue normal. El estudio de hipercoagulabilidad reflejó un estado de heterocigosis para el factor V de Leiden con una resistencia para la proteína C (ratio): 1,87 (normal: 2-5). El estudio familiar desveló el estado de heterocigosis del padre con una resistencia a la proteína C (ratio): 1,65 (normal: 2-5).
Figura 1.Caso 1. Lesiones hiperintensas puntiformes sugerentes de microinfartos.
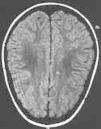
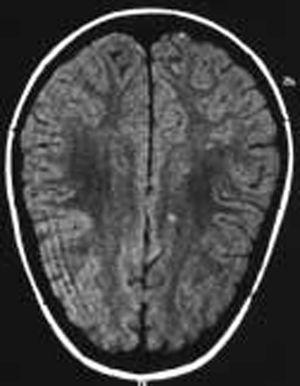
La evolución del paciente ha sido favorable sin tratamiento. Actualmente el paciente se encuentra asintomático con fondo de ojo normal y campimetría visual prácticamente normal (ojo izquierdo 108/120, y ojo derecho 112/120) (fig. 2).
Figura 2.Caso 2. Lesiones sugerentes de microinfartos.
Caso 2
Paciente varón de 10 años de edad en estudio desde los 2 años por manchas "café con leche", que refiere episodios insidiosos de cefalea desde los 4 años de edad. En los últimos meses han aumentado la frecuencia e intensidad de manera progresiva, haciéndose diarias, de localización frontal, carácter opresivo y acompañándose de fotofobia, fonofobia y dolor periocular. Ceden con el reposo, el sueño y con ibuprofeno.
Entre los antecedentes familiares destaca una madre sana con abortos de repetición y padre con esclerosis múltiple. No existe consanguinidad. En la exploración física destacaba la presencia de cuatro manchas "café con leche" de más de 1 cm de diámetro y aproximadamente 12 manchas de menos de 0,5 cm de diámetro. El resto de la exploración fue normal.
En el fondo de ojo se apreció una lesión tipo pars planitis bilateral. La TC fue normal. La punción lumbar objetivó una PIC de 420 mmH2O. La citología, bioquímica y cultivos fueron normales. La RM craneal destacaba hiperseñales en secuencias T2 inespecíficas en la sustancia blanca frontal adyacente al asta frontal del ventrículo lateral izquierdo (fig. 1). La resonancia craneal por angiografía fue normal. La agudeza visual de 0,8 en ojo derecho y 0,7 en ojo izquierdo. El estudio de autoinmunidad fue normal. En el estudio de hipercoagulabilidad presenta mutación del gen del FVL en estado de heterocigosis, con una resistencia a la proteína C activada (ratio) de 1,67. El resto del estudio de coagulación y homocisteína fue normal.
Actualmente el paciente recibe tratamiento con ácido acetilsalicílico y clorhidrato de propranolol. Ha recuperado la agudeza visual en ambos ojos, aunque persisten los episodios de cefalea.
Discusión
La asociación entre HIB y trastornos protrombóticos es una teoría fisiopatológica reciente, desconocida pero no por ello infrecuente 11.
El FVL es la trombofilia asociada más frecuentemente a la trombosis cerebral esporádica en la población general 12. La prevalencia del FVL en la población europea oscila entre el 4 y el 5 %, siendo prácticamente nula en la población africana 13. Se caracteriza por presentar una mutación puntual en el nucleótido 1,691 del cromosoma 1 que sintetiza una proteína aberrante, arginina por glutámico en la posición 506, Arg506Glu, condicionando un estado de resistencia a la acción anticoagulante de la proteína C activada 14. Ontológicamente, algunos autores han considerado el FVL como una mejoría adaptativa de la especie humana debido al efecto protector sobre la hemorragia cerebral en la edad neonatal 15,16. Sin embargo, el estado de heterocigosis para el FVL incrementa el riesgo de trombosis venosa en siete veces y en 80 veces si se trata de estado homocigótico para dicho factor 14.
Se han descrito accidentes vasculares cerebrales en la edad pediátrica como trombosis de la arteria basilar, infartos de la arteria central de la retina, infartos talámicos, trombosis del seno venoso e incluso parálisis cerebral infantil, que presentaban el FVL como único factor de riesgo de enfermedad cerebrovascular 17-21. Incluso se ha relacionado el FVL en la etiopatogenia de la migraña juvenil 22. Sin embargo, son escasos los trabajos en los que han relacionado fisiopatológicamente la HIB y el FVL. Probablemente la elevada prevalencia de la mutación sugiera una incidencia real infravalorada de esta asociación.
Se sugiere que los microtrombos de la vellosidades aracnoideas dificultaría la reabsorción del LCR. La trombosis de los pequeños vasos cerebrales, la agresión isquémica y el daño microvascular aparecen como la explicación fisiopatológica a la asociación de HIB y los estados de hipercoagulabilidad 7. En nuestros pacientes no hemos encontrado evidencia de lesión del árbol cerebrovascular; sin embargo, las lesiones difusas inespecíficas en secuencias T2 en la sustancia blanca podrían sugerir microinfartos vasculares cerebrales.
Actualmente los criterios para el tratamiento anticoagulante en la HIB resultan desconocidos, debido a la ausencia de trabajos y estudios clínicos en este sentido. Parece evidente que los pacientes sintomáticos homocigotos para el FVL, con antecedentes familiares de trombosis, o con algún factor de riesgo añadido de trombosis podrían beneficiarse de la anticoagulación. Sin embargo, los estados heterocigotos para el FVL deben evaluarse otros tratamientos previos 10.
En resumen, con esta publicación se sugiere la relación etiopatogénica entre HIB y FVL y consideramos necesario incluir en los protocolos diagnósticos y en el tratamiento clínico de los pacientes con HIB el estudio de hipercoagulabilidad que incluya la resistencia a la proteína C activada y la determinación de la mutación para el FVL dada la alta prevalencia de esta mutación en la población.