La hipogammaglobulinemia en los primeros meses postrasplante de progenitores hematopoyéticos (TPH) es común en pacientes pediátricos. Durante esta fase se debe administrar tratamiento sustitutivo con inmunoglobulina humana por vía parenteral para la prevención de infecciones. En algunos casos, esta hipogammaglobulinemia persiste en el tiempo, lo que obliga a prolongar el tratamiento cuando el paciente ya no suele ser portador de una vía central, por lo que son candidatos ideales para el tratamiento de reemplazo por vía subcutánea.
Existe escasa bibliografía publicada que describa el uso de esta vía en pacientes pediátricos sometidos a TPH; sin embargo, está ampliamente descrita y con muy buenos resultados en el tratamiento de reemplazo en los niños con inmunodeficiencias primarias.
Pacientes y métodosSe realiza un estudio observacional, descriptivo y longitudinal de carácter retrospectivo. Durante los años 2008-2019 se evalúan a todos los pacientes pediátricos sometidos a TPH en nuestro centro que presentan una hipogammaglobulinemia crónica persistente (superior a un año). Se evalúa la fase de tratamiento con inmunoglobulina intravenosa (Privigen®) y los primeros 4 años de tratamiento con inmunoglobulina subcutánea (Hizentra®) mediante un cuestionario.
ResultadosDurante los años 2008-2019 se han realizado en nuestro centro 175 trasplantes de precursores hematopoyéticos, de los cuáles 143 (82%) superaron los 3 meses postrasplante. De estos, 3 (2%) pacientes presentaron una hipogammaglobulinemia persistente. Los 3 comparten factores descritos en la bibliografía involucrados en la reconstitución inmune. Mediante el cuestionario se observa que el cambio de gammaglobulina intravenosa a subcutánea ha supuesto una gran mejoría en la calidad de vida de los pacientes.
ConclusionesEl origen de la hipogammaglobulinemia crónica de nuestros pacientes presenta diferentes factores, y no se puede atribuir a una sola causa. Debido al limitado número de pacientes no es posible establecer conclusiones a nivel poblacional. Hemos podido observar que el tratamiento de reemplazo con Hizentra® al 20% ha sido igual de eficaz que la vía intravenosa, sin evidenciarse un aumento en las infecciones bacterianas. Además, ha supuesto una mejoría de la calidad de vida y mayor comodidad expresada por los propios pacientes.
Hypogammaglobulinemia in the first months after allogeneic hematopoietic stem cell transplantation (HSCT) is common in pediatric patients. During this phase, replacement therapy with human immunoglobulin must be administered parenterally to prevent infections. In some cases, this hypogammaglobulinemia persists over time, which forces further treatment when the patient is usually no longer a carrier of a central line, making them ideal candidates for subcutaneous replacement therapy.
There is little published literature describing the use of this method in pediatric patients undergoing HSCT, widely described in replacement treatment in children with primary immunodeficiencies with very good results.
Patients and methodsAn observational, descriptive, longitudinal and retrospective study is carried out. During the years 2008–2019, we evaluated all pediatric patients undergoing HSCT in our center with persistent chronic hypogammaglobulinemia (for over a year). The treatment phase with intravenous immunoglobulin (Privigen®) and the first four years of treatment with subcutaneous immunoglobulin (Hizentra®) are evaluated using a questionnaire.
ResultsDuring the years 2008-2019, 175 patients underwent HSCT, 143 (82%) of whom exceeded three months after transplantation. 3 (2%) of them had persistent hypogammaglobulinemia. All three share factors described in the literature involved in immune reconstitution. After analyzing the questionnaire, it is observed that switching from intravenous to subcutaneous gammaglobulin has involved a great improvement in their quality of life.
ConclusionsThe origin of chronic hypogammaglobulinemia in our patients shows different factors and cannot be attributed to a single cause. Due to the limited number of patients no conclusions can be drawn at the population level. We have been able to observe that replacement treatment with Hizentra® 20% has been as effective as the intravenous administration without evidence of an increase in bacterial infections. Furthermore, it has also led to an improvement in quality of life and increased comfort, as the patients themselves have stated.
La hipogammaglobulinemia es una complicación frecuente en los primeros meses después de un trasplante de progenitores hematopoyéticos (TPH) en niños y adultos jóvenes1. Esta se define en general por valores de inmunoglobulina G (IgG) inferiores a 400mg/dl1 o por debajo del nivel inferior normal, especialmente en los niños menores de 2 años.
Este estado se origina por el retraso en la reconstitución de linfocitos B, y por la presencia de bajos niveles de IgG antes del procedimiento1,2. Se han descrito múltiples factores implicados en la reconstitución inmune1–7, entre los que cabe destacar la edad del paciente, enfermedad de base, quimioterapia previa, acondicionamiento del trasplante, uso de rituximab8 (anti-CD20), fuente de los progenitores hematopoyéticos, depleción de linfocitos T, compatibilidad del HLA, estatus serológico frente al virus herpes, enfermedad injerto contra receptor (EICR), tratamiento inmunosupresor, tratamiento antimicrobiano e infusiones de linfocitos del donante.
Mientras que la reconstitución del sistema inmunitario innato1,2,4 (granulocitos, monocitos y células NK) suele ser muy precoz después del trasplante (habitualmente antes de los 3 meses), la reconstitución del sistema inmunitario adquirido (linfocitos T y B) es más tardía. Por esta razón, la producción de anticuerpos no suele verificarse antes de los 6 meses postrasplante. Para las IgM el tiempo puede variar de 3 a 6 meses, mientras que para las IgG suele ser mayor, a partir de 12 meses o más si existen complicaciones como la presencia de enfermedad de injerto contra receptor, en la que puede que no se llegue a alcanzar una recuperación completa de la función humoral4.
Con el objetivo de evitar al máximo las infecciones bacterianas y mitigar las reactivaciones víricas en el primer año postrasplante1,2, se recomienda la administración de gammaglobulinas para mantener niveles superiores a 400mg/dl, aunque siempre se deben ajustar a la edad del paciente, a sus comorbilidades y a la evolución clínica.
El uso de inmunoglobulinas se inició en los pacientes con deficiencia primaria de anticuerpos, inicialmente de forma intramuscular en el año 1980, pasándose posteriormente a la intravenosa1. En ambos casos se presentaban efectos secundarios frecuentes como fiebre, dolor local o cefalea. En 1991 se demostró que la administración de gammaglobulina subcutánea era igual de eficaz, bien tolerada y con menos efectos secundarios9. Hoy en día, un gran porcentaje de pacientes afectos de inmunodeficiencias primarias, con afectación profunda cuantitativa o cualitativa de la síntesis de inmunoglobulinas, reciben el tratamiento de reemplazo con inmunoglobulina subcutánea debido a las ventajas que ofrece su perfil farmacocinético y de reacciones adversas1.
En la fase inmediata postrasplante, el tratamiento con gammaglobulinas se administra vía intravenosa ya que se presupone que será un tratamiento a corto plazo y los pacientes aún conservan el acceso venoso central. Aunque se ha demostrado que el uso de gammaglobulina subcutánea resulta eficaz y seguro en pediatría10, existe poca experiencia en pacientes pediátricos postrasplante1.
Los objetivos primarios de este trabajo son describir los factores que se han observado relacionados con la hipogammaglobulinemia crónica postrasplante en nuestros pacientes y describir mediante una encuesta el grado de satisfacción y calidad de vida con la administración de gammaglobulina subcutánea en domicilio. Como objetivo secundario se describe si existe diferencia frente a las infecciones con el reemplazo de gammaglobulina intravenosa a subcutánea.
Material y métodosSe realiza un estudio observacional, descriptivo y longitudinal de carácter retrospectivo en nuestro centro durante los años 2008-2019. Se evalúan a los pacientes pediátricos con hipogammaglobulinemia crónica (definiendo como tal la que persiste más de un año tras el TPH).
En este estudio se evalúa la fase inicial de tratamiento con inmunoglobulina intravenosa (Privigen®) y los primeros 4 años de tratamiento con inmunoglobulina subcutánea (Hizentra®). Las variables analizadas son la edad del paciente en el diagnóstico y en el momento del trasplante, enfermedad de base, tratamiento quimioterápico previo al trasplante, tipo de acondicionamiento, fuente de precursores hematológicos, identidad HLA, depleción de linfocitos T, tratamiento inmunosupresor, presencia de EICR, infecciones durante la fase postrasplante, niveles de inmunoglobulinas durante el tratamiento sustitutivo y niveles IgG previos al TPH.
Los datos se obtuvieron a través de la historia clínica y mediante una entrevista telefónica, bajo consentimiento informado de los padres. En la primera fase (fase retrospectiva) la entrevista se realizó a los padres de los pacientes debido a la corta edad de estos y la ausencia de recuerdos fidedignos de ese periodo. En esta etapa se evalúa el tratamiento con inmunoglobulina intravenosa. La segunda fase (fase actual) se ha realizado entrevistando al propio paciente (junto con los padres), puesto que actualmente tienen una edad en la que son conscientes de su enfermedad y capaces de valorar el tratamiento con inmunoglobulina subcutánea.
Este cuestionario se diseñó expresamente para nuestro estudio (fig. 1) y se basa en los cuestionarios de calidad de vida pediátricos que se utilizan para la valoración de inmunoglobulinas subcutáneas en los pacientes con inmunodeficiencias primarias (PedsQL, CHQ-PF5011). Los datos se registraron en Microsoft Excel®. El objetivo de esta fase es conocer las diferencias en la calidad de vida entre ambas vías de administración.
Encuesta diseñada exclusivamente para evaluar la calidad de vida de los pacientes con hipogammaglobulinemia crónica postrasplante alogénico de precursores hematopoyéticos durante el tratamiento con IgG intravenosa y el actual tratamiento con IgG subcutánea (puntuación mínima: 0, corresponde a satisfacción total; puntuación máxima: 52, corresponde insatisfacción total).
Durante los años 2008-2019 se han realizado un total de 175 TPH en nuestro centro, de los cuáles 143 (82%) superaron los 3 meses postrasplante. De estos, 3 (2%) presentan un déficit de IgG persistente de más de un año de evolución postrasplante. Los 3 han precisado tratamiento de reemplazo con inmunoglobulina intravenosa al inicio con paso posterior a vía subcutánea.
Los 3 pacientes presentan patologías diferentes por la que se indicó el TPH. Dos de ellos precisaron de un segundo TPH, por fallo del injerto en uno de ellos y recaída hematológica en el otro.
En la tabla 1 se presenta un resumen de las variables estudiadas en los 3 pacientes.
Variables estudiadas en los 3 pacientes que presentaron un déficit de IgG persistente de más de un año de evolución postrasplante de progenitores hematopoyéticos
| Paciente | Diagnóstico | Tandas de quimioterapia | Acondicionamiento | EICR | Tratamiento EICR | Rituximab |
|---|---|---|---|---|---|---|
| 1 | LAL | -SHOP-LAL 2015-LAL recidiva SHOP 2008-LAL refractaria SEHOP 2008 | 1. MA: VP-16, CFM, RCT2. MA: TT, FLU, Bu | Grado III-IV(digestiva, cutánea y hepática) | CsA, MTX, C, MMF, B, FEC, TAC, SIR | Sí |
| 2 | Síndrome Griscelli | HLH-2004: en 3 ocasiones | 1. IR: ALEM, FLU, MEL | Grado II (cutánea) | CsA, MMF, C | Sí |
| 3 | MPS tipo VII (enfermedad de Sly) | 1. IR: ALEM, FLU, MEL2. MA: Bu, CFM, ATG | Grado II (cutánea) | CsA, MMF, C | Sí |
ALEM: alentuzumab; ATG: globulina antitimocítica; B: budesonida; Bu: busulfán; C: corticoides; CFM: ciclofosfamida; CsA: ciclosporina; EICR: enfermedad injerto contra receptor; FEC: fotoaferesis extracorpórea; FLU: fludarabina; IR: intensidad reducida; LAL: leucemia linfoblástica aguda; MA: mieloablativo; MEL: melfalán; MMF: micofenolato; MPS: mucopolisacaridosis; MTX: metotrexate; RCT: radioterapia corporal total; SEHOP: Sociedad Española de Hematología y Oncología Pediátricas; SIR: sirolimus; TAC: tacrolimus; TT: tiotepa; VP-16: etopósido.
Paciente 1 (varón): diagnosticado a los 8 años de edad de leucemia linfoblástica aguda tipo B de alto riesgo. Recibe tratamiento quimioterápico según protocolo LAL SHOP 2005. A los 10 años de edad se diagnostica recidiva hematológica precoz, por lo que recibe tratamiento quimioterápico de recidivas (LAL SHOP 2008) y se realiza primer TPH de médula ósea de hermana HLA idéntica (acondicionamiento mieloablativo con etopósido, ciclofosfamida y radioterapia corporal total), profilaxis EICR con ciclosporina y metotrexate y profilaxis de Pneumocystis jiroveci con cotrimoxazol. A la edad de 12 años se diagnostica segunda recaída hematológica por lo que recibe tratamiento quimioterápico según protocolo LAL refractaria SHOP 2008 (clofarabina, etopósido, ciclofosfamida, citarabina y triple intratecal) con segundo TPH de sangre periférica del mismo donante (acondicionamiento mieloablativo con tiotepa, fludarabina y busulfan ajustado), profilaxis de la EICR con ciclosporina y de Pneumocystis jiroveci con cotrimoxazol. Como complicaciones destacables presenta reactivación del virus Epstein-Barr en el segundo trasplante que precisa tratamiento con rituximab y EICR aguda grado III-IV (digestiva, cutánea y hepática) que precisa adición de tratamiento inmunosupresor con corticoides, micofenolato, budesonida oral, fotoaféresis extracorpórea y posteriormente tacrolimus y sirolimus.
Presenta unos niveles de inmunoglobulina G previos al primer trasplante de 256mg/dl (normalidad: 570-1.570mg/dl). Recibe profilaxis con inmunoglobulina humana intravenosa desde el primer trasplante a dosis crecientes que van desde 0,27-0,66g/kg/4 semana (Privigen®) manteniéndose durante todo este tiempo con valores de media de 677mg/dl, presentando un valle a 190mg/dl coincidiendo con la suspensión temporal del tratamiento.
Se realiza cambio a inmunoglobulina subcutánea iniciando dosis a 0,15g/kg/2 semanas (Hizentra®) a los 5 años tras el segundo trasplante con el que mantiene valores medios de 868mg/dl y con un valor valle de 447mg/dl a los 3 años de tratamiento, por lo que se decide aumentar la dosis sin observar valles posteriores. La dosis al final del estudio es de 0,20g/kg/2 semanas.
No se detectan infecciones bacterianas durante el tratamiento con gammaglobulina intravenosa ni subcutánea.
Respecto a los niveles de linfocitos T-helper, el paciente presenta unos valores entre 100-501/μl durante el primer año postrasplante y 109-344 linfocitos T-helper/μl durante los 3 meses posteriores al segundo trasplante, recuperando posteriormente valores normales por edad (p10: 640 linfocitos T-helper/μl).
Se mantiene en remisión completa de su enfermedad desde el segundo trasplante.
Paciente 2 (varón): diagnosticado a los 4 años de edad de síndrome de Griscelli a raíz de síndrome hemofagocítico asociado a infección por Epstein-Barr, y por el que recibe tratamiento según protocolo HLH-2004 (dexametasona, ciclosporina y etopósido). Ha presentado 3 recidivas tratadas con el mismo protocolo. A los 7 años de edad se realiza TPH de sangre periférica de donante no emparentado con identidad HLA 9/10 (diferencia en un antígeno locus B) con acondicionamiento de intensidad reducida (alentuzumab, fludarabina y melfalan), profilaxis de la EICR con ciclosporina y micofenolato, y de Pneumocystis jiroveci con cotrimoxazol. Como complicaciones destacables presenta EICR aguda grado II (cutánea) que precisa corticoterapia intravenosa y reactivación del virus de Epstein-Barr que se trató con rituximab.
Presenta unos niveles de inmunoglobulina G pre-trasplante de 550mg/dl (normalidad: 571-1.700mg/dl). Recibe profilaxis con inmunoglobulina humana intravenosa desde el trasplante a dosis crecientes que van desde 0,28 a 0,43/kg/4 semana (Privigen®) con el que mantiene en todo momento valores de media de 676mg/dl y valle de 171mg/dl, coincidiendo con la suspensión temporal del tratamiento.
Se realiza cambio a inmunoglobulina subcutánea a dosis iniciales de 0,15g/kg/semana (Hizentra®) a los 6 años del trasplante con lo que presenta niveles medios de IgG de 1.094mg/dl sin valores valle destacables. La dosis al final del estudio es de 0,20g/kg/semana.
No se detectan infecciones bacterianas durante el tratamiento con gammaglobulina intravenosa ni subcutánea.
Con referencia a los niveles de linfocitos T-helper, presenta unos valores entre 136-468/μl/durante 7 meses postrasplante, recuperando posteriormente valores normales por edad (p10: 540 linfocitos T-helper/μl).
El paciente se mantiene en remisión completa de su enfermedad desde el trasplante.
Paciente 3 (mujer): diagnosticada al año de edad de mucopolisacaridosis tipo VII (enfermedad de Sly). A los 2 años de edad se realiza TPH de médula ósea de donante no emparentado HLA idéntico (10/10) con acondicionamiento de intensidad reducida (alentuzumab, fludarabina y melfalan), profilaxis de la EICR con ciclosporina y de Pneumocystis jiroveci con cotrimoxazol. Como complicaciones destacables presenta reactivación de virus Epstein-Barr tratado con rituximab y EICR aguda grado II (cutánea) que precisa corticoterapia intravenosa y micofenolato oral. Los niveles de beta-glucuronidasa se normalizan transitoriamente.
A los 3 años de edad se detecta pérdida del implante y se realiza segundo TPH de sangre de cordón umbilical de donante no emparentado HLA idéntico (10/10) con acondicionamiento mieloablativo (busulfan ajustado, ciclofosfamida y ATG), profilaxis de la EICR con ciclosporina y profilaxis de Pneumocystis jiroveci con cotrimoxazol. Como complicaciones destacables presenta reactivación del virus Epstein-Barr tratado con rituximab en 2 ocasiones y EICR aguda grado II-III (cutáneas y digestiva) que precisa tratamiento con corticoterapia, budesonida oral y tacrolimus.
Presenta unos niveles de inmunoglobulina G previos al primer trasplante de 958mg/dl (normalidad: 383-1.070mg/dl). Recibe profilaxis con inmunoglobulina humana intravenosa desde el primer trasplante a dosis discretamente crecientes y más reducidas en el tiempo, que van desde 0,37g/kg/2 semanas a 0,15g/kg/semana (Privigen®). Se mantiene en todo momento con valores medios de IgG plasmáticos de 707mg/dl, presentando un valle a 138mg/dl coincidiendo con la suspensión temporal del tratamiento.
Se realiza cambio a inmunoglobulina subcutánea a dosis iniciales de 0,17g/kg/2 semanas (Hizentra®) a los 4 años del segundo trasplante con lo que presenta niveles medios de IgG de 623mg/dl sin valores valle destacables. La dosis al final del estudio 0,25g/kg/2 semanas.
No se detectan infecciones bacterianas durante el tratamiento con gammaglobulina intravenosa ni subcutánea.
Respecto a los niveles de linfocitos T-helper, el paciente presenta unos valores entre 9,8-165/μl durante 6 meses tras el primer trasplante y 129-303 linfocitos T-helper/μl durante 10 meses tras el segundo trasplante recuperando posteriormente valores normales por edad (p10: 880 linfocitos T-helper/μl).
Permanece en quimera total del donante y se mantienen niveles normales de beta-glucuronidasa desde el segundo trasplante hasta la actualidad.
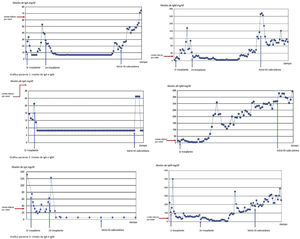
En la figura 2 se muestran las gráficas de evolución de los niveles de IgA e IgM en los 3 pacientes. Como se puede observar en la gráfica del paciente 1, los niveles de IgA aumentan progresivamente a partir de los 4 años tras el segundo trasplante, mientras que los de IgM se recuperan en el período entre trasplantes y posteriormente no vuelven aumentar hasta 4 años tras el segundo trasplante. En el paciente 2 se observa que no recupera en ningún momento niveles de IgA por edad, mientras que sí recupera niveles de IgM por edad a partir del año del TPH. En cuanto al paciente 3, se observa que a partir del segundo trasplante ya no recupera los niveles de IgA mientras que sí recupera niveles de IgM a partir de los 14 meses tras el segundo trasplante.
Evolución de los niveles de IgA e IgM de los 3 pacientes con hipogammaglobulinemia crónica post-TPH. En el paciente 1, los niveles de IgA aumentan progresivamente a partir de los 4 años tras el segundo trasplante, mientras que los de IgM se recuperan en el período entre trasplantes y posteriormente no vuelven aumentar hasta 4 años tras el segundo trasplante. En el paciente 2 se observa que no recupera en ningún momento niveles de IgA por edad, mientras que sí recupera niveles de IgM por edad a partir del año del TPH. En el paciente 3 se observa que a partir del segundo trasplante ya no recupera los niveles de IgA mientras que sí recupera niveles de IgM a partir de los 14 meses tras el segundo trasplante.
Dada la persistencia de necesidad de gammaglobulina intravenosa en todos ellos se realizó estudio fenotípico de células B en sangre periférica hallando una disminución considerable de células B de memoria con cambio de isotipo o switched, que son las productoras de IgG e IgA, lo que podría justificar la hipogammaglobulinemia crónica postrasplante. Por el contrario, el porcentaje de linfocitos B naïve, se encontraba elevado. En la tabla 2 se adjuntan los últimos resultados de cada paciente.
Estudio fenotípico de células B en sangre periférica en los 3 pacientes con hipogammaglobulinemia crónica postrasplante de progenitores hematopoyéticos
| Linfocitos b (CD19+)/Ul | Linfocitos b memoria switched (IgD− CD27+) | Naïve (IgD+ CD27−) | |
|---|---|---|---|
| Paciente 18 años tras el segundo trasplante | 718 | 2,48%Valor de normalidad: p10 4%, p50 10%, p90 16% | 93,66% |
| Paciente 25 años postrasplante | 519 | 3%Valor de normalidad: p10 6%, p50 9%, p90 16% | 94% |
| Paciente 37 años tras el segundo trasplante | 477 | 0,43%Valor de normalidad: p10 6%, p50 9%, p90 16% | 97,22% |
Ante la verificación de la hipogammaglobulinemia crónica se realiza cambio a gammaglobulina subcutánea (Hizentra®) en el año 2015 a los 3 pacientes. Tras realizar educación sanitaria a la familia y al paciente en la técnica de administración del tratamiento, este se continuó en el domicilio con buena tolerancia y alcanzando en los 3 pacientes niveles IgG>400mg/dl durante todo el seguimiento. No se registran infecciones bacterianas durante el mismo.
En los resultados de la encuesta de calidad de vida realizada a los 3 pacientes y a sus padres, todos coinciden en la satisfacción del tratamiento subcutáneo versus el tratamiento intravenoso.
La puntuación media en la encuesta a los padres (fase gammaglobulina intravenosa) es de 37 puntos, mientras que la puntuación media de la encuesta al propio paciente (fase de gammaglobulina subcutánea) es de 2,6 puntos. La puntuación mayor (máximo: 52 puntos) indica más afectación en todos los ítems encuestados (interferencia con las actividades del día a día, sentimientos negativos o dificultad con el sueño, relación con los demás y afectación escolar), mientras que la puntuación menor (mínimo 0 puntos) corresponde a la satisfacción total. Todos los ítems son mejor valorados en la encuesta realizada por el propio paciente con la gammaglobulina subcutánea, lo que evidencia una mayor satisfacción con esta vía de tratamiento.
Los pacientes valoran positivamente el no tener que trasladarse al hospital para la administración del tratamiento y poder continuar con su vida normal. A destacar como comentario añadido de los pacientes números 1 y 3 que refieren, además, gran diferencia ante los efectos secundarios que les ocasionaba el tratamiento intravenoso (cefalea y dolores generalizados en ambos casos) y que no presentan con la administración subcutánea. Ninguno manifiesta complicaciones locales con la administración de gammaglobulina subcutánea durante este tiempo, salvo «leve dolor con el pinchazo» en la paciente número 3, la más joven de edad.
DiscusiónEn el TPH, la reconstitución inmunológica se acompaña de una fase de hipogammaglobulinemia que se suele resolver en los meses posteriores; pero en algunos casos esta recuperación no se produce, con persistencia de una hipogammaglobulinemia crónica que se prolonga más allá del año post-TPH. En el estudio de Sudin M, et al.1,2 se detecta una proporción entre el 371 y el 48%2 de los niños con hipogammaglobulinemia superior a 3 meses post-TPH, aunque no se describe la incidencia de hipogammaglobulinemia persistente como la que muestran nuestros pacientes con necesidad de remplazamiento externo mantenido que ha demostrado su eficacia para la prevención de infecciones1. A pesar de que esta substitución tiene beneficios potenciales, implica numerosas visitas hospitalarias de duración considerable, efectos secundarios y gastos económicos elevados.
El objetivo de este estudio es describir las características de los pacientes que desarrollan una hipogammaglobulinemia crónica, así como conocer el grado de satisfacción con el cambio de inmunoglobulina subcutánea como tratamiento crónico. De forma secundaria, se pretende evaluar las infecciones asociadas durante el tratamiento sustitutivo con gammaglobulina y si existen diferencias entre ambas vías de administración.
En nuestro estudio con 175 pacientes, 3 de ellos (2%) desarrollaron hipogammaglobulinemia crónica postrasplante. Los 3 pacientes comparten factores descritos en la bibliografía involucrados en una reconstitución inmune pobre o incompleta como son la edad precoz del trasplante, diagnóstico de base onco-hematológico, tratamiento con rituximab por reactivación del virus Epstein-Barr, acondicionamiento mieloablativo (en 2 pacientes) y tratamiento inmunosupresor por presencia de EICR.
El rituximab es un anticuerpo monoclonal que se une al receptor CD20 de las células B. Las células B naïve (CD20+ IgD+ CD27−) se forman en la médula ósea y migran a los órganos linfoides secundarios para su diferenciación en células B de memoria con cambio isotipo o switched (CD20+ IgD− CD27+). Posteriormente, recirculan hacia la sangre periférica y hacia los tejidos linfáticos o se convierten en células plasmáticas permaneciendo en la médula ósea. El receptor CD20 es expresado únicamente en las células B que se encuentran en sangre periférica y no se expresa en células plasmáticas. Por ello, el anticuerpo anti-CD20 no afecta a dichas células y, por tanto, no se genera una depleción completa de los linfocitos B12.
Unos niveles bajos de células B de memoria switched y un aumento de células B naïve, como muestran nuestros pacientes, se ha descrito durante la reconstitución posterior al tratamiento con rituximab12. Esto sugiere que la predominancia de células B naïve durante la reconstitución podría contribuir a la duración de la hipogammaglobulinemia. Esta población incluye las células B reguladoras que previenen la recaída de la enfermedad hematológica al promover la tolerancia inmunológica mediante la producción de IL-10, IL35 y TGF-β que suprimen la expansión de linfocitos proinflamatorios12. Nuestros pacientes mantienen en sus últimos análisis valores anormalmente altos de células B naïve y valores de células B memoria switched por debajo del percentil 10 de normalidad por edad13, hecho que explica la persistencia de hipogammaglobulinemia G y la necesidad de administración externa.
Se ha reportado que la incidencia de hipogammaglobulinemia transitoria o persistente después del uso de rituximab en adultos varía entre el 15 y el 40%3. En los casos de hipogammaglobulinemia persistente se han descrito otros factores concomitantes como los regímenes asociados con fludarabina, ciclofosfamida o micofenolato de mofetil (este último inhibe la síntesis de los ácidos nucleicos y previene la activación de las células B y T)14. Los 3 fármacos están presentes en los tratamientos de nuestros pacientes. En otros casos resulta de una inmunodeficiencia primaria encubierta12, por lo que la etiología de la hipogammaglobulinemia persistente se considera multifactorial.
En el estudio de Sudin M, et al.2 (2015) se observa que los pacientes más jóvenes, los que presentan EICR y aquellos con niveles más altos de IL6 y IL7 pre-trasplante presentan con mayor frecuencia hipogammaglobulinemia persistente. Estas interleucinas mantienen a los linfocitos B en su fase más inmadura o estadios transicionales e inhabilitan el cambio de isotipo de inmunoglobulina, que explicaría por qué los pacientes con hipogammaglobulinemia G tienen niveles aceptables de IgM y pobres en IgA, como también hemos observado en nuestros pacientes. Además, se debe considerar que los bajos niveles de linfocitos T-helper tras un TPH, como también presentan nuestros pacientes, contribuyen a la hipogamaglobulinemia G. Los linfocitos T-helper son necesarios para el cambio de isotipo de inmunoglobulina, y en ausencia de ellos el linfocito B es activado por antígenos independientes del timo, con producción de IgM, pero no de IgA ni de IgG.
Después de un TPH los pacientes presentan una susceptibilidad aumentada para infecciones víricas, bacterianas y fúngicas. Este aumento de riesgo es debido, en parte, a la hipogammaglobulinemia que se produce en el periodo inicial tras el TPH. Generalmente, la recuperación de los linfocitos B se produce entre los 6 y 9 meses postrasplante, la IgM lo hace entre los 4 y 6 meses, mientras que la normalización de la IgG puede retrasarse hasta 12 meses o más en caso de complicaciones1, por lo que la administración profiláctica de IgG intravenosa es necesaria en estos casos. A pesar de que actualmente las guías no recomiendan la administración rutinaria en todos los pacientes, sí que propone al menos mantener unos niveles de IgG ≥400mg/dl para disminuir el número de infecciones, lo que sí ha demostrado ser efectivo en numerosos estudios1,15.
En el caso de nuestros pacientes, los 3 recibieron IgG intravenosa de forma profiláctica manteniendo niveles superiores a 400mg/dl durante el tiempo que permanecen con hipogammaglobulinemia. Con el paso del tratamiento a vía subcutánea, no se registran diferencias a nivel de infecciones bacterianas, manteniéndose libres de dicha complicación durante todo el seguimiento del estudio.
Se ha evaluado en numerosos estudios la eficacia de las inmunoglobulinas por vía subcutánea en pacientes adultos y en niños menores de 12 años10,16 con inmunodeficiencias primarias y secundarias10,17–22, e incluso en niños menores de 5 años20, sin demostrar diferencias estadísticamente significativas respecto al número y la gravedad de las infecciones18,21,22.
En el estudio de Sudin M, et al.1 (2012) se compara el uso de inmunoglobulina subcutánea con intravenosa en pacientes pediátricos sometidos a TPH, encontrando que los pacientes que reciben tratamiento vía subcutánea presentan mayor estabilidad en los niveles de IgG con menos efectos secundarios y sin diferencias significativas en cuanto al número de infecciones. A nivel familiar fue bien valorada y se agradeció la reducción de visitas médicas. No se registraron dificultades durante el aprendizaje de la administración de gammaglobulina subcutánea.
Considerando las limitaciones de nuestro estudio (bajo número de pacientes, encuesta no validada y retrospectiva realizada a padres la primera e hijos la segunda) hemos observado que para los 3 pacientes el cambio de gammaglobulina intravenosa a subcutánea ha supuesto una gran mejora en su calidad de vida. Aunque el cuestionario utilizado no esté validado, nuestros resultados coinciden con los datos descritos en la bibliografía con un aumento de los índices de calidad de vida y satisfacción del paciente23–26, tanto en adultos como en niños que han recibido inmunoglobulina subcutánea afectos de una inmunodeficiencia primaria.
Además de la eficacia demostrada y de la experiencia positiva con las inmunoglobulinas subcutáneas, se ha demostrado también una reducción del coste27-30 y de las necesidades de visitas hospitalarias. Es por ello, que parece razonable ofrecer este tratamiento a los pacientes que ya no tienen acceso por vía venosa central, que siguen precisando tratamiento sustitutivo con inmunoglobulinas tras el trasplante y que no requieren ingreso hospitalario.
ConclusionesA pesar del limitado número de pacientes de este estudio, que impide establecer conclusiones a nivel poblacional, podemos afirmar que el tratamiento de reemplazo con gammaglobulina subcutánea, Hizentra® al 20%, ha sido igual de eficaz que la vía intravenosa sin evidenciarse un aumento en las infecciones bacterianas. Además, ha supuesto una mejoría de la calidad de vida y mayor comodidad expresada por los propios pacientes. La flexibilidad que ofrece este tratamiento supone un gran avance para los pacientes pediátricos que requieren continuadas visitas al hospital.
En lo referente al origen de la hipogammaglobulinemia crónica tras un TPH podemos observar que los pacientes presentan diferentes factores que podrían justificarlo. Cabe destacar el uso de rituximab como el más evidente y relacionado directamente en la reconstitución inmunológica de las células B de memoria switched. A pesar de esto, los 3 pacientes comparten muchos otros factores concomitantes, y por ende no es posible atribuirlo a esta única causa.
FinanciaciónBeca IgMAPs recibida el 13/09/17.
Conflicto de interesesEste estudio ha sido realizado gracias a una beca IgMAPs del laboratorio CSL Behring. «CSL Behring S.A provided medical writing support and grant, having no role in the review or development of the publication».