En los últimos años se ha producido un cambio en el concepto del crecimiento intrauterino retardado (CIR), pasando de estar definido únicamente por criterios de peso a estar definido y estadificado por criterios doppler. Este estudio pretende evaluar el riesgo neonatal de una cohorte de neonatos con CIR precoz moderado-grave definidos por criterios doppler.
Población y métodosSe realizó un estudio multicéntrico de cohortes prospectivo en el que se incluyó una cohorte de neonatos con restricción de crecimiento intrauterino precoz con doppler alterado, y una cohorte de control sin alteraciones doppler, pareada por sexo y edad gestacional.
ResultadosSe incluyeron un total de 105 pacientes (50 casos, 55 controles). Se encontró mayor morbilidad respiratoria en el grupo CIR, con mayor necesidad de surfactante (30 vs. 27,3%, OR 5,3 [IC95% 1,1-26,7]), mayor necesidad de oxígeno suplementario (66 vs. 49,1%, OR 5,6 [IC95%1,5-20,5]), y menor supervivencia sin displasia broncopulmonar (70 vs. 87,3%, OR 0,16 [IC95% 0,03-0.99]). Los pacientes CIR requirieron un ingreso más prolongado y más días de nutrición parenteral, y presentaron una mayor incidencia de alteraciones hematológicas como neutropenia y trombocitopenia. El valor de lactato al nacimiento fue mayor en el subgrupo de CIR grave (6,12 vs. 2,4mg/dl, p=0,02).
ConclusionesEl diagnóstico de CIR precoz moderado-grave definido por criterios doppler conlleva un mayor riesgo de morbilidad respiratoria, nutricional y hematológica, independiente del peso y la edad gestacional. Estos pacientes, por tanto, deben ser considerados de mayor riesgo que pretérminos constitucionalmente de bajo peso o pretérminos no CIR.
In recent years, there has been a change in the conceptualization of fetal growth restriction (FGR), which has gone from being defined solely based on weight criteria to being defined and staged based on Doppler criteria. The aim of our study was to evaluate neonatal risk in a cohort of neonates with moderate to severe early-onset FGR defined by Doppler criteria.
Population and methodsWe conducted a multicentre prospective cohort study in a cohort of neonates with early-onset fetal growth restriction and abnormal Doppler findings, and a control cohort without Doppler abnormalities matched for sex and gestational age.
ResultsA total of 105 patients (50 cases, 55 controls) were included. We found a higher frequency of respiratory morbidity in the FGR group, with an increased need of surfactant (30 vs. 27.3%; OR 5.3 [95% CI 1.1-26.7]), an increased need for supplemental oxygen (66 vs. 49.1%; OR 5.6 [95% CI 1.5-20.5]), and a decreased survival without bronchopulmonary dysplasia (70 vs. 87.3%; OR 0.16 [95% CI 0.03-0.99]). Patients with FGR required a longer length of stay and more days of parenteral nutrition and had a higher incidence of haematological abnormalities such as neutropenia and thrombopenia. The lactate level at birth was higher in the severe FGR subgroup (6.12 vs. 2.4mg/dL; P=.02).
ConclusionsThe diagnosis of early-onset moderate to severe FGR defined by Doppler criteria carries a greater risk of respiratory, nutritional and haematological morbidity, independently of weight and gestational age. These patients, therefore, should be considered at increased risk compared to constitutionally small for gestational age preterm infants or preterm infants without FGR.
La introducción de la ecografía-doppler en el estudio prenatal en las mujeres embarazadas ha provocado un gran cambio en el seguimiento del feto con bajo peso para la edad gestacional, sobre todo en el de presentación más precoz1. Se ha pasado de un estudio puramente morfológico a un estudio funcional con la evaluación doppler. Tras la realización de estudios multicéntricos adecuados2,3, se ha podido avanzar en la distinción del feto con retraso de crecimiento intrauterino de causa placentaria y aquel con bajo peso constitucional, que son más de la mitad de los niños de bajo peso para la edad gestacional4,5.
Los protocolos actuales6,7 permiten una estadificación en función de la gravedad de la insuficiencia placentaria, lo que ayuda a decidir la finalización del embarazo y la vía de parto8. En nuestro país estos protocolos se han implantado de modo muy rápido en la mayoría de los centros hospitalarios y han cambiado de modo sustancial el manejo perinatal del recién nacido con crecimiento intrauterino retardado (CIR). Es por estos protocolos que las unidades de neonatología tienen ingresos por prematuridad «iatrogénica» en niños CIR precoces de grado moderado o grave con finalización del embarazo programada sin presentar un registro fetal gravemente alterado o indicación materna para la finalización (normalmente por preeclampsia grave), que eran las indicaciones de finalización que habrían tenido hace unos años. Estudios recientes han mostrado que estos protocolos han reducido la incidencia de complicaciones graves prenatales, como el desprendimiento de placenta o la muerte fetal intraútero, manifestación final y más grave de la insuficiencia placentaria9–11.
Sin embargo, toda esta nueva información ha sido poco analizada en estudios que evalúen específicamente la morbilidad en el recién nacido en función de datos doppler prenatales. La mayoría de los registros y bases de datos poblacionales que promueven las sociedades científicas al respecto de la prematuridad o el bajo peso no incluyen variables doppler y siguen estudiando a los niños pretérmino con bajo peso para la edad gestacional12. Por estos estudios sabemos que los neonatos que nacen con un percentil menor del 10% presentan una mayor morbilidad, pero en este grupo tan heterogéneo un gran número de pacientes son recién nacidos constitucionalmente pequeños que no han tenido propiamente una restricción en su crecimiento, lo que, por tanto, implica un potencial sesgo de selección que contribuiría a diluir la influencia en la morbilidad del diagnóstico de CIR. Conocer esta información es importante para el manejo de estos pacientes en el paritorio, en la unidad neonatal y durante su seguimiento, al ser pacientes de potencial riesgo de trastornos en su neurodesarrollo13.
Con esta premisa fue realizado este estudio, cuyo objetivo principal consistió en crear de modo prospectivo una cohorte de recién nacidos con insuficiencia placentaria precoz definida con criterios doppler, y compararla con una cohorte de recién nacidos pretérmino pareada por sexo y edad gestacional en la que el estudio doppler funcional de la placenta fuese normal.
Material y métodosSe realizó un estudio multicéntrico de cohortes prospectivo en 7 unidades de neonatología de la red sanitaria pública durante un periodo de 33 meses (noviembre 2019-agosto 2022).
Se incluyó una cohorte de niños pretérmino con fallo placentario avanzado (CIR>I) por criterios doppler prenatal, y una cohorte de control con niños pretérmino pareados por edad gestacional y sexo sin ninguna alteración en el control doppler prenatal.
Para los criterios doppler en el diagnóstico y estadificación de los pacientes con insuficiencia placentaria (CIR) se utilizó la clasificación de Figueras y Gratacos8. En los casos se seleccionaron pacientes con alteración en doppler en la arteria umbilical con diástole cero o flujo reverso en la arteria umbilical, con independencia de la presencia o no de redistribución de flujo definida por alteración en doppler en la arteria cerebral media o alteración en la función cardíaca fetal definida por alteración en el ductus venoso fetal.
Se excluyeron los casos con síndrome genético, síndrome polimalformativo o infección congénita. Se excluyeron neonatos con gestación gemelar monocorial, al no estar suficientemente evaluado el estudio doppler en este grupo de pacientes.
El manejo en la sala de partos y el ingreso en la unidad neonatal se realizaron conforme a los protocolos de cada unidad.
Todas las variables se anotaron en un cuaderno de recogida de datos. Las variables demográficas, de seguimiento prenatal incluyendo estudio doppler, manejo en sala de partos, somatométricas, hematimetría al ingreso y evolución posnatal durante el ingreso se obtuvieron de sus historias clínicas. La displasia broncopulmonar (DBP) se definió como la necesidad de oxígeno durante más de 28 días. La enterocolitis necrosante (ECN) se definió por la escala de Bell modificada desde el primer estadio de sospecha ia, creando una variable diferente para recoger la ECN que precisó tratamiento quirúrgico. La retinopatía del prematuro se definió como cualquier grado de retinopatía que presentase el paciente en la clasificación internacional de retinopatía de la Academia Americana de Oftalmología.
Se realizó un análisis descriptivo de todas las variables, expresando las cuantitativas como media, desviación típica, mediana y rango, y las cualitativas como valor absoluto y porcentaje. Para la comparación de variables cualitativas se utilizó el test de chi-cuadrado. La comparación de medias se realizó, tras comprobar la normalidad, con el test de Kolmogorov-Smirnov, con la t de Student o con la U de Mann-Whitney, según procediese. Se estudió la asociación de variables cuantitativas con el coeficiente de correlación de Spearman. Se realizaron análisis multivariantes de regresión logística binomial ajustados por Z-score de peso en la comparación de las 2 cohortes principales, y por peso y edad gestacional en el análisis de subgrupos. Se consideraron significativos valores de p<0,05, con un planteamiento bilateral. Todos los análisis se realizaron con el programa estadístico SPSS® v. 24.0.
Previamente al inicio del estudio se obtuvo la aprobación por parte del Comité de Ética de la Investigación del centro promotor (código registro 2019/425). De todos los pacientes se obtuvo el consentimiento informado escrito firmado por padres o tutores.
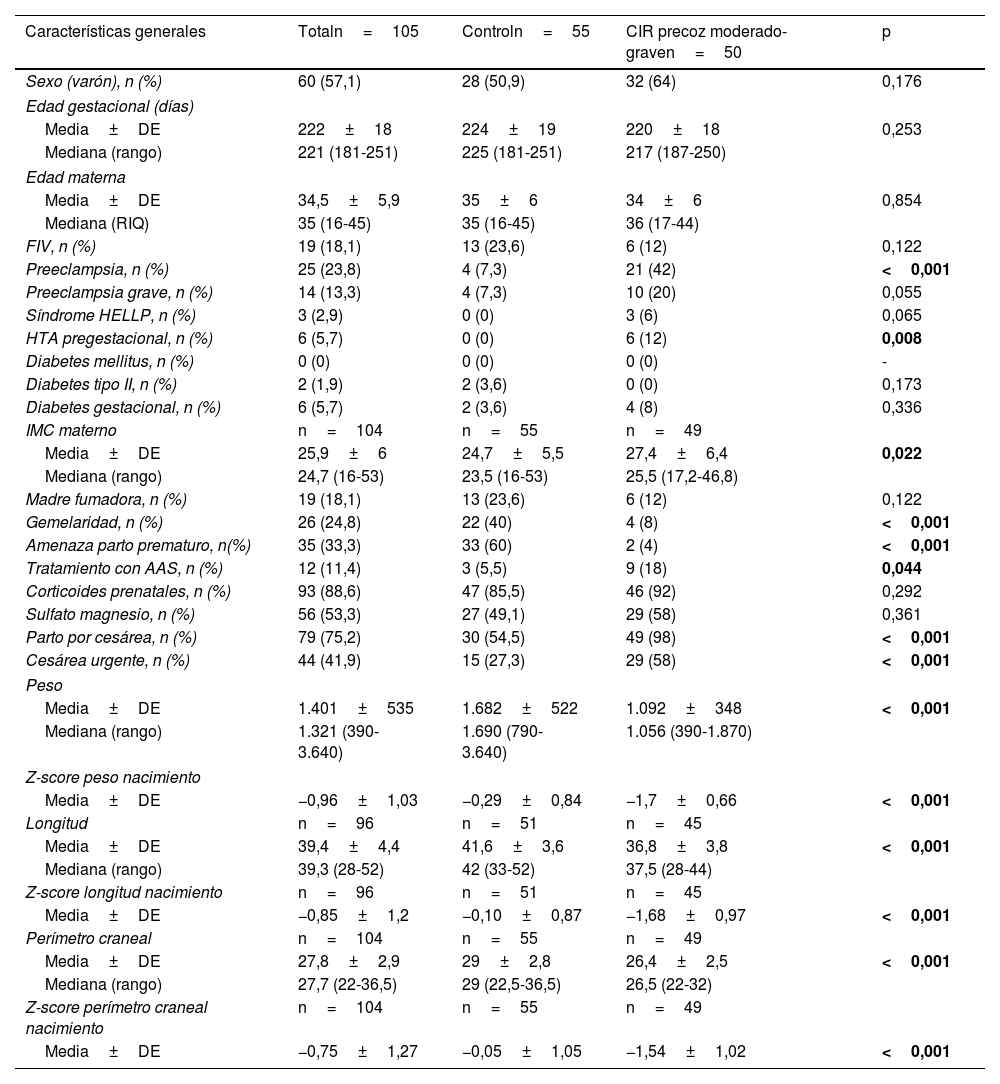
ResultadosSe estudiaron un total de 105 pacientes, 55 del grupo control y 50 casos en el grupo de insuficiencia placentaria moderada o grave. Dentro de los casos, 18 pacientes fueron clasificados como CIR grave (iii o iv) y 32 como CIR moderado (ii).
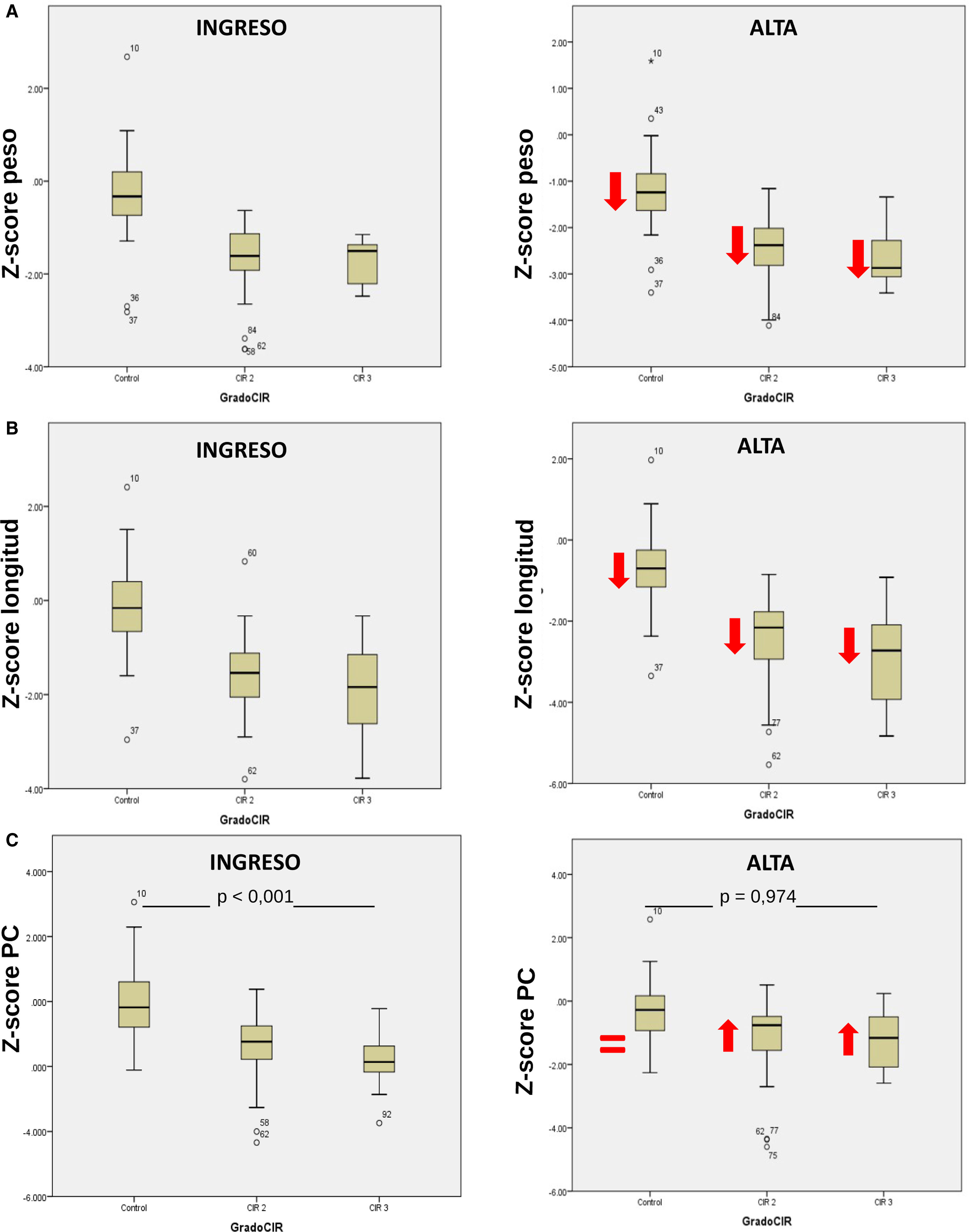
Las características generales de los pacientes incluidos en el estudio se muestran en la tabla 1. En la figura 1 se presenta un diagrama de cajas con la somatometría al ingreso y a las 36 semanas de edad corregida de los pacientes del grupo control y por subgrupos CIR II y CIR III.
Características generales de la serie
| Características generales | Totaln=105 | Controln=55 | CIR precoz moderado-graven=50 | p |
|---|---|---|---|---|
| Sexo (varón), n (%) | 60 (57,1) | 28 (50,9) | 32 (64) | 0,176 |
| Edad gestacional (días) | ||||
| Media±DE | 222±18 | 224±19 | 220±18 | 0,253 |
| Mediana (rango) | 221 (181-251) | 225 (181-251) | 217 (187-250) | |
| Edad materna | ||||
| Media±DE | 34,5±5,9 | 35±6 | 34±6 | 0,854 |
| Mediana (RIQ) | 35 (16-45) | 35 (16-45) | 36 (17-44) | |
| FIV, n (%) | 19 (18,1) | 13 (23,6) | 6 (12) | 0,122 |
| Preeclampsia, n (%) | 25 (23,8) | 4 (7,3) | 21 (42) | <0,001 |
| Preeclampsia grave, n (%) | 14 (13,3) | 4 (7,3) | 10 (20) | 0,055 |
| Síndrome HELLP, n (%) | 3 (2,9) | 0 (0) | 3 (6) | 0,065 |
| HTA pregestacional, n (%) | 6 (5,7) | 0 (0) | 6 (12) | 0,008 |
| Diabetes mellitus, n (%) | 0 (0) | 0 (0) | 0 (0) | - |
| Diabetes tipo II, n (%) | 2 (1,9) | 2 (3,6) | 0 (0) | 0,173 |
| Diabetes gestacional, n (%) | 6 (5,7) | 2 (3,6) | 4 (8) | 0,336 |
| IMC materno | n=104 | n=55 | n=49 | |
| Media±DE | 25,9±6 | 24,7±5,5 | 27,4±6,4 | 0,022 |
| Mediana (rango) | 24,7 (16-53) | 23,5 (16-53) | 25,5 (17,2-46,8) | |
| Madre fumadora, n (%) | 19 (18,1) | 13 (23,6) | 6 (12) | 0,122 |
| Gemelaridad, n (%) | 26 (24,8) | 22 (40) | 4 (8) | <0,001 |
| Amenaza parto prematuro, n(%) | 35 (33,3) | 33 (60) | 2 (4) | <0,001 |
| Tratamiento con AAS, n (%) | 12 (11,4) | 3 (5,5) | 9 (18) | 0,044 |
| Corticoides prenatales, n (%) | 93 (88,6) | 47 (85,5) | 46 (92) | 0,292 |
| Sulfato magnesio, n (%) | 56 (53,3) | 27 (49,1) | 29 (58) | 0,361 |
| Parto por cesárea, n (%) | 79 (75,2) | 30 (54,5) | 49 (98) | <0,001 |
| Cesárea urgente, n (%) | 44 (41,9) | 15 (27,3) | 29 (58) | <0,001 |
| Peso | ||||
| Media±DE | 1.401±535 | 1.682±522 | 1.092±348 | <0,001 |
| Mediana (rango) | 1.321 (390-3.640) | 1.690 (790-3.640) | 1.056 (390-1.870) | |
| Z-score peso nacimiento | ||||
| Media±DE | −0,96±1,03 | −0,29±0,84 | −1,7±0,66 | <0,001 |
| Longitud | n=96 | n=51 | n=45 | |
| Media±DE | 39,4±4,4 | 41,6±3,6 | 36,8±3,8 | <0,001 |
| Mediana (rango) | 39,3 (28-52) | 42 (33-52) | 37,5 (28-44) | |
| Z-score longitud nacimiento | n=96 | n=51 | n=45 | |
| Media±DE | −0,85±1,2 | −0,10±0,87 | −1,68±0,97 | <0,001 |
| Perímetro craneal | n=104 | n=55 | n=49 | |
| Media±DE | 27,8±2,9 | 29±2,8 | 26,4±2,5 | <0,001 |
| Mediana (rango) | 27,7 (22-36,5) | 29 (22,5-36,5) | 26,5 (22-32) | |
| Z-score perímetro craneal nacimiento | n=104 | n=55 | n=49 | |
| Media±DE | −0,75±1,27 | −0,05±1,05 | −1,54±1,02 | <0,001 |
AAS: ácido acetil salicílico; CIR: crecimiento intrauterino retardado; DE: desviación estándar; FIV: fecundación in vitro; IMC: índice de masa corporal; RIQ: rango intercuartílico.
En negrita se resaltan las diferencias estadísticamente significativas entre ambos grupos.
Diagramas de cajas de los valores somatométricos del grupo control y por subgrupos, al ingreso y a las 36 semanas de edad corregida. (A) Z-score de peso en el grupo control, CIR moderado y grave al ingreso y a las 36 semanas. Las flechas muestran una tendencia a la disminución en Z-score en cada subgrupo como ejemplo de la restricción de crecimiento extrauterino que padecieron. (B) Z-score de longitud al ingreso y a las 36 semanas en cada subgrupo. Las flechas muestran una disminución respecto a la media de ingreso en cada subgrupo. (C) Z-score del perímetro craneal al ingreso y las 36 semanas. El grupo control no muestra reducción respecto al ingreso, el PC del CIR moderado y del CIR grave muestran un crecimiento recuperador o catch-up precoz sin diferencias significativas a las 36 semanas.
En cuanto a los datos doppler, 32 pacientes presentaron diástole cero en el estudio del índice de pulsatilidad (IP) en la arteria umbilical, por lo que fueron definidos como CIR moderado o CIR II. De estos, 27 pacientes (84,4%) presentaron un IP en la arteria cerebral media menor al 5% como signo de redistribución de flujo cerebral y ningún paciente mostró alteración doppler en el ductus venoso atribuible a afectación cardíaca fetal. El resto de los casos (18 pacientes) presentó un flujo retrógrado en el IP de la arteria umbilical, por lo que fueron definidos como CIR grave o CIR III. Todos los pacientes con CIR grave presentaron alteración en IP en la arteria cerebral media<5% y 15/18 pacientes presentaron alteración en el doppler del ductus venoso como signo de fallo cardíaco fetal, 11 con IP elevado por encima del 95% y 4 con flujo reverso en el ductus venoso.
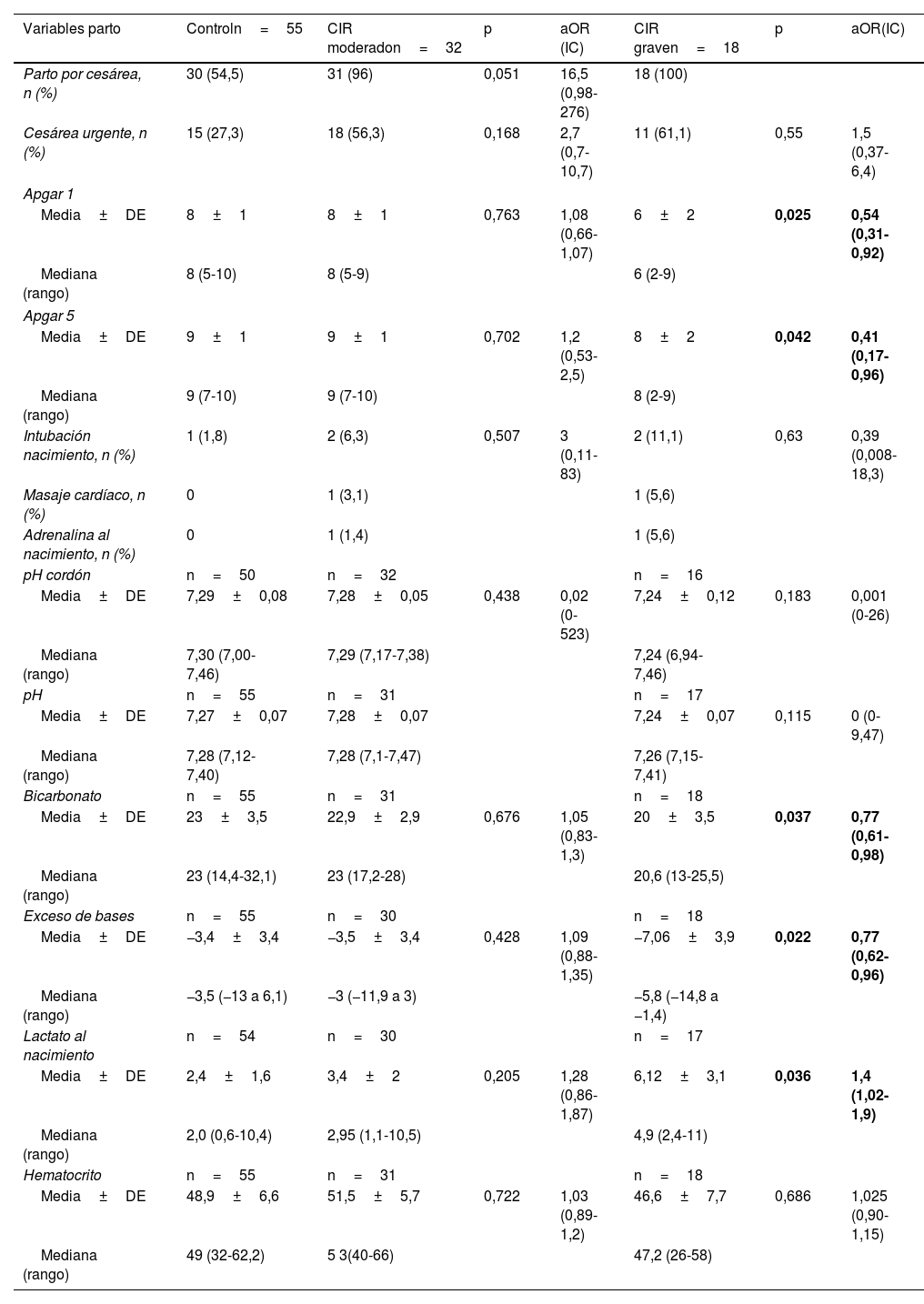
En la tabla 2 se muestran las variables del manejo perinatal inmediato del grupo control y por subgrupos; los valores de lactato al nacimiento de esta tabla se muestran gráficamente en la figura 2, donde se observa un peor estado al nacimiento, con menores valores de Apgar y datos analíticos de mayor acidosis láctica en el CIR grave.
Análisis de regresión logística multivariante por grupos. Variables del periodo perinatal inmediato
| Variables parto | Controln=55 | CIR moderadon=32 | p | aOR (IC) | CIR graven=18 | p | aOR(IC) |
|---|---|---|---|---|---|---|---|
| Parto por cesárea, n (%) | 30 (54,5) | 31 (96) | 0,051 | 16,5 (0,98-276) | 18 (100) | ||
| Cesárea urgente, n (%) | 15 (27,3) | 18 (56,3) | 0,168 | 2,7 (0,7-10,7) | 11 (61,1) | 0,55 | 1,5 (0,37-6,4) |
| Apgar 1 | |||||||
| Media±DE | 8±1 | 8±1 | 0,763 | 1,08 (0,66-1,07) | 6±2 | 0,025 | 0,54 (0,31-0,92) |
| Mediana (rango) | 8 (5-10) | 8 (5-9) | 6 (2-9) | ||||
| Apgar 5 | |||||||
| Media±DE | 9±1 | 9±1 | 0,702 | 1,2 (0,53-2,5) | 8±2 | 0,042 | 0,41 (0,17-0,96) |
| Mediana (rango) | 9 (7-10) | 9 (7-10) | 8 (2-9) | ||||
| Intubación nacimiento, n (%) | 1 (1,8) | 2 (6,3) | 0,507 | 3 (0,11-83) | 2 (11,1) | 0,63 | 0,39 (0,008-18,3) |
| Masaje cardíaco, n (%) | 0 | 1 (3,1) | 1 (5,6) | ||||
| Adrenalina al nacimiento, n (%) | 0 | 1 (1,4) | 1 (5,6) | ||||
| pH cordón | n=50 | n=32 | n=16 | ||||
| Media±DE | 7,29±0,08 | 7,28±0,05 | 0,438 | 0,02 (0-523) | 7,24±0,12 | 0,183 | 0,001 (0-26) |
| Mediana (rango) | 7,30 (7,00-7,46) | 7,29 (7,17-7,38) | 7,24 (6,94-7,46) | ||||
| pH | n=55 | n=31 | n=17 | ||||
| Media±DE | 7,27±0,07 | 7,28±0,07 | 7,24±0,07 | 0,115 | 0 (0-9,47) | ||
| Mediana (rango) | 7,28 (7,12-7,40) | 7,28 (7,1-7,47) | 7,26 (7,15-7,41) | ||||
| Bicarbonato | n=55 | n=31 | n=18 | ||||
| Media±DE | 23±3,5 | 22,9±2,9 | 0,676 | 1,05 (0,83-1,3) | 20±3,5 | 0,037 | 0,77 (0,61-0,98) |
| Mediana (rango) | 23 (14,4-32,1) | 23 (17,2-28) | 20,6 (13-25,5) | ||||
| Exceso de bases | n=55 | n=30 | n=18 | ||||
| Media±DE | −3,4±3,4 | −3,5±3,4 | 0,428 | 1,09 (0,88-1,35) | −7,06±3,9 | 0,022 | 0,77 (0,62-0,96) |
| Mediana (rango) | −3,5 (−13 a 6,1) | −3 (−11,9 a 3) | −5,8 (−14,8 a −1,4) | ||||
| Lactato al nacimiento | n=54 | n=30 | n=17 | ||||
| Media±DE | 2,4±1,6 | 3,4±2 | 0,205 | 1,28 (0,86-1,87) | 6,12±3,1 | 0,036 | 1,4 (1,02-1,9) |
| Mediana (rango) | 2,0 (0,6-10,4) | 2,95 (1,1-10,5) | 4,9 (2,4-11) | ||||
| Hematocrito | n=55 | n=31 | n=18 | ||||
| Media±DE | 48,9±6,6 | 51,5±5,7 | 0,722 | 1,03 (0,89- 1,2) | 46,6±7,7 | 0,686 | 1,025 (0,90-1,15) |
| Mediana (rango) | 49 (32-62,2) | 5 3(40-66) | 47,2 (26-58) | ||||
aOR: odds ratio ajustada por peso+edad gestacional; CIR: crecimiento intrauterino retardado; DE: desviación estándar; IC: intervalo de confianza.
En negrita se resaltan las diferencias estadísticamente significativas.
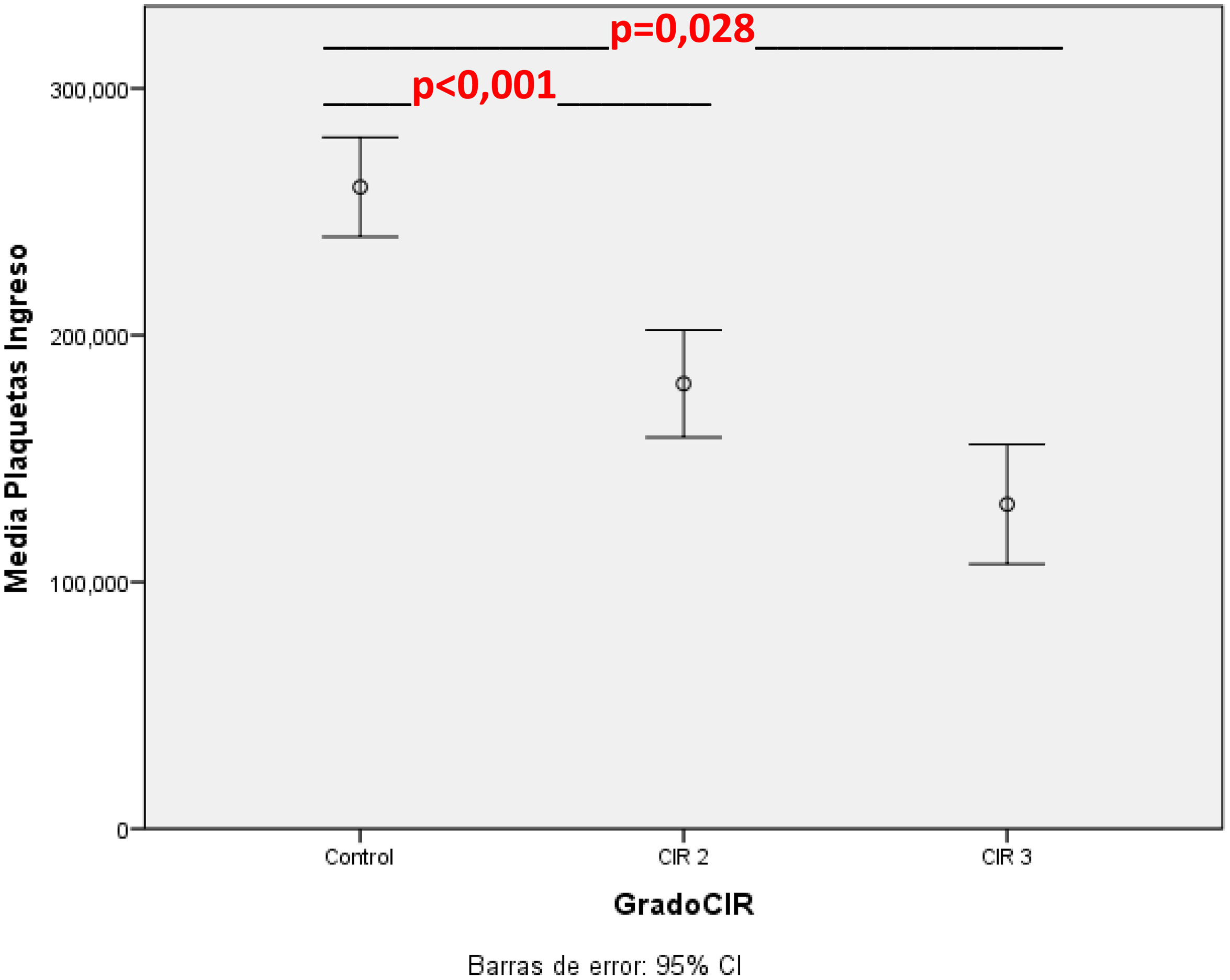
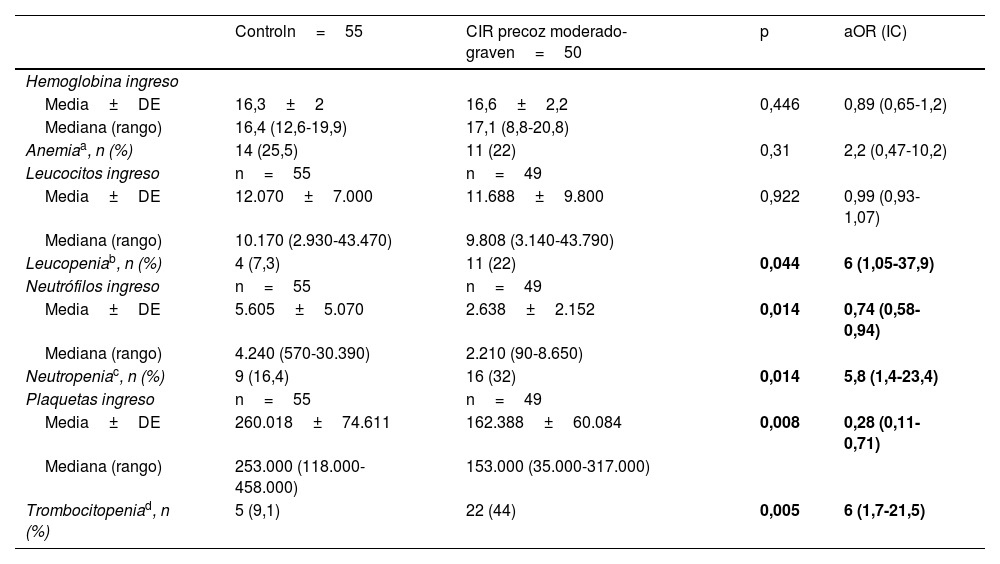
En la tabla 3 se muestran los valores de hematimetría al ingreso por cohortes, corregida por Z-score de peso, donde se observa una mayor incidencia de trombocitopenia y neutropenia en el grupo CIR moderado-grave. La distribución de los valores del recuento plaquetario en el grupo control y por subgrupos se muestra gráficamente en la figura 3.
Valores de hematimetría al ingreso por cohortes, análisis de regresión logística corregida por Z-score de peso
| Controln=55 | CIR precoz moderado-graven=50 | p | aOR (IC) | |
|---|---|---|---|---|
| Hemoglobina ingreso | ||||
| Media±DE | 16,3±2 | 16,6±2,2 | 0,446 | 0,89 (0,65-1,2) |
| Mediana (rango) | 16,4 (12,6-19,9) | 17,1 (8,8-20,8) | ||
| Anemiaa, n (%) | 14 (25,5) | 11 (22) | 0,31 | 2,2 (0,47-10,2) |
| Leucocitos ingreso | n=55 | n=49 | ||
| Media±DE | 12.070±7.000 | 11.688±9.800 | 0,922 | 0,99 (0,93-1,07) |
| Mediana (rango) | 10.170 (2.930-43.470) | 9.808 (3.140-43.790) | ||
| Leucopeniab, n (%) | 4 (7,3) | 11 (22) | 0,044 | 6 (1,05-37,9) |
| Neutrófilos ingreso | n=55 | n=49 | ||
| Media±DE | 5.605±5.070 | 2.638±2.152 | 0,014 | 0,74 (0,58-0,94) |
| Mediana (rango) | 4.240 (570-30.390) | 2.210 (90-8.650) | ||
| Neutropeniac, n (%) | 9 (16,4) | 16 (32) | 0,014 | 5,8 (1,4-23,4) |
| Plaquetas ingreso | n=55 | n=49 | ||
| Media±DE | 260.018±74.611 | 162.388±60.084 | 0,008 | 0,28 (0,11-0,71) |
| Mediana (rango) | 253.000 (118.000-458.000) | 153.000 (35.000-317.000) | ||
| Trombocitopeniad, n (%) | 5 (9,1) | 22 (44) | 0,005 | 6 (1,7-21,5) |
aOR: odds ratio ajustada por Z-score de peso; CIR: crecimiento intrauterino retardado; DE: desviación estándar; IC: intervalo de confianza.
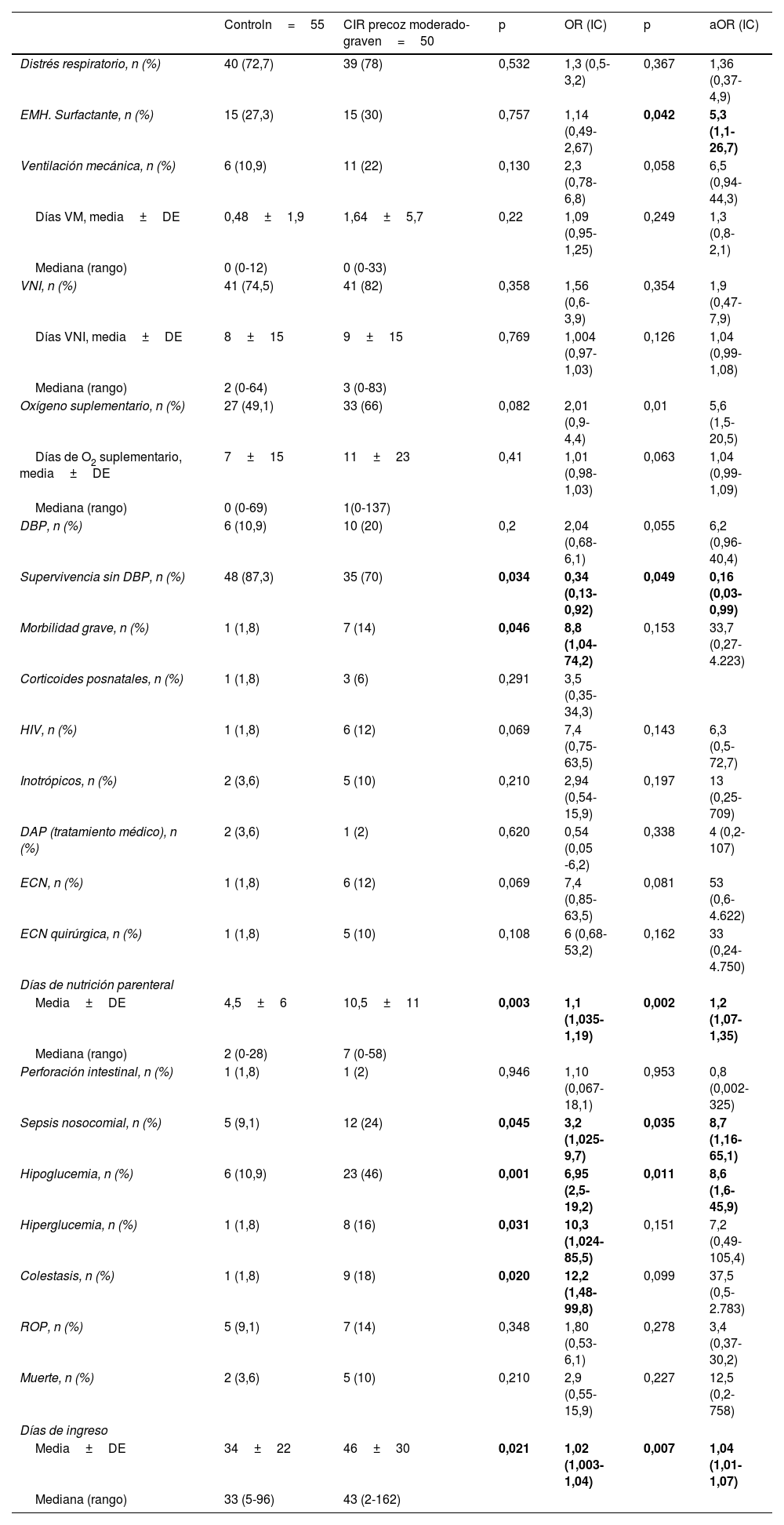
En la tabla 4 se muestran las variables de morbilidad neonatal estudiadas en los pacientes en un análisis de regresión logística entre ambas cohortes, en bruto y ajustada por peso. En ella se observa una asociación independiente del Z-score de peso al nacer entre el diagnostico de CIR moderado grave y una mayor necesidad de surfactante, una mayor necesidad de oxígeno al ingreso, una menor supervivencia libre de DBP, mayor incidencia de sepsis nosocomial e hipoglucemia, así como mayor duración de la nutrición parenteral y el ingreso hospitalario.
Morbilidad por grupos. Regresión logística entre ambas cohortes, sin ajustar y ajustada por peso
| Controln=55 | CIR precoz moderado-graven=50 | p | OR (IC) | p | aOR (IC) | |
|---|---|---|---|---|---|---|
| Distrés respiratorio, n (%) | 40 (72,7) | 39 (78) | 0,532 | 1,3 (0,5-3,2) | 0,367 | 1,36 (0,37-4,9) |
| EMH. Surfactante, n (%) | 15 (27,3) | 15 (30) | 0,757 | 1,14 (0,49-2,67) | 0,042 | 5,3 (1,1-26,7) |
| Ventilación mecánica, n (%) | 6 (10,9) | 11 (22) | 0,130 | 2,3 (0,78-6,8) | 0,058 | 6,5 (0,94-44,3) |
| Días VM, media±DE | 0,48±1,9 | 1,64±5,7 | 0,22 | 1,09 (0,95-1,25) | 0,249 | 1,3 (0,8-2,1) |
| Mediana (rango) | 0 (0-12) | 0 (0-33) | ||||
| VNI, n (%) | 41 (74,5) | 41 (82) | 0,358 | 1,56 (0,6-3,9) | 0,354 | 1,9 (0,47-7,9) |
| Días VNI, media±DE | 8±15 | 9±15 | 0,769 | 1,004 (0,97-1,03) | 0,126 | 1,04 (0,99-1,08) |
| Mediana (rango) | 2 (0-64) | 3 (0-83) | ||||
| Oxígeno suplementario, n (%) | 27 (49,1) | 33 (66) | 0,082 | 2,01 (0,9-4,4) | 0,01 | 5,6 (1,5-20,5) |
| Días de O2 suplementario, media±DE | 7±15 | 11±23 | 0,41 | 1,01 (0,98-1,03) | 0,063 | 1,04 (0,99-1,09) |
| Mediana (rango) | 0 (0-69) | 1(0-137) | ||||
| DBP, n (%) | 6 (10,9) | 10 (20) | 0,2 | 2,04 (0,68-6,1) | 0,055 | 6,2 (0,96-40,4) |
| Supervivencia sin DBP, n (%) | 48 (87,3) | 35 (70) | 0,034 | 0,34 (0,13-0,92) | 0,049 | 0,16 (0,03-0,99) |
| Morbilidad grave, n (%) | 1 (1,8) | 7 (14) | 0,046 | 8,8 (1,04-74,2) | 0,153 | 33,7 (0,27-4.223) |
| Corticoides posnatales, n (%) | 1 (1,8) | 3 (6) | 0,291 | 3,5 (0,35-34,3) | ||
| HIV, n (%) | 1 (1,8) | 6 (12) | 0,069 | 7,4 (0,75-63,5) | 0,143 | 6,3 (0,5-72,7) |
| Inotrópicos, n (%) | 2 (3,6) | 5 (10) | 0,210 | 2,94 (0,54-15,9) | 0,197 | 13 (0,25-709) |
| DAP (tratamiento médico), n (%) | 2 (3,6) | 1 (2) | 0,620 | 0,54 (0,05 -6,2) | 0,338 | 4 (0,2-107) |
| ECN, n (%) | 1 (1,8) | 6 (12) | 0,069 | 7,4 (0,85-63,5) | 0,081 | 53 (0,6-4.622) |
| ECN quirúrgica, n (%) | 1 (1,8) | 5 (10) | 0,108 | 6 (0,68-53,2) | 0,162 | 33 (0,24-4.750) |
| Días de nutrición parenteral | ||||||
| Media±DE | 4,5±6 | 10,5±11 | 0,003 | 1,1 (1,035-1,19) | 0,002 | 1,2 (1,07-1,35) |
| Mediana (rango) | 2 (0-28) | 7 (0-58) | ||||
| Perforación intestinal, n (%) | 1 (1,8) | 1 (2) | 0,946 | 1,10 (0,067-18,1) | 0,953 | 0,8 (0,002-325) |
| Sepsis nosocomial, n (%) | 5 (9,1) | 12 (24) | 0,045 | 3,2 (1,025-9,7) | 0,035 | 8,7 (1,16-65,1) |
| Hipoglucemia, n (%) | 6 (10,9) | 23 (46) | 0,001 | 6,95 (2,5-19,2) | 0,011 | 8,6 (1,6-45,9) |
| Hiperglucemia, n (%) | 1 (1,8) | 8 (16) | 0,031 | 10,3 (1,024-85,5) | 0,151 | 7,2 (0,49-105,4) |
| Colestasis, n (%) | 1 (1,8) | 9 (18) | 0,020 | 12,2 (1,48-99,8) | 0,099 | 37,5 (0,5-2.783) |
| ROP, n (%) | 5 (9,1) | 7 (14) | 0,348 | 1,80 (0,53-6,1) | 0,278 | 3,4 (0,37-30,2) |
| Muerte, n (%) | 2 (3,6) | 5 (10) | 0,210 | 2,9 (0,55-15,9) | 0,227 | 12,5 (0,2-758) |
| Días de ingreso | ||||||
| Media±DE | 34±22 | 46±30 | 0,021 | 1,02 (1,003-1,04) | 0,007 | 1,04 (1,01-1,07) |
| Mediana (rango) | 33 (5-96) | 43 (2-162) | ||||
aOR: odds ratio ajustada por Z-score de peso; CIR: crecimiento intrauterino retardado; DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; DE: desviación estándar; ECN: enterocolitis necrosante; EMH: enfermedad de membrana hialina; HIV: hemorragia intraventricular; IC: intervalo de confianza; LMPV: leucomalacia periventricular; OR: odds ratio; O2: oxígeno; PC: perímetro craneal; Qx: quirúrgico; ROP: retinopatía del prematuro; VM: ventilación mecánica; VNI: ventilación no invasiva.
En negrita se resaltan las diferencias estadísticamente significativas.
El bajo peso al nacimiento es un factor de riesgo conocido de morbilidad en el neonato pretérmino14, sin embargo, no contamos con muchos datos sobre la morbilidad asociada al pretérmino de bajo peso debido a insuficiencia placentaria. En este estudio, realizado en 7 unidades neonatales que realizan de forma rutinaria estudio de doppler fetal para la detección de insuficiencia placentaria, hemos observado como el diagnóstico de CIR moderado-grave por criterios doppler se asocia a una mayor morbilidad neonatal de modo independiente de la edad gestacional o el peso al nacer. Nuestros resultados son útiles para la comunidad neonatal, toda vez que permiten resaltar la importancia de diferenciar entre los recién nacidos constitucionalmente de peso bajo y aquellos con peso restringido por insuficiencia placentaria, lo que ayudaría a individualizar el manejo en la unidad neonatal.
A pesar de que hay algún estudio que afirma que el estrés sometido a los fetos CIR influye positivamente en su madurez respiratoria15, nuestros datos reflejan, tal y como se puede objetivar en la tabla 4, una mayor afectación respiratoria en los pacientes CIR, presentando mayor necesidad de soporte con oxígeno y hasta 5 veces más necesidad de tratamiento con surfactante que en el grupo de pretérminos sin alteración doppler prenatal. El 87% de los pacientes del grupo control sobrevivieron sin DBP, sin embargo, en el grupo CIR y de modo estadísticamente significativo, lo hicieron el 70%. Nuestra serie también presenta diferencias en la presencia de DBP entre ambos grupos estudiados que, aunque no fueron significativas, estuvieron muy cerca de la significación estadística. El mayor riesgo de presentar DBP en pacientes CIR definidos con criterios doppler ya ha sido reseñado en alguna publicación reciente16,17.
La desnutrición y la hipoxia crónica a la que están sometidos los fetos con insuficiencia placentaria no solo producen más morbilidad respiratoria: la diferencia en peso de los pacientes CIR siempre se ha destacado como causa en esta diferencia en la morbilidad. Es por ello que mostramos las OR en bruto y corregidas por peso para reseñar que aun de modo independiente al peso al nacimiento la insuficiencia placentaria provoca mayor incidencia de hipoglucemia y sepsis nosocomial, mayor necesidad de días de nutrición parenteral y prolonga el ingreso hospitalario.
La repercusión a nivel intestinal del CIR ha sido una asociación clásicamente descrita en neonatología. En nuestro caso, las diferencias encontradas en las tasas de ECN (1,8% en control vs. 12% en CIR) no fueron significativas en el análisis realizado; la presencia de redistribución de flujo cerebral en el feto CIR con vasodilatación cerebral y contracción en el lecho esplácnico se ha propuesto como causa de este hecho en varios estudios18. Dos factores han influido probablemente en estos resultados: uno es la baja incidencia de ECN en nuestro medio con protocolos de alimentación en el niño pretérmino y de riesgo que fomentan la lactancia materna y el apoyo de bancos de leche materna; otro factor que no podemos descartar es que de facto en el paciente CIR se haya realizado una pauta de alimentación más conservadora con más vigilancia de signos de intolerancia oral, lo que, además de la presencia de un peso más bajo, retrasa la consecución de la alimentación enteral completa y prolonga los días de nutrición parenteral, lo que sesgaría nuestros resultados reduciendo las complicaciones en los pacientes con crecimiento restringido.
En los datos de hematimetría al nacimiento no hay diferencias significativas en la serie roja, pero sí hay importantes diferencias en la presencia de leucopenia y en el recuento de neutrófilos al ingreso. Los pacientes CIR presentan 5,8 veces más riesgo de presentar neutropenia al ingreso (<1.500 neutrófilos/mm3). El riesgo de trombocitopenia entre el grupo CIR es 6 veces mayor, de modo independiente a la edad gestacional y el peso de los pacientes. Es importante destacar la potente asociación entre los datos doppler prenatales y la reducción progresiva en el recuento plaquetario del paciente al ingreso. En el análisis del subgrupo de pacientes CIR III las diferencias respecto a control (no CIR grave) se mantienen significativas a pesar del menor número de pacientes en este subgrupo. Tal y como podemos ver en la figura 3, el recuento plaquetario es progresivamente menor a medida que progresa la alteración doppler en la arteria umbilical fetal y avanza la enfermedad placentaria. Esto provoca que el 66,7% de los pacientes CIR grave en nuestro estudio presenten trombocitopenia al ingreso. Este dato lo interpretamos en relación con el consumo plaquetario progresivo que presenta la placenta afectada, tal y como se observa en los análisis de anatomía patológica de las placentas con mala función, en donde se describe la presencia de áreas progresivas de infarto y trombosis placentaria10,19.
En las variables de sala de partos existen pocos estudios que analicen el riesgo de depresión perinatal y la mayor necesidad de reanimación en niños prematuros asociados a la presencia de alteraciones doppler prenatales. En nuestro análisis por subgrupos (tabla 2) ajustado por peso y edad gestacional, los niños con CIR moderado, con diástole cero en IP de arterias umbilicales, no presentan mayor riesgo que el control en la adaptación en la sala de partos, sin diferencias significativas en test de Apgar o datos de acidosis. En cambio, el grupo de CIR III se asocia a peor puntuación en el test de Apgar y mayor grado de acidosis, sin observarse mayor necesidad de intubación o uso de adrenalina en la reanimación. Esta información es importante de cara a la anticipación en la sala de partos antes de la asistencia al recién nacido.
En el análisis de los datos obtenidos de la somatometría, se evaluó a los recién nacidos en ambos grupos al ingreso (tabla 1) y a las 36 semanas de edad gestacional. En la figura 1 observamos que los Z-score de longitud y peso en toda la serie de casos presentan un retraso de crecimiento extrauterino de similar magnitud; el hallazgo más importante se objetiva en el perímetro craneal, donde los niños del grupo CIR presentan un crecimiento compensador «catch-up» muy importante, dejando de existir diferencias significativas en el Z-score de perímetro craneal a las 36 semanas de edad corregida respecto al control. La compensación en el crecimiento del niño CIR en los primeros meses de vida es un hecho objetivado en muchos estudios, no así esta recuperación en perímetro craneal tan precoz, constatable al alta de la unidad neonatal. Es probable que la ausencia de catch-up asociada a un mejor pronóstico en neurodesarrollo en los niños con bajo peso para la edad gestacional esté en relación con que es el subgrupo de niños con bajo peso constitucional, sin restricción de crecimiento, el que presenta esta ausencia del crecimiento compensador, al no haber estado restringido su potencial de crecimiento. La presencia de este crecimiento compensador, por tanto, es propia del grupo de niños con bajo peso y crecimiento restringido y es el hecho de ser CIR lo que crea un peor pronóstico en su neurodesarrollo. La definición con criterios doppler de los niños con restricción de crecimiento debería constatar este hecho en estudios longitudinales en el futuro20,21.
El número total de pacientes incluidos en el estudio impide el análisis más pormenorizado por subgrupos de los niños con CIR grave, y de los pacientes CIR grave con flujo reverso en ductus venoso (CIR IV con alta sospecha de acidosis fetal e indicación de finalización urgente del embarazo). Una serie de casos más numerosa también favorecería un análisis multivariante más amplio que incluyese otras variables prenatales además del estudio doppler, como la preeclampsia, la preeclampsia grave o el síndrome HELLP. Esta es una de las principales debilidades de nuestro estudio, a pesar de haber creado un diseño multicéntrico para conseguir el mayor número de casos posible. Nuevos estudios multicéntricos con más pacientes serían necesarios para obtener un análisis más pormenorizado. De modo ideal, además, sería necesaria la realización de estudios longitudinales, que junto con la morbilidad perinatal22 analicen la evolución ponderal y el neurodesarrollo a los 2 años y a partir de los 6 años de edad23. Numerosos estudios relacionan el trastorno del espectro autista, el fracaso escolar y el menor coeficiente intelectual, y el TDAH con la insuficiencia placentaria13,24–27.
Creemos que la mayor fortaleza de nuestro trabajo ha sido crear una cohorte suficiente de niños CIR moderado-grave para detectar la mayor morbilidad en algunas afecciones que afectan al niño pretérmino, independientemente de su peso o edad gestacional, y poder así alertar del mayor riesgo perinatal que experimentan los fetos sometidos al estrés fetal que conlleva la insuficiencia placentaria con desnutrición e hipoxia crónica para fomentar el desarrollo de nuevos estudios que estudien al niño CIR definido con criterios doppler.
En conclusión, los datos doppler prenatales nos ayudan a definir, en los recién nacidos pretérmino, a los pacientes con insuficiencia placentaria y su grado de afectación. Esta información es importante en la anticipación para el manejo de estos pacientes en la sala de partos con más riesgo de mala adaptación al nacimiento en los pacientes CIR III. De modo independiente a su edad gestacional y a su peso, los pacientes CIR moderado-grave presentan una mayor morbilidad perinatal a nivel respiratorio y hematológico, mayor sepsis tardía e hipoglucemia, y un incremento de los días de nutrición parenteral y días de ingreso.
FinanciaciónLa realización de este estudio no ha contado con financiación por parte de ninguna institución pública o privada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés en la realización de este estudio.
Resultados parciales de esta investigación fueron presentados como comunicación oral en el XXIX Congreso de la Sociedad Española de Neonatología el 6 de octubre de 2023 y en el LXXIII Congreso anual de la Sociedad de Pediatría de Galicia el 10 de noviembre de 2023.