Comparar el rendimiento (total de muestras obtenidas) de nebulizadores ultrasónicos de flujo bajo y alto en la inducción de esputo en niños asmáticos, y valorar los efectos adversos asociados.
Pacientes y métodosSe nebulizó suero salino hipertónico a concentraciones crecientes (3%, 4%, 5%) utilizando nebulizadores ultrasónicos de bajo flujo (Omron NE-U07®; flujo 1ml/min) y de alto flujo (Omron NE-U12®; flujo 3 ml/min, y DeVilbiss Ultraneb 3000®; flujo 2,5ml/min).
ResultadosSe realizaron 49 inducciones en 49 pacientes entre 7 y 15 años de edad (en 15 niños se utilizó un nebulizador de bajo flujo y en 34 niños un nebulizador de alto flujo (Omron NEU12®: 6 casos, DeVilbiss Ultraneb 3000®: 28 casos). Se obtuvieron 37 muestras. Treinta y seis presentaban<20% de células escamosas y 26 tenían una viabilidad ≥60%. El rendimiento de la prueba fue mayor con los nebulizadores de alto flujo (85,3% de muestras), frente al 53% (p=0,04). El 69% de las muestras obtenidas con los nebulizadores de alto flujo fueron válidas, frente al 62,5% con el de bajo flujo (p=0,7).
Con los nebulizadores de alto flujo disminuyó la incidencia de tos (17,6%, p=0,08) y de picor de ojos (0%, p=0,02), respecto al nebulizador de bajo flujo (47% y 20% respectivamente), aunque aumentó el sabor desagradable (82,3%, p<0,001) y la sialorrea (14,7%, p=0,3).
ConclusionesCon los nebulizadores ultrasónicos de alto flujo se consigue un mayor rendimiento de la técnica sin que se observe un aumento de efectos adversos significativos.
To compare low and high flow nebulizers performance (total of samples) and its side effects on sputum induction in asthmatic children.
Patients and methodsSputum induction was performed by inhalation of a hypertonic saline solution at increasing concentrations (3%, 4% and 5%) using low flow (OMRON NE-U07®; flow rate 1ml/min), or high flow (OMRON NE-U12®; flow rate 3ml/min, and DeVilbiss Ultraneb 3000®; flow rate 2.5ml/min) ultrasonic nebulizers.
ResultsWe performed 49 inductions in 49 patients from 7 to 15 years old (in 15 children we used a low flow nebulizer (Omron NE-U07®) and in 34 children a high flow nebulizer (OMRON NEU12®, 6 patients, and DeVilbiss Ultraneb 3000®, 28 patients). We obtained 37 samples of which 36 had less than 20% of squamous cells, and 26 had a viability ≥60%. The test performance was higher with high-flow nebulizers, obtaining 85.3% of samples compared to 53% (p=0.04). A total of 69% of samples obtained with the high flow nebulizer were valid, compared to 62.5% (p=0.7) with the low flow nebulizers.
With high flow rate nebulizers the incidence of cough (17.6%, p=0.08) and itchy eyes (0%, p=0.02) decreased with the low flow nebulizer (47% and 20% respectively), but bad taste (82.3%, p <0.001) and salivation (14.7%, p=0.3) increased.
ConclusionsWith high flow rate ultrasonic nebulizers we obtain a higher performance of the technique without an increase in significant side effects.
El asma se caracteriza por una inflamación crónica de las vías respiratorias que, histológicamente, consiste en una infiltración de la mucosa bronquial por células inflamatorias, una descamación de células epiteliales, una hiperplasia de células mucosas y un engrosamiento de la submucosa1,2. Otros cambios descritos y que forman parte del remodelado bronquial son el engrosamiento de la lámina reticular de la membrana basal, la hipertrofia de la musculatura lisa bronquial, la hiperplasia de fibroblastos y miofibroblastos3,4.
El estudio y la monitorización de la inflamación en el asma han adquirido en los últimos años un importante papel que complementa la medición de la función pulmonar5–9. La determinación de la inflamación bronquial en el asma es un reflejo directo de la enfermedad, mientras que los estudios de función pulmonar reflejarían sus consecuencias.
El análisis de muestras de esputo inducido ha facilitado el estudio de la inflamación en el asma al tratarse de un método no invasivo a partir del cual podemos determinar las células predominantes y el grado de inflamación5,10–12.
Para la realización de la técnica de la inducción de esputo se utiliza un nebulizador ultrasónico con suero salino hipertónico. El nebulizador debe generar partículas de un diámetro aerodinámico de la mediana de la masa (MMAD) de un rango determinado y con un flujo determinado.
Se han descrito algunos efectos adversos en la inhalación de suero salino hipertónico como tos, sialorrea, dolor de garganta, aerofagia, sensación de hormigueo en manos y cara y broncoespasmo10,13.
Diferentes autores han realizado estudios en adultos comparando la utilización de nebulizadores de bajo y alto flujo en la inducción de esputo. Popov et al14 compararon la tasa de éxito en la inducción de esputo mediante la utilización de 2 nebulizadores ultrasónicos, de alto (2,17ml/min) y bajo flujo (0,87ml/min) y un nebulizador tipo jet (flujo de 0,49ml/min). Con los nebulizadores ultrasónicos obtuvieron un mayor número de muestras respecto al nebulizador tipo jet, aunque no existieron diferencias entre los nebulizadores ultrasónicos de alto y bajo flujo. Sí observaron una mayor sensación de molestias en los pacientes que utilizaron el nebulizador ultrasónico de alto flujo, siendo directamente proporcional la sensación de molestias al débito de flujo. No encontraron diferencias entre los diferentes nebulizadores respecto a la caída del volumen espiratorio forzado en el primer segundo (FEV1). Belda et al15 compararon la utilización de 2 nebulizadores de alto (1,90ml/min) y bajo (0,87ml/min) flujo en pacientes asmáticos y encontraron que la viabilidad celular fue mayor en las muestras obtenidas con el nebulizador de alto flujo. En otro estudio en adultos sanos y con enfermedad pulmonar obstructiva crónica (EPOC), Kelly et al16 compararon también 2 nebulizadores de alto (3ml/min) y bajo (0,4ml/min) flujo, sin que observaran diferencias estadísticamente significativas en cuanto al peso del esputo obtenido, la viabilidad celular y el número total de células por gramo de esputo. Sí que encontraron que con el nebulizador de bajo flujo la caída del FEV1 fue menor y aumentó la tolerancia a la nebulización (determinada por la percepción de la dificultad respiratoria a partir de la escala de Borg y la sensación desagradable del procedimiento).
No está claro a partir de los estudios previos si es más conveniente utilizar nebulizadores de alto o bajo flujo, ya que con los nebulizadores de alto flujo se podría obtener un mayor rendimiento de la técnica (mayor número de muestras obtenidas), aunque ello podría ser a costa de un mayor número de efectos secundarios importantes (broncoespasmo). Por otro lado, no conocemos estudios realizados en niños que hayan analizado estos hechos.
En nuestro trabajo pretendemos comprobar si es posible obtener un mayor número de muestras de esputo, utilizando nebulizadores de alto flujo, y si ello ocurriría sin que suponga un aumento de los efectos secundarios.
Pacientes y métodosSe realizó un estudio prospectivo de tipo observacional. Se trata de un estudio piloto dentro de un estudio más amplio para estudiar las características de la inflamación en niños con asma.
Se reclutaron mediante un muestreo de conveniencia niños asmáticos de entre 7 y 15 años en las consultas de la Unidad de Neumología Pediátrica de un hospital terciario.
El diagnóstico de asma se estableció si el paciente presentaba clínica compatible con una prueba broncodilatadora positiva y/o prueba de esfuerzo con caída del FEV1 >o=15% o prueba de metacolina con PC20<8mg/ml o PD20<7,8μmol.
Se incluyeron niños asmáticos en fase estable (sin exacerbación aguda) y que no hubieran presentado ningún episodio de infección de vías respiratorias altas en las últimas 6 semanas.
Se valoró la gravedad del asma, clasificando a los pacientes de acuerdo con su evolución en el último año en asma episódica ocasional, episódica frecuente, persistente moderada y persistente grave17.
El estudio se llevó a cabo previa información y consentimiento informado de los padres y fue aprobado por el Comité de Ética e Investigación Clínica.
En una única visita se recogieron los datos clínicos y de anamnesis, se realizó una espirometría forzada y, a continuación, la inducción de esputo.
Se recogieron las siguientes variables: edad, sexo, FEV1 basal, tipo de nebulizador ultrasónico utilizado, débito de flujo (ml/min) del nebulizador, tamaño de las partículas nebulizadas o MMAD (μm), descripción de efectos adversos observados en cada niño, obtención o no de muestra, contaminación de la muestra (porcentaje de células escamosas, provenientes de la saliva, >20%), viabilidad (porcentaje de células viables, no teñidas con el azul de tripano ≥60%), y muestras válidas (células escamosas<20% y células viables ≥60%).
En la realización de la espirometría forzada se recogió el mejor valor de FEV1 de tres maniobras válidas, de acuerdo con la normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), expresándolo en porcentaje del valor teórico18.
Inicialmente se realizó una espirometría basal y, posteriormente, los niños inhalaron 400μg de salbutamol a través de una cámara espaciadora antes de iniciar la inducción. Para realizar la inducción de esputo, se nebulizó suero salino hipertónico a concentraciones crecientes (3%, 4% y 5%), 5min por cada concentración, según el método descrito por Pizzichini et al19.
Después de cada período de 5min se midió el FEV1, interrumpiéndose la prueba si el FEV1 disminuía >15%. Los niños se enjuagaron la boca con agua antes de la inducción y entre cada período de 5min, para minimizar la contaminación de la muestra por saliva. Después de cada período de 5min se animaba al niño a que tosiera y arrancara el esputo para depositarlo en un contenedor estéril.
Se utilizaron 2 tipos de nebulizadores ultrasónicos: de bajo flujo (Omron NE-U07®; débito de flujo 1ml/min, MMAD 3,5μm) (en los 15 primeros niños estudiados), y de alto flujo (en los 34 niños siguientes, Omron NE-U12®; débito 3ml/min, MMAD 4μm y DeVilbiss Ultraneb 3000®; débito 2,5ml/min, MMAD 4μm).
Para el procesado de la muestra se seleccionaron los tapones de moco de origen bronquial, bien diferenciados de la saliva, que contiene numerosas células escamosas. Los tapones seleccionados se pesaron y se añadió un volumen (en mililitros) de solución de dithiotreitol (DTT) al 0,1% (Calbiochem, La Jolla, CA, USA) igual a 4 veces el peso del esputo (en g). Se agitó el mezclador durante 10–15s a velocidad media. Posteriormente, se colocó el tubo en banco mecedor durante 15min. Se añadió un volumen de PBS (solución salina de Dulbecco tamponada con fosfatos) igual al de la solución de DTT empleada. La suspensión resultante se filtró a través de una gasa de nylon de 48μm (para retener restos de moco bronquial) y esta se centrifugó a 1.500rpm durante 10min. Tras la centrifugación se obtuvo un sedimento, «pellet», que es el que contiene las células, y un sobrenadante que se congeló a –80°C para posteriores determinaciones. A partir del sedimento se procedió al recuento celular en una cámara de contaje celular (cámara de Neubauer), mediante microscopio óptico. Se anotó la proporción de células escamosas de la saliva y se determinó la viabilidad celular mediante el método de exclusión del azul de tripano que tiñe las células muertas, con membrana destruida.
El análisis estadístico de los datos se ha realizado mediante el programa Medcalc®, versión 10.0.2.0. Para realizar las comparaciones entre los grupos se ha aplicado el test de Kruskal-Wallis o la t de Student, si las variables seguían una distribución normal, en el caso de las variables cuantitativas, y el test de Chi cuadrado o la prueba exacta de Fisher en el de las cualitativas. Se han considerado significativos valores de p<0,05.
ResultadosSe realizaron 49 inducciones de esputo en 49 niños (27 varones) asmáticos (34 con asma atópica y 15 con asma no atópica) con una edad mediana de 11 años (rango de 7 a 15 años). Catorce pacientes presentaban asma episódica ocasional, 12 episódica frecuente, 14 persistente moderada y 9 persistente grave. El porcentaje del FEV1 respecto al valor teórico medio antes de la inducción de esputo fue del 97,7% (IC95% 91,2%–104,2%).
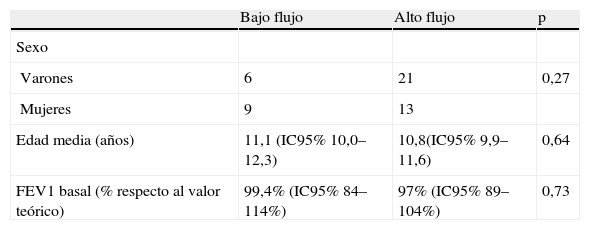
No se observaron diferencias entre los grupos de bajo flujo y alto flujo en cuanto a la edad, sexo, y FEV1 basal (tabla 1).
Comparación de las características basales entre los grupos «bajo flujo» y «alto flujo»
| Bajo flujo | Alto flujo | p | |
| Sexo | |||
| Varones | 6 | 21 | 0,27 |
| Mujeres | 9 | 13 | |
| Edad media (años) | 11,1 (IC95% 10,0–12,3) | 10,8(IC95% 9,9–11,6) | 0,64 |
| FEV1 basal (% respecto al valor teórico) | 99,4% (IC95% 84–114%) | 97% (IC95% 89–104%) | 0,73 |
FEV1: volumen espiratorio forzado en el primer segundo; IC95%: intervalo de confianza al 95%.
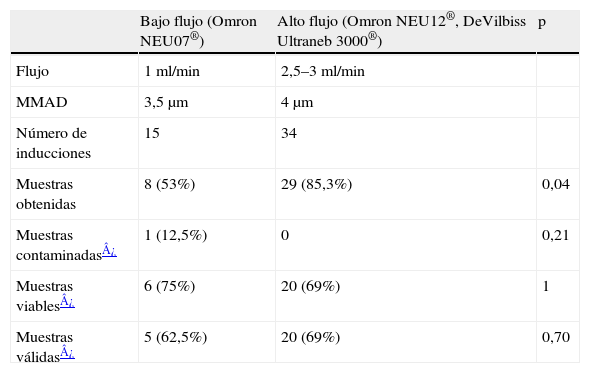
En 15 niños se realizó la inducción de esputo utilizando un nebulizador ultrasónico de bajo flujo (Omron NE-U07®) y en 34 niños se hizo con un nebulizador ultrasónico de alto flujo (Omron NE-U12® 6 casos, DeVilbiss Ultraneb 3000® 28 casos). Se obtuvieron 37 muestras (75,5% del total de las inducciones), de las que 36 tenían células escamosas ≤20% y 26 una viabilidad ≥60%, lo que supone un total de 25 muestras válidas (51% de todas las inducciones).
El rendimiento de la prueba fue mayor con los nebulizadores de alto flujo, con los que se obtuvo un 85,3% de muestras, frente al 53% (p=0,04) con los de bajo flujo. El 62,5% de las muestras obtenidas con el nebulizador de bajo flujo fueron válidas, frente al 69% con los de alto flujo (p=0,7) (tabla 2), lo que resulta en un 33% de muestras válidas respecto al total de intentos de inducción con los nebulizadores de bajo flujo, frente al 59% con los de alto flujo (p=0,22).
Rendimiento de los diferentes nebulizadores utilizados para la inducción de esputo
| Bajo flujo (Omron NEU07®) | Alto flujo (Omron NEU12®, DeVilbiss Ultraneb 3000®) | p | |
| Flujo | 1ml/min | 2,5–3ml/min | |
| MMAD | 3,5μm | 4μm | |
| Número de inducciones | 15 | 34 | |
| Muestras obtenidas | 8 (53%) | 29 (85,3%) | 0,04 |
| Muestras contaminadas¿ | 1 (12,5%) | 0 | 0,21 |
| Muestras viables¿ | 6 (75%) | 20 (69%) | 1 |
| Muestras válidas¿ | 5 (62,5%) | 20 (69%) | 0,70 |
MMAD: diámetro aerodinámico de la mediana de la masa.
No hubo diferencias en el rendimiento de la técnica entre los niños con diferente gravedad del asma (p=0,13), ni en relación a la edad de los pacientes comparando los niños de 7–9 años con los de mayor edad (p=0,26)
No hubo diferencias en el rendimiento entre los dos tipos de nebulizadores de alto flujo (p=0,26).
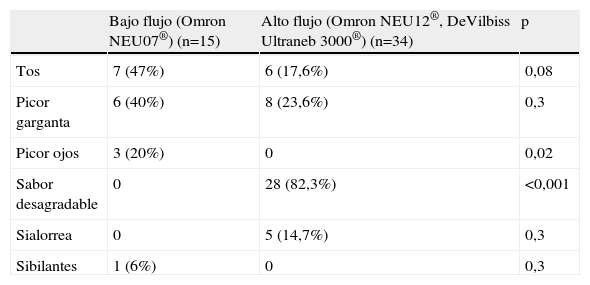
En cuanto a los efectos adversos observados, fueron de tipo local y leve, en todos los casos (tabla 3). En ninguno de los 49 niños se observó caída del FEV1>15%, y solo en 4 casos fue superior al 10% (3 con el nebulizador de bajo flujo y uno con los de alto flujo).
Efectos secundarios de los diferentes nebulizadores utilizados para la inducción de esputo
| Bajo flujo (Omron NEU07®) (n=15) | Alto flujo (Omron NEU12®, DeVilbiss Ultraneb 3000®) (n=34) | p | |
| Tos | 7 (47%) | 6 (17,6%) | 0,08 |
| Picor garganta | 6 (40%) | 8 (23,6%) | 0,3 |
| Picor ojos | 3 (20%) | 0 | 0,02 |
| Sabor desagradable | 0 | 28 (82,3%) | <0,001 |
| Sialorrea | 0 | 5 (14,7%) | 0,3 |
| Sibilantes | 1 (6%) | 0 | 0,3 |
Con el nebulizador de bajo flujo se presentó tos en el 47% de los pacientes, picor de garganta en el 40% y picor de ojos en el 20%. Con los nebulizadores de alto flujo disminuyó la incidencia de tos (17,6%) y de picor de ojos (0%), aunque se vio aumentado el sabor desagradable (82,3%) y la sialorrea (14,7%).
DiscusiónEn nuestro trabajo hemos observado que se obtiene un mayor rendimiento (mayor número de muestras obtenidas) en la inducción de esputo en niños con asma cuando se utilizan nebulizadores de alto flujo.
Esto concuerda con los datos recogidos en la literatura en cuanto a un mayor rendimiento cuando se utilizan nebulizadores de alto flujo (>2ml/min)10,12,20 .
El MMAD de las partículas nebulizadas, en los pocos trabajos en niños en los que es citado, es<5μm21,22, al igual que en los 3 nebulizadores utilizados en nuestro trabajo. Este tamaño (<5μm) permite que las partículas nebulizadas alcancen la vía aérea más distal y disminuye el impacto de las partículas en la orofaringe.
En cuanto al porcentaje de muestras válidas (muestras con una contaminación por células escamosas<20% y viabilidad celular ≥60%) obtenidas del 51% de las inducciones, los resultados son inferiores a los que obtienen otros autores (Wilson et al20, 56%; Covar et al13, 77%; Grootendorst et al17, 95% [este último en niños de 12 a 17 años]). Debe tenerse en cuenta que en nuestro trabajo, por criterios de calidad de la muestra, consideramos un punto de corte de 60% para determinar que la muestra era viable, lo que elimina muestras con viabilidad celular ≥50%, que otros autores aceptan como adecuadas10,19.
En algunos trabajos en los que obtienen un alto rendimiento de la inducción de esputo (>70% de muestras válidas), no se contempla la viabilidad celular y se considera contaminación de la muestra cuando el porcentaje de células escamosas es >80%, lo que va en detrimento de la calidad de las muestras de esputo obtenidas13,21.
Se ha alcanzado un mayor rendimiento (total de número de muestras obtenidas) con los nebulizadores de alto flujo. Sin embargo, no existen diferencias estadísticamente significativas en cuanto al número de muestras viables y/o válidas entre los 2 tipos de nebulizadores. Al depender la viabilidad de la muestra de numerosas variables (total de células obtenidas en la muestra, tiempo que transcurre desde la obtención de la muestra hasta su procesado y lectura al microscopio, técnica del procesado en el laboratorio), y al haber obtenido un mayor número de muestras con los nebulizadores de alto flujo, creemos que con un tamaño muestral mayor y con el perfeccionamiento de la técnica, se obtendría un número mayor de muestras válidas (células escamosas <20% y células viables ≥60%) con los nebulizadores de alto flujo.
Los efectos adversos descritos con los nebulizadores de bajo y alto flujo utilizados, son similares a los descritos en la literatura. En ninguno de los 49 niños se observó una caída del FEV1>15%.
El hecho de que con el nebulizador que produce partículas de menor MMAD (Omron NE-U07®, MMAD ≥3,5μm) se haya observado un porcentaje más elevado de tos y picor de garganta podría deberse a que este nebulizador presenta un débito de flujo menor al de los otros dos nebulizadores, lo que favorecería el impacto de partículas en la orofaringe.
En conclusión, la inducción de esputo es una técnica válida y segura en los niños. Los nebulizadores ultrasónicos de mayor débito de flujo consiguen un mayor rendimiento de la técnica, sin que se observe un aumento de los efectos adversos más molestos.
FinanciaciónEstudio financiado con las siguientes ayudas: Beca Fundació Oscar Ravà de la FUCAP (2005) y Beca SENP (2005).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.