La infección por citomegalovirus es frecuente en pacientes trasplantados cardiacos. Foscarnet se utiliza, con evidencia limitada, como tratamiento de segunda línea tras el fracaso de ganciclovir en estos pacientes. Presentamos un caso de alteraciones electrolíticas por foscarnet administrado para el tratamiento de infección por citomegalovirus en un paciente pediátrico trasplantado cardiaco. La infección se resolvió tras 6 semanas de tratamiento, apareciendo niveles de calcio iónico bajos durante la infusión del fármaco e hipomagnesemia mantenida tratada con suplementos, que revirtieron al retirar el fármaco.
Cytomegalovirus infection is common in cardiac transplant patients. Foscarnet is used, with limited evidence, as second-line treatment after ganciclovir failure in these patients. We describe the case of a paediatric cardiac transplant patient who developed electrolyte disturbances during foscarnet treatment for cytomegalovirus infection. The infection resolved after 6 weeks of treatment. Low ionized calcium and magnesium levels were observed during the drug infusion, which were treated with supplements. The serum levels reverted to normal after drug withdrawal.
El foscarnet es un análogo de pirofosfato que inhibe la ADN polimerasa viral. En pediatría, se utiliza como primera línea en el tratamiento de la infección por citomegalovirus (CMV) en pacientes trasplantados de médula ósea, por el riesgo de neutropenia asociado a ganciclovir1, o en segunda línea tras el fracaso de ganciclovir, en cualquier otro tipo de pacientes2,3. En ambos casos se considera indicación off-label por no estar autorizado su uso en pacientes menores de 18 años4.
Dado que no está bien establecido el perfil de seguridad en niños ni su efecto sobre el desarrollo del esqueleto, solo debe administrarse cuando el beneficio potencial sea superior a los posibles riesgos. Por este motivo, se ha utilizado en casos de ineficacia o toxicidad por ganciclovir, por su diferente perfil de efectos adversos. Ganciclovir produce como efecto adverso principal neutropenia, mientras que foscarnet puede causar alteración de la función renal y de los electrolitos. Estos efectos se han observado en pacientes postrasplante de médula ósea en tratamiento preventivo para CMV, así como en pacientes adultos VIH-positivos infectados por CMV. En un estudio en pacientes adultos VIH-positivos se observó una disminución de los niveles de calcio (Ca) y magnesio (Mg) iónicos tras la infusión de foscarnet que se recuperaron hasta los niveles basales a las 10 h de haber finalizado la infusión5.
Presentamos un caso de alteraciones electrolíticas por foscarnet administrado para el tratamiento de una infección por CMV en un paciente pediátrico trasplantado cardiaco.
Caso clínicoVarón de 2 años, portador de trasplante cardiaco ortotópico por disfunción ventricular severa (tras cirugía de segundo estadio de Norwood por síndrome de ventrículo izquierdo hipoplásico, diagnosticado en periodo prenatal), que ingresó con cuadro de infección respiratoria de 48 h de duración, sin fiebre, con tos, aumento del trabajo respiratorio e hipoxemia (saturación del 88% con aire ambiente). Presentaba deposiciones pastosas, amarillentas, sin productos patológicos, en número de 3 al día.
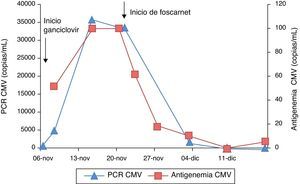
A los 2 días del ingreso, se diagnosticó una infección activa por CMV con carga viral de 868 copias/ml medida por reacción en cadena de la polimerasa (PCR). Se instauró tratamiento con ganciclovir a dosis de 5mg/kg/12h. A los 8 días del inicio del tratamiento, se administraron inmunoglobulinas anti-CMV (Cytotect® Biotest), por aumento en la PCR a 35.856 copias/ml y antigenemia de 52 a 100 células.
A los 13 días de tratamiento con ganciclovir, el paciente presentó empeoramiento clínico, con febrícula y aumento de la tos, de las secreciones y del trabajo respiratorio. Ante la falta de respuesta al tratamiento con ganciclovir (persistencia de 33.576 copias/ml por PCR), se cambió el tratamiento antiviral a foscarnet, a dosis de 90mg/kg/12h hasta negativización del CMV. La familia fue informada de dicha administración de foscarnet y firmó el correspondiente consentimiento informado.
En el día 12 de tratamiento con foscarnet, se detectaron en la analítica de control valores de Ca total (8,8mg/dl) y Mg (1,6mg/dl) muy próximos al límite inferior del intervalo de normalidad (Ca = 8,8-10,4mg/dl y Mg = 1,6-2,5mg/dl), permaneciendo normal la función renal: cistatina C = 0,78mg/l (rango normal: 0,5-0,96mg/l) y filtrado glomerular estimado = 99ml/min/1,73 m2 (rango normal: 80-120ml/min/1,73 m2). El tratamiento con foscarnet resultó efectivo, con mejoría clínica del paciente y reducción progresiva de la carga viral de CMV medida por PCR y de la antigenemia (fig. 1).
En la cuarta semana de tratamiento con foscarnet, el paciente desarrolló una infección del catéter por estafilococo epidermidis, que fue tratada con vancomicina y requirió ingreso en el Servicio de Cuidados Intensivos Pediátricos (UCIP) por cuadro de edema de pulmón, hipoxemia y aumento del trabajo respiratorio.
Al ingreso en la UCIP, presentó niveles de Ca total (corregido por albúmina) de 8,9mg/dl y de Mg de 1,2mg/dl, siendo los valores del resto de los electrolitos y de los parámetros bioquímicos de función renal y hepática normales. El niño recibió suplementos de Mg, inicialmente por vía intravenosa y posteriormente aportes enterales por sonda nasogástrica.
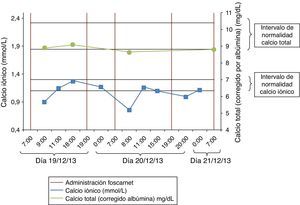
En analítica de control al día siguiente presentó Ca total de 8,2mg/dl y Ca iónico de 0,9mmol/l, sin clínica asociada (intervalo normal 1,1-1,3mmol/l). Ante la sospecha de un posible efecto quelante causado por el foscarnet, se monitorizaron los niveles de Ca total y Ca iónico en diferentes horarios (antes, durante y después de la administración de foscarnet). El fármaco se administraba en perfusión por vía intravenosa de 2 h.
Se comprobó que los valores de Ca iónico durante la infusión del foscarnet (una hora tras el inicio de la infusión) eran bajos (0,76-0,95mmol/l), siendo normales antes y después del tratamiento. Sin embargo, los valores de Ca total no se modificaron en relación con la administración del fármaco (fig. 2).
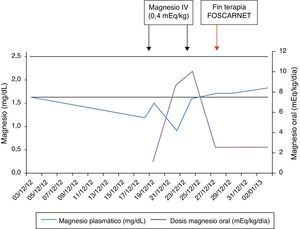
Los valores de Mg fueron bajos (0,9-1,5mg/dl), a pesar de suplementarse el mismo, requiriendo un aumento de estos aportes (hasta 10 mEq/kg/día, incluso con dosis por vía intravenosa) para normalizar la magnesemia. Cuando el paciente finalizó el tratamiento con foscarnet, pudieron disminuirse los suplementos de Mg (fig. 3).
El paciente no presentó clínica indicativa de hipomagnesemia ni hipocalcemia. Los niveles de fosfato, PTH y vitamina D fueron normales. El paciente completó 6 semanas de tratamiento con foscarnet, con resolución de la infección por CMV. Este caso se notificó al Centro de Farmacovigilancia correspondiente.
En la figura 4 se presenta un esquema con la evolución en el tiempo del tratamiento farmacológico del paciente.
DiscusiónEl foscarnet ha demostrado ser un fármaco eficaz en pacientes pediátricos trasplantados de médula ósea como tratamiento anticipatorio ante una positivización del número de copias de CMV en sangre periférica6. También se ha utilizado en pacientes pediátricos con trasplante de órgano sólido, renal y hepático7, y trasplante cardiaco en adultos8,9. En un ensayo clínico aleatorizado, foscarnet demostró la misma supervivencia a los 180 días postrasplante que ganciclovir (pacientes mayores de 12 años, trasplantados de médula ósea, con serologías variables en cuanto a donante/receptor para CMV). Foscarnet estuvo menos relacionado que ganciclovir con episodios de neutropenia severa o trombocitopenia, pero presentó con mayor frecuencia anormalidades electrolíticas del Ca y el Mg6. En un ensayo clínico fase ii que utilizaba ganciclovir y foscarnet a días alternos en pacientes de alto riesgo (trasplante médula ósea, con donante o receptor seropositivos para CMV), el 25% de los pacientes tuvieron que interrumpir la terapia con foscarnet por alteraciones electrolíticas o renales de origen multifactorial10.
En el caso de infecciones por CMV en pacientes trasplantados resistentes al tratamiento con ganciclovir, las guías de práctica clínica recomiendan el uso de foscarnet, pero la evidencia es limitada en pacientes pediátricos2,3. El caso descrito demuestra la eficacia de foscarnet en el tratamiento de una infección por CMV en un paciente pediátrico trasplantado cardiaco que no respondió al tratamiento con ganciclovir. El niño presentó alteraciones electrolíticas asociadas al tratamiento (hipocalcemia e hipomagnesemia), que no llegaron a producir sintomatología clínica.
La disminución de Ca y Mg producida por foscarnet se atribuye a un efecto quelante por su estructura de pirofosfato. Estos complejos se forman en disolución y se ha comprobado una relación lineal entre las concentraciones sanguíneas de foscarnet y los iones Ca y Mg en sangre11. Por otro lado, las concentraciones de Ca total no parecen modificarse, por lo que es probable que el Ca de los complejos del foscarnet sea medido en la determinación bioquímica (al igual que el de otras sales o complejos circulantes, como citrato y otros).
En nuestro paciente, los niveles de PTH y vitamina D fueron normales un mes después del inicio del tratamiento con foscarnet, por lo que es poco probable que esta fuera la causa de las alteraciones.
El déficit de Ca y Mg puede producir náuseas, cefalea, parestesias, convulsiones, irritabilidad muscular y tetania. En los estudios publicados, los pacientes no presentaron sintomatología ante la disminución de los niveles de los mismos debido a que recibieron suplementos de Ca y Mg por vía intravenosa6,12.
La disminución del Ca iónico coincidente con la infusión de foscarnet es transitoria y se recupera en las horas siguientes. Es posible no observar esta alteración en la analítica rutinaria (si no incluye medición del Ca iónico), al no modificarse el Ca total. Por tanto, es necesario conocer este efecto adverso y monitorizar los niveles de Ca iónico antes, durante y después de la infusión de foscarnet, sobre todo ante un tratamiento prolongado13. Esto permitirá detectar el descenso y suplementar con Ca si se dan niveles excesivamente bajos que puedan producir clínica (< 0,70mmol/l) o si este no se recupera tras el tratamiento (< 1,1mmol/l). Sería recomendable determinar periódicamente los niveles de Mg y suplementar a los pacientes en caso necesario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Trabajo presentado como Comunicación oral breve en el XXVIII Congreso de la Sociedad Española de Cuidados Intensivos Pediátricos. Pamplona, 2013.