Introducción
Las infecciones respiratorias virales tienen un enorme impacto en la población pediátrica y son responsables de una morbimortalidad considerables. Los virus son una causa frecuente de infecciones respiratorias de vías altas y bajas en los niños1. Sin embargo, el conocimiento etiológico de estas infecciones es limitado. Afortunadamente en los últimos años, la implantación y perfeccionamiento de las técnicas de reacción en cadena de la polimerasa (PCR), ha permitido ampliar nuestra visión en cuanto a la etiología de las infecciones respiratorias. Algunos virus como los rinovirus crecen con dificultad en los cultivos celulares por lo que se ha infraestimado su frecuencia hasta que gracias a la PCR, se ha conocido su importancia real como causante de infecciones de vías bajas en lactantes2, o como desencadenante de exacerbaciones de asma en escolares3,4, adultos5,6, o en pacientes afectados de enfermedad pulmonar obstructiva crónica (EPOC)7. Las técnicas de PCR han permitido conocer también la existencia de otros virus respiratorios importantes en la población pediátrica, como el metapneumovirus humano (hMPV) descrito recientemente en Holanda8 y posteriormente en distintos lugares del mundo9-12, entre ellos España13,14. Sin embargo, el porcentaje de infecciones respiratorias sin detección de ningún agente etiológico es aún significativo.
En el año 2005 se ha clonado un nuevo virus respiratorio, llamado bocavirus humano (HBoV) de muestras respiratorias procedentes de lactantes y niños suecos con infección respiratoria de vías bajas15. Los análisis filogenéticos del genoma completo de HBoV mostraron que este virus está muy relacionado con el parvovirus bovino y un virus canino, y que es miembro del género Bocavirus, subfamilia Parvovirinae, familia Parvoviridae. Hasta ahora, el único Parvoviridae humano conocido pertenece al género Erythrovirus, siendo el parvovirus B19 (genotipo 1) el mejor caracterizado y el responsable de la quinta enfermedad en niños16.
La serie inicial de HBoV estaba compuesta por 17 niños ingresados (3,1 %), de los que 14 eran infecciones sencillas por HBoV y tres coinfecciones por HBoV, virus respiratorio sincitial (VRS) y adenovirus. La mayoría de los pacientes eran menores de 2 años. La fiebre y el distrés respiratorio fueron frecuentes y la duración de la hospitalización osciló entre 1 y 8 días. Un mes después se publicó otra serie de 18 niños australianos menores de 3 años con infección respiratoria, de los que los autores no aportaron datos clínicos detallados y en los que se detectó HBoV17. La prevalencia de HBoV en esta serie fue del 5,6 % del total, siendo el segundo virus en frecuencia tras el VRS. Los autores australianos detectaron coinfección con otro virus respiratorio en el 55,6 % de las infecciones por HBoV. A lo largo del año 2006 se han descrito nuevas series de casos de infección por HBoV en diversos países como Japón18, Francia19, Canadá20, Sudáfrica21, Estados Unidos22, Jordania23, Reino Unido24 o Alemania25. En la mayoría de ellas HBoV aparece como un virus frecuente en pacientes de entre 6 meses y 4 años con infecciones respiratorias de vías altas o bajas, con un patrón de circulación a lo largo de todo el año, aunque con cierto predominio en los meses de invierno, y con una elevada tasa de coinfecciones con otros virus respiratorios. Sin embargo, aún quedan muchos aspectos por aclarar relativos al comportamiento de este nuevo virus. Por ello y dado el escaso conocimiento existente en la actualidad acerca de la frecuencia real y el comportamiento clínico del HBoV, hemos planteado un estudio cuyos objetivos han sido determinar si HBoV ha circulado en España, estimar la frecuencia de infecciones por HBoV en los niños hospitalizados por infección respiratoria y describir sus características clínicas y epidemiológicas.
Pacientes y métodos
Este estudio se enmarca dentro de una línea de investigación prospectiva acerca de las infecciones respiratorias virales en niños, llevada a cabo en el Servicio de Pediatría del Hospital Severo Ochoa (Leganés, Madrid), en colaboración con el Laboratorio de Gripe y Virus Respiratorios del Instituto Carlos III, financiada por el Fondo de Investigaciones Sanitarias (FIS N.º 98/0310). Sucintamente, el diseño de este estudio consiste en que una vez obtenido el consentimiento informado de los padres, todos los pacientes hospitalizados por infección respiratoria son incluidos en el estudio, procediéndose a una recogida prospectiva de los datos clínicos, según un cuestionario diseñado al efecto. Además, a todos los pacientes se les recoge una muestra respiratoria mediante aspirado nasofaríngeo, remitiéndose en medio de transporte viral al Laboratorio de Gripe y Virus Respiratorios del Centro Nacional de Microbiología, Instituto de Salud Carlos III de Madrid, donde son procesadas en las 24 h siguientes a su recogida. Se separan 2 alícuotas de 200 µl. Una de ellas es procesada inmediatamente, mientras que la segunda se almacena a 80 °C para posteriores análisis.
Con objeto de estudiar la presencia de HBoV se incluyeron todos los niños menores de 14 años ingresados por infección respiratoria en nuestro servicio, desde octubre de 2004 a octubre de 2005. Como ya se ha descrito, la recogida de los datos clínicos se realizó de manera prospectiva. Igualmente prospectivo fue el estudio virológico para todos los virus respiratorios, excepto para HBoV, cuya presencia fue investigada en muestras que previamente habían sido congeladas a 80 °C.
Variables clínicas
Se analizaron las variables epidemiológicas de edad, sexo y estacionalidad y las características clínicas de los pacientes entre las que se incluyeron la presencia de fiebre, la saturación transcutánea de oxígeno, la leucocitosis, la proteína C reactiva sérica, el resultado de la radiografía de tórax, el diagnóstico clínico y la duración del ingreso.
Los diagnósticos finales fueron definidos como:
1.Bronquiolitis: primer episodio de disnea espiratoria de comienzo agudo con signos previos de infección respiratoria en niños menores de 24 meses (Criterios de McConnochie26).
2.Episodio recurrente de sibilancias: infección respiratoria con sibilancias habiendo presentado algún episodio similar previo en niños menores de 24 meses.
3.Crisis asmática: episodio de dificultad respiratoria y sibilancias espiratorias en niños mayores de 2 años.
4.Neumonía: infiltrado focal con consolidación en la radiografía de tórax en ausencia de sibilancias.
5.Infección respiratoria de vías altas (IRVA): síntomas catarrales, sin broncoespasmo asociado, acompañados o no de fiebre.
6.Laringitis aguda: obstrucción de la vía aérea superior acompañada de estridor inspiratorio.
Análisis estadístico
Las variables cuantitativas se expresaron como media ± desviación estándar y las variables cualitativas como proporciones. Las características clínicas y las variables de laboratorio fueron comparadas mediante el test U Mann-Whitney, el test de la chi cuadrado y test exacto de Fisher. Se consideró estadísticamente significativo un valor de p < 0,05. Todo el análisis fue realizado empleando el Statistical Package of Social Science (SPSS), Versión 12.0.
Estudio virológico
Se realizó RT-PCR para VRS-A y B, adenovirus, influenza A, B y C, parainfluenza 1, 2, 3 y 4 y rinovirus27,28 según nuestro grupo ha descrito previamente, en todas las muestras de aspirado nasofaríngeo. Además se ha estudiado la presencia de hMPV, mediante 2 ensayos independientes de RT-PCR según se detalla en una publicación previa29.
PCR para bocavirus
Las muestras clínicas se han extraído en un extractor automático BioRobot M48 utilizando el kit de extracción correspondiente (Qiagen, Hilden, Germany). Se ha utilizado un total de 200 µl de muestra clínica a la que se ha añadido la cantidad de 100 copias de control interno. Los ácidos nucleicos se diluyen en un total de 50 µl de buffer de dilución.
Se han elegido bloques conservados de secuencias en el gen que codifica para la proteína NP-1 y la región intergénica VP1/VP2, utilizando las secuencias completas disponibles hasta la fecha en la base de datos GenBank (DQ000495 y DQ000496). En la primera amplificación se obtiene un producto amplificado de 609 bp que se somete a una segunda amplificación con primers internos generando un producto de amplificación final de 243 bp.
Se ha incluido un control interno de amplificación para eliminar los falsos negativos debidos a que la muestra clínica pueda contener inhibidores de la amplificación o fallos en la extracción del material genético. El tamaño de banda del control interno es 350 bp.
Para estandarizar la nested-PCR específica de HBoV y conocer la sensibilidad y especificidad se ha clonado un producto de amplificación (609 bp) en un plásmido pCR4-TOPO (TOPO-TA Cloning Kit with One Shot TOP10 Chemically Competent E. coli, Invitrogen, Carlsbad, CA). La sensibilidad obtenida con este plásmido equivale a 10 copias de genoma viral.
Resultados
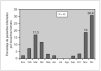
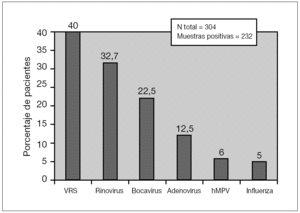
Se obtuvieron un total 304 muestras procedentes de 301 niños de 11 días a 10 años con infección respiratoria. De las 304 muestras estudiadas, 232 (76,3 %) resultaron positivas para algún agente viral. De ellos, 91 (30 %) correspondieron a VRS, 76 (25 %) a rinovirus y 52 (17,1 %) a HBoV. Otros virus detectados en orden de frecuencia fueron adenovirus, hMPV, e influenza (fig. 1).
Figura 1. Frecuencia relativa de los aislamientos virales positivos. VRS: virus respiratorio sincitial; hMPV: metapneumovirus humano.
Se identificó HBoV en 52 muestras (17,1 %; IC 95 %: 13 a 21) correspondientes a 49 pacientes. Un niño con el diagnóstico de crisis asmática ingresó en octubre de 2004, noviembre de 2004 y diciembre de 2004. En las tres ocasiones se detectó HBoV en el aspirado nasofaríngeo. Otro paciente, con drepanocitosis fue hospitalizado en dos ocasiones (diciembre de 2004 y mayo de 2005) detectándose HBoV en ambas.
Características clínicas asociadas a infección por HBoV
Las características clínicas de los niños infectados por HBoV se muestran en la tabla 1. El rango de edad fue de 4,3-52 meses, pero la mayoría eran lactantes: el 50 % eran menores de 13,6 meses y el 75 % menores de 2 años. La mayoría no presentaba previamente enfermedades significativas, excepto un paciente con drepanocitosis.
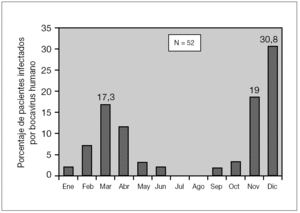
El pico de máxima frecuencia de infecciones por HBoV se registró en diciembre y noviembre, seguido de marzo y abril (fig. 2).
Figura 2. Distribución mensual de las infecciones por bocavirus humano.
El diagnóstico más frecuente fue sibilancias recurrentes/crisis asmática seguido por el de bronquiolitis. La duración media de los ingresos fue de 4,7 días (DE: 3,6; rango: 1-19 días) con una mediana de 4 días. Un lactante con asma grave del lactante fue hospitalizado en tres ocasiones (duración de los ingresos: 5, 10 y 19 días) y en los 3 ingresos se detectó HBoV y al menos otro virus respiratorio.
Una niña de 2,5 años de edad con neumonía, presentó un derrame pleural severo bilateral, que requirió drenaje pleural. No se aisló ninguna bacteria ni en sangre ni en líquido pleural.
Otra niña de 3,5 años con antecedente de anemia de células falciformes, presentó dos infecciones por bocavirus. En la primera, en diciembre de 2004, el ingreso fue motivado por una crisis vasooclusiva, desarrollando durante el ingreso una neumonía nosocomial. HBoV fue el único agente detectado. En mayo de 2005 la niña reingresó con fiebre alta y rinorrea, detectándose en el aspirado nasofaríngeo bocavirus y adenovirus.
Dos lactantes de 12 y 14 meses de edad con infección sencilla por bocavirus, presentaron fiebre sin foco (salvo mínima rinorrea), hipotensión, exantema petequial y afectación del estado general. Ambos fueron diagnosticados de sepsis clínica, precisando uno de ellos ingreso en la unidad de cuidados intensivos (UCI). En ambos casos no se detectó ningún otro microorganismo.
Un niño de 22 meses, infectado por HBoV y adenovirus, fue ingresado por celulitis facial, observándose sinusitis en la tomografía computarizada.
La fiebre y la hipoxemia fueron frecuentes. Un total de 19 niños (36,5 %) recibieron tratamiento antibiótico durante su ingreso: 13 de ellos presentaban infiltrado/atelectasia en la radiografía de tórax, dos presentaban un cuadro clínico compatible con sepsis y otro paciente tuvo una crisis vasooclusiva con fiebre elevada.
Se identificó coinfección con otro virus respiratorio en 39 (75 %) de las 52 muestras positivas para bocavirus: adenovirus en nueve (23 %), VRS en ocho (20,5 %), rinovirus en siete (18 %), hMPV en tres (7,6 %), parainfluenza en uno (2,5 %) y enterovirus en uno (2,5 %). Las coinfecciones fueron múltiples en 10 casos (25,6 %).
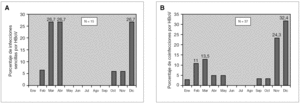
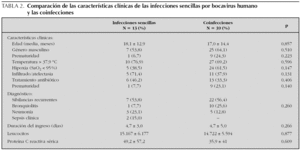
En la tabla 2 se describen las características clínicas de las 13 infecciones simples por HBoV, comparándolas con las de las infecciones dobles o múltiples. La fiebre fue muy frecuente, elevada y prolongada en ambos grupos. La temperatura media en los niños febriles con infección sencilla por HBoV fue 39 ± 1 °C y se prolongó durante 5,6 ± 3,8 días. La distribución estacional fue similar en ambos, aunque las infecciones sencillas fueron algo más frecuentes en primavera (fig. 3). No se observaron diferencias significativas entre los grupos en el resto de las variables estudiadas.
Figura 3. Distribución mensual de las infecciones sencillas por bocavirus humano en comparación con las coinfecciones de bocavirus con otros virus respiratorios.
Discusión
Se describe por primera vez una serie de pacientes infectados por HBoV en España. Según nuestros resultados, la frecuencia de las infecciones respiratorias asociadas a HBoV en niños ingresados es muy elevada: 22,4 % de todos los casos positivos y 17,1 % del total. Esta es una de las frecuencias más elevadas descritas hasta ahora. En la serie original, descrita por Allander et al15, la frecuencia de infecciones por HBoV era del 3,1 %. Poco después, otros investigadores en Australia17, Japón18, Canadá20 y Francia19, publicaron series en las que HBoV suponía el 5,6 , 5,7 , 1,5 y 4,4 % de las infecciones respiratorias, respectivamente. Estudios posteriores han arrojado cifras de frecuencia muy similares22,24. En cambio, en dos estudios realizados en Alemania25 y en Sudáfrica21 en niños hospitalizados, se encontró HBoV en el 10,3 y 11 % de los casos. Muy recientemente, se han descrito dos series, una en Jordania23, en la que se describieron 57 infecciones por HBoV en una muestra de 326 niños menores de 5 años, lo que suponía un 18,3 % del total y otra en Finlandia en la que la incidencia de HBoV fue de 19 %30. Estas cifras concuerdan con la observada por nuestro grupo. Existen varias posibles explicaciones para la mayor frecuencia de HBoV encontrada en nuestro estudio en comparación con algunos de los previos. En primer lugar, es posible que existan diferencias regionales o estacionales en la incidencia de las infecciones por HBoV. Por otro lado, algunos estudios han investigado la frecuencia de HBoV sólo en las muestras negativas para otros virus respiratorios18,20. Dada la elevada proporción de coinfecciones encontrada en las series sueca (17,6 %)15, australiana (55 %)17 y en nuestros propios pacientes (75 %), es muy probable que se pueda haber infravalorado la verdadera frecuencia de HBoV, al dejar sin diagnosticar las infecciones simultáneas de HBoV con otros virus respiratorios.
Con respecto a la frecuencia relativa de HBoV, en nuestra serie fue el tercero más frecuente, después de VRS y rinovirus. En la serie australiana17, HBoV fue el segundo virus en frecuencia, pero hay que tener en cuenta que en ese estudio no se realizó PCR para rinovirus y publicaciones previas han demostrado que el rinovirus es uno de los agentes virales más frecuentes en las infecciones respiratorias de los niños, ocupando el segundo puesto tras VRS31,32. Nuestro estudio, en el que se ha investigado mediante RT-PCR múltiple descrita previamente por nuestro grupo, la presencia de VRS, adenovirus, influenza A, B y C, parainfluenza 1, 2, 3 y 4, y se ha realizado RT-PCR para hMPV, rinovirus y HBoV, puede suponer una aproximación bastante real a la frecuencia relativa de HBoV en las infecciones respiratorias graves de los niños, demostrando que es uno de los virus más frecuentes. No obstante nuestra serie está referida a una sola temporada y es conocida la variabilidad anual de las infecciones virales por lo que esta frecuencia debe confirmarse en estudios a más largo plazo.
Las infecciones por HBoV difieren del resto de las infecciones respiratorias al menos en un aspecto: la elevadísima frecuencia con la que coinfectan con otros virus respiratorios. En el 75 % de las muestras positivas para HBoV, se detectó simultáneamente otro virus respiratorio, por orden de frecuencia: adenovirus, VRS, rinovirus y hMPV. Esta es una de las tasas de coinfecciones más elevadas descritas hasta ahora junto con la de la serie jordana, con coinfecciones en el 72 % de los casos23. En la serie australiana las infecciones mixtas fueron también muy frecuentes: 56 %17, aunque el rinovirus no fue incluido en diagnóstico virológico. En otros estudios las tasas de coinfección, aunque elevadas, son considerablemente inferiores a las descritas por nuestro grupo, probablemente porque la metodología empleada es diferente. En la serie japonesa y americana22 sólo se investigó la presencia de HBoV en muestras negativas para otros virus, por lo que no se puede extraer ninguna conclusión acerca de las infecciones dobles o múltiples. Manning et al24, en Edimburgo, empleando una PCR múltiple para la detección de VRS, influenza A y B, parainfluenza 1-3 y adenovirus encontraron coinfecciones en el 43 % de las muestras positivas a HBoV. Esta cifra, aunque elevada, probablemente es inferior a la real ya que no se investigó la presencia de rinovirus ni de hMPV, con los que HBoV coinfecta frecuentemente. En los estudios llevados a cabo en en Sudáfrica21, Alemania33 y Francia19 se encontraron infecciones simultáneas de HBoV con otros virus en el 37, 50 y 36 %, respectivamente. En los tres estudios la técnica empleada para la detección de VRS, influenza A y B, parainfluenza 1-3 y adenovirus fue la inmunofluorescencia, bastante menos sensible que la PCR múltiple empleada por nuestro grupo y por los investigadores jordanos. En ninguno de ellos se tuvo en cuenta la presencia de rinovirus, que es uno de los virus que coinfecta con más frecuencia con HBoV y en el estudio alemán tampoco se investigó hMPV.
Nuestros resultados indican una mayor incidencia de las infecciones por HBoV en los meses de invierno y primavera. La mayoría de los casos descritos inicialmente en Suecia15 y Australia17 ocurrieron también en invierno. Todos los casos de la serie japonesa fueron diagnosticados desde junio a mayo18. En cambio, en la serie canadiense no se encontró predominio estacional en la circulación de HBoV. Estas discrepancias probablemente se explican porque el grupo de Canadá sólo investigó la presencia de HBoV en las muestras negativas para otros virus respiratorios. Teniendo en cuenta la elevada frecuencia de coinfección de HBoV con VRS y adenovirus, que circulan predominantemente en invierno, y rinovirus y hMPV que tienen un pico de incidencia en primavera11,34, no es de extrañar que las muestras positivas para HBoV se detectaran en el estudio canadiense, fuera de estos períodos.
Curiosamente, un paciente ingresó en tres ocasiones distintas en misma temporada con sibilancias en el contexto de infección respiratoria y en los tres episodios se detectó HBoV. Igualmente, otra niña fue hospitalizada en dos temporadas distintas por una infección respiratoria de vías bajas y en las dos se identificó HBoV. Estos datos pueden reflejar la ausencia de inmunidad permanente tras las infecciones por HBoV, como ocurre con otros virus respiratorios, la dificultad en aclarar el virus de las vías respiratorias o bien la circulación de distintos genotipos del virus en la misma temporada.
La distribución de la edad de los pacientes infectados por HBoV en nuestra serie fue similar a la descrita previamente15,17,19. La mayoría de las infecciones por HBoV ocurren entre los 6 meses y los 3 años de edad. Esta distribución etaria es compatible con protección frente a la infección en los primeros meses de vida por la transferencia de anticuerpos maternos. A buen seguro en los próximos años se realizarán estudios de seroprevalencia de anticuerpos frente a HBoV que aportarán luz en este campo.
Las manifestaciones clínicas asociadas más frecuentemente a la infección por HBoV fueron sibilancias recurrentes/exacerbación asmática, bronquiolitis y neumonía tanto en las infecciones sencillas como en las coinfecciones. En la misma línea apuntan los resultados de Allander et al30 que en una serie de 259 niños hospitalizados por bronquiolitis o sibilancias recurrentes/exacerbación asmática, detectaron al menos un virus en el 95 % de los casos, de los que el 19 % correspondían a HBoV.
La mayoría de los niños (71 %) presentó fiebre elevada, tal como también han comunicado varios estudios previos15,17,18,20 y más de la mitad presentaron hipoxia. También fue frecuente la presencia de infiltrado radiológico (44 % en los que se realizó radiografía). Prácticamente la mitad de los niños con infección simple por HBoV recibieron tratamiento antibiótico. Esta elevada cifra contrasta con la tasa de antibioterapia comunicada en lactantes hospitalizados por infección respiratoria en publicaciones previas de nuestro grupo: 19 % para niños con infección por hMPV, 13,6 % para niños con infección por VRS34 o 21 % para infecciones por rinovirus31. Probablemente, la fiebre alta, la leucocitosis y la elevada frecuencia de infiltrado pulmonar, en ausencia de agente etiológico, motivaron que casi la mitad de los niños con infección simple por HBoV fueran tratados con antibiótico. Probablemente de haberse conocido en tiempo real la presencia de HBoV en el aspirado nasofaríngeo, se hubiera modificado la actitud terapéutica en muchos de estos pacientes.
Esta es la primera vez que se describe afectación sistémica grave con exantema cutáneo asociada a la infección por HBoV. Efectivamente 2 lactantes presentaron importante afectación del estado general, exantema petequial y uno de ellos, hipotensión por lo que fue ingresado en la UCI, con la sospecha de sepsis. El reciente hallazgo de ADN viral en suero de niños con infecciones respiratorias por HBoV30 apoya la idea de que HBoV pueda asociarse con manifestaciones sistémicas extrapulmonares. En un estudio previo se han descrito 5 casos de infección por HBoV con exantema maculopapular35, pero en el contexto de un cuadro clínico más leve que el de nuestros pacientes. Dado que una típica enfermedad exantemática, como la quinta enfermedad, está producida por el parvovirus B1916, muy próximo genéticamente al HBoV, no es de extrañar que este virus pueda también manifestarse con exantema cutáneo.
Es muy complicado demostrar causalidad en los casos en los que se detecta HBoV o cualquier nuevo patógeno respiratorio. Los principios clásicos de Koch han quedado relegados debido a que muchos microorganismos que son claramente patógenos no cumplen dichos principios y a que es muy difícil disponer de modelos animales. Por otra parte, la inoculación controlada del virus a voluntarios sanos es cada vez más complicada por problemas éticos. Por tanto, la demostración de causalidad suele venir dada no por un único estudio, sino por la acumulación progresiva de evidencia en ese sentido y por la asociación consistente en el tiempo de un microorganismo con una enfermedad concreta o un grupo de enfermedades. La presencia en nuestro estudio de 15 pacientes con infección única por HBoV y con afectación clínica significativa, puede ser sugestiva del papel patogénico de este virus. En la misma dirección apuntan los resultados de Kessebir et al22, que incluyeron en su serie 96 niños sanos sin que en ninguno de ellos se detectara HBoV.
En conclusión, aunque son necesarios más estudios que confirmen el papel patogénico del HBoV, nuestros resultados parecen confirmar el carácter epidémico de la infección por HBoV y su importante papel como patógeno en las infecciones respiratorias pediátricas, especialmente en los niños menores de 2 años. En este grupo de edad, HBoV puede ser el tercer virus más frecuentemente asociado a infecciones respiratorias graves. Sus manifestaciones clínicas son similares a la de otros virus respiratorios, aunque también puede asociarse a cuadros febriles con exantema y posiblemente a otras manifestaciones extrapulmonares aún no descritas. Dada la elevada frecuencia y el importante impacto clínico de las infecciones por HBoV, parece necesario incorporar la detección rutinaria de este virus en el diagnóstico de las infecciones respiratorias graves de los niños, ya que ello mejoraría considerablemente la atención sanitaria de estos pacientes, evitando pruebas complementarias y tratamiento antibióticos en muchos casos innecesarios, así como la transmisión nosocomial del virus.
Estudio parcialmente financiado por el Fondo de Investigaciones Sanitarias. FIS N.º 98/0310.
Correspondencia: Dra. M.ªL. García-García.
Castilla, 3 Bis. 28290 Las Rozas. Madrid. España.
Correo electrónico: marialuzgarcia@terra.es
Recibido en abril de 2007.
Aceptado para su publicación en abril de 2007.