La nutrición parenteral agresiva con aportes energéticos y proteicos altos se utiliza para mejorar el crecimiento y el neurodesarrollo en recién nacidos prematuros de muy bajo peso. No obstante, hallazgos recientes sugieren que su uso puede ocasionar alteraciones electrolíticas. El objetivo del estudio era comparar la prevalencia de hipercalcemia, hipofosfatemia e hipopotasemia en dos grupos de recién nacidos prematuros que recibieron nutrición parenteral con distintos aportes de aminoácidos y analizar variables perinatales y nutricionales asociadas a la ocurrencia de alteraciones electrolíticas.
MétodosEstudio retrospectivo observacional, con comparación de dos grupos de recién nacidos prematuros con peso < 1.500 g y edad gestacional < 33 semanas, que recibían nutrición parenteral. Uno de los grupos recibió < 3 g/kg/d de aminoácidos, mientras que el otro recibió ≥ 3 g/kg/d. Se analizó la prevalencia de distintas alteraciones electrolíticas y su asociación con la nutrición parenteral agresiva, con ajustes para posibles factores de confusión.
ResultadosEl análisis incluyó 114 recién nacidos: 60 que recibieron < 3 g/kg/d de aminoácidos (bajo aporte) y 54 que recibieron ≥ 3 g/kg/d (alto aporte). La prevalencia de alteraciones electrolíticas fue similar en ambos grupos. La prevalencia de hipercalcemia fue de 1,67% en el grupo de bajo aporte y 1,85% en el grupo de alto aporte (p > 0,99). Los respectivos valores para las otras alteraciones fueron 11,7 vs. 9,3% en el caso de la hipofosfatemia grave y 15,0 vs. 11,1% en el caso de la hipopotasemia (p > 0,99). Se observó que una relación calcio:fósforo superior a 1,05 mostraba un efecto protector frente a la hipofosfatemia (p = 0,007).
ConclusionesNo se observó asociación entre la hipercalcemia, hipofosfatemia o la hipopotasemia y el aporte de aminoácidos mediante nutrición parenteral en la población de recién nacidos prematuros con altos aportes de aminoácidos.
Aggressive parenteral nutrition with delivery of high amino acid and energy doses is used to improve growth and neurodevelopmental outcomes in very low birth weight (VLBW) preterm infants. Recent findings, however, suggest that this approach may cause electrolyte imbalances. The aim of our study was to compare the prevalence of hypercalcaemia, hypophosphataemia, and hypokalaemia in 2 groups of preterm infants that received parenteral nutrition with different amounts of amino acids and to analyse perinatal and nutritional variables associated with the development of electrolyte imbalances.
MethodsWe conducted a retrospective observational study comparing 2 groups of preterm infants born before 33 weeks’ gestation with birth weights of less than 1,500 g managed with parenteral nutrition. One of the groups received less than 3 g/kg/day of amino acids and the other received 3 g/kg/day of amino acids or more. We analysed the prevalence of electrolyte imbalances and possible associations with aggressive parenteral nutrition, adjusting for potential confounders.
ResultsWe studied 114 infants: 60 given less than 3 g/kg/day of amino acids (low-intake group) and 54 given at least 3 g/kg/day (high-intake group). The prevalence of electrolyte imbalances was similar in both groups. The prevalence of hypercalcaemia was 1.67% in the low-intake group and 1.85% in the high-intake group (p > .99), the prevalence of severe hypophosphataemia 11.7 vs. 9.3%, and the prevalence of hypokalaemia 15.0 vs. 11.1% (p > .99). A calcium to phosphorus ratio greater than 1.05 had a protective effect against hypophosphataemia (p = .007).
ConclusionsWe did not find any association between hypercalcemia, hypophosphatemia, and hypokalemia and amino acid intake by PN in the population of premature infants with quite high amino acid intake values.
Los recién nacidos prematuros de muy bajo peso (RNPMBP) (peso al nacer < 1.500 g) son un colectivo con alto riesgo de restricción posnatal del crecimiento (RCIU) debido a la interrupción prematura del transporte de nutrientes a través de la placenta en un momento crítico del crecimiento y desarrollo1. Para abordar este problema, las guías clínicas actuales recomiendan administrar un régimen agresivo de nutrición parenteral (NP) para garantizar aportes energéticos y proteicos altos, en combinación con la lactancia materna2–5.
Aunque esta estrategia se ha mostrado efectiva para optimizar la nutrición posnatal y el neurodesarrollo, los hallazgos de algunos estudios recientes sugieren que un alto aporte de aminoácidos (> 3 g/kg/día) puede causar alteraciones electrolíticas en esta población, afectando especialmente al metabolismo del calcio y fósforo4–9.
Como se ha descrito previamente, aportes altos de energía y aminoácidos en la primera semana de vida mantendrían las células en un estado anabólico, lo que conllevaría un aumento en la concentración intracelular de fósforo y potasio, necesarios en la producción de ácidos nucleicos y el trifosfato de adenosina (ATP), entre otros procesos. Un aporte inadecuado de fósforo y potasio conduce a concentraciones plasmáticas deficientes de estos electrolitos y concentraciones aumentadas de calcio, producto fundamentalmente de la resorción osea6–8. Este proceso se conoce como «síndrome de alimentación placentaria interrumpida del recién nacido prematuro»10–12.
En un ensayo clínico aleatorizado que comparó dos protocolos de nutrición en recién nacidos de muy bajo peso, Moltu et al.7 encontraron una prevalencia mayor de hipercalcemia, hipofosfatemia e hipopotasemia y un riesgo mayor de septicemia en recién nacidos que recibieron 3,5 g/kg/día de aminoácidos, en comparación con recién nacidos en un grupo de control que recibieron aproximadamente 2 g/kg/día. Por otro lado, Bonsante et al.8 encontraron una correlación entre distintos aportes de aminoácidos (< 1,5 g/kg/día; 1,5-2 g/kg/día; y > 2 g/kg/día) y el desarrollo de hipercalcemia e hipofosfatemia, detallando que estas alteraciones se dieron con mayor frecuencia en recién nacidos que recibieron aportes mayores. Más recientemente, Brener et al.9 reportaron una asociación entre la NP agresiva y la hipercalcemia y la hipofosfatemia al comparar recién nacidos prematuros manejados con un régimen nutricional agresivo (2,3-3,7 g/kg/día) con controles manejados con un régimen estándar (2,5-3,1 g/kg/día).
Las alteraciones electrolíticas no suelen producir síntomas, ya que se corrigen precozmente. No obstante, la hipercalcemia (definida como concentraciones de calcio total > 3,5 mmol/l o concentraciones de calcio iónico > 1,73 mg/dL), puede ocasionar vómitos, irritabilidad e incluso arritmia ventricular, mientras que la hipofosfatemia grave (concentraciones de fosfato < 0,9 mmol/l) se asocia a debilidad muscular, una mayor duración del soporte ventilatorio e infecciones nosocomiales12,13.
El objetivo del estudio fue evaluar la asociación entre el aporte proteico de la NP y la presencia de alteraciones electrolíticas (hipercalcemia, hipofosfatemia e hipopotasemia) en una cohorte de RNPMBP.
Los objetivos secundarios fueron analizar el momento del inicio y la duración de las alteraciones en electrolíticas de fosfato y de calcio y evaluar la adecuación de la relación calcio:fósforo (Ca:P) de la solución de NP empleada en nuestro hospital.
MétodosDiseño del estudioEstudio observacional, retrospectivo, no controlado, abierto realizado en el Área Materno-Infantil del Hospital Universitario Vall d’Hebron de Barcelona entre enero y diciembre de 2016. El estudio fue aprobado por el Comité Ético de Investigación Clínica del hospital (EPA(AG)58/2018(5383).
Se identificaron los sujetos para estudio mediante la revisión de los registros de prescripción de NP del Servicio de Farmacia del hospital. Se incluyeron RNPMBP y edad gestacional < 33 semanas, que recibieron NP en la Unidad de Cuidados Intensivos Neonatales. Se excluyeron recién nacidos con anomalías congénitas mayores y anomalías cromosómicas.
Variables de estudioEn nuestro hospital, la NP para recién nacidos prematuros se individualiza de acuerdo con el estado clínico, la edad (días de vida) y el peso del paciente, tal como se establece en la cuarta edición de las guías de nutrición pediátrica del hospital14.
En el primer día de vida, algunos recién nacidos que necesitan soporte nutricional reciben una bolsa de NP estándar si nacen en horario de guardia, mientras que otros reciben una bolsa de NP individualizada si nacen en horario de trabajo habitual.
La solución estándar para el primer día de vida (hasta el 2017) consistía en un volumen de 150 mL que aportaba 16,2 kcal, 9,5 g de hidratos de carbono, 3,6 g de aminoácidos, 0,9 g de lípidos, y 1,66 mEq de calcio (osmolaridad, 725 mOsm/l). Siguiendo el protocolo, la dosis fue de 60 a 90 mL/kg/día en recién nacidos con pesos inferiores a 1.000 g y de 65 a 80 mL/kg/día en recién nacidos con pesos de 1.000 a 1.500 g. Estos volúmenes correspondían a un aporte proteico de menos de 2,2 g/kg/día.
Tras el primer día, todas las soluciones de NP se individualizaron para cada paciente con base en su edad y peso. La guía establece la ingesta calórica y proteica recomendada para los días 1-8 de vida, con dosis ajustadas al estado clínico del paciente14. La guía del hospital establece una dosis inicial de aminoácidos de 2,5 g/kg/día hasta un máximo de 3,5 g/kg/día.
La administración de electrolitos se basa en las recomendaciones de la guía y las alteraciones detectadas se corrigen mediante la adaptación de la solución de NP o suplementación con electrolitos al día siguiente. La administración de calcio (gluconato cálcico 10%) comienza el primer día y la administración de fósforo (glicerofosfato sódico) y de potasio (cloruro o acetato potásico) el segundo día de vida. De este modo, la relación Ca:P oscila de 0,7 a 1,1 mmol de calcio por 1 mmol de fósforo14.
A ser posible, la nutrición enteral (NE) trófica a base de leche materna propia o donada se combina con la NP desde el primer día de vida. El volumen inicial de leche materna es de 10 a 20 mL/kg/día, que se incrementa gradualmente según la tolerancia. Como no siempre se puede obtener la cantidad necesaria de leche materna, asumimos que la mayoría del volumen de NE correspondió a leche materna donada madura, la cual, según la guía de nutrición pediátrica de nuestro hospital14, contiene 70 mg/mL de hidratos de carbono, 11 mg/mL de proteína, 45 mg/mL de lípidos, 150 mg/mL de sodio, 500 mg/mL de potasio, 400 mg/mL de cloruro, 340 mg/l de calcio, 140 mg/l de fósforo, 0,5 mg/l de hierro, 32 mg/l de magnesio, 250 μg/l de cobre y 1.200 μg/l de zinc.
Los recién nacidos recibieron NP hasta que desarrollaron tolerancia a la NE total.
Recolección de datosSe recogieron las siguientes variables de las historias clínicas: edad gestacional, sexo, peso al nacer, antecedente de RCIU, uso de corticoides prenatales, distrés respiratorio, ductus arterioso persistente, uso de ibuprofeno intravenoso, sepsis, enterocolitis necrosante y supervivencia a los 30 días.
Se recogieron las ingestas diarias alcanzadas mediante tanto la NP como la NE en cada recién nacido, con desglose del volumen, energía, macronutrientes (glucosa, proteínas y lípidos) y micronutrientes (sodio, potasio, cloruro calcio y fósforo) administrados. También se recogieron las cantidades adicionales de electrolitos (fosfato, calcio y potasio) aportados a través de la NP y la NE. En todos los casos, la duración del seguimiento correspondió al período de NP.
Se recogieron las concentraciones plasmáticas de sodio, fosfato, calcio, potasio, urea, creatinina y fosfatasa alcalina registrados durante el período de NP. No se hicieron distinciones entre concentraciones séricas y plasmáticas. Otras variables analizadas incluyeron la concentración de calcio iónico, obtenido mediante gasometría arterial, las concentraciones plasmáticas de sodio, potasio y cloruro obtenidos mediante potenciometría indirecta, la concentración de calcio total obtenido mediante colorimetría con Arsenazo III y la concentración de fosfato obtenido por calorimetría indirecta (analizador Beckman Coulter AU5800; Beckman Coulter International S.A., Rue Juste-Olivier 22, PO Box 1059, CH – 1260, Nyon, Suiza).
Se definió hipofosfatemia leve, moderada y grave como una concentración plasmática inferior a 1,29 mmol/l, 1,1 mmol/l, y 0,9 mmol/l, respectivamente, la hipopotasemia como una concentración plasmática inferior a 3,5 mmol/l, y la hipercalcemia como una concentración plasmática de calcio total superior a 2,8 mmol/l y de calcio iónico superior a 1,3 mmol/l.
Análisis estadísticoLas variables continuas se expresan como media y desviación estándar (DE) o mediana y rango, y las categóricas como frecuencias absolutas y porcentajes. Se clasificó a los recién nacidos en dos grupos, según hubieran recibido menos 3 g/kg/día de aminoácidos (bajo aporte) o 3 o más g/kg/día (alto aporte). Se resumieron las características clínicas, analíticas y demográficas de los recién nacidos y se compararon en los dos grupos. Las variables continuas se compararon mediante la prueba t de Student-Fisher y las variables categóricas mediante la prueba χ2 o la prueba exacta de Fisher, según procediese.
En el análisis inferencial se evaluó la asociación entre las concentraciones de calcio, fósforo y potasio y (i) variables perinatales, (ii) ingestas nutricionales, y (iii) la relación Ca:P mediante regresión logística o lineal. Las variables perinatales incluidas en el modelo fueron la edad gestacional, el sexo, el peso al nacer, el RCIU, el uso de corticoides prenatales, el distrés respiratorio, el ducto arterioso persistente, el uso de ibuprofeno intravenoso, la sepsis, la enterocolitis necrosante y la supervivencia a los 30 días de vida. En el análisis multivariante se incluyeron todas las variables con resultados significativos en el análisis univariante (p < 0,05) inicial y se empleó el método de eliminación hacia atrás (p < 0,10). Se evaluó el efecto de posibles variables de confusión, tales como la edad gestacional, el peso al nacer, el antecedente de RCIU, la ingesta energética y el aporte de NP y NE.
El análisis estadístico se llevó a cabo con el software IBM SPSS Statistics, versión 18.0 (SPSS Inc; Chicago, EEUU). La significación estadística se estableció para un valor de p < 0,05.
ResultadosSe identificaron 135 recién nacidos que recibieron NP candidatos a estudio, de los que se excluyeron 21 por datos incompletos o por no cumplir los criterios de inclusión. La muestra final comprendió 114 recién nacidos prematuros. En el análisis se incluyeron un total de 306 mediciones de fosfato, 503 de calcio y 464 de potasio.
Las características perinatales e ingestas nutricionales de cada grupo se presentan en las tablas 1 y 2. El grupo de bajo aporte (aporte de aminoácidos < 3 g/kg/día) comprendió 60 pacientes y el de alto aporte (≥ 3 g/kg/día) 54 pacientes. Las características demográficas y clínicas fueron comparables en ambos grupos, con excepción de la sepsis, que fue más frecuente en el grupo de alto aporte, aunque la diferencia no fue estadísticamente significativa. Al comparar los aportes de la NP y la NE en ambos grupos se observaron diferencias significativas en todos los nutrientes y electrolitos, excepto en el aporte de magnesio de la NP.
Características perinatales de los pacientes con aportes altos y bajos de aminoácidos
| Características | Grupo | |||
|---|---|---|---|---|
| Grupo de bajo aporte< 3 g/kg/dían = 60 | Grupo de alto aporte≥3 g/kg/dían = 54 | p-valor | ||
| Variables | ||||
| Sexo femenino | n (%) | 34 (52,31) | 31 (57,41) | > 0,99 |
| Edad gestacional (semanas) | Media ± DE | 28,26 ± 2,43 | 28,79 ± 2,71 | > 0,99 |
| Peso al nacer (g) | Media ± DE | 1075 ± 281 | 1062 ± 276 | > 0,99 |
| Crecimiento intrauterino retardado | n (%) | 25 (41,67) | 27 (50,00) | > 0,99 |
| Corticoides prenatales | n (%) | 58 (96,67) | 50 (92,59) | > 0,99 |
| Distrés respiratorio | n (%) | 49 (81,67) | 37 (68,52) | > 0,99 |
| Ducto arterioso persistente | n (%) | 17 (28,33) | 17 (31,48) | > 0,99 |
| Ibuprofeno intravenoso | n (%) | 11 (18,33) | 12 (22,22) | > 0,99 |
| Sepsis | n (%) | 10 (16,67) | 17 (31,49) | > 0,99 |
| Enterocolitis necrosante | n (%) | 1 (1,67) | 1 (1,85) | > 0,99 |
| Duración de nutrición parenteral (días) | Media ± DE | 8,88 ± 8,45 | 8,74 ± 5,81 | > 0,99 |
| Mortalidad a los 30 días | % | 3,3 | 7,4 | > 0,99 |
| Administración de solución estándar el primer día | n (%) | 15 (25) | 27 (50) | < 0,001 |
Características de la nutrición administrada a los pacientes en los grupos de altos aportes y bajos aportes proteicos
| Características | Grupo | |||
|---|---|---|---|---|
| Grupo de bajo aporte< 3 g/kg/dían = 60 | Grupo de alto aporte≥3 g/kg/dían = 54 | p-valor | ||
| Composición media diaria de la nutrición parenteral | ||||
| Volumen (mL/g/día) | Media ± DE | 85,58 ± 12,63 | 103,48 ± 17,91 | < 0,001 |
| Energía (kcal/kg/día) | Media ± DE | 54,51 ± 6,29 | 63,48 ± 7,47 | < 0,001 |
| Proteína (aminoácidos) (g/kg/día) | Media ± DE | 2,67 ± 0,30 | 3,21 ± 0,24 | < 0,001 |
| Hidratos de carbono (glucosa) (g/kg/día) | Media ± DE | 6,83 ± 0,81 | 8,10 ± 1,35 | < 0,001 |
| Lípidos (g/kg/día) | Media ± DE | 1,68 ± 0,28 | 1,92 ± 0,33 | < 0,001 |
| Sodio (mEq/kg/día) | Media ± DE | 2,20 ± 0,69 | 2,60 ± 0,86 | < 0,05 |
| Potasio (mEq/kg/día) | Media ± DE | 1,32 ± 0,34 | 1,51 ± 0,28 | < 0,05 |
| Fósforo (mmol/kg/día) | Media ± DE | 0,65 ± 0,14 | 0,70 ± 0,14 | < 0,001 |
| Calcio (mEq/kg/día) | Media ± DE | 1,35 ± 0,24 | 1,59 ± 0,15 | < 0,001 |
| Relación Ca:P (mmol:mmol) | Media ± DE | 1,04:1 ± 0,21 | 1,17:1 ± 0,20 | < 0,001 |
| Magnesio (mEq/kg/día) | Media ± DE | 0,12 ± 0,09 | 0,12 ± 0,11 | > 0,99 |
| Composición media diaria de la nutrición enteral de los pacientes (leche materna donada) | ||||
| Volumen (mL/kg/día) | Media ± DE | 58,73 ± 23,22 | 40,52 ± 23,87 | < 0,001 |
| Dosis suplementarias de electrolitos | ||||
| Sodio (mEq) | Media ± DE | 0,15 ± 0,37 | 0,11 ± 0,25 | > 0,99 |
| Potasio (mEq) | Media ± DE | 0,01 ± 0,04 | 0,02 ± 0,05 | > 0,99 |
| Fósforo (mmol) | Media ± DE | 0,02 ± 0,07 | 0,00 ± 0,01 | > 0,99 |
| Calcio (mEq) | Media ± DE | 0,02 ± 0,12 | 0,01 ± 0,03 | > 0,99 |
Ca:P = relación calcio:fósforo.
El análisis multivariante no detectó asociaciones significativas entre las concentraciones plasmáticas de calcio y las variables perinatales, los aportes de NP o NE o la relación Ca:P. Las únicas variables asociadas significativamente a la concentración plasmática de fósforo fueron el aporte de potasio (p = 0,017) y el de calcio (p = 0,01) en la NP. De manera similar, los únicos modificadores significativos de la concentración plasmática de potasio fueron los aportes de calcio (p = 0,002) y de fósforo (p = 0,05) en la NP.
Las concentraciones medias de calcio, fósforo y potasio en cada grupo se presentan en la tabla 3, junto con la frecuencia absoluta y porcentaje de pacientes que desarrollaron hipercalcemia, hipofosfatemia e hipopotasemia.
Prevalencia de hipercalcemia, hipofosfatemia e hipopotasemia en recién nacidos prematuros, según el aporte de aminoácidos en la nutrición parenteral
| Grupo de bajo aporte< 3 g/kg/dían = 60 | Grupo de alto aporte≥3 g/kg/dían = 54 | p-valor | ||
|---|---|---|---|---|
| Calcio total (mmol/l) | Media ± DE | 2,22 ± 0,32 | 2,27 ± 0,18 | > 0,99 |
| Calcio iónico (mg/dL) | Media ± DE | 1,13 ± 0,39 | 1,12 ± 0,42 | > 0,99 |
| Fosfato (mmol/l) | Media ± DE | 1,5 ± 0,41 | 1,53 ± 0,36 | > 0,99 |
| Potasio (mmol/l) | Media ± DE | 4,45 ± 0,76 | 4,42 ± 0,47 | > 0,99 |
| Hipercalcemia(calcio plasmático > 2,8 mmol/l) | Recién nacidos, n (%) | 1 (1,67) | 1 (1,85) | > 0,99 |
| Medidas alteradas, n (%) | 1/261 (0,38) | 1/242 (0,41) | > 0,99 | |
| Hipercalcemia (calcio iónico > 1,3 mmol/l) | Recién nacidos, n (%) | 42 (70) | 43 (79,6) | > 0,99 |
| Medidas alteradas, n (%)) | 164/303 (54,13) | 196/338 (58,99) | > 0,99 | |
| Hipofosfatemia leve(P < 1,29 mmol/l) | Recién nacidos, n (%) | 22 (36,67) | 21 (38,89) | > 0,99 |
| Medidas alteradas, n (%) | 62/148 (41,89) | 50/158 (31,65) | 0,063 | |
| Hipofosfatemia moderada (p < 1,1 mmol/l) | Recién nacidos, n (%) | 13 (21,67) | 15 (27,78) | > 0,99 |
| Medidas alteradas, n (%) | 33/148 (22,30) | 25/158 (15,82) | 0,150 | |
| Hipofosfatemia grave(p < 0,9 mmol/l) | Recién nacidos, n (%) | 7 (11,67) | 5 (9,26) | > 0,99 |
| Medidas alteradas, n (%) | 16/148 (10,81) | 10/158 (6,33) | 0,161 | |
| Hipopotasemia(K < 3,5 mmol/l) | Recién nacidos, n (%) | 9 (15,00) | 6 (11,11) | > 0,99 |
| Medidas alteradas, n (%) | 21/237 (8,86) | 10/227 (4,41) | 0,055 |
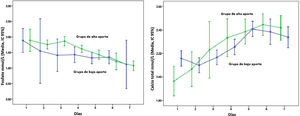
La figura 1 presenta la evolución de las concentraciones plasmáticas diarias de calcio y fosfato, mostrando una tendencia clara hacia la hipercalcemia y la hipofosfatemia con el paso de los días.
Al analizar las asociaciones entre la relación Ca:P y los aportes de electrolitos en la NP, se observó un efecto protector de una relación superior a 1,05:1 frente a la hipofosfatemia (p = 0,007), mientras que relaciones menores aumentaban su riesgo (p = 0,072). Este efecto protector se observó con relaciones de hasta 1,4:1.
En el análisis de la asociación entre la relación Ca:P y las cantidades totales de electrolitos aportadas mediante NP, NE y fluidos adicionales, encontramos que una relación superior a 1,00:1 (hasta 1,3:1) se comportaba como un factor protector frente a la hipofosfatemia moderada (p = 0,043), mientras que relaciones menores se asociaban a un riesgo aumentado (p = 0,128).
DiscusiónEn los últimos años, varios autores han sugerido que la NP agresiva precoz en recién nacidos prematuros podría asociarse a trastornos metabólicos graves7–9,15-18. Se ha demostrado que la nutrición en los primeros días de vida afecta al metabolismo del calcio, fósforo y potasio y puede dar lugar a síndrome de realimentación8,10–12.
Se observó una prevalencia similar de hipercalcemia, hipofosfatemia e hipopotasemia en los recién nacidos prematuros que recibieron NP con un aporte de aminoácidos de 3 g/kg/día o superior (grupo de alto aporte) y en aquellos que recibieron aportes inferiores a 3 g/kg/día (grupo de bajo aporte).
En su ensayo clínico aleatorizado, que comparó dos grupos de recién nacidos de muy bajo peso, Moltu et al.7 observaron que los recién nacidos que recibieron una media de 3,7 g de proteína/kg/día (DE: 0,11) exhibieron un crecimiento posnatal mayor, en comparación con los que recibieron una media de 2,5 g/kg/día (0,18), aunque la incidencia de alteraciones electrolíticas (hipercalcemia, hipofosfatemia e hipopotasemia) y de septicemia también fue mayor en el grupo con aportes proteicos elevados. Bonsante et al.8 también encontraron una incidencia mayor de hipofosfatemia e hipercalcemia en recién nacidos prematuros que recibieron aportes altos de aminoácidos (2,3 ± 0,8 g/kg/día), en comparación con recién nacidos que recibieron aportes intermedios (1,49 ± 0,34 g/kg/día) o bajos (1,2 ± 0,8 g/kg/día). Los hallazgos de Brener et al.9 fueron similares en su estudio retrospectivo que comparó recién nacidos con una ingesta de aminoácidos de 3,3-3,7 g /kg/día versus 2,5-3,1 g/kg/día.
En nuestra cohorte, los aportes medios de aminoácidos fueron de 2,67 ± 0,3 g/kg/día en el grupo de bajo aporte y de 3,21 ± 0,24 g/kg/día en el grupo de alto aporte. La razón principal por la que la diferencia fue así de pequeña es que la composición de la NP venía dictada por las guías del hospital14. Además de ser similares, estos valores fueron bastante altos, por lo que las diferencias en el aporte de aminoácidos pueden no haber sido lo suficientemente grandes para tener un efecto detectable en los resultados, hecho que distingue a nuestra muestra de las de los estudios comentados anteriormente. Esto también podría explicar por qué no se encontró una correlación entre el aporte de aminoácidos y las alteraciones electrolíticas. Dicho de otro modo, casi todos los recién nacidos en nuestro estudio recibieron aportes proteicos mayores de 2,6 g/kg/día, por lo que su riesgo de desarrollar alteraciones electrolíticas fue similar7–9,15-18. Por otro lado, aunque se encontraron diferencias entre los grupos en las cantidades de electrolitos administradas por medio de la NP, una vez se tuvo en cuenta el aporte contribuido por la NE no hubo diferencias en el aporte total de electrolitos recibido por cada grupo. También cabe considerar que, como las soluciones de NP en nuestro hospital se individualizan a diario para satisfacer los requerimientos de cada paciente, la corrección precoz de las alteraciones electrolíticas podría explicar la baja prevalencia observada en el estudio. Otro factor a tener en cuenta es que aunque la suplementación con electrolitos fue similar en ambos grupos, también podría haber contribuido a dicha corrección precoz, aunque los datos disponibles no permitieron establecer relaciones de causalidad.
Las alteraciones electrolíticas fueron bastante menos frecuentes en nuestra cohorte, en comparación con otros estudios, excepto en el caso del calcio iónico. La hipofosfatemia se clasificó en tres categorías según la concentración plasmática de fósforo. Se registró hipofosfatemia leve (< 1.29 mmol/l) en el 36,6% (22/60) de los pacientes en el grupo de bajo aporte y el 38,9% (21/54) de los pacientes en el grupo de alto aporte. Aplicando el mismo punto de corte para definir la hipofosfatemia, Moltu et al.7 y Brener et al.9 reportaron porcentajes del 77% (36/40 pacientes) y el 90% (17/22 pacientes), respectivamente, en los grupos recién nacidos con aportes elevados de aminoácidos. La frecuencia de la hipofosfatemia moderada (< 1,1 mmol/l) en nuestro estudio fue del 21,7% (13/60 pacientes) en el grupo de bajo aporte y del 27,8% (15/54 pacientes) en el grupo de alto aporte. En otro estudio que también aplicó el mismo punto de corte, Brener et al.20 encontraron que el 58,3% (35/60) de los pacientes que recibieron de 3 a 3,5 g/kg/día de aminoácidos desarrollaron hipofosfatemia moderada. Por último, en nuestra muestra se observó hipofosfatemia grave (< 0,9 mmol/l), que puede tener impacto clínico en el 11,7% (7/60) de los pacientes en el grupo de bajo aporte y el 9,3% (5/54) de los pacientes en el grupo de alto aporte12,13. Aplicando un punto de corte similar (< 1 mmol/l), Bonsante et al.8 observaron que el 18,9% (11/53) de los recién nacidos en el grupo de aportes elevados desarrollaron hipofosfatemia grave.
Se analizaron las concentraciones plasmáticas de calcio total e iónico, ya que el primero varía en relación con las concentraciones de albúmina, que suelen ser bajas en los recién nacidos prematuros. Considerando exclusivamente la concentración de calcio total, sólo hubo un paciente con hipercalcemia en cada grupo. Esta prevalencia tan baja contrasta fuertemente con las proporciones del 6,2% (3/48 pacientes) y del 30,2% (16/53 pacientes) reportadas por Bonsante et al.8 en recién nacidos que recibieron aportes bajos y altos de aminoácidos, respectivamente. En cambio, la prevalencia de hipercalcemia calculada con base en los niveles plasmáticos de calcio iónico fue mucho mayor: 70% (42/60) en el grupo de bajo aporte y 79,6% (43/54) en el grupo de alto aporte. Brener et al.9 reportaron una proporción similar del 87% (35/40) en pacientes con aportes mayores de aminoácidos.
Por último, se registró hipopotasemia en el 15% (9/60) de los pacientes en el grupo de bajo aporte y en el 11,11% (6/54) de los pacientes en el grupo de alto aporte. Una vez más, estas proporciones contrastaron marcadamente con las correspondientes proporciones del 46% (11/24 pacientes) y el 88% (21/24 pacientes) descritas por Moltu et al.7
En nuestra serie, tanto la hipofosfatemia como la hipercalcemia tendieron a aparecer hacia el final del período de NP, lo que fue consistente con los hallazgos de Moltu et al.7 y Bonsante et al.8, aunque estos autores reportaron concentraciones menores de fósforo y mayores de calcio. Esto podría deberse al síndrome de realimentación, que generalmente aparece a los dos o tres días, o a incrementos en el volumen de NE durante el período de NP, que disminuyen la oportunidad de corregir alteraciones electrolíticas.
El fósforo es un mineral esencial para el metabolismo celular, ya que participa en la producción de ATP y en el correcto funcionamiento de las células inmunitarias. La falta de fósforo se asocia a la debilidad muscular, la resistencia a la insulina, el fracaso de la extubación y la sepsis7,12,13,19-21. La sepsis fue más frecuente en los recién nacidos prematuros que recibieron aportes mayores de aminoácidos en los ensayos aleatorizados de Moltu et al.7 y Brener et al.7,20 En nuestro estudio, la sepsis también fue más frecuente en el grupo de alto aporte, aunque no de manera significativa.
Según Senterre et al.21 y las guías de la ESPGHAN/ESPEN/ESPR/CSPEN sobre NP pediátrica, en los RNPMBP debería mantenerse una relación Ca:P ratio de 0,8 a 1,1:1 en la primera semana de vida. Esta relación consigue una reducción en la incidencia de hipofosfatemia y, por lo tanto, hipercalcemia en pacientes con ingestas energéticas y proteicas optimizadas que no reciben aportes altos de calcio y fósforo (0,8-2 y 1-2 mmol/kg/día, respectivamente). Después de la primera semana se recomienda una relación mayor (1-1,3:1), ya que los requerimientos de calcio y fósforo aumentan durante este período (a 1,6-3,5 y 1,6-3,5 mmol/kg/día, respectivamente)13,21.
En nuestra serie, se observó un efecto protector de valores de la relación Ca:P superiores a 1,05 frente a la hipofosfatemia moderada (p = 0,007), mientras que valores superiores se asociaron a un riesgo aumentado (p = 0,072). Por lo tanto, el uso de relaciones mayores a la recomendada (posiblemente de hasta 1,4:1) en la primera semana de vida podría reducir la incidencia de hipofosfatemia en recién nacidos prematuros de muy bajo peso.
Las enfermedades perinatales y las anomalías congénitas son responsables del 76,2% de las muertes en bebés menores de un año en nuestro entorno. La mortalidad en recién nacidos menores de 28 días de edad en el año 2016 fue del 16,5%22. En nuestra serie, la mortalidad a los 30 días fue de 3,3% en el grupo de bajo aporte y de 7,4% en el grupo de alto aporte. Teniendo en cuenta que se excluyó a recién nacidos con anomalías congénitas, estos valores son consistentes con los datos de nuestro entorno. Ninguna de las variables de estudio se asoció a un aumento de la mortalidad.
Nuestro estudio presenta las limitaciones inherentes a su diseño retrospectivo y observacional. Las revisiones de historias clínicas suelen estar limitadas por la falta de datos y posibles sesgos. No se habían registrado resultados de análisis de sangre en todos los recién nacidos, ya que estas pruebas se solicitaron según se consideró necesario. Otra limitación importante es que ambos grupos acabaron recibiendo aportes proteínicos altos debido a que la prescripción de la NP viene dictada por las guías del hospital. Además, hubo variabilidad en el aporte proteico en el primer día de vida, dependiendo de si se administraba a los pacientes NP estándar o se aplicaba el protocolo. Otra limitación es que se asumió que la mayor parte de la NE administrada a recién nacidos consistió en leche maternal madura, pero no nos fue posible diferenciar entre distintas composiciones según la madurez de la leche. No obstante, se dispuso de datos para un número considerable de casos durante el período de estudio.
En conclusión, nuestro análisis de una muestra de recién nacidos prematuros de muy bajo peso que recibieron aportes elevados de aminoácidos no objetivó asociaciones entre la hipercalcemia, la hipofosfatemia, y la hipopotasemia y el aporte de aminoácidos administrado en la NP. No obstante, se encontró un efecto protector de la optimización de la relación Ca:P en la NP frente a la hipofosfatemia en esta población, por lo que consideramos que es una opción que merece ser contemplada.
AgradecimientosNuestro agradecimiento al Dr. Félix Castillo Salinas, jefe del Servicio de Neonatología del Hospital Universitario Vall d’Hebron de Barcelona, por sus contribuciones a este proyecto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.