El consumo de azúcares libres se ha relacionado con el exceso de peso, recomendando la OMS una ingesta <10% de la energía total. El objetivo fue valorar la asociación entre el consumo de azúcares libres a los 12 meses y el riesgo de exceso de peso a los 30 meses en niños sanos.
Material y métodosEstudio longitudinal en 81 niños seguidos desde el nacimiento hasta los 30 meses. Se registró: historia clínica y antropometría al nacer, a los 12 y 30 meses. Se clasificó el estado ponderal en con y sin exceso de peso, según los valores de la OMS. A los 12 meses se analizó la ingesta de energía y nutrientes diferenciando la ingesta de azúcares libres y azúcares naturales. Se realizaron análisis multivariantes ajustados por las principales variables confusoras.
ResultadosUn 40,4% de los niños de 12 meses realizaron ingestas de azúcares libres superiores a las recomendadas, siendo significativamente mayores en los niños con exceso de peso a los 30 meses (60,9%). La mayor ingesta de azúcares libres a los 12 meses se asocia a un mayor riesgo de exceso de peso a los 30 meses (OR: 1,136; IC 95%: 1,033-1,248).
ConclusionesLos lactantes de 12 meses realizan una ingesta de azúcares libres muy superior a la recomendada. Esta ingesta elevada podría ser un factor de riesgo de exceso de peso ya en edades tempranas.
The consumption of free sugars has been related to excess weight, with the WHO recommending an intake of <10% of total energy. The aim of this study is to assess the association between the consumption of free sugars at 12 months and the risk of excess weight at 30 months in healthy children.
Material and methodsA longitudinal study was conducted on 81 children followed-up from birth to 30 months. A record was made of the clinical history and anthropometry, at birth, and at 12 and 30 months. Weight status was classified as with or without excess weight, according to WHO values. At 12 months, the intake of energy and nutrients was analysed by differentiating the intake of free and natural sugars. Multivariate analyses adjusted for the main confounding variables were performed.
ResultsFree sugars were consumed by 40.4% of the 12-month-old children, being higher than that recommended, and being significantly higher in children with excess weight at 30 months (60.9%). The higher intake of free sugars at 12 months is associated with an increased risk of excess weight at 30 months (OR: 1.130, 95% CI: 1.032-1.238).
ConclusionsThe consumption of free sugars is much higher than that recommended in 12-month-old infants. This high intake could be a risk factor for excess weight, even at early ages.
La obesidad es una enfermedad crónica que puede manifestarse desde los primeros años de vida1. El aumento de la prevalencia de sobrepeso y obesidad en la edad pediátrica2,3 sigue siendo un importante problema social y de salud pública y su prevalencia está aumentando en todo el mundo4. Concretamente, la prevalencia general de sobrepeso y obesidad en niños de 0 a 5 años en 1990 fue del 4,2%, en 2010 fue del 6,7%, y la Organización Mundial de la Salud (OMS) ha estimado que en 2020 será del 9%5. La obesidad durante la infancia y la adolescencia se ha asociado con un mayor riesgo de desarrollar diabetes tipo 2, hipertensión, enfermedad coronaria y síndrome metabólico en el adulto, además de afectar al bienestar físico y psicosocial6,7.
Las prácticas alimentarias realizadas durante el primer año de vida son reconocidas como un factor importante que puede comportar exceso de adiposidad en el niño8. Durante este período crítico de grandes cambios alimentarios, un exceso de energía, un desequilibrio en la calidad de los macronutrientes y las deficiencias o excesos nutricionales pueden crear conductas alimentarias inapropiadas, que pueden conllevar cambios metabólicos y aumentar el riesgo de obesidad9. En las últimas décadas, el aumento del consumo de azúcares libres (AL) ha suscitado un gran interés al relacionarse con la obesidad, especialmente en niños y adolescentes10. Este aumento se ha asociado a una menor adecuación nutricional en su aporte alimentario. Ante esta situación, la OMS recomienda limitar la ingesta de AL (azúcares añadidos [AA], azúcares presentes de forma natural en zumos de fruta y concentrados de zumos de fruta) hasta no más del 10% del porcentaje total de energía para prevenir la obesidad y enfermedades relacionadas, y detalla que restringir la ingesta a <5% podría ofrecer beneficios adicionales, especialmente en relación con la caries dental11. Existen controversias en estudios prospectivos que analizaron el consumo de AL y AA, en relación con la composición corporal de niños12-15. Estos estudios se realizaron en niños europeos, estadounidenses y africanos, todos ellos de edades comprendidas entre los 9meses (M) y los 9 años. El metaanálisis de Te Morenga et al. (2013) aporta pruebas de que una elevada ingesta de AL, AA o de bebidas azucaradas es un factor determinante del peso corporal, y lo relaciona con enfermedades como la hipertensión, dislipidemia y resistencia a la insulina tanto en la infancia como en la edad adulta16. Sin embargo, el metaanálisis de Forshee et al. (2008)17 obtuvo un riesgo cercano a cero.
Hay muy pocos estudios que valoren el papel de un elevado consumo de AL durante la primera infancia con el incremento de obesidad. Por este motivo, el objetivo del estudio fue valorar la asociación entre el consumo de AL a los 12M y el riesgo de exceso de peso a los 30M, en un grupo de niños sanos de una población española.
Material y métodosDiseñoEstudio longitudinal de lactantes seguidos desde el nacimiento hasta los 30M de vida.
MuestraSe seleccionaron 81 recién nacidos sanos, procedentes del estudio Defensas18 y con datos sobre las variables principales, alimentarias y antropométricas, a los 12 y 30M.
El estudio fue aprobado por el Comité de Ética del Hospital Universitario Sant Joan de Reus (Tarragona, España).
El tamaño de la muestra necesario para observar diferencias en el estado ponderal a los 30M entre los niños que ingirieron más del 10% de AL a los 12M (39,1 y 60,9%) fue de 42 sujetos en cada grupo, asumiendo un riesgo alfa de 0,05 y un riesgo beta inferior a 0,2 en un contraste bilateral (versión 7.12, Granmo, IMIM Hospital del Mar, Barcelona, España).
Mediciones y recogida de datosLos niños del presente estudio tenían registrados datos del embarazo y nacimiento. En la tabla 1 se presentan estos datos y los datos antropométricos a los 12 y 30M. También fueron recogidos datos de historia clínica, alimentación y antropometría por pediatras y nutricionistas estandarizados en la recolección de variables en el estudio.
Características generales de la madre y del recién nacido
| Madres | |||
|---|---|---|---|
| Edad de la madre, años | 32,3 (4,4) | ||
| Nivel socioeconómico, % | Bajo | 8,9 (7) | |
| Medio | 46,8 (38) | ||
| Alto | 44,3 (36) | ||
| Fumadoras, % | 16,5 (13) | ||
| Tipo de parto, % | Eutócico | 67,1 (56) | |
| Fórceps | 8,2 (7) | ||
| Cesárea | 21,9 (18) | ||
| Primíparas, % | 58,1 (47) | ||
| Edad gestacional, semanas | 39,6 (1,2) | ||
| Recién nacido | |||
| Sexo masculino, % | 44,6 (36) | ||
| Lactancia materna, % | 0 meses | 84,2 (48) | |
| 6 meses | 33,3 (19) | ||
| 12 meses | 5,4 (3) | ||
| 10-min APGAR | 10 (0,1) | ||
| Peso, kg | 3,3 (1,2) | ||
| Talla, cm | 50,1 (1,9) | ||
| Antropometría | 12 meses | 30 meses | |
| Peso, kg | 10,1 (1,2) | 14,4 (1,6) | |
| Talla, cm | 75,9 (3) | 92,8 (4,1) | |
| Estado ponderal, %a | Bajo peso | 5,2 (5) | 9,9 (7) |
| Normopeso | 63,6 (52) | 50,6 (42) | |
| Sobrepeso | 19,5 (15) | 27,2 (22) | |
| Obesidad | 11,7 (9) | 12,3 (10) |
Los valores expresados como media (desviación estándar) o porcentaje (n).
Se registraron los datos sociodemográficos, de salud de la madre y del bebé al nacer. Se obtuvieron 3 categorías del nivel socioeconómico utilizando el índice de Hollingshead19: bajo, medio y alto. Las variables obstétricas y perinatales recogidas fueron: sexo (V/M) del recién nacido, edad gestacional, tipo de parto, alimentación del lactante (lactancia materna o lactancia artificial), puntuación de Apgar (a los 10min después del nacimiento). Se anotó el consumo de tabaco durante el embarazo usando una encuesta específicamente diseñada para este estudio. También se registraron todos los problemas médicos y todas las vacunas recibidas por el lactante durante este período.
Variables antropométricasSe registraron el peso y la talla al nacer, y a los 12 y 30M. En el nacimiento y a los 12M el peso se midió con una báscula electrónica SECA (Vogel y Halke GmbH & Co, Hamburgo, Alemania) con una precisión de 5g, y la longitud se midió con un tallímetro con una precisión de 0,1cm (modelo PE-RILB-STND). El perímetro craneal se midió utilizando una cinta métrica flexible con una precisión de 1mm. A los 30M tanto el peso como la talla se midieron mediante una báscula electrónica con estadiómetro (modelo SECA 764). Los indicadores de crecimiento infantil tales como peso para la edad al nacer, peso para la longitud a los 12M y peso para la talla a los 30M z-score se calcularon utilizando el método LMS20,21. El valor Z equivale a la puntuación desviación estándar (DE), donde los valores oscilan entre −3 y +3 DE. Según las variables peso para edad al nacer, peso para la longitud a los 12M y peso para la talla a los 30M se clasificaron los niños en delgados (<−1 y ≥−3), normopeso (≥−1 y ≤+1), sobrepeso (>+1 y ≤+2) y obesidad (>+2) (OMS21); y también se creó la variable estado ponderal con 2 grupos: sin exceso de peso (bajo peso y normopeso) y con exceso de peso (sobrepeso y obesidad).
Alimentación infantilSe realizó un recordatorio de 24h a los 12M mediante entrevista a los padres, con dos nutricionistas entrenadas y estandarizadas. Todas las cantidades de alimentos y bebidas consumidas fueron expresadas en gramos/persona/día. Para calcular la ingesta de nutrientes se utilizó la tabla de composición de alimentos REGAL «Répertoire général des Aliments»22 complementada con una tabla de composición de alimentos española «Mataix Verdú»23. Se calculó el porcentaje de energía total aportado por los macronutrientes.
Se hizo un registro de todas las tomas de leche materna, leche artificial y de vaca. El volumen de leche materna se estimó según la edad del niño: 600ml/día a los 6M24. La leche artificial se calculó teniendo en cuenta que por cada 30ml de agua, se añaden 4,7g de leche en polvo. Los datos de composición de la leche materna se obtuvieron del Tratado de nutrición del Prof. Gil25.
A partir de los hidratos de carbono simples se crearon 2 variables: los azúcares naturales, procedentes de frutas enteras, verduras, leche y cereales (arroz, pan, pasta, harina), y los AL procedentes de postres lácteos azucarados, bebidas azucaradas (zumos naturales y comerciales, refrescos), cereales dulces (cereales de desayuno azucarados, galletas, pastelería/bollería) y chocolate, azúcar y miel.
Se calculó el porcentaje de AL ingeridos respecto al porcentaje de energía total. Este cálculo permite obtener el valor de referencia que indica la OMS11, que debe ser <10% de la energía total.
Análisis estadísticoLos resultados se presentan como porcentajes, medias y desviaciones estándar.
Se utilizó la prueba t de Student para comparar las medias y la prueba de Chi-cuadrado para comparar las variables categóricas.
Para estudiar la relación entre el porcentaje de energía aportado por los AL a los 12M y el exceso de peso a los 30M se realizó un modelo de regresión logística. Como variable dependiente se utilizó: peso para la talla a los 30M en 2 categorías (0: sin exceso de peso; 1: exceso de peso). Como variable independiente se introdujo con el método ENTER la variable «AL a los 12 M, %» y el modelo se ajustó por las siguientes variables confusoras: porcentaje de energía procedente de azúcares naturales (%), almidones (%), proteínas (%), lípidos (%), fibra (g) y energía (kcal) a los 12M, peso al nacer (0: sin exceso de peso; 1: exceso de peso), tipo de lactancia hasta los 6M (0: fórmula infantil; 1: lactancia materna exclusiva/mixta), sexo (0: femenino; 1: masculino) y nivel socioeconómico (0: bajo; 1: medio/alto).
En todos los casos, el nivel de significación se estableció en p<0,05. Se analizaron los datos con SPSS para Windows versión 20.0.
ResultadosEn la tabla 1 se presentan las características de la madre y del recién nacido a los 12 y 30M. Participaron 81 bebés, de los cuales el 44,6% eran varones. Un 84,2% de los niños tomaron lactancia materna exclusiva en el nacimiento. Un 31,2% y un 39,5% presentaron exceso de peso a los 12 y 30M.
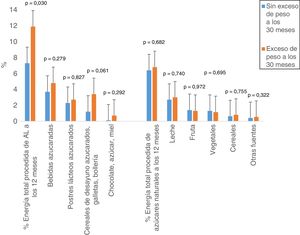
Los niños con exceso de peso a los 30M tuvieron un mayor aporte de energía procedente de los AL (%) a los 12M, respecto al grupo sin exceso de peso a los 30M (tabla 2). Un 60,9% de los niños con exceso de peso ingirieron >10% de la ingesta energética total en AL versus el 39,1% sin exceso de peso. En global, el 40,4% de los niños realizaron una ingesta de AL superior al 10% recomendado por la OMS de la energía total. La figura 1 muestra el porcentaje de energía aportado por los AL y los azúcares naturales a los 12M, según el estado ponderal de los niños a los 30M. Se observa de forma significativa (p=0,030) una ingesta total de AL mayor en aquellos niños con exceso de peso versus los sin exceso de peso a los 30M. Esta elevada ingesta proviene del mayor consumo de bebidas azucaradas, cereales de desayuno azucarados, galletas, bollería, chocolate, azúcar y miel.
Ingesta de energía y macronutrientes a los 12 meses según el estado ponderal a los 30 meses de edad
| Estado ponderal a los 12 meses | Estado ponderal a los 30 meses | |||||
|---|---|---|---|---|---|---|
| Sin exceso de pesoMedia (DE)n=57 | Exceso de pesoMedia (DE)n=24 | p-valor | Sin exceso de pesoMedia (DE)n=49 | Exceso de pesoMedia (DE)n=32 | p-valor | |
| Ingesta a los 12 meses | ||||||
| Lactancia exclusiva/mixta a los 6 meses, % | 69,2 (55) | 30,8 (27) | 0,435 | 54,5 (44) | 47,8 (37) | 0,489 |
| Energía, kcal | 1.056,5 (233,6) | 1.057,3 (189,9) | 0,990 | 1.089,5 (234,7) | 1.053,6 (215,6) | 0,484 |
| Proteínas, g | 32,6 (10,3) | 36,6 (12,3) | 0,240 | 34,8 (12,3) | 34 (10,9) | 0,288 |
| Hidratos de carbono, g | 137,3 (31,2) | 134,5 (20,3) | 0,716 | 137,7 (29,3) | 138,3 (29,6) | 0,863 |
| Almidones, g | 26,8 (21,7) | 27,1 (17,2) | 0,956 | 29 (19,9) | 28,8 (24) | 0,782 |
| Azúcares naturalesa, g | 24,4 (7,6) | 23,0 (7,8) | 0,531 | 24,9 (7,8) | 23,3 (7,4) | 0,574 |
| Azúcares libresb, g | 29,3 (30,5) | 31,6 (31,1) | 0,286 | 28,8 (31,1) | 33,8 (32,1) | 0,646 |
| Lípidos, g | 41,2 (11,0) | 41,3 (13,2) | 0,866 | 43,1 (11,8) | 40,5 (12,2) | 0,423 |
| Fibra, g | 11,3 (7,7) | 10,7 (3,4) | 0,991 | 11,8 (7,8) | 10,3 (2,4) | 0,347 |
| Energía procedente de macronutrientes: | ||||||
| Proteínas, % | 12,9 (2,3) | 13,6 (2,8) | 0,298 | 13,6 (2,7) | 12,7 (2,2) | 0,224 |
| Hidratos de carbono, % | 52,1 (5,4) | 51,6 (6,9) | 0,762 | 50,8 (4,9) | 52,9 (7,0) | 0,279 |
| Almidones, % | 9,5 (6,7) | 10,1 (5,9) | 0,764 | 10,1 (6,4) | 10,3 (6,8) | 0,263 |
| Azúcares naturalesa, % | 6,8 (2,7) | 6,3 (2,6) | 0,555 | 6,4 (2,4) | 6,8 (2,6) | 0,711 |
| Azúcares libresb, % | 7,9 (7,6) | 10,3 (8,9) | 0,092 | 7,3 (7,2) | 11,9 (10,5) | 0,030 |
| Lípidos, % | 34,9 (4,1) | 34,7 (5,6) | 0,866 | 35,3 (4) | 34,4 (5,8) | 0,500 |
| Porcentaje de niños con ingesta de energía >10% procedente de los azúcares libres, según estado ponderal a los 30 meses, % | 39,1 | 60,9 | 0,032 | |||
Los valores son representados como media, desviación estándar (DE).
En la tabla 3 se muestra la asociación entre la ingesta de macronutrientes a los 12M y el riesgo de presentar exceso de peso a los 30M, mediante una regresión logística. La ingesta de AL a los 12M se asocia a una mayor probabilidad de tener exceso de peso a los 30M (OR=1,136; p=0,008). Los varones también tienen incrementada la probabilidad de tener exceso de peso (OR=5,348; p=0,045).
Asociación entre la ingesta de macronutrientes a los 12 meses, junto a otras variables, y el riesgo de aparición de exceso de peso a los 30 meses
| Variable dependiente | Variable independiente | OR ajustada | IC 95% | p-valor |
|---|---|---|---|---|
| Peso para la talla a los 30 meses (sin exceso de peso vs. exceso de peso) | Azúcares libres 12 M, % | 1,136 | (1,033-1,248) | 0,008 |
| Azúcares naturales 12 M, % | 1,139 | (0,815-1,592) | 0,445 | |
| Almidones 12 M, % | 1,101 | (0,964-1,257) | 0,154 | |
| Proteínas 12 M, % | 0,770 | (0,548-1,082) | 0,132 | |
| Lípidos 12 M, % | 1,013 | (0,854-1,202) | 0,879 | |
| Fibra 12 M, g | 0,903 | (0,779-1,047) | 0,176 | |
| Energía 12 M, kcal | 0,998 | (0,994-1,003) | 0,420 | |
| Peso para la edad z-score 0 M (0: sin exceso de peso; 1: exceso de peso) | 5,370 | (0,574-50,236) | 0,141 | |
| Lactancia 6 M (0: LA; 1: LM/LMX) | 0,669 | (0,118-3,776) | 0,649 | |
| Sexo (0: femenino; 1: masculino) | 5,348 | (1,036-27,605) | 0,045 | |
| Nivel socioeconómico (0: bajo; 1: medio/alto) | 1,700 | (0,128-22,560) | 0,688 |
Regresión logística múltiple. OR ajustada por azúcares libres, azúcares naturales, almidones, proteínas, fibra, lípidos, peso para la edad z-score 0 meses (0: sin exceso de peso; 1: exceso de peso), lactancia 6 meses (0: lactancia artificial [LA]; 1: lactancia materna [LM]/lactancia mixta [LMX]), sexo (0: femenino; 1: masculino), nivel socioeconómico (0: bajo; 1: medio/alto).
El presente estudio ha descrito la relación entre el exceso de energía aportada por los AL en su alimentación a los 12M y el exceso de peso a los 30M. Los niños pequeños realizan una ingesta de AL muy superior al 10% de la energía total, punto de corte límite recomendado por la OMS11. Varios estudios han descrito esa relación en población adolescente y adulta, pero sin embargo es muy escasa la información en niños pequeños.
Nuestro estudio se llevó a cabo en la ciudad de Reus (Tarragona). La mayoría de los niños eran de familias con un nivel cultural medio-alto. El procedimiento para la toma de medidas antropométricas, para la valoración de la alimentación, así como para las diferentes entrevistas y cuestionarios, fue estandarizado entre los profesionales del estudio con el fin de reducir la variabilidad en la recopilación de datos.
En nuestro estudio se observó un elevado porcentaje de niños con exceso de peso a los 12M (31,2%) que incluso aumentó a los 30M (39,5%), similar a un reciente estudio español realizado a nivel nacional4. Estas elevadas prevalencias en la infancia se han relacionado con un elevado consumo de alimentos procesados energéticos, ricos en grasas, azúcares y proteínas, un bajo consumo de frutas y verduras, un nivel educativo y socioeconómico familiar bajo, sedentarismo y pocas horas de sueño26.
La OMS recomienda reducir el consumo de AL a menos del 10% de la ingesta calórica total a la población general. No obstante, existe una discrepancia debida a la inclusión o no de los zumos de fruta en el término de AL11. Nuestro análisis se ha realizado utilizando la definición de la OMS, ya que los zumos de fruta naturales favorecen un menor grado de compensación energética que cuando se consume fruta sólida, promoviendo un exceso de energía y una baja ingesta de fibra27. No obstante, otros autores declaran que no hay suficiente evidencia para afirmar la relación con el sobrepeso/obesidad como con el resto de bebidas azucaradas28.
En nuestro estudio se observó que un elevado porcentaje de lactantes realizaron un consumo >10% de AL de la ingesta energética superior a lo recomendado por la OMS, y que esta se vio incrementada con la edad. En el estudio de Sette et al., realizado en una cohorte italiana de 3.323 niños y adultos, observaron una ingesta superior de hidratos de carbono solubles (25%) en edades comprendidas entre los 0 y 2,9 años29. Este término podría corresponder a los AL aunque no se define claramente. También se observó un consumo superior a lo recomendado de AA en la encuesta del Departamento de Salud de Inglaterra y el Food Standards30,31 realizada en lactantes y niños pequeños de 4 a 18M. Este consumo superior al 10% de AL y/o AA se ha relacionado con la obesidad y enfermedades crónicas9-11,16,32. Existe diversidad en las terminologías referidas a los azúcares. Alles et al. analizaron distintos estudios sobre ingesta de nutrientes en Europa y reconocieron la diversidad de la terminología utilizada9. Hur et al. midieron el consumo de bebidas azucaradas, incluyendo en la misma terminología los zumos de fruta naturales10.
Nuestros resultados muestran que la ingesta de AL a los 12M incrementa en un 12% la presencia de exceso de peso a los 30M. La mayoría de estudios realizados tanto en adultos como en niños comparan el consumo de bebidas azucaradas con el incremento de la obesidad, siendo muy pocos los que contemplan la ingesta total de AL16. Si bien la ingesta total de AL y/o AA se ha visto relacionada con el exceso de peso en adultos, en niños hay muy pocos estudios que relacionen esta ingesta con el exceso de peso, ya que la mayoría se han estudiado solamente con bebidas azucaradas17,32,33. Únicamente 2 estudios han observado una relación con el riesgo de exceso de peso en niños14,15, mientras que otros no han observado relación13,34-36. Similar a nuestros hallazgos, en el Proyecto del Factor de Riesgo Coronario de Turku, los niños con una ingesta de AL elevada entre los 13M y los 9 años pesaron más en el primer año del estudio, aunque a partir de los 4 a 9 años su índice de masa corporal (IMC) fue inferior al de los niños con consumo medio o bajo de AL14. Maunder et al. (2015) observaron un mayor índice de sobrepeso/obesidad en niños de edades comprendidas entre los 4 y 8 años que consumieron más AA15. Por el contrario, otros estudios prospectivos realizados en niños de orígenes alemán, hispánico y estadounidense no estuvieron relacionados con cambios concurrentes en el IMC13,34,36, aunque en el estudio de Davis et al. (2009) se analizó el consumo de AA y bebidas azucaradas36. El resto de macronutrientes se encuentran dentro de los objetivos nutricionales establecidos por la OMS37.
Muchos de los alimentos para bebés son ricos en AL y/o AA y estos suelen introducirse en la dieta de forma muy temprana, por lo que, además de favorecer el riesgo de desarrollar una obesidad posterior, podrían predisponer a una preferencia posterior por este gusto32,38. Aunque la OMS aconseja disminuir el consumo de AL en niños y recomienda no introducir el azúcar en la dieta del lactante hasta el año de edad, la legislación europea y la Directiva 2006/125/CE o el Real decreto 490/1998 consienten una proporción de azúcares superior a lo recomendado (20% de energía a partir de AA) en los alimentos infantiles39. Elliot y Conlon (2015) observaron que la mayoría de alimentos infantiles presentan un perfil nutricional desaconsejable y algunos de ellos superan con creces el contenido de azúcares40.
Esta ingesta excesiva, tanto de AL como de AA, en edades tempranas debería ser limitada; no solo favorece el exceso de peso, sino que también predispone al desarrollo de caries, diabetes tipo 2, hipertensión, resistencia a la insulina y dislipidemia16, así como una menor adecuación a la dieta ya que estos no proporcionan nutrientes esenciales. Por lo tanto, la alimentación en esta etapa debería ser revisada para aumentar el cumplimiento de las recomendaciones dietéticas durante este período y así alcanzar un estado nutricional óptimo tanto a corto como a largo plazo. También sería de gran interés utilizar una única terminología de los azúcares para evitar la confusión existente hasta el día de hoy.
Nuestro estudio presenta ciertas limitaciones, tales como el reducido tamaño de la muestra. No obstante, este estudio aporta datos longitudinales de un grupo de edad, que dispone de escasos datos en la literatura. Creemos que los resultados reflejan de forma clara el exceso de consumo de AL en esta edad, aunque son necesarios futuros estudios con mayor número de muestra para confirmar la relación estudiada. Además, no ha podido realizarse metodológicamente ningún ajuste que permita conocer el papel que realizan los zumos de fruta naturales versus los comerciales, debido a la discrepancia generada en la inclusión de estos en el término de AL. No obstante, en este estudio se ha seguido el criterio que define la OMS. Otra limitación fue no poder evaluar el peso de las madres del estudio, aunque tuvimos en cuenta otros importantes factores de confusión descritos en la literatura que también pueden influir en el exceso de peso del niño.
ConclusiónNuestros resultados muestran nuevos datos sobre la relación entre la ingesta de AL a los 12M y el exceso de peso a los 30M. Un 40,4% de niños a los 12M realizan una ingesta de AL superior a la recomendada por la OMS. Esta ingesta a los 12M se asocia a una mayor probabilidad de presentar exceso de peso a los 30M, por lo que podría ser perjudicial ya en la primera infancia. No obstante, estos resultados deberían ser confirmados con más estudios en edades tempranas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a los bebés y sus padres por participar en este estudio y a todo el equipo de investigación DeFensas: Núria Voltas, Carmen Hernández, Josefa Canals, Joaquín Escribano, Rosa Jiménez, Josep Maria Barroso.