Introducción
Las tasas de curación en niños afectados de leucemia linfoblástica aguda (LLA) han aumentado en los últimos años hasta el 80 %, aproximadamente. Ha sido posible gracias a la mejoría en el diagnóstico, a la identificación de factores pronósticos y a la utilización de tratamientos adaptados al grupo de riesgo de cada paciente. Todos los protocolos de tratamiento constan de inducción a la remisión, consolidación, profilaxis sobre el sistema nervioso central (SNC) y mantenimiento 1-5. La respuesta al tratamiento de inducción es uno de los factores pronósticos más importantes. Actualmente se consigue la remisión citológica en más del 95 % de los niños afectados de LLA. Se considera como tal la presencia de menos del 5 % de células blásticas en médula ósea después del tratamiento de inducción. Un porcentaje aún importante de estos niños recaerá posteriormente. Esto quiere decir que algunas células leucémicas han sido resistentes al tratamiento administrado, persisten en pequeñas cantidades en la médula ósea y no son identificables a microscopia óptica. A estas células se las llama enfermedad mínima residual (EMR) o leucemia mínima residual. Hay varios métodos para reconocerlas en función de las anomalías moleculares, cromosómicas, reordenamientos genéticos o características inmunológicas. Las translocaciones cromosómicas se identifican habitualmente sólo en una pequeña proporción de pacientes; por lo tanto, son poco útiles para estudio de EMR. El estudio de reordenamientos de los genes que codifican la síntesis de inmunoglobulinas o los receptores de las células T por técnica de reacción en cadena de la polimerasa (PCR) ha sido muy utilizada, tiene una elevada sensibilidad, detectando una célula entre 10 4-10 5, pero es demasiado laboriosa. La citometría de flujo ofrece una detección de la leucemia mínima residual fácilmente aplicable a la práctica clínica por su rapidez y fácil metodología. Se basa en estudios multiparamétricos con el uso de tres o cuatro fluorocromos a la vez que permiten la detección en el momento del diagnóstico de diferentes "inmunofenotipos leucémicos" (IL); esto es, infidelidades de línea, asincronismos madurativos, marcadores ectópicos o fenotipos infrecuentes en la población linfocitaria normal. Con esta aproximación se pueden detectar marcadores "diana" de EMR en el 90 % de los enfermos.
La detección precoz de la EMR identifica a los pacientes en riesgo de recaída que pueden beneficiarse de una intensificación precoz del tratamiento y, por otro lado, puede evitar efectos secundarios en niños de bajo riesgo que no necesitan tratamientos tan agresivos.
El objetivo de nuestro estudio es identificar la EMR por citometría de flujo en nuestros pacientes afectados de LLA, establecer un nuevo concepto de remisión completa y conocer su significado pronóstico.
Pacientes, material y métodos
Se incluyeron en el estudio 53 pacientes diagnosticados y tratados en nuestro servicio desde junio de 1999 hasta abril de 2003. El grupo estaba constituido por 28 varones y 25 niñas con una edad que oscilaba entre 1 y 15 años (media: 7 años). El diagnóstico se estableció por microscopia óptica en función de las características morfológicas de las muestras de médula ósea según la clasificación FAB. Todos eran diagnósticos iniciales salvo tres, que habían presentado recidiva medular y se hallaban en segunda remisión al tiempo de su inclusión en el estudio. Estos últimos fueron excluidos del análisis estadístico. La clasificación inmunológica siguió los criterios ya establecidos por el grupo EGIL 6. Seis pacientes presentaban leucemias de fenotipo T, uno bifenotípica y el resto, 46, eran LLA de precursores B. El estudio citogenético se pudo realizar en 26 pacientes (49 %). Quince presentaban alteraciones citogenéticas de buen pronóstico (hiperdiploidías, t[12;21] o reordenamientos ETV6/RUNX1) y cuatro de mal pronóstico (alteraciones 11q23, reordenamientos MLL, translocaciones [4;11], [9;22] o reordenamiento BCR/ABL) 7. Según las características clinicobiológicas iniciales (edad, número de leucocitos, fenotipo inmunológico, alteraciones citogenéticas, infiltración extramedular y respuesta al tratamiento), se consideró que 17 (34 %) niños estaban en bajo riesgo de recaída, 25 (50 %) en riesgo intermedio y 8 (16 %) presentaban alto riesgo 8. Todos los pacientes estaban en remisión citológica (< 5 % células blásticas en médula ósea) al tiempo de su inclusión en el estudio y tenían al menos un fenotipo útil para seguimiento. Recibieron tratamiento según protocolos del grupo Pethema adaptados al grupo de riesgo. El protocolo para niños de alto riesgo contemplaba la posibilidad de trasplante de precursores hematopoyéticos (TPH) en primera remisión después de quimioterapia intensiva. Los pacientes en segunda remisión recibieron tratamientos intensivos y fueron sometidos a TPH, así como otro paciente afectado de LLA bifenotípica. Los resultados del estudio de EMR no debían modificar el protocolo terapéutico.
Se diseñó el estudio con 6 puntos de análisis y se fijó como umbral de positividad 0,01 % o, lo que es lo mismo, el hallazgo de 1 célula entre 10000. Los puntos de estudio fueron postinducción (EMR1), posconsolidación (EMR2), a 6 y 12 meses de mantenimiento (EMR3 y EMR4), antes de la retirada de quimioterapia (EMR5) y 3 meses postsupresión de la misma (EMR6). En el momento del diagnóstico se utilizó en todos los casos un panel de anticuerpos unidos a fluorocromos de tres colores para el diagnóstico de la LLA (EGIL-1995) y para la determinación de los IL que servirían para el seguimiento posterior de la EMR.
Las muestras de médula ósea se obtuvieron mediante punción aspirativa de 1 cm 3 de sangre medular con aguja de 0,8 mm de diámetro, mediante técnica aséptica en cresta ilíaca posterosuperior o en esternón. Se recogieron en tubos con EDTA K3 y se procesaron dentro de las siguientes 24 h. Se prepararon 2 x 10 6 células para el marcaje con cada combinación de anticuerpos. En un primer tiempo se tomaron 2 x 10 4 células totales, se dibujó una región sobre las células CD19+ o CD7+ y se determinó el porcentaje de las mismas sobre las totales. En un segundo tiempo se activó una ventana sólo con los eventos CD19+ o CD7+ y se analizaron las células con IL. Con un cálculo sencillo se obtuvo el porcentaje de las mismas sobre el total.
Resultados
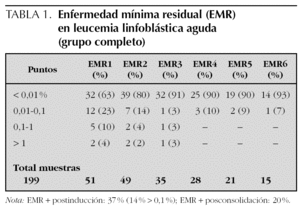
Se analizaron un total de 199 muestras (tabla 1), 51 postinducción (EMR1), de las cuales 37 % eran positivas (> 0,01 %) con un 14 % de éstas superiores a 0,1 %. Cuarenta y nueve se habían extraído posconsolidación (EMR2) con un 20 % de las mismas positivas, 35 a 6 meses de mantenimiento (EMR3), siendo el 91 % de las mismas negativas, 28 a los 12 meses (EMR4), 21 presupresión de quimioterapia (EMR5) y 15 a 3 meses de haberla suprimido (EMR6). En los últimos controles el 90 % de las muestras se mantenían negativas.
Para saber qué pacientes presentaban persistencia de EMR se realizó el análisis por grupos de riesgo según las características clinicobiológicas al diagnóstico y se vio que los niños de alto riesgo, según la clasificación tradicional, tenían niveles altos postinducción con un 57 % de muestras positivas frente a un 26 y 45 % en los otros dos grupos. Si el umbral lo poníamos en 0,1 % había un 28 % de muestras positivas frente a 14 y 4 % en los otros dos grupos. Además, un 43 % de las muestras de los niños de alto riesgo se mantenían positivas posconsolidación. La eliminación de la EMR era más rápida en el grupo de riesgo intermedio donde prácticamente todas las muestras, el 96 %, eran negativas después del tratamiento de consolidación y además la reducción postinducción había sido mejor que en el grupo de bajo riesgo. Posiblemente intervinieron en este último punto las diferencias en el tratamiento administrado.
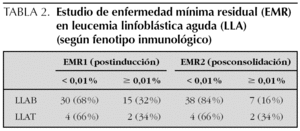
Se analizaron también los resultados según el fenotipo inmunológico en el momento del diagnóstico (tabla 2) y se vio que, aunque postinducción no había ninguna diferencia, una proporción más alta de pacientes con leucemias de fenotipo T mantenía concentraciones elevadas de EMR posconsolidación.
Si se analiza la evolución posterior de los 18 pacientes que presentaron valores de EMR > 0,01 después del tratamiento de inducción, se observa que 12 se negativizaron posconsolidación, 4 a los 6 meses de mantenimiento, 2 con valores postinducción superiores al 0,1 % recayeron a 4 y 11 meses de diagnóstico y uno con una leucemia bifenotípica mantuvo niveles altos hasta recibir tratamiento de rescate.
Analizando las recidivas que han presentado este grupo de enfermos vemos que con una mediana de seguimiento de 26 meses (ext. 4-55) han presentado recaída 4 (8 %) enfermos. Dos eran pacientes de alto riesgo por edad y mala respuesta citológica inicial, presentaban valores de EMR > 0,1 % en los dos primeros puntos de análisis, lo cual representa resistencia al tratamiento de administrado y recayeron a los 4 y 11 meses del diagnóstico. Otro paciente con recidiva medular precoz no tenía características de mal pronóstico iniciales, aunque sí mantuvo valores de EMR entre 0,01 y 0,1 %. El cuarto paciente era un adolescente con recidiva testicular aislada de forma precoz.
En el grupo de pacientes con EMR negativa después del tratamiento de inducción no se ha observado ninguna recaída.
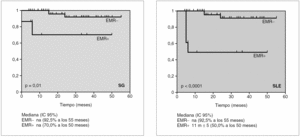
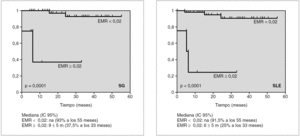
Se realizó un análisis estadístico para ver la diferencia evolutiva según la eliminación de la EMR postinducción y vimos que no habían diferencias significativas en cuanto a la supervivencia libre de enfermedad (SLE), pero sí en la supervivencia global (SG) con una p < 0,0001 (fig. 1). Además, utilizando el programa CART (fig. 2) vimos que a un umbral de EMR de 0,02 postinducción las diferencias eran muy importantes tanto en la SLE como en la supervivencia global.
Figura 1. Evolución según enfermedad mínima residual (EMR) postinducción. SG: supervivencia global; SLE: supervivencia libre de enfermedad.
Figura 2. Evolución según enfermedad mínima residual (EMR) postinducción (umbral a 0,02 en EMR1; CART program).
Discusión
El estudio de la EMR en niños afectos de LLA tiene dos objetivos. El primero y más importante es conocer la velocidad de destrucción de la masa leucémica y utilizar este parámetro como factor pronóstico fundamental que permita tomar decisiones terapéuticas. Lo conseguimos con las primeras determinaciones, postinducción (EMR1) y posconsolidación (EMR2). El segundo objetivo es predecir cualquier recaída antes de la aparición de manifestaciones clínicas o hematológicas. Para ello se utiliza la monitorización secuencial 9,10.
La importancia clínica del estudio de la EMR queda avalada por los múltiples estudios aparecidos en la literatura médica durante los últimos años.
El grupo BFM en 1998 proponía el estudio secuencial con nueve puntos de análisis. Utilizaba técnicas de biología molecular. Refería valor pronóstico en todos los puntos, pero de forma especial en los dos primeros, lo cual les llevó a establecer tres grupos pronósticos independientes. Observaban que los niños con EMR < 0,01 % en los dos primeros puntos de estudio tenían una SLE del 98 % frente al 76 y 16 % en los otros grupos 11. Más tarde publicaron otro artículo haciendo referencia a la mayor lentitud en la eliminación de la EMR en los pacientes de fenotipo T 12.
Si nos centramos en los estudios realizados con técnicas inmunológicas de citometría de flujo cabe destacar los del Hospital de Sant Jude en Memphis (EE.UU.). Coustan-Smith et al 13,14 publicaron sus resultados por primera vez en 1998, obtenidos sobre 158 niños tratados con un protocolo uniforme, y concluyeron que la detección de EMR postinducción se asociaba a alteraciones genéticas de mal pronóstico, que la incidencia de recaídas era del 32 % frente al 7 % si la EMR era mayor o menor de 0,1 % y que la persistencia de EMR en la semana 14 era un factor de muy mal pronóstico. Poco después, Pui y Campana 15 proponían un nuevo concepto de remisión completa para estos niños, basándose en el estudio inmunológico de la EMR 15.
Dworzak et al 16, en Austria, estudiaron a 108 niños con cuatro puntos de análisis y referían como de gran importancia la información obtenida en el día +33 y en la semana 12. Casi al mismo tiempo otro estudio europeo de Björklund et al 17 en Suecia establecía que los niveles de MR > 0,01 % durante y después de la inducción implicaban peor SLE. El estudio más amplio publicado es el del Children's Oncology Group 18, en 2003, sobre 1.016 niños afectados de LLA de fenotipo B. Describían la relación de la EMR postinducción con otros factores pronósticos ya conocidos y concluían que los niños de alto riesgo, según la clasificación tradicional, tenían una eliminación más lenta, hallazgo similar al observado en nuestro grupo de enfermos.
Marshall et al 19,20. investigaron la importancia de la monitorización secuencial y observaron que el análisis combinado del estudio de la EMR en los meses 1 y 24 pueden predecir con seguridad la aparición posterior de recaídas en estos niños. Finalmente comentar el estudio de Neale et al 21 que compara la citometría de flujo identificando IL, con la técnica de PCR por amplificación de genes que codifican receptores de antígenos, y concluye que los resultados son concordantes en la mayoría de casos y que la utilización de los dos métodos a la vez aseguraría la identificación de la EMR en todos los enfermos.
Nuestros resultados están tomados sobre un grupo homogéneo de pacientes, tratados en un único centro con protocolos basados en la experiencia del grupo Pethema. En todos los casos ha habido al menos un IL "diana" para el seguimiento la cual ha demostrado la utilidad de la técnica. Es importante que las muestras de médula ósea tengan una buena celularidad mononucleada y poca contaminación con sangre periférica. La preparación técnica de la muestra y la adquisición de las células debe realizarse en menos de 24 h para impedir que aumente la población en apoptosis que interfiera los resultados. De 199 muestras analizadas 51 lo fueron postinducción, con un 37 % de las mismas positivas y 49 posconsolidación con un 20 % de muestras superiores al 0,01 %. Se ha podido identificar a un grupo de pacientes de muy buen pronóstico con valores de EMR < 0,01 % en los dos primeros puntos de estudio. En este grupo no hemos observado ninguna recaída. Por otro lado, el hallazgo de EMR+ en esos dos puntos ha significado resistencia al tratamiento y por tanto un factor de mal pronóstico que se debe tener en cuenta en el tratamiento posterior. En todas las recidivas observadas en el grupo completo había una positividad en esos dos puntos.
Como conclusiones finales decimos que el estudio de la EMR puede identificar a un grupo de pacientes de muy buen pronóstico, con valores negativos (< 0,01 %) en EMR1 y EMR2 y que el hallazgo de EMR positiva en los dos primeros puntos significa resistencia al tratamiento y un factor de mal pronóstico que se debe tener en cuenta en todos los protocolos actuales.