Introducción
El término megauréter indica la presencia de una dilatación más o menos intensa del uréter, asociada o no a una dilatación concomitante del sistema colector. El megauréter primario incluye todas aquellas dilataciones ureterales debidas a una alteración congénita e idiopática de la porción terminal del uréter. Debe ser diferenciado del megauréter secundario a alteraciones estructurales del tracto urinario (duplicidades, ureterocele, válvulas de uretra posterior, etc.) y de otras condiciones patológicas como la vejiga neurógena, síndrome de Prune-Belly, diabetes insípida, etc.
Según la clasificación propuesta por King1 y actualmente más aceptada existen 4 variedades de megauréter primario según la causa que provoque la dilatación: refluyente, obstructivo, refluyente y obstructivo y no refluyente y no obstructivo.
Las formas obstructivas pueden inducir a un estasis urinario, a infecciones recurrentes y a una pérdida irreversible de la función renal1. Se ha demostrado que este tipo de megauréteres se benefician de una corrección quirúrgica2,3. Por el contrario las formas no obstructivas y no refluyentes, que son la mayoría (43-83 % de los casos), evolucionan hacia la resolución espontánea de la dilatación ureteral, manteniendo un crecimiento renal normal, sin necesidad de una intervención quirúrgica4-10. Las diferencias clínicas y etiopatogénicas entre las formas obstructivas y no obstructivas no están bien definidas, no pudiéndose predecir con antelación cuál va a ser la evolución de cada nuevo caso. Sin embargo, al igual que sucedió con la hidronefrosis, en los últimos años se ha producido un cambio significativo en el tratamiento de estos pacientes, siendo en este momento casi siempre expectante y no quirúrgico4-10.
En este estudio retrospectivo hemos analizado a un grupo muy homogéneo de lactantes con megauréter primario no refluyente (obstructivo y no obstructivo). Hemos valorado la evolución de la dilatación ureteral en función del tratamiento seguido así como la incidencia y características de la lesión renal de los riñones con megauréter. Hemos investigado además, si existe algún factor ecográfico o del renograma al diagnóstico, que nos permita predecir en qué casos será necesario realizar una intervención quirúrgica.
Pacientes y métodos
Hemos analizado retrospectivamente todos los pacientes controlados en la Sección de Nefrología Pediátrica de nuestro hospital, por haber sido diagnosticados prenatalmente de un megauréter primario no refluyente, durante el período de tiempo comprendido entre enero de 1990 y diciembre de 2005.
Fueron excluidos del estudio: los megauréteres primarios sintomáticos diagnosticados después del nacimiento, los megauréteres secundarios a alteraciones estructurales del tracto urinario (duplicidades renales, ectopias renales, divertículos paraureterales obstructivos, vejigas neurógenas, válvulas de uretra posterior, síndrome de Prune-Belly) y los asociados a patología contralateral (agenesias renales unilaterales, displasia renal multiquística, hidronefrosis).
Inicialmente se recuperaron de nuestra base de datos 145 pacientes. Un total de 58 casos cumplieron los criterios de inclusión. Los 87 restantes fueron excluidos del estudio.
Estudio por técnicas de imagen
El estudio por técnicas de imagen realizado en estos pacientes ya ha sido descrito con detalle en una publicación anterior11. Brevemente recordar que en todos los casos se practicó al nacimiento, una ecografía renal y de vías urinarias y una ureterocistografía miccional seriada cíclica (CUMS). Para graduar el megauréter se utilizó la clasificación preconizada por la Sociedad Americana de Urología Fetal que divide a los megauréteres en 3 grados según el diámetro anteroposterior del uréter, medido en un corte longitudinal en la ecografía a nivel del tercio distal del mismo, en su entrada en la vejiga12: grado I, cuando el diámetro anteroposterior oscila entre 5 y 7 mm; grado II cuando se encuentra entre 7 y 10 mm, y grado III cuando es mayor de 10 mm. Se consideró que el grado I era leve y los grados II y III graves.
En 52/58 pacientes (90 %) se realizó un renograma isotópico directo (MAG3) al mes de vida aproximadamente. Durante el seguimiento, la repetición de la ecografía y renograma dependió del tiempo de persistencia del megauréter y fue individualizado en cada caso. En los intervenidos quirúrgicamente, la ecografía y el renograma postintervención se realizó a los 3 meses de la misma, siempre y cuando persistiese la dilatación. En todos los casos intervenidos se practicó una cistografía isotópica directa para descartar un reflujo vésico-ureteral postintervención. Para valorar el grado de obstrucción, se analizaron los siguientes parámetros en el renograma: a) la función renal diferencial obtenida a nivel renal, y b) el drenaje de la vía urinaria, el cual viene definido por las curvas de eliminación del radiofármaco obtenidas a nivel renal y ureteral y el tiempo medio (T1/2) de lavado del radiofármaco obtenido a nivel renal. Se consideró que la función renal era normal cuando era igual o mayor del 40 %, que estaba moderadamente disminuida cuando se encontraba entre el 20 y el 39 % y afectada de forma grave cuando era menor del 20 %. Si el T1/2 era menor de 15 min se consideró que el drenaje de la vía urinaria era normal. Si se encontraba entre 15 y 20 min era equívoco o indeterminado y si era mayor de 20 min era indicativo de obstrucción13-15. En pacientes con megauréter bilateral la función renal diferencial no fue considerada como un verdadero indicador de la función renal y estos pacientes fueron seguidos más estrechamente siendo intervenidos quirúrgicamente ante cualquier sospecha razonable de existir una obstrucción.
En 42/58 pacientes (72 %) se practicó un 99Tc-ácido dimercaptosuccínico (DMSA) cuando el megauréter ya había desaparecido o se había estabilizado. En 16 casos no se consideró necesario realizarlo, porque el parénquima renal en ecografías seriadas era normal. En el DMSA se identificaron tres modalidades diferentes de lesión renal: a) lesiones focales o grado I, definidas como defectos de hipocaptación intraparenquimatosa en riñones de tamaño y función conservada; b) lesiones globales o grado II, caracterizadas por riñones disminuidos de tamaño, con hipocaptación global del radiofármaco y con función diferencial entre el 20 y el 39 %, y c) lesiones atróficas o grado III, definidas como riñones muy disminuidos de tamaño y muy poco funcionantes con una función diferencial menor del 20 %16,17.
Evaluación de la función renal
En 50/58 pacientes (86 %) se realizó algún estudio de función renal en algún momento del seguimiento. Como ya se ha descrito en un estudio previo11, el filtrado glomerular se valoró mediante el filtrado glomerular renal (GFR) estimado por la talla según la fórmula de Schwartz18 y se expresó en forma de z-score. La capacidad de concentración renal se valoró mediante una prueba de restricción hídrica11.
Seguimiento clínico de los pacientes
Todos los pacientes estaban asintomáticos al diagnóstico y todos fueron controlados de forma rutinaria en la consulta externa de Nefrología Pediátrica. Durante los primeros 12 meses de vida, el control se realizó según la evolución individual de cada caso, cada 1-3 meses o siempre que presentaba sintomatología. Posteriormente cada 6-12 meses. En cada visita se medía el peso, la talla y la presión arterial (PA). Se realizaba además una tira reactiva de orina y un urocultivo. Solamente se perdió 1/58 pacientes (2 %) en el seguimiento.
Tratamiento
En todos los pacientes se instauró al diagnóstico un tratamiento profiláctico continuo con trimetoprima-sulfametoxazol (TMP-SMX) o nitrofurantoína en 1 o 2 dosis según se ha descrito previamente11. Por regla general el tratamiento profiláctico se mantuvo hasta que se produjo una disminución significativa de la dilatación ureteral o hasta los 12 meses de vida. En los pacientes que en base a los hallazgos de la ecografía o del renograma se consideró que existía una obstrucción en la unión ureterovesical, se intervinieron quirúrgicamente practicándose una reimplantación vesicoureteral según técnica de Cohen con remodelaje tipo Hendren cuando el diámetro del uréter a reimplantar era superior a 1 cm o no había espacio suficiente en la vejiga para reimplantarlo con comodidad.
Métodos estadísticos
Se describen las variables mediante los estadísticos más apropiados a su naturaleza y escala de medición. Se emplearon las pruebas de la chi cuadrado para comparación de variables categóricas entre grupos y la t de Student para variables continuas. La relación entre variables continuas se estudió mediante modelos de regresión lineal múltiple. La curación y su relación en el tiempo se analizó mediante pruebas bivariantes de supervivencia (Kaplan-Meier y log-rank test) y multivariante, regresión de Cox. Todo el análisis estadístico se realizó mediante el paquete estadístico Systat V 9.0.
Resultados
Características clínicas
En la tabla 1 se especifican las características clínicas de los 58 pacientes con megauréter primario. Destacar el predominio del sexo masculino y de la afectación del lado izquierdo. El diagnóstico fue realizado muy precozmente.
Datos ecográficos prenatales
Aunque todos los pacientes fueron diagnosticados prenatalmente, solamente en 40/58 casos (69 %) se conocían datos de la ecografía prenatal. La edad gestacional media al diagnóstico prenatal fue de 31 semanas (rango: 18-40 semanas). En el 21 % de los pacientes el diagnóstico se realizó antes de las 30 semanas y en el 79 % después de las 30 semanas. En el 58 % de los casos la dilatación era moderada-grave y en el resto de leve. En la mayoría de los casos no se conocía si la dilatación era pélvica, ureteral o ambas.
Tratamiento
Un total de 49/58 pacientes (85 %) recibieron un tratamiento expectante no quirúrgico. De ellos 38 eran unilaterales y 11 bilaterales lo que hacía un total de 60 unidades renales con megauréter de los cuales 52 (87 %) eran graves (grados II y III) (fig. 1). El resto de pacientes, 9/58 (15 %), recibieron un tratamiento quirúrgico. De ellos 7 eran unilaterales y 2 bilaterales. En total había 11 megauréteres pero sólo se intervinieron 10 ya que en uno de los 2 casos bilaterales uno de los megauréteres se corrigió espontáneamente. Todos ellos eran graves (fig. 1).
Figura 1.Tests diagnósticos realizados y tratamiento seguido en 58 pacientes con megauréter primario no refluyente, estratificados según el tipo de tratamiento. De los 10 megauréteres intervenidos, en 8 se realizó una reimplantación ureterovesical y en 2 una nefrectomía por tratarse de riñones atróficos.
Evolución de los pacientes del grupo no quirúrgico
Evolución ecográfica
En el 77 % de los megauréteres (46 megauréteres) se produjo una curación espontánea del mismo, en el 13 % hubo una mejoría y en el 10 % restante no se apreciaron cambios en el seguimiento. No obstante el parénquima renal, de las unidades renales en las que persistió la dilatación, era normal (tabla 2).
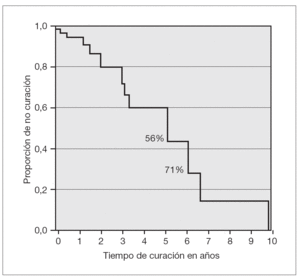
La edad media de los pacientes cuando se produjo la curación espontánea de los megauréteres fue de 7 meses y 15 días (rangos: 40 días-6 años y 8 meses; mediana: 11 meses y 21 días). La curva de supervivencia de Kaplan-Meier representa gráficamente el tiempo de curación espontánea, el cual fue del 56 y 71 % de los casos a los 5,09 y a los 6,28 años, respectivamente. Se estimó que la probabilidad de curación en nuestra serie era del 85 % (fig. 2).
Figura 2. Tiempo de curación del megauréter (curva de supervivencia). El 56 y el 71 % de los megauréteres se corrigieron espontáneamente a los 5,09 y 6,28 años, respectivamente.
Inicialmente se realizó un análisis univariante donde se seleccionaron las variables que se utilizaron posteriormente para llevar a cabo un análisis multivariante. Este último puso de manifiesto que la edad de curación del megauréter dependía exclusivamente del sexo de los pacientes siendo más tardía en las mujeres (p < 0,05). No dependía ni del grado inicial de la dilatación ureteral (p = 0,31) ni de la función inicial del riñón afectado en el renograma (p = 0,65).
Evolución en el renograma isotópico directo
En 5/49 pacientes (10 %) no fue necesario practicar un renograma porque el megauréter mejoró rápidamente en poco tiempo. En 23/49 (47 %) solamente se practicó un renograma al diagnóstico por el mismo motivo. En los 21/49 (43 %) pacientes restantes se realizaron 2 o más renogramas durante la evolución (fig. 1). En total había 54 unidades renales con megauréter que tenían renograma inicial y 25 con renograma final. En 4/54 (7 %) la función renal diferencial inicial se encontraba ligeramente disminuida (entre 34 y 39 %). En los 50 casos restantes (93 %) la función renal diferencial era normal (tabla 3). En el renograma final solamente había una unidad renal con función renal disminuida (entre 30 y 40 %). Los 3 casos restantes normalizaron la función (tabla 3). El valor medio de la función renal diferencial al inicio era de 46,11 ± 5 y en el último renograma de 46,86 ± 5 %.
El valor medio del T1/2 en el renograma inicial era de 7,87 ± 5 y en el último renograma de 5,54 ± 3 % min. Al diagnóstico solamente hubo una unidad renal (2 %) con megauréter cuyo T1/2 era patológico (> 20 min). Otros 2 casos (4 %) tenían un T1/2 indeterminado entre 15 y 20 min. En el último renograma todos los pacientes tenían un T1/2 normal (fig. 3).
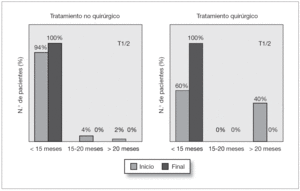
Figura 3. Valoración evolutiva del drenaje de la vía urinaria (T½) en el renograma inicial y final de los pacientes con megauréter primario no refluyente del grupo no quirúrgico y del grupo quirúrgico.
En resumen en el último renograma el drenaje de todas las unidades renales del grupo no quirúrgico se había normalizado y solamente uno tenía la función renal disminuida.
Evolución de los pacientes del grupo quirúrgico
Un total de 9 pacientes fueron intervenidos quirúrgicamente por presentar algún dato indicativo de obstrucción. En 2 pacientes se trataba de riñones atróficos por lo que se practicó una nefrectomía. En los 7 restantes se practicó una reimplantación vesicoureteral según técnica de Cohen, unilateral en 6 casos y bilateral en uno (8 megauréteres reimplantados) (fig. 1). La edad media a la intervención fue de 7 meses (rango: 27 días-1 año y 9 meses; mediana: 6 meses). El 78 % de los pacientes fueron intervenidos antes del mes de vida y el 89 % antes de los 2 meses.
Indicaciones de la intervención quirúrgica
Las indicaciones de la intervención quirúrgica fueron: megauréter muy grave en 3/9 casos (33 %), T1/2 alargado en el renograma en otros 3/9 (33 %), aumento de la dilatación ureteral en el seguimiento en un caso (11 %), función renal disminuida al diagnóstico en un caso (11 %) y función renal disminuida asociada a un T1/2 alargado en otro caso (11 %).
Evolución de la ecografía
En 7 unidades renales (incluidas las 2 nefrectomías) el megauréter se corrigió tras la intervención y en uno se produjo una mejoría del mismo. Los otros 2 casos restantes no presentaron mejoría en el seguimiento (tabla 2).
Evolución en el renograma diurético
En 8 pacientes (10 megauréteres) se realizó un renograma diurético preintervención (fig. 1). En un paciente el megauréter era tan grave que se intervino sin realizar renograma previo. El valor medio de la función renal inicial de los 10 megauréteres era 33 % (rango: 6-45 %; mediana: 37,5 %). En 6/10 megauréteres dicha función era mayor del 40 %, en 3/10 se encontraba entre el 20 y el 30 % y en un caso era menor de 20 %. En este último caso y en el que no se practicó renograma preintervención se realizó una nefrectomía por atrofia renal (tabla 3).
Tras la intervención quirúrgica se realizó un renograma en 6 pacientes (8 megauréteres). El valor medio de la función renal diferencial de los riñones afectados ascendió al 41 % (rango: 32-46; mediana: 42). En seis la función renal diferencial era mayor del 40 % y en dos se encontraba entre el 20 y el 39 %. Los 3 pacientes restantes no tenían renograma postintervención, dos por haber sido nefrectomizados y uno porque en la ecografía a los 3 meses de la intervención no presentaba dilatación ureteral y no se consideró necesario.
El valor del T1/2 en el renograma inicial era de 14,50 min (rango: 3,76-25,01; mediana: 10,32). Al diagnóstico había 4/10 unidades renales con un T1/2 mayor de 20 min (en un caso el megauréter era bilateral y en las 2 unidades renales el T1/2 estaba alterado). Las 6/10 unidades renales restantes tenían un T1/2 menor de 15 min (fig. 3).
Tras la intervención quirúrgica en todos los casos el T1/2 se había normalizado salvo en los 2 casos nefrectomizados que no tenían renograma. El valor medio del T1/2 postintervención era de 6,91 min (rango: 3,51-10,71; mediana: 6,97) (fig. 3).
En resumen, Tras la intervención quirúrgica había 2 riñones con función renal moderadamente disminuida y dos en los que se había realizado una nefrectomía por atrofia renal. El T1/2 se había normalizado en todos los casos.
Estudio del parénquima renal con DMSA
En 42/58 pacientes (72 %) se practicó un DMSA (52 riñones de 71). La edad media al realizar el DMSA fue de 2 años y 10 meses (rango: 22 días-11 años y 10 meses; mediana 2 años y 1 mes). Es decir, en la mayoría de los casos, el DMSA se realizó fuera de la fase activa del proceso cuando el megauréter había desaparecido o se había estabilizado. El DMSA mostró una lesión del parénquima en el riñón con megauréter en 5/71 casos (7 %). En 2/71 (3 %) había una atrofia renal (lesión grado III), en 2/71 (3 %) una lesión global (grado II) y en 1/71 (1 %) una lesión focal (grado I). De los 5 casos con lesión renal, cuatro pertenecían al grupo quirúrgico (una lesión grado I, una lesión grado II y las dos lesiones grado III) y uno (lesión grado II) al grupo no quirúrgico. Sólo los pacientes con megauréter grados II-III tenían lesión renal. Al comparar la función renal diferencial de los riñones sanos sin megauréter y la de los riñones sanos con megauréter pero sin lesión renal, no había diferencias significativas. La función renal de los riñones con megauréter y lesión renal, estaba significativamente disminuida. La disminución era tanto mayor cuanto mayor era el grado de la lesión (tabla 4).
Evaluación de la función renal y control de la presión arterial
El z-score medio del GFR estimado por la talla en 31/58 pacientes (53 %) con megauréter era de 0,55 (rango: 1,95 y 4,24; mediana: 0,41). Todos los pacientes por tanto tenían un filtrado glomerular dentro de lo normal para su edad independientemente de que tuvieran o no lesión renal. La presión arterial fue normal en todos los pacientes durante el tiempo que duró el estudio.
El valor medio de la prueba de restricción hídrica realizada en 19/58 pacientes (33 %) era de 929 mOsm/kg (rango: 489-1.136; mediana: 916). Sólo 2 pacientes tenían una afectación significativa de la capacidad de concentración. Los dos tenían un GFR normal y solamente uno de ellos tenía una lesión renal que era bilateral (grado I en un riñón y grado II en el otro).
Infección del tracto urinario en el seguimiento
De los 58 pacientes, 19 (33 %) tuvieron uno o varios episodios de infección del tracto urinario (ITU) en el seguimiento. En total hubo 39 episodios de ITU, 24 de ellos con sintomatología y 15 asintomáticos. En 10 ocasiones fue necesario el ingreso del paciente.
Discusión
No hace muchos años el megauréter primario era diagnosticado cuando producía sintomatología (infección, hematuria, masa abdominal, litiasis, etc.) y en general el tratamiento era quirúrgico en prácticamente todos los casos2,3,19-21. Tras la introducción de la ecografía prenatal como método de cribado para la detección de las malformaciones fetales, se han publicado numerosos estudios donde se describe cómo la mayoría de los megauréteres primarios, evolucionan hacia su resolución espontánea sin necesidad de realizar una intervención quirúrgica, dejando claro que la dilatación de la vía urinaria no es sinónimo de obstrucción. Como consecuencia, en este momento la mayoría de los autores consideran que el tratamiento inicial de elección es expectante y no quirúrgico.
Todos estos hechos quedan claramente reflejados en este estudio retrospectivo sobre una serie muy homogénea de 58 neonatos con megauréter primario no refluyente. Coincidiendo con la literatura especializada, en nuestros pacientes hubo un claro predominio del sexo masculino y una afectación mayor del lado izquierdo22 (tabla 1). El 85 % de los pacientes no precisaron intervención quirúrgica y en la curva de supervivencia se estimó que la probabilidad de la curación espontánea en nuestra serie era del 85 % (fig. 2). De hecho durante la evolución, el 73 % de los megauréteres no intervenidos se resolvieron espontáneamente y un 13 % adicional mejoraron. Si el tiempo de seguimiento hubiera sido más prolongado, el número de casos resueltos de forma espontánea hubiera sido más elevado. Hubo 6/60 (10 %) megauréteres no intervenidos que no sufrieron cambios en el grado de dilatación del uréter, pero durante el tiempo que duró el estudio la función de estos riñones se mantuvo estable y ninguno de ellos presentaba lesiones parenquimatosas. Es decir, la persistencia de la dilatación ureteral no es un signo de mal pronóstico ya que no es indicativo de lesión parenquimatosa.
Es importante destacar que en más de la mitad de los pacientes intervenidos de nuestra serie (55 %), la indicación de cirugía se basó en una alteración del T1/2 y/o de la función renal diferencial en el renograma. Sin embargo, estudios clínicos recientes han puesto en evidencia que en el recién nacido y en el lactante, las alteraciones de estos dos últimos parámetros no siempre son indicativos de obstrucción y deben ser interpretados con precaución. Se ha demostrado que no existe una buena correlación entre la función renal inicial del riñón afectado y la progresión posterior de la dilatación en la ecografía23 y que los modelos de drenaje (T1/2) tienen poca sensibilidad y especificidad para diferenciar los megauréteres obstructivos de los que no lo son8,23,24. Todas estas dificultades diagnósticas parecen estar en relación con la inmadurez renal y de las vías urinarias durante los primeros meses de la vida22,24,25. Como se demuestra en el análisis multivariante realizado en nuestra serie, no se dispone de factores iniciales como por ejemplo el grado de dilatación del uréter o la función renal diferencial entre otros, que predigan con exactitud qué megauréteres se van a resolver espontáneamente y cuáles se van a beneficiar de una intervención26-28. Ello nos obliga a realizar un control prolongado de los parámetros ecográficos y del renograma, con el fin de valorar los cambios que sufren durante la evolución.
En este sentido llama la atención en nuestra serie, que aunque casi todos los megauréteres eran importantes, todos los casos que inicialmente tenían alterado el drenaje de la vía urinaria en el grupo no quirúrgico (7 % de casos) lo normalizaron al final del seguimiento. Ello corrobora que el T1/2 alargado, no es sinónimo de obstrucción, pudiendo normalizarse espontáneamente en el seguimiento (fig. 3). Es probable que algunos pacientes de nuestra serie intervenidos por tener un T1/2 alargado (40 %) hubieran evolucionado de la misma manera si se hubiese mantenido una actitud expectante no quirúrgica.
En el grupo no quirúrgico a pesar de la gravedad de la mayoría de los megauréteres, el valor medio inicial y final de la función renal diferencial era normal. Al final del seguimiento solamente había un riñón en este grupo, con función renal disminuida el cual presentaba una lesión grado II en el DMSA (tablas 3 y 4). En el grupo quirúrgico inicialmente había 4 riñones con función renal disminuida. En dos de ellos se practicó una nefrectomía por tratarse de riñones atróficos, uno mantuvo la función disminuida, teniendo una lesión grado II en el DMSA y otro normalizó la función renal (tablas 3 y 4). Había un último caso con una lesión renal grado I y una función normal.
Las lesiones grados II y III (4 riñones) estaban presentes al nacimiento y no sufrieron modificaciones posteriores en el seguimiento lo cual es indicativo de que tenían un origen congénito y eran la consecuencia de un desarrollo metanéfrico anómalo durante la embriogénesis29.
Por otro lado aunque el 33 % de los pacientes presentaron uno o varios episodios de ITU, en los 4 casos con lesión grados II y III se descartó con seguridad que hubiera alguna relación entre la lesión renal y la ITU. No se pudo conocer si la lesión grado I era congénita o adquirida. En la actualidad no hay estudios que evidencien con exactitud cuál es el valor del tratamiento profiláctico en estos pacientes. Mientras no se disponga de datos al respecto, nuestra política es mantener dicho tratamiento hasta el año de edad o hasta que se produzca una mejoría clara de la dilatación ureteral.
Estos resultados van a favor de que el tratamiento inicial del megauréter primario sería expectante y no quirúrgico. La intervención quirúrgica estaría reservada para aquellos casos que durante el seguimiento se produjera un aumento de la dilatación ureteral, un deterioro de la función renal diferencial del riñón afectado y/o cuando apareciese sintomatología importante8.
Durante el tiempo que duró el estudio todos los pacientes mantuvieron la función glomerular normal. Solamente dos de ellos tenían una alteración leve-moderada de la capacidad de concentración renal. Ninguno desarrolló una hipertensión arterial (HTA).
La etiopatogenia del megauréter primario no refluyente es desconocida. Las formas no obstructivas que como ya hemos mencionado, en el neonato son la mayoría, se han tratado de explicar teniendo en cuenta los cambios fisiológicos que se producen en la vía urinaria fetal tras el parto. Así por ejemplo, la producción de orina fetal en el tercer trimestre, es 4-6 veces mayor que en el recién nacido. Ello se debe a las diferencias en las resistencias vasculares renales, en el GFR y en la capacidad de concentración. Se cree que este flujo urinario fetal tan alto, puede contribuir a la dilatación urinaria en ausencia de una obstrucción verdadera. Otro factor contribuyente a la dilatación podría ser el aumento de la "compliance" del uréter fetal secundaria a diferencias en el depósito de colágeno tipo III, elastina y otras proteínas del uréter. Por último, también podría contribuir en algunos casos, la presencia de obstrucciones anatómicas o funcionales transitorias, que mejoran después del nacimiento, como por ejemplo la existencia de pliegues ureterales fetales o el retraso en el desarrollo del peristaltismo normal22,30.
Con respecto a las formas obstructivas existe un acuerdo general de que no hay una verdadera obstrucción a nivel de la unión ureterovesical, sino una alteración funcional del segmento yuxtavesical de 0,5-4 cm de largo que es incapaz de transportar la orina a un flujo adecuado. Ello produce una retención de orina por encima de dicho segmento y a una dilatación del uréter. Endoscópicamente en la mayoría de los casos el uréter se inserta en una posición normal en el trígono, con un túnel submucoso de características normales. Se han propuesto diferentes teorías etiopatogénicas para explicar este fenómeno como un depósito excesivo de colágeno alrededor de las células musculares31 o cambios segmentarios en las células musculares del segmento adinámico con atrofia de la capa longitudinal profunda que es la que conduce las ondas peristálticas, e hipertrofia de la capa circular superficial32 que es la que causa la obstrucción. Recientemente Nicotina et al32, han sugerido un posible papel patogénico del transforming growth factor beta o TGF-b el cual cuando está presente retrasa la maduración y diferenciación de las células musculares lisas. Estos autores demostraron que en los megauréteres primarios el TGF-b, normalmente presente en el uréter durante la vida intrauterina y no después, desaparece de forma mucho más lenta de la porción adinámica ureteral que en los uréteres sin esta patología. Este hecho indicaría que la desaparición espontánea del megauréter primario, sería secundaria a un retraso madurativo en el desarrollo del uréter. Existen más teorías al respecto30.
Este estudio tiene algunas limitaciones o debilidades. La más importante se refiere a que al ser retrospectivo, en algunos pacientes hemos tenido dificultades a la hora de conocer las características del megauréter, sobre todo al graduarlo y al valorar la variaciones funcionales de las unidades renales afectadas. No obstante se trata de una serie numerosa, con unas características muy homogéneas y con un tiempo de seguimiento prolongado. Mientras duró el estudio, los pacientes fueron controlados de forma muy estrecha y bajo los mismos criterios. El personal médico y de enfermería permaneció estable y los estudios por técnicas de imagen fueron realizados siempre por los mismos médicos especialistas.
En conclusión, el megauréter primario no refluyente es una condición casi siempre funcional y benigna que se normaliza espontáneamente en los primeros meses de la vida, siendo muy pocos los pacientes que necesitan ser intervenidos. Aunque no se dispone de un método exacto para diagnosticar la presencia de obstrucción al nivel de la unión ureterovesical, la mayoría de los autores consideran que el tratamiento inicial debe ser no quirúrgico, reservando la intervención para aquellos casos en los que durante el seguimiento se produzca un aumento de la dilatación ureteral, un deterioro de la función renal diferencial y/o aparezca sintomatología importante. En un grupo muy reducido de pacientes (7 % de nuestra serie), la unidad renal perteneciente al megauréter puede presentar una lesión renal irreversible más o menos grave la mayoría de las veces de origen congénito que no guarda relación con la curación o persistencia del megauréter y que por tanto no se beneficia de una intervención quirúrgica.
Correspondencia: Dr. R. Areses Trapote.
Sección de Nefrología Pediátrica. Servicio de Pediatría. Hospital Donostia.
P.º Dr. Beguiristain, s/n. 20014 San Sebastián. España.
Correo electrónico:rareses@chdo.osakidetza.net
Recibido en enero de 2007.
Aceptado para su publicación en enero de 2007.