Las microangiopatías trombóticas (MAT) son entidades infrecuentes que suelen causar afectación renal, hematológica, neurológica y cardiovascular, con síntomas inespecíficos pero graves. Con la finalidad de mejorar el conocimiento de sus características clínicas, el proceso diagnóstico y el tratamiento en la fase aguda, se ha creado el registro de MAT en las unidades de cuidados intensivos pediátricos (UCIP) de España (Registro MATUCIP).
Pacientes y métodosEstudio observacional, multicéntrico, realizado en 20 UCIP españolas desde enero de 2017 hasta diciembre de 2021 que incluyó niños mayores de 1mes con diagnóstico de MAT y seguimiento hasta el alta de la UCIP.
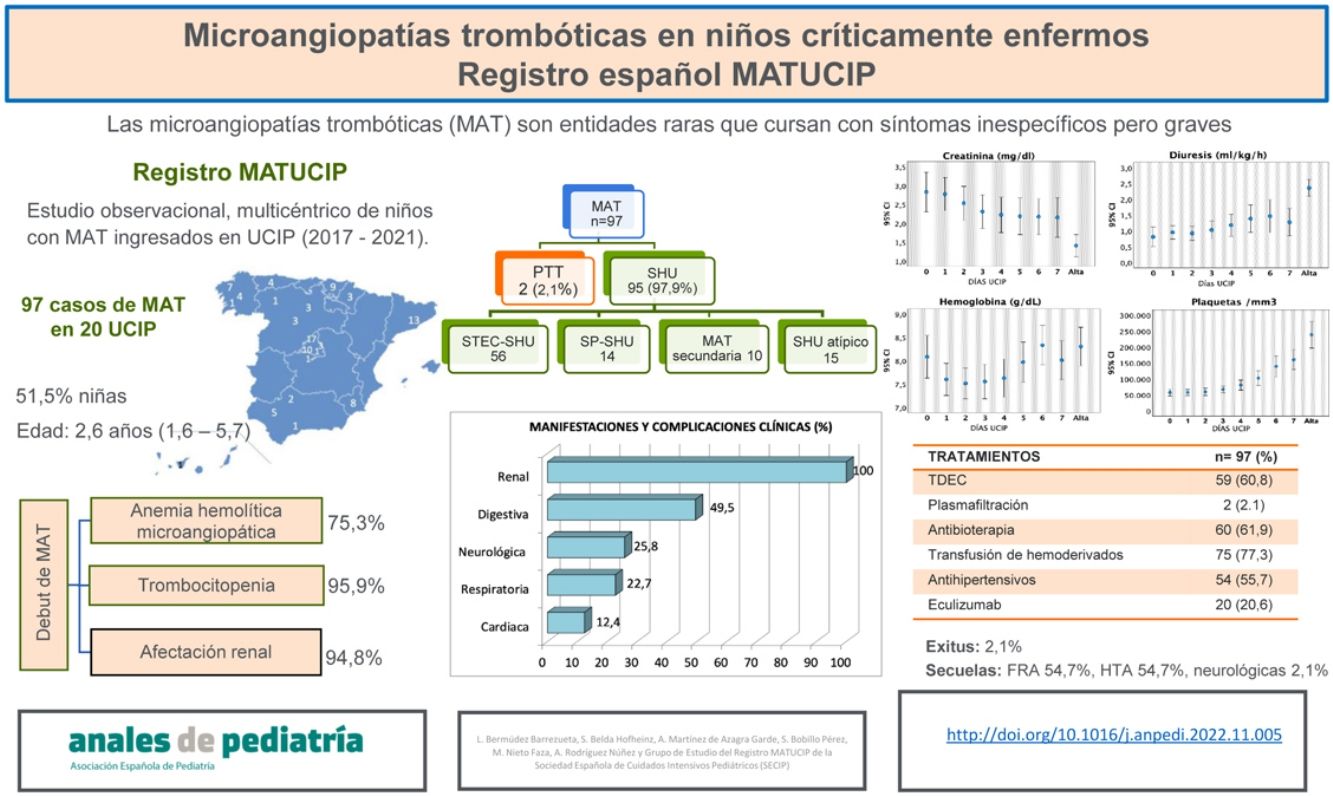
ResultadosSe incluyeron 97 pacientes (51,5% mujeres), con una mediana de edad de 2,6años (RIQ: 1,6-5,7). La clínica inicial fue de tipo gastrointestinal (74,2%), respiratoria (14,4%), cuadro febril (5,2%), neurológica (3,1%) y otras (3,1%). Al ingreso, el 75,3% presentaban anemia hemolítica microangiopática, el 95,9% trombocitopenia y el 94,8% daño renal agudo. Fueron diagnosticados de síndrome hemolítico urémico (SHU) asociado a Escherichia coli productora de toxina Shiga el 57,7%, SHU por Streptococcus pneumoniae el 14,4%, SHU atípico el 15,6%, MAT secundaria el 10,3% y púrpura trombótica trombocitopénica el 2,1%. Desarrollaron hipertensión arterial el 89,7%, manifestaciones digestivas el 49,5%, respiratorias el 22,7%, neurológicas el 25,8% y cardiacas el 12,4%. El 60,8% requirieron depuración extrarrenal y el 2,1%, plasmaféresis. Recibieron eculizumab 20 pacientes. La mediana de estancia en la UCIP fue de 8,5días (RIQ: 5-16,5). Dos niños fallecieron.
ConclusionesEl registro MATUCIP muestra la variabilidad clínica de las MAT que ingresan en la UCIP. Conocer la forma de presentación y la evolución de las MAT puede facilitar el diagnóstico etiológico precoz. Este registro permite conocer mejor el espectro clínico de estas entidades en las que los datos publicados son escasos.
Thrombotic microangiopathies (TMA) are rare diseases usually presenting with renal, haematological, neurologic and cardiovascular involvement and nonspecific but severe symptoms. A registry of TMA cases managed in Spanish paediatric intensive care units (the MATUCIP registry) was established with the aim of gaining knowledge on their clinical characteristics, diagnosis and acute-phase treatment.
Patients and methodsWe conducted a prospective multicentre observational study in 20 paediatric intensive care units (PICUs) in Spain from January 2017 to December 2021 in children aged more than 1month with TMAs, who were followed up through the discharge from the PICU.
ResultsThe sample included 97 patients (51.5% female) with a median age of 2.6years (interquartile range [IQR]: 1.6-5.7). The initial manifestations were gastrointestinal (74.2%), respiratory (14.4%), fever (5.2%), neurologic (3.1%) and other (3.1%). At admission, 75.3% of patients had microangiopathic haemolytic anaemia, 95.9% thrombocytopenia and 94.8% acute kidney injury. Of the total sample, 57.7% of patients received a diagnosis of Shiga toxin-associated haemolytic uraemic syndrome (HUS), 14.4% of Streptococcus pneumoniae-associated HUS, 15.6% of atypical HUS, 10.3% of secondary TMA and 2.1% of thrombotic thrombocytopenic purpura. Eighty-seven patients (89.7%) developed arterial hypertension, and 49.5% gastrointestinal, 22.7% respiratory, 25.8% neurologic and 12.4% cardiac manifestations. Also, 60.8% required renal replacement therapy and 2.1% plasma exchange. Twenty patients received eculizumab. The median PICU stay was 8.5days (IQR: 5-16.5). Two children died.
ConclusionsThe MATUCIP registry demonstrates the clinical variability of TMA cases requiring admission to the PICU. Knowledge of the presentation and outcomes of TMAs can facilitate early aetiological diagnosis. This registry can help improve our understanding of the clinical spectrum of these diseases, for which there is a dearth of published data.
Las microangiopatías trombóticas (MAT) son enfermedades raras en los niños (3casos/1.000.000 habitantes/año) que causan cuadros agudos graves, con afectación renal, hematológica, neurológica y cardiovascular1-4. El síndrome hemolítico urémico (SHU) es la principal MAT por su frecuencia relativa y su morbimortalidad5,6.
Histopatológicamente la MAT es el resultado de lesiones endoteliales con activación del complemento y/o sistemas de coagulación7,8. La agregación plaquetaria y la formación de trombos en vasos de pequeño calibre provocan isquemia en el riñón y en otros órganos9-11.
El SHU es una de las principales causas de insuficiencia renal en la infancia. Clínicamente se caracteriza por anemia hemolítica microangiopática (AHMA), trombocitopenia y daño renal6,12,13. La mayoría de casos ocurren después de una infección entérica por Escherichia coli productora de toxina Shiga (Shiga toxin-producing Escherichia coli [STEC-SHU] o SHU típico)3,14, siendo menos los relacionados con Streptococcus pneumoniae, alteraciones genéticas o adquiridas en la vía alternativa del complemento causantes del SHU atípico (SHUa), errores innatos del metabolismo, infecciones, fármacos y condiciones subyacentes como tumores, trasplantes y enfermedades autoinmunes (MAT secundarias)6,13,15-18.
Los niños con MAT pueden presentar múltiples síntomas inespecíficos, lo que condiciona que el proceso diagnóstico sea complejo19,20. Los casos más graves precisan cuidados intensivos y soporte de la función renal y de otros órganos4,18.
Dada su rareza, y para conocer mejor sus características clínicas, el proceso diagnóstico y el tratamiento en la fase aguda, se ha creado el registro de MAT en las unidades de cuidados intensivos pediátricos (UCIP) españolas, cuyos resultados generales presentamos (Registro MATUCIP).
Material y métodosSe realizó un estudio de cohorte observacional, multicéntrico, durante 5años (retrospectivo: enero de 2017 a junio de 2018, y prospectivo: de junio de 2018 a enero de 2022), con participación de 20 hospitales españoles. Se incluyeron de forma consecutiva niños mayores de 1mes ingresados en la UCIP con primer diagnóstico de MAT y seguimiento hasta el alta de la UCIP.
La sospecha diagnóstica se basó en la presencia de anemia hemolítica (hemoglobina <10g/dl y/o esquistocitos >1% en frotis de sangre periférica y/o elevación de LDH y/o disminución de haptoglobina), trombocitopenia (plaquetas <150.000/mm3 o descenso >25% del valor basal) y daño renal agudo (DRA) según los criterios KDIGO201221, hipertensión arterial22 o sedimento urinario alterado (proteinuria y/o hematuria). Además, se registraron las sospechas de MAT que no cumplieron la triada clásica al ingreso.
Los subtipos de MAT se clasificaron como: a)STEC-SHU: sintomatología gastrointestinal y confirmación etiológica (Esherichia coli productora de toxina Shiga) mediante técnicas microbiológicas; b)STEC-SHU probable: cuadro clínico y evolución compatible con STEC-SHU sin causa verificable ni alteración del complemento; c)SHUsp: SHU relacionado con infección confirmada por Streptococcus pneumoniae; d)MAT secundaria a condiciones previas o infecciones con confirmación microbiológica; e)púrpura trombótica trombocitopénica (PTT): déficit de ADAMTS-13 (metaloproteasa del factor de Von Willebrand <10%), y f)SHUa: diagnóstico de exclusión de otras causas, con o sin confirmación genética de desregulación del complemento.
Se recogieron los datos demográficos, los antecedentes personales y familiares, los tratamientos crónicos, las manifestaciones clínicas iniciales, las pruebas complementarias, los tratamientos, la evolución y las complicaciones durante el ingreso en la UCIP. Se compararon las características basales y evolutivas entre los diferentes subtipos de MAT. Los procesos diagnósticos y terapéuticos se realizaron de modo independiente al registro.
El estudio fue aprobado por el Comité de Ética de la Investigación de Galicia (código 2018/228).
El análisis estadístico se realizó con el programa IBM SPSS 24.0 para Windows® (SPSS Inc., Chicago, Illinois, EE.UU.). Las variables categóricas se expresan con valores absolutos y porcentajes. Las variables cuantitativas se describen como media ±desviación estándar y/o mediana y rango intercuartílico, según la distribución de normalidad de los datos (Kolmogorov-Smirnov p>0,05). El análisis de las características de los subtipos de MAT se realizó mediante la prueba Kruskal-Wallis para variables continuas, y con el test exacto de Fisher o chi-cuadrado (χ2) para variables categóricas. Se consideró estadísticamente significativo el valor de p<0,05.
ResultadosSe registraron 99 niños (entre 1 y 17 pacientes por UCIP; mediana: 4). Se excluyeron 2 que no cumplieron los criterios de MAT, incluyéndose finalmente 97 pacientes.
La mediana de edad fue de 2,6años (RIQ: 1,6-5,7), siendo el 51,5% mujeres. El cuadro clínico inicial fue gastrointestinal en el 74,2% de los casos, en el 14,4% respiratorio, en el 5,2% cuadro febril, en el 3,1% neurológico, y el 3,1% presentaron síntomas inespecíficos, como astenia y anorexia. La tabla 1 muestra los datos de laboratorio al momento de la sospecha de MAT.
Datos de laboratorio en el momento de la sospecha clínica de MAT
| Media (DE) | Mediana [RIQ] | |
|---|---|---|
| Equilibrio ácido-base | ||
| pH | 7,32 (0,09) | 7,31 [7,27-7,38] |
| Bicarbonato (mmol/l) | 17,5 (4,3) | 17,0 [14,3-20,1] |
| EB (mmol/l) | −8 (5,2) | −8,2 [11,3 a −5] |
| Lactato (mmol/l) | 1,8 (2) | 1,2 [0,8-1,7] |
| Electrólitos | ||
| Sodio (mEq/l) | 133,8 (5,7) | 134 [130-138] |
| Cloro (mEq/l) | 101,8 (8,8) | 103 [98-108] |
| Potasio (mEq/l) | 4,8 (1,1) | 4,5 [4-5,3] |
| Calcio (mg/dl) | 8,4 (0,8) | 8,5 [8-8,9] |
| Hematología | ||
| Hemoglobina (g/dl) | 8,3 (2,3) | 8,4 [6,8-9,9] |
| Hematocrito (%) | 24,1 (6,8) | 24,3 [19,5-29,1] |
| Plaquetas (109/l) | 57,91 (56) | 47 [27-70] |
| Reticulocitos (%); n=59 | 5,5 (6,9) | 2,7 [1,8-6,8] |
| Haptoglobina (mg/dl); n=82 | 14,2 (24,9) | 5 [5-10,7] |
| Coagulación | ||
| TP (segundos); n=55 | 12,4 (4,9) | 12 [11,1-13] |
| TTPA (segundos) | 28,8 (15) | 27 [24-29] |
| INR | 1,08 (0,2) | 1,06 [0,97-1,11] |
| Dímero D (ng/ml); n=34 | 5.847 (6.421) | 3.625 [1.400-6.867] |
| Fibrinógeno (mg/dl); n=85 | 527 (713) | 417 [319-506] |
| Bioquímica | ||
| Glucosa (mg/dl) | 99 (24,9) | 95 [82-109] |
| Urea (mg/dl) | 154,5 (105) | 126 [77-203] |
| Creatinina (mg/dl) | 2,86 (2,64) | 1,93 [0,84-4,035] |
| LDH (U/l) | 3.298 (3.348) | 2596 [1.809-3.900] |
| Bilirrubina (mg/dl) | 1,67 (1,7) | 1,2 [0,8-1,94] |
| GOT (U/l) | 172,6 (170) | 120 [76-210] |
| GGT (U/l) | 49,8 (61,4) | 21 [11-67] |
| GPT (U/l) | 69,8 (116) | 31 [16-65] |
| CK (U/l); n=40 | 200 (305) | 113 [66,5-188] |
| Troponina μg/ml; n=40 | 17,8 (49,8) | 5,85 [1,3-10,4] |
| Amilasa; n=62 | 80,7 (71,3) | 60,5 [40-97] |
| Lipasa (U/l); n=36 | 122,8 (185) | 41 [21-174] |
| Albúmina (mg/dl); n=20 | 3 (0,5) | 3 [2,7-3,22] |
| Cistatina C (mg/l); n=29 | 2,7 (1,6) | 2,22 [1,34-4,4] |
CK: creatina-cinasa; EB: exceso de base; GGT: gamma-glutamil transferasa; GOT: transaminasa glutámico oxalacética; GPT: glutamato-piruvato transaminasa; INR: international normalized ratio; LDH: lactato deshidrogenasa; TP: tiempo de protrombina; TTPA: tiempo de tromboplastina parcial activado;
En 91 casos se buscaron esquistocitos en el frotis sanguíneo, con resultado positivo en 83 (91,2%). El test de Coombs se solicitó en 81 pacientes, siendo positivo en 10 (12,3%).
En 91 casos se analizó el C3, teniendo hipocomplementemia (<80mg/dl) el 39,6%. En 90 niños se estudió el C4, detectándose hipocomplementemia (<12mg/dl) en el 22,2%. Los resultados de los niveles de complemento y ADAMTS-13 se muestran en la tabla 2.
Niveles de complemento y ADAMTS-1
| n 97 (%) | Media (DE) | Mediana | Rango | RIQ | |
|---|---|---|---|---|---|
| C3 (mg/dl) | 91 (93,8) | 86,2 (27,2) | 87,5 | 1-153 | 66-105,7 |
| C4 (mg/dl) | 90 (92,8) | 17,4 (8,4) | 16 | 2,8-53,2 | 12,6-21 |
| CH50 | 33 (34) | 111,4 (154) | 68 | 0-810 | 43-104 |
| ADAMTS-13 (%) | 68 (70) | 64,8 (26,4) | 68 | 0-112 | 50-85 |
ADAMTS-13: A Disintegrin and Metalloproteinase with a ThromboSpondin type1 motif, member 13; CH50: complemento hemolítico al 50%.
En el 86,6% de los pacientes se confirmó una etiología infecciosa. En 80 se investigó infección por E.coli enterohemorrágica productora de toxina Shiga, con resultado positivo en 53 pacientes (tabla 3). En 32/97 casos algún otro cultivo fue positivo (13 hemocultivos, 6 coprocultivos, 8 urinocultivos, 2 líquido pleural y 3 aspirado traqueal). Se buscaron virus respiratorios en 48 pacientes, detectándose al menos uno en 16, siendo el más frecuente Rinoenterovirus (11 casos).
Métodos microbiológicos utilizados para investigar E.coli enterohemorrágica productora de toxina Shiga
| Muestras analizadasn=80 | Resultado positivon=53 | Rendimiento diagnóstico | |
|---|---|---|---|
| ELISA | 25 | 14 | 56% |
| Coprocultivo con sorbitol-MacConkey | 23 | 15 | 65,2% |
| PCR para genes de toxinas Shiga 1 y 2 | 32 | 24 | 75% |
ELISA: enzimo-inmunoanálisis; PCR: reacción en cadena de la polimerasa; Rendimiento diagnóstico: número total de muestras positivas/número total de muestras analizadas (%).
Fueron diagnosticados de STEC-SHU confirmado 53 niños (54,6%), de STEC-SHU probable 3 (3,1%), con cuadro clínico y evolución compatible con STEC-SHU pero con coprocultivo negativo, de SHUsp 14 (14,4%), de MAT secundaria a otras infecciones 9 (9,3%), de MAT secundaria a lupus eritematoso sistémico1 (1%), de SHUa 15 (15,6%) y de PTT2 (2,1%). Se observaron diferencias entre los subtipos de MAT, tanto en las características basales como en las manifestaciones clínicas, de laboratorio y de evolución en la UCIP, que se resumen en la tabla 4.
Diagnóstico diferencial de las microangiopatías trombóticas de los pacientes del registro MATUCIP
| STEC-SHU (n=56) | SHU por neumococo (n=14) | MAT secundaria (n=10) | SHU atípico (n=15) | PTT (n=2) | p | |
|---|---|---|---|---|---|---|
| Edad (años) | 2,7 [2-5,2] | 1,4 [1,1-1,8] | 4,8 [2,3-10] | 3,2 [1,6-7,9] | 8,3 [7,6-9] | 0,002 |
| Sexo (femenino) | 26 (46,4) | 6 (42,9) | 6 (60) | 10 (66,7) | 1 (50) | 0,622 |
| Peso (kg) | 14,3 [12,3-19,5] | 10,4 [10-11,7] | 21,9 [13,5-26,7] | 15,4 [11,5-24,5] | 35 [31-39] | 0,001 |
| Cuadro clínico inicial | <0,001 | |||||
| Gastrointestinal | 55 (98,2) | 1 (7,1) | 5 (50) | 10 (66,7) | 1 (50) | |
| Respiratoria | 0 | 11 (78,6) | 2 (20) | 1 (6,7) | 0 | |
| Neurológica | 1 (1,8) | 0 | 0 | 2 (13,3) | 0 | |
| Otra sintomatología | 0 | 2 (14,3) | 3 (30) | 2 (13,3) | 1 (50) | |
| Triada clásica al debuta | 40 (71,4) | 14 (100) | 5 (50) | 7 (46,7) | 0 | 0,003 |
| Al debut | ||||||
| Anemia (Hb <10 g/dl) | 41 (73,2) | 14 (100) | 6 (60) | 10 (66,7) | 2 (100) | 0,124 |
| Hemoglobina (g/dl) | 8,3 [6,9-10,2] | 6,2 [5,1-8,4] | 9,3 [7-10,7] | 9 [7,2-10,7] | 7,6 [6,8-8,4] | 0,051 |
| Trombocitopenia | 55 (98,2) | 14 (100) | 10 (100) | 12 (80) | 2 (100) | 0,022 |
| Plaquetas (103/μl) | 46,5 [28-66,5] | 19 [13-29] | 70 [51-101] | 70 [38-95] | 19 [10-37] | <0,001 |
| Creatinina (mg/dl) | 2,1 [1,1-5,2] | 1,2 [0,7-1,3] | 1,8 [0,7-3,5] | 2,5 [0,9-4,6] | 0,6 [0,5-0,6] | 0,038 |
| Urea al ingreso (mg/dl | 145 [92-224] | 94 [77-140] | 132 [75-166] | 128 [72-189] | 42,5 [38-47] | 0,070 |
| LDH (U/l) | 2813 [1972-4155] | 3815 [1963-4751] | 1622 [840-2995] | 2438 [1713-2987] | 1990 [1540-2441] | 0,089 |
| Haptoglobina (mg/dl) | 5 [3,9-12,1] | 5,5 [5-6,8] | 5,7 [5-44,3] | 5 [4,8-10,3] | 5 [12,5- 20] | 0,858 |
| GOT (U/l) | 105 [70,5-186] | 197 [158-317] | 92 [41-153] | 118 [69-229] | 86,7 [72-101] | 0,007 |
| Complemento | ||||||
| C3 (mg/dl) | 93,3 [78-109] | 66,7 [50-90] | 76,7 [59-93] | 84 [59,5-102] | 76,3 [60-93] | 0,029 |
| C4 (mg/dl) | 16 [12,4-20,8] | 13 [7,6-15] | 17,3 [11,8-32] | 18,2 [17-23] | 16 [12,8-19] | 0,069 |
| Hipocomplementemia C3 | 14/50 (28) | 9/14 (64,3) | 6/10 (60) | 6/15 (40) | 1/2 (50) | 0,084 |
| Hipocomplementemia C4 | 11/49 (22,4) | 6/14 (42,9) | 3/10 (30) | 0 /15 (0) | 0/2 (0) | 0,070 |
| Actividad ADAMTS-13% | 68 [52 -85] | 50,3 [44-66] | 58 [42-107] | 76 [60-86] | 0 | 0,060 |
| Coombs positivo (n=81) | 1/47 (2,1) | 8/9 (88,9) | 1/9 (11) | 0 | 0 | <0,001 |
| Daño renal agudo | 55 (98,2) | 14 (100) | 9 (90) | 14 (93,3) | 0 | <0,001 |
| Hipertensión arterial | 49 (87,5) | 14 (100) | 10 (100) | 13 (86,7) | 1 (50) | 0,158 |
| Proteinuria | 45 (80,3) | 10 (71,4) | 8 (80) | 14 (93,3) | 2 (100) | 0,776 |
| Hematuria | 42 (75) | 9 (64,3) | 8 (80) | 13 (86,7) | 2 (100) | 0,952 |
| Manifestaciones clínicas | ||||||
| Digestivas | 33 (58,9) | 4 (28,6) | 6 (60) | 4 (26,7) | 0 | 0,041 |
| Neurológicas | 11 (19,6) | 5 (35,7) | 5 (50) | 4 (26,7) | 0 | 0,232 |
| Cardiacas | 3 (5,4) | 5 (35,7) | 3 (30) | 1 (6,7) | 0 | 0,004 |
| Respiratorias | 5 (8,9) | 14 (100) | 3 (30) | 0 | 0 | <0,001 |
| TDEC | 35 (62,5) | 11 (78,6) | 5 (50) | 8 (53,3) | 0 | 0,209 |
| Días de TDEC (n=59) | 6 [4-11] | 8,5 [5-11,5] | 11 [10-15] | 5 [4-10] | − | 0,421 |
| Hemoderivados | 42 (75) | 12 (85,7) | 9 (90) | 10 (66,7) | 2 (100) | 0,524 |
| Eculizumab | 3 (5,4) | 1 (7,1) | 2 (20) | 14 (93,3) | 0 | <0,001 |
| Días de UCIP | 6,5 [4,5-12,5] | 16,5 [9-22] | 13,5 [7-23] | 9 [4,5-14,5] | 6 [4-8] | 0,026 |
| Secuelas al alta UCIP | ||||||
| Enfermedad renal aguda | 27 (48,2) | 4 (28,6) | 6 (60) | 8 (53,3) | 0 | 0,389 |
| Hipertensión arterial | 27 (48,2) | 7 (50) | 8 (80) | 10 (66,6) | 0 | 0,250 |
| Neurológicas | 0 | 0 | 0 | 2 (13,3) | 0 | − |
ADAMTS-13: A Disintegrin and Metalloproteinase with a ThromboSpondin type 1 motif, member 13; GOT: transaminasa glutámico oxalacética; LDH: lactato deshidrogenasa; TDEC: terapias de depuración extrarrenal continuas; UCIP: unidad de cuidados intensivos pediátricos.
Al ingreso en la UCIP, únicamente 66 pacientes (68%) presentaban la triada clásica (AHMA, trombocitopenia y DRA). El 24,7% de los niños no presentaban anemia, en el 8,8% no se observaban esquistocitos, el 4,1% no tenían trombocitopenia y el 5,2% no cumplían criterios de DRA.
En cuanto a la evolución, los pacientes presentaron diversas manifestaciones clínicas y complicaciones. Todos tuvieron algún tipo de afectación renal, observándose DRA en 92 (94,8%), hipertensión arterial en 87 (89,7%) y alteraciones del sedimento urinario en 83 (85,6%). Presentaron manifestaciones digestivas 48 pacientes (49,5%), respiratorias 22 (22,7%), neurológicas 25 (25,8%) y cardiacas 12 (12,4%) (tabla 5).
Manifestaciones y complicaciones clínicas de los pacientes incluidos en el registro
| Afectación | n=97 | % |
|---|---|---|
| Renal | 97 | 100 |
| Daño renal agudo | 92 | 94,8 |
| Hipertensión arterial | 85 | 87,6 |
| Proteinuria y/o hematuria | 82 | 84,5 |
| Digestivas | 48 | 49,5 |
| Diarrea y/o vómitos | 30 | 30,9 |
| Hemorragia digestiva baja | 6 | 6,2 |
| Colitis | 4 | 4,1 |
| Pancreatitis | 4 | 4,1 |
| Peritonitis | 3 | 3,1 |
| Íleo / pseudobstrucción intestinal | 3 | 3,1 |
| Prolapso rectal | 1 | 1 |
| Hepatitis colestásica | 1 | 1 |
| Respiratorias | 22 | 22,7 |
| Neumonía ±derrame pleural | 14 | 14,4 |
| Insuficiencia respiratoria y ventilación mecánica | 10 | 10,3 |
| Derrame pleural aislado | 4 | 4,1 |
| Síndrome de distrés respiratorio agudo | 2 | 2,1 |
| Edema agudo de pulmón | 1 | 1 |
| Neurológicas | 25 | 25,8 |
| Alteración del nivel de conciencia | 15 | 15,5 |
| Convulsiones | 7 | 7,2 |
| Accidente cerebrovascular | 3 | 3,1 |
| Encefalitis | 2 | 2,1 |
| Irritabilidad | 3 | 3,1 |
| Hemiparesia | 2 | 2,1 |
| Coma | 1 | 1,6 |
| Muerte encefálica | 1 | 1,6 |
| Cardíacas | 12 | 12,4 |
| Shock / Inestabilidad hemodinámica | 6 | 6,5 |
| Insuficiencia cardíaca | 3 | 4,8 |
| Derrame pericárdico | 2 | 3,2 |
| Hipertrofia ventricular | 1 | 1 |
En lo que respecta a la función renal, la diuresis el primer día fue variable, con anuria en el 28,9% y oliguria (<1ml/kg/hora) en el 32% de los casos. Al ingreso, las cifras de creatinina oscilaron entre 0,1 y 13,3mg/dl (mediana: 1,93mg/dl) y el 25% presentaron valores >4mg/dl. Las cifras de urea oscilaron entre 25 y 532mg/dl (mediana: 126mg/dl) y el 25% presentaron valores >200mg/dl. De los 92 pacientes diagnosticados de DRA, 17 presentaron estadio1, 10 estadio2 y 65 estadio3 según la clasificación KDIGO2012. La evolución de la diuresis, las cifras de creatinina y de urea se muestran en la figura 1.
Se observó anemia al ingreso en 73 pacientes (75,3%), presentando el 100% AHMA durante la primera semana y precisando 72 (74,2%) al menos una transfusión de concentrado de hematíes. Al ingreso, 93 pacientes (95,9%) tenían trombocitopenia y 2 tuvieron un descenso de plaquetas (<150.000/mm3) durante los días siguientes; 41 (42,3%) precisaron alguna transfusión de plaquetas. La figura 2 muestra la evolución de las cifras de hemoglobina y de plaquetas.
En cuanto a los tratamientos empleados, en la fase aguda se administró al menos un bolo de cristaloides en el 50,5% y albúmina en el 24,7% de los casos. Las terapias de depuración extrarrenal continuas (TDEC) se utilizaron en 59 pacientes (60,8%), con una mediana de duración de 7días (RIQ: 4-12). En 38 casos se utilizó hemodiafiltración venovenosa continua (HDFVVC); en 16, diálisis peritoneal, y 5 niños recibieron ambas terapias. La mediana de edad de los pacientes que iniciaron diálisis peritoneal fue de 2,5años (RIQ: 1,7-3,9) frente a 2,4años (RIQ: 1,6-5,9) en aquellos que recibieron HDFVVC como terapia inicial, sin que se observaran diferencias en el método de TDEC en relación con la edad (p=0,97).
Recibieron eculizumab 20 niños (20,6%), 14 de ellos con diagnóstico de SHUa y 6 con otros diagnósticos (2MAT secundarias, 1SHUsp y 3STEC-SHU con manifestaciones neurológicas graves o insuficiencia renal persistente). La mediana de tiempo desde el diagnóstico de MAT hasta el inicio de eculizumab fue de 2,5días (RIQ: 1,5-5). La tabla 6 muestra los tratamientos realizados.
Tratamientos realizados durante el ingreso en la UCIP
| n=97 (%) | |
|---|---|
| Técnicas de depuración extrarrenal | 59 (60,8) |
| Hemodiafiltración | 38 (39,2) |
| Diálisis peritoneal | 16 (16,5) |
| Hemodiafiltración +diálisis peritoneal | 5 (5,2) |
| Plasmaféresis | 2 (2,1) |
| Antibioterapia | 60 (61,9) |
| Hemoderivados | |
| Transfusión de concentrado de hematíes | 72 (74,2) |
| Transfusión de plaquetas | 41 (42,3) |
| Plasma fresco congelado | 4 (4,1) |
| Antihipertensivo | 54 (55,7) |
| Eculizumab | 20 (20,6) |
Dos pacientes fallecieron (2,1%). Uno tuvo una meningitis por neumococo y SHU asociado, evolucionando a muerte encefálica el primer día. El otro presentó STEC-SHU con evolución clínica desfavorable y manifestaciones neurológicas graves (status epiléptico e infartos cerebrales), falleciendo a los 9días.
Los 95 pacientes restantes fueron dados de alta de la UCIP tras una mediana de 8,5días (RIQ: 5-16,5). En ese momento, 52 (54,7%) presentaban enfermedad renal aguda: 3 en estadio1, 11 en estadio2 y 38 en estadio3 según la clasificación KDIGO2012. La mediana de creatinina al alta fue de 0,9mg/dl (RIQ: 0,44-2), urea 78mg/dl (RIQ: 38,8-119) y diuresis 2,2ml/kg/h (RIQ: 1,5-3). Además, 52 niños (54,7%) presentaban hipertensión arterial y 2 tenían secuelas neurológicas (encefalopatía epiléptica y hemiparesia izquierda).
DiscusiónNuestro registro es el primero centrado en las MAT durante su ingreso en la UCIP y aporta información relevante sobre su espectro clínico, su variabilidad clínica, el manejo terapéutico y los resultados a corto plazo.
La clasificación de las MAT se ha ido actualizando según los avances en el conocimiento de sus mecanismos fisiopatológicos, su etiología y los procesos implicados4,8,15. En nuestro registro, el 57,7% de los niños presentaron STEC-SHU y el 15,6%, SHUa. Estos resultados difieren de las casuísticas «clásicas», que atribuían al STEC-SHU cerca del 90% de los casos de MAT y al SHUa menos del 10%6,10,23. Aunque la menor proporción de STEC-SHU y el incremento de casos de SHUa podrían estar sesgados por el ámbito del estudio (niños en la UCIP), nuestros datos sugieren que la frecuencia relativa de los subtipos de MAT podría estar variando debido a la mejora en la identificación de estas entidades15,24.
A pesar de las diferentes causas y factores desencadenantes, las MAT comparten aspectos fisiopatológicos comunes, caracterizados por un estado proinflamatorio endotelial con formación de trombos en capilares y arteriolas, que conduce a la triada de AHMA, trombocitopenia y daño orgánico6. Sin embargo, estas tres manifestaciones no siempre coexisten, tal como hemos observado en nuestro registro, donde solamente el 68% de los pacientes las presentaban al ingreso en la UCIP. De modo similar, estudios previos han descrito casos de MAT sin trombocitopenia o esquistocitos, siendo la afectación renal la manifestación más constante al diagnóstico10,19,23,25,26. Fremeaux-Bacchi et al.26 estudiaron una cohorte de 89 niños con SHUa y observaron que inicialmente el 15% no mostraban trombocitopenia y el 6% no tenían anemia. Una presentación incompleta dificulta la sospecha clínica y el diagnóstico temprano, esencial en estos procesos.
Aunque el test de Coombs y el frotis de sangre periférica son pruebas básicas para el diagnóstico de AHMA, no se realizaron en todos los pacientes. Sin embargo, el diagnóstico se apoyó en otros criterios, como niveles elevados de LDH y/o disminución de haptoglobina, observándose AHMA en todos los casos durante la primera semana de ingreso.
Hemos encontrado diferencias clínicas entre los subtipos de MAT. Así, la edad de presentación fue menor en pacientes con SHUsp, la triada clínica estuvo presente al diagnóstico únicamente en el 46,7% de los casos de SHUa, mientras que se observó en el 100% de los pacientes con SHUsp y en ninguno de los niños con PTT. La anemia y la trombocitopenia fueron más graves en los pacientes con SHUsp y PTT, y la creatinina fue mayor en los pacientes con SHUa y STEC-SHU. El test de Coombs fue positivo en el 89% de los casos de SHUsp, mientras que en los demás fue predominantemente negativo. Se observó consumo de complemento prácticamente en todos los subtipos de MAT (más marcado en el SHUsp), siendo menos frecuente en los pacientes con STEC-SHU.
El STEC-SHU afecta principalmente a menores de 5años10,27. Se estima que el 15% de niños con infección por E.coli enterohemorrágica desarrollarán SHU6,20. En el presente registro se investigó la STEC en los 80 pacientes con sintomatología gastrointestinal o inespecífica, siendo positiva en 53 (66,3%). Tres se consideraron casos probables en base a la edad, la presentación y la evolución, teniendo en cuenta que la excreción de E.coli enterohemorrágica y sus toxinas es transitoria, por lo que la probabilidad de detección disminuye a partir del séptimo día14,28,29. Los niños con STEC-SHU del registro tenían un rango de edad de 2 a 5años y presentaron una evolución relativamente favorable, con menor estancia en la UCIP en relación con otros tipos de SHU, si bien un paciente con complicaciones neurológicas falleció. Aunque el pronóstico del STEC-SHU ha mejorado en los últimos años, su mortalidad se estima todavía entre el 2 y el 5%, presentando afectación neurológica aguda hasta el 25% de los casos14.
El SHUa merece especial atención al disponer de tratamiento específico con eculizumab y otros inhibidores del complemento15,23,24,30. Su incidencia se ha cifrado en 3,5-7 casos por millón de niños20, presentando el 70% su primer episodio antes de los 2años6,24. El SHUa es el resultado de un defecto genético o adquirido con desregulación de la vía alternativa del complemento; sin embargo, hasta en el 30 al 50% de los pacientes no se identifica una mutación en los genes conocidos asociados a la enfermedad6,20,31. En el registro MATUCIP, 15niños (15,6%) fueron diagnosticados de SHUa con una mediana de edad de 3,2años, similar a la publicada por Ito et al.32. Presentaron un cuadro clínico inicial poco específico, con manifestaciones digestivas, neurológicas y respiratorias, trombocitopenia leve o ausente al debut en el 20% de los casos, complicaciones neurológicas y cardiacas, cifras de creatinina elevadas, aunque con corta duración de las TDEC y sin mortalidad asociada. El 93% recibieron eculizumab. Si bien se ha señalado que hasta el 30% de los niños con SHUa pueden tener síntomas gastrointestinales, en nuestra cohorte se presentaron en dos tercios de los casos, lo que debe tenerse en cuenta en el diagnóstico diferencial con el STEC-SHU. El diagnóstico de SHUa se realizó excluyendo otras causas, y aunque se solicitaron estudios genéticos, sus resultados no estuvieron disponibles durante el ingreso en la UCIP, por lo que la decisión de iniciar tratamiento con eculizumab se basó en criterios clínicos y de laboratorio. Hasta la disponibilidad de este fármaco, el SHUa tenía mal pronóstico, con mortalidad y morbilidad elevadas15; su utilización ha permitido disminuir la progresión a insuficiencia renal terminal o muerte del 30-50% al 9% en niños3,12. La evolución favorable de los casos de SHUa que hemos registrado y que fueron tratados precozmente con eculizumab (mediana de 2,5días) es concordante con dichos datos.
Las MAT secundarias a otras condiciones son entidades muy raras10,23. Se registraron 10 casos, principalmente asociadas a infecciones. Estos pacientes presentaron sintomatología variada, ausencia de anemia al debut en el 40% de los casos, complicaciones respiratorias, neurológicas y cardiacas, mayor duración de las TDEC y estancia en la UCIP prolongada. La MAT es un proceso complejo con desequilibrio entre inmunidad, coagulación y complemento, donde las infecciones pueden actuar como precipitantes en pacientes predispuestos genéticamente33. Se ha demostrado activación del complemento en MAT secundarias, existiendo un estrecho límite entre estas entidades y el SHUa10,20. Dado que en aproximadamente la mitad de los niños el SHUa primario puede desencadenarse por eventos intercurrentes, es discutible si las MAT secundarias deberían considerarse dentro de ese grupo10. En consecuencia, aunque no existan evidencias definitivas al respecto, algunos autores han propuesto la utilización de eculizumab en estas entidades33.
En lo que respecta al SHUsp, la proporción observada (14,4%) es similar a las últimas series publicadas de la era posvacunal3,16,34. El SHUsp ocurre en el 0,4 al 0,6% de las infecciones por neumococo16,17,20 y su incidencia parece estar aumentando, a expensas de los serotipos no vacunales16,34. En nuestro registro los niños con SHUsp tenían menor edad, anemia y trombocitopenia significativa al debut y peor evolución clínica, con complicaciones neurológicas, cardiacas, utilización de TDEC y mayor estancia en la UCIP. Un paciente con meningitis por neumococo y SHUsp falleció. Análogamente a nuestra cohorte, otros autores han informado una evolución más grave de los pacientes con SHUsp en comparación con el STEC-SHU3,16,17,35,36.
La PTT es una entidad muy rara en niños, con elevada morbimortalidad4,23,37. En el registro, 2pacientes fueron diagnosticados de PTT adquirida y se caracterizaron por tener mayor edad, anemia y trombocitopenia significativas, función renal conservada y ausencia de manifestaciones neurológicas, presentando buena evolución tras el tratamiento precoz con corticoides y plasmaféresis. Aunque clásicamente la PTT se ha descrito con la pentada de anemia hemolítica, trombocitopenia, síntomas neurológicos, fallo renal y fiebre, pocos pacientes presentan todos los síntomas, tal como se ha observado en nuestra cohorte3,38.
En relación con los tratamientos utilizados, más de la mitad de los pacientes precisaron alguna TDEC, siendo la más empleada la HDFVVC, lo que pone de manifiesto el desplazamiento de la diálisis peritoneal por las técnicas lentas continuas en el niño crítico. El método de depuración extrarrenal de elección no se relacionó con la edad del paciente, y aunque desconocemos los motivos, la elección del método probablemente estuvo condicionada por la experiencia de cada UCIP39.
Nuestro estudio tiene algunas limitaciones. Es un registro nacional voluntario que no incluye a todos los niños con MAT en España durante el periodo analizado. Al ser un estudio observacional, el proceso diagnóstico y terapéutico no fue homogéneo entre las UCIP. Además, el seguimiento se limitó al tiempo de estancia en la UCIP, sin que se aportaran datos de la evolución a largo plazo.
ConclusionesEl reconocimiento temprano de las MAT y su diagnóstico diferencial basado en la etiología representa un reto en el ámbito de los cuidados intensivos, considerando su rareza y variabilidad clínica. En algunos tipos de MAT el tratamiento específico precoz resulta fundamental para reducir el riesgo de daño orgánico irreversible o de muerte. El registro MATUCIP expone los aspectos característicos de las MAT desde una perspectiva de la práctica clínica real en la UCIP, describiendo la evolución y el efecto de los tratamientos empleados en la fase aguda. Nuestros resultados permiten conocer de forma detallada el proceso diagnóstico precoz de las MAT en la UCIP, para así mejorar el enfoque terapéutico de estas entidades.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesEl grupo de estudio MATUCIP ha recibido financiación parcial para la realización de las reuniones de trabajo por parte de Alexion SA. Antonio Rodríguez Núñez, Sylvia Belda Hofheinz y Amelia Martínez de Azagra Garde han participado en actividades docentes financiadas por Alexion SA.
A los miembros del Grupo de Estudio del registro MATUCIP de la SECIP y a todas las personas que han colaborado en el registro.
Lorena Bermúdez Barrezueta (H. Clínico Universitario de Valladolid), Sylvia Belda Hofheinz y Ana Arias Felipe (H. Universitario 12 de Octubre), Amelia Martínez de Azagra Garde y María I. Iglesias Bouza (H. Infantil Universitario Niño Jesús), Sara Bobillo Pérez (H. Sant Joan de Déu), Manuel Nieto Faza (H. Universitario de Cruces), Juan Francisco Collado Capar y María Miñambres Rodríguez (H. Clínico Universitario Virgen de la Arrixaca), Raquel Díaz Soto y Ángela Ferrer Barba (Complejo Hospitalario Universitario de La Coruña), Inmaculada Sánchez Ganfornina y Elena González Río (H. Universitario Virgen del Rocío), Corsino Rey Galán (H. Central de Asturias), Débora Sanz Álvarez y María José Santiago Lozano (H. General Universitario Gregorio Marañón), María Luisa Palacios Loro (H. Universitario de Navarra), Esteban Gómez Sánchez (H. Universitario de Burgos), Andrés Alcaraz Romero (H. Universitario de Getafe), Lourdes Artacho González (H. Universitario de Málaga), Raúl Montero Yéboles (H. Universitario Reina Sofía), Luis J. Ferrero de la Mano (H. Universitario de León), Raúl Borrego Domínguez (Complejo Hospitalario de Toledo), Diana Álvarez Demanuel (H. Álvaro Cunqueiro de Vigo), Victoria Guerra Martín (H. de Tenerife), Paula Santos Herráiz y Raúl Borrego (H. Universitario de Toledo).
Coordinador: Antonio Rodríguez Núñez (H. Clínico Universitario de Santiago de Compostela).
Los resultados preliminares de este trabajo fueron presentados en el 35.° Congreso Nacional de la Sociedad Española de Cuidados Intensivos Pediátricos (SECIP), celebrado del 17 al 21 de mayo de 2021.
Los miembros del Grupo de Estudio del Registro MATUCIP de la Sociedad Española de Cuidados Intensivos Pediátricos (SECIP) se presentan en el Anexo 1.