La nefropatía de reflujo es el término radiológico que se utilizó para expresar la existencia de lesiones morfológicas renales en pacientes con reflujo vesicoureteral (RVU). Este concepto morfológico se acuñó a partir de los datos de imagen recogidos, aunque sin realizar estudios complementarios básicos de función renal. Este estudio se diseñó para demostrar que las pruebas de función renal básicas muestran resultados distintos en presencia de RVU activo y una vez desaparecido.
Pacientes y métodosEstudio descriptivo retrospectivo longitudinal en el que se incluyeron 89niños (46V, 43M) con RVU diagnosticado mediante cistouretrografía miccional seriada. Las pruebas básicas de función renal recogidas fueron la osmolalidad urinaria máxima (UOsm) y los cocientes urinarios albúmina/creatinina y NAG/creatinina. Los datos acopiados correspondían a dos momentos: al diagnosticarse el RVU y cuando ya se había curado.
ResultadosSe comprobaron diferencias cuantitativas en los tres parámetros funcionales al comparar los correspondientes a ambos momentos del estudio. En el análisis cualitativo, en relación con la intensidad del RVU, se apreciaron diferencias en UOsm al diagnóstico y en el cociente albúmina/creatinina una vez desaparecido el RVU. En este último momento se observó un aumento significativo en el cociente albúmina/creatinina en los pacientes con pérdida de parénquima renal en relación con aquellos sin lesiones morfológicas residuales.
ConclusionesEl defecto en la capacidad de concentración renal es el hallazgo más frecuente en niños con RVU activo (auténtica nefropatía de reflujo), mientras que una vez curado el RVU la alteración funcional más frecuente es el aumento de la excreción de albúmina, en relación con el daño residual existente en el parénquima renal. Puesto que la alteración funcional es diferente en los niños con RVU activo y cuando ya no está presente, no se debería utilizar el mismo término para ambas situaciones puesto que, aunque próximas, son entidades distintas. El término nefropatía displásico-cicatricial reflejaría mejor las características de estos pacientes una vez curado el RVU.
Reflux nephropathy is a radiologic condition commonly used to express the existence of renal morphological lesions in patients who have or had vesicoureteral reflux (VUR). This morphological concept is used based on the image data collected, without conducting basic complementary renal function studies. The present study was designed to demonstrate that patients with active VUR present different functional renal alterations from those shown by patients with disappeared VUR.
Patients and methodsLongitudinal descriptive retrospective analysis including 89 children (46M, 43F) with VUR diagnosis through a standard voiding cystourethrogram (VCUG). The basic renal function tests collected were the maximum urinary osmolality (UOsm) and the urinary albumin/creatinine and NAG/creatinine ratios. The data collected corresponded to two moments, when VUR was diagnosed and when it had already disappeared.
ResultsQuantitative differences were verified in the three functional parameters when comparing those corresponding to both moments of the study. In the qualitative analysis, in relation to the intensity of the VUR, differences were observed in UOsm at diagnosis and in the albumin/creatinine ratio once the VUR had cured. At this last moment, a significant increase in the albumin/creatinine ratio was observed in patients with loss of renal parenchyma in relation to those without residual morphological lesions.
ConclusionsConcentrating ability defect is the most frequent finding in children with active reflux (true reflux nephropathy), whereas the most frequent functional disturbance found, once VUR has cured, is an increase in urinary albumin excretion, related to parenchymal damage. The term dysplastic-scarring nephropathy, could be more appropriate for patients with residual morphological lesions and impaired renal function, once VUR is cured.
El término pielonefritis crónica fue el primero que se acuñó para describir las lesiones renales residuales permanentes observadas en niños que habían sufrido una o más infecciones del tracto urinario (ITU) febriles1. En los años sesenta se observó una posible relación entre pielonefritis crónica y reflujo vesicoureteral (RVU), por lo que empezó a emplearse el termino nefropatía de reflujo2. El nuevo concepto, inicialmente radiológico, establecía la asociación entre RVU, cicatrices renales y la opción de desarrollar enfermedad renal crónica3, si bien se hizo poco hincapié en la presencia de otros defectos funcionales renales asociados. A finales de los años noventa del pasado siglo se recomendó no emplear dicho término, puesto que se demostró que el RVU estéril no produce cicatrices4, y que la infección del parénquima renal, más que el RVU, es el requisito necesario para su desarrollo5, lo que significa que el RVU no es la auténtica causa de las cicatrices, sino la inflamación aguda localizada en el parénquima renal4-7. Por ello, se invitó a sustituir el término nefropatía de reflujo por el de nefropatía cicatricial o cicatrices renales adquiridas(acquired renal scarring)8. No obstante, con este término quedaban minusvaloradas las lesiones congénitas (displasia, hipodisplasia) que pueden estar asociadas a RVU y que se han denominado como nefropatía congénita por reflujo(congenital reflux nephropathy)8,9.
Estudios preliminares han demostrado que el RVU interfiere en la función tubular renal. Así, se ha publicado la existencia de una disminución de la capacidad de concentración renal10,11, un aumento de la excreción urinaria de albúmina12 y una elevación de la excreción urinaria de NAG13.
Este estudio se diseñó para evaluar si las alteraciones observadas en las pruebas básicas de función renal son diferentes cuando el RVU es activo en relación con cuando, una vez resuelto, solo persiste la pérdida de parénquima renal residual congénita o adquirida.
Pacientes y métodosDiseñoEstudio descriptivo retrospectivo longitudinal en el que se incluyeron los datos correspondientes a 89 pacientes menores de 16años de edad (46V, 43M) diagnosticados de RVU mediante cistouretrografía miccional seriada entre enero de 2003 y diciembre de 2016. Habían sido seguidos al menos durante 2años en las consultas externas de Nefrología Pediátrica de nuestro hospital y constaba en sus historias clínicas, al menos, la determinación de la osmolalidad urinaria máxima (UOsm) al final del seguimiento. Sesenta y dos pacientes habían sido intervenidos quirúrgicamente y 27 habían recibido tratamiento conservador.
La edad media al diagnóstico fue de 23,9±31,1meses (rango: 0-164meses). Treinta y nueve niños fueron diagnosticados de RVU antes de los 6meses de edad y 50 después de esta edad. Setenta y un pacientes fueron estudiados por padecer una o más ITU. Además, 16 pacientes fueron estudiados al detectarse anomalías morfológicas antenatales en la ecografía (13 hidronefrosis y 3 riñones de pequeño tamaño). La hematuria macroscópica fue el primer signo diagnóstico en los dos pacientes restantes.
El RVU se clasificó en cinco grados (I-V) de acuerdo con la clasificación del Comité Internacional para el estudio del Reflujo (International Reflux Study Committee)14. Cuando el RVU era bilateral (n=43), se le asignó el mayor grado. Diecisiete pacientes se clasificaron como RVU leve (2 gradoI, 15 gradoII), 39 moderado (gradoIII) y 33 severo (27 gradoIV, 6 gradoV).
El RVU se trató de forma conservadora (con o sin profilaxis antibiótica) en 27 pacientes (30,3%), con técnicas de cirugía abierta en 15 casos (16,8%) y con tratamiento cistoscópico en 47 niños (52,8%). El RVU estaba curado a los 5,86±3,65años (rango: 1,06-14,83años). Todos tenían más de dos años de edad al final del periodo de seguimiento (6,28±3,75 años; rango 2-16 años).
Al diagnóstico, se utilizaron los datos de las muestras tomadas más próximas a la cistouretrografía miccional seriada. Las determinaciones de los parámetros funcionales estudiados se obtuvieron al menos 4meses después de que se hubiera superado un episodio de pielonefritis aguda.
Criterios de inclusiónLos criterios de inclusión fueron los siguientes:
- a)
RVU primario diagnosticado mediante cistouretrografía miccional seriada y curado tras tratamiento conservador o quirúrgico.
- b)
Disponer, al menos, de una prueba de imagen (ecografía ó gammagrafía con 99mTc-DMSA [ácido dimercatosuccínico]) en los dos momentos del estudio (al diagnóstico y al final del seguimiento).
- c)
Tener recogido en la historia clínica, al menos, el valor de la UOsm al final del periodo de seguimiento. Además, los datos de las otras pruebas de función renal (cocientes albúmina/creatinina y NAG/creatinina) se utilizaron cuándo estuvieron disponibles
Se excluyeron todos los pacientes mayores de 16años con RVU y todos los niños de cualquier edad diagnosticados de displasia renal multiquística, estenosis pieloureteral o vesicoureteral, valvas de uretra posterior o vejiga neurógena.
Estudios morfológicosSe había realizado una ecografía al diagnóstico en 85 casos y a todos los pacientes al final del seguimiento (n=89). Se diagnosticó hidronefrosis leve en los niños con un diámetro anteroposterior de la pelvis renal entre 0,5 y 2cm, e hidronefrosis moderada-severa cuando dicho diámetro fue ≥2cm. Se realizó una gammagrafía renal con 99mTc-DMSA a 72niños en el momento del diagnóstico y a 80 pacientes al final del seguimiento. Se hizo el diagnóstico de displasia renal congénita cuando se comprobó la existencia de riñones de tamaño reducido con alteraciones morfológicas y una captación menor del 20% en la primera gammagrafía realizada15.
Prueba de concentración con desmopresina (DDAVP)Tras vaciar la vejiga, se administraron 20μg de desmopresina por vía intranasal, 0,2mg (200μg) de desmopresina en tabletas, o bien 0,12mg (120μg) del liofilizado oral (MELT) que se disuelve instantáneamente en la boca. Se recogieron las tres muestras de orina emitidas a continuación, que, en el caso de que el niño fuera continente, estuvieron separadas por intervalos de 90min. Se limitó moderadamente la ingesta de líquidos. En el caso de lactantes entre 1 y 12meses, se administró una dosis intranasal de 10μg de desmopresina por la mañana y se restringieron los biberones a la mitad hasta las 18h para disminuir el riesgo de intoxicación por agua. Se dio como resultado de la prueba el valor máximo de UOsm obtenido11,16.
Procedimientos analíticosLa creatinina urinaria se determinó por un test colorimétrico basado en el método de Jaffe (Creatinine Jaffe Gen.2, Roche). La albúmina se midió usando una técnica nefelométrica (Array) y la actividad de la NAG usando un test colorimétrico basado en la hidrólisis de 3-cresolsulfoneftaleína-N-acetil-β-D-glucosaminidasa (Roche). La UOsm se midió mediante la depresión del punto de congelación en un osmómetro Osmo Station OM-6050 (Menarini Diagnostics).
Valores normalesLos valores normales utilizados como referencia para la UOsm máxima después de desmopresina han sido previamente publicados por nuestro grupo en 125 niños sanos11. Así, para la UOsm, en lactantes de 1 a 3meses el percentil5 es 532mOsm/kg; de 3 a 6meses, 616mOsm/kg; de 6 a 9meses, 645mOsm/kg, y de 9 a 12meses, 740mOsm/kg. En los niños mayores de un año de edad el límite inferior de la normalidad es 800mOsm/kg16. Los valores normales relacionados con la edad utilizados como referencia para los cocientes albúmina/creatinina y NAG/creatinina han sido publicados previamente17.
Análisis estadísticoSe utilizó la prueba de Kolmogorov-Smirnov para analizar la distribución de la muestra. En el análisis descriptivo los resultados se expresaron como porcentajes para las variables categóricas y con el valor medio ±desviación estándar para las variables continuas que seguían una distribución normal. Las variables cuantitativas que no tenían una distribución normal se expresaron como mediana y rango intercuartil (cocientes albúmina/creatinina y NAG/creatinina). Las pruebas ANOVA y Kruskal-Wallis se utilizaron para comparar variables con o sin distribución normal, respectivamente. Las diferencias entre muestras relacionadas se evaluaron mediante las pruebas de Friedman o Wilcoxon. Se empleó la prueba chi-cuadrado para comparar la frecuencia entre grupos de variables cualitativas con la corrección de Yates cuando fue necesario. Se calcularon los índices de eficiencia diagnóstica para comparar los datos del RVU grave con respecto a los de RVU leve-moderado, tanto en situación de RVU activo como de RVU curado. Así, se calcularon la sensibilidad, la especificidad, los valores predictivos positivo (VPP) y negativo (VPN), los cocientes de probabilidad positivo (CPP) y negativo (CPN) y la odds ratio con el 95% del intervalo de confianza de los tres marcadores funcionales estudiados. Los datos se analizaron utilizando el programa estadístico SPSS versión 20.0 (SPSS Inc., Chicago, IL, EE.UU.). El valor de p<0,05 se consideró estadísticamente significativo.
ResultadosSe encontraron hallazgos anormales en las pruebas de imagen en 52 niños en el momento del diagnóstico: riñón displásico (n=14), un área de cicatriz unilateral (n=14), varias áreas de cicatrices (n=11), hidronefrosis leve aislada (n=7), hidronefrosis aislada moderada-grave (n=1), doble sistema colector (n=4) y agenesia renal (n=1). Además, en 14 pacientes se observaron áreas de captación disminuida típicas de pielonefritis aguda en la gammagrafía realizada en fase aguda con 99mTc-DMSA. La imagen del riñón fue normal en el resto de los casos (n=23). De los 14niños con riñón displásico, 10 eran varones, 8 tenían RVU gradoIV y 6 RVU gradoIII.
Al final del periodo de seguimiento, 19 pacientes presentaban una cicatriz unilateral (un paciente asociaba un doble sistema), 16 mostraron varias áreas de cicatrices, 14 eran portadores de un riñón displásico, como se ha indicado, y 9 presentaban riñones atróficos; un paciente tenía una agenesia renal. La morfología renal fue normal en los 30niños restantes (3 con un doble sistema colector). En resumen, 59 pacientes tenían una reducción variable del parénquima renal y 30 poseían un parénquima renal aparentemente intacto.
En la tabla 1 se muestra el análisis cualitativo de los parámetros de función renal en los pacientes agrupados según el grado inicial del RVU, al diagnóstico del RVU y al final del seguimiento. Se observaron diferencias estadísticamente significativas en la UOsm, de tal modo que en el momento del diagnóstico estaba reducida en el 21% de los niños con RVU leve, en el 37% de los niños con RVU moderado y en el 67% de los niños con RVU grave. Al final del seguimiento se observó una diferencia estadísticamente significativa en la frecuencia de pacientes con cociente albúmina/creatinina aumentado en relación con el grado de reflujo: ninguno con RVU leve, 10% de niños con RVU moderado y 39% de niños con RVU severo (tabla 1).
Análisis cualitativo de los parámetros de función renal en relación al grado de RVU en el momento del diagnóstico y al final del seguimiento
| RVUleve | RVUmoderado | RVUsevero | p | ||||
|---|---|---|---|---|---|---|---|
| UOsm máxima al diagnóstico (RVU activo) | Normal 11 | Reducida 3 | Normal 22 | Reducida 13 | Normal 10 | Reducida 20 | 0,008 |
| UOsm máxima al final del seguimiento (RVU curado) | Normal 17 | Reducida 0 | Normal 37 | Reducida 2 | Normal 27 | Reducida 6 | ns |
| Albúmina/creatinina al diagnóstico (RVU activo) | Normal 11 | Elevado 1 | Normal 25 | Elevado 3 | Normal 19 | Elevado 8 | ns |
| Albúmina/creatinina al final del seguimiento (RVU curado) | Normal 16 | Elevado 0 | Normal 30 | Elevado 3 | Normal 23 | Elevado 9 | 0,02 |
| NAG/creatinina al diagnóstico (RVU activo) | Normal 7 | Elevado 0 | Normal 13 | Elevado 6 | Normal 10 | Elevado 4 | ns |
| NAG/creatinina al final del seguimiento (RVU curado) | Normal 8 | Elevado 0 | Normal 22 | Elevado 0 | Normal 18 | Elevado 0 | – |
A partir de los datos mostrados en la tabla 1 se estudiaron los índices de eficiencia diagnóstica para comparar los datos del RVU grave con respecto al RVU leve-moderado en ambos periodos del estudio (tabla 2). La UOsm máxima mostró una sensibilidad del 66,67% para distinguir ambos tipos de RVU, que se redujo al 18,18% al desaparecer el mismo. La sensibilidad de los otros dos parámetros al diagnóstico fue baja. Una vez curado el RVU, la especificidad tanto de la UOsm máxima como del cociente albúmina/creatinina fue superior al 90%, y la del cociente NAG/creatinina, del 100%. La odds ratio fue estadísticamente significativa para la UOsm y la eliminación urinaria de albumina en ambos periodos del estudio (tabla 2).
Resultados obtenidos en los índices de calidad y eficiencia diagnóstica del reflujo vesicoureteral (RVU) grave vs. RVU leve-moderado al diagnóstico y al final del seguimiento, de los parámetros de función renal básica determinados
| S(IC 95%) | E(IC 95%) | VPP(IC 95%) | VPN(IC 95%) | CPP(IC 95%) | CPN(IC 95%) | Odds ratiop(IC 95%) | |
|---|---|---|---|---|---|---|---|
| Osmolalidad urinaria máxima al diagnóstico (RVU activo) | 66,67% (47,19-82,71) | 67,35% (52,46-80,05) | 55,56% (43,73-66,78) | 76,74% (65,74-85,02) | 2,04 (1,27-3,28) | 0,49 (0,29-0,85) | 4,12p=0,004(1,57-10,83) |
| Osmolalidad urinaria máxima al final del seguimiento (RVU curado) | 18,18% (6,98-35,46) | 96,43% (87,69-99,56) | 75,00% (39,11-93,34) | 66,67% (62,82-70,30) | 5,09 (1,09-23,78) | 0,85 (0,72-1,00) | 6p=0,035(1,13-31,7) |
| Albúmina/creatinina al diagnóstico (RVU activo) | 29,63% (13,75-50,18) | 90,00% (76,34-97,21) | 66,67% (40,05-85,69) | 65,45% (59,23-71,19) | 2,96 (0,99-8,87) | 0,78 (0,60-1,02) | 3,78p=0,048(1,00-14,2) |
| Albúmina/creatinina al final del seguimiento (RVU curado) | 28,12% (13,75-46,75) | 93,88% (83,13-98,72) | 75,00% (46,76-91,11) | 66,67% (61,42-71,53) | 4,59 (1,34-15,69) | 0,77 (0,61-0,96) | 6p=0,01(1,48-24,31) |
| NAG/creatinina al diagnóstico (RVU activo) | 28,57% (8,39-58,1) | 76,92% (56,35-91,03) | 40,00% (18,38-66,38) | 66,67% (57,46-74,76) | 1,24 (0,42-3,67) | 0,93 (0,63-1,27) | 1,33ns(0,30-5,83) |
| NAG/creatinina al final del seguimiento (RVU curado) | 0% (0-18,53) | 100% (88,43-100) | – | 62,5% (62,5-62,5) | – | 1 (1-1) | 1,64ns(0,03-86,68) |
CPN: cociente de probabilidad negativo; CPP: cociente de probabilidad positivo; E: especificidad; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
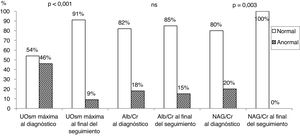
En la tabla 3 se muestra el análisis cuantitativo y cualitativo de los parámetros de función renal en el primer momento (al diagnóstico del RVU) y al final del periodo de seguimiento (RVU curado). Se apreciaron diferencias significativas en los valores cuantitativos de los tres parámetros estudiados. Al diagnóstico, el 46% de los niños mostraron disminución de la capacidad de concentración, el 18% un aumento del cociente albúmina/creatinina y el 20% un incremento del cociente NAG/creatinina. Al final del seguimiento, la capacidad de concentración (UOsm máxima) estaba disminuida en solo el 9% de pacientes y el cociente albúmina/creatinina estaba incrementado en el 15%. Todos los pacientes con RVU curado mostraron un cociente NAG/creatinina normal (fig. 1). De los 8 pacientes con defecto de la capacidad de concentración al final del seguimiento, 7 (87%) mostraron pérdida de parénquima renal (tabla 3).
Análisis cuantitativo y cualitativo de los parámetros de función renal en el momento del diagnóstico del RVU y al final del seguimiento
| Al diagnóstico de RVU(RVU activo) | Al final del seguimiento(RVU curado) | p | |||
|---|---|---|---|---|---|
| UOsm máxima (mOsm/kg)(n=79) | 670,1±245,6 | 927,9±119,3 | <0,001 | ||
| UOsm máxima | Normal 43(54%) | Reducida 36(46%) | Normal 81(91%) | Reducida 8(9%)a | <0,001 |
| Albúmina/creatinina (μg/μmol) (n=66) | 1,93 (3,01) | 1,05 (1,23) | <0,001 | ||
| Albúmina/creatinina | Normal 55(82%) | Elevado 12(18%) | Normal 69(85%) | Elevado 12(15%) | ns |
| NAG/creatinina (U/g)(n=27) | 7,37 (14,98) | 2,48 (1,8) | <0,001 | ||
| NAG/creatinina | Normal 39(80%) | Elevado 10(20%) | Normal 48(100%) | Elevado 0(–) | 0,003 |
Representación gráfica de los porcentajes normales y anormales de los tres parámetros funcionales estudiados en el momento del diagnóstico del RVU y al final del periodo de seguimiento (datos mostrados en la tabla 3).
Al final del estudio, cuando los niños se agruparon en función de que tuvieran o no pérdida de parénquima renal, el número de pacientes con aumento del cociente albúmina/creatinina fue significativamente mayor entre los que tenían pérdida de parénquima (tabla 4).
Estudio cualitativo de los parámetros de función real en relación con la pérdida de parénquima renal, al final del seguimiento (RVU curado)
Los valores de la tasa de filtración glomerular (GFRe) calculados con la fórmula de Schwartz actualizada (2009) no se han presentado en ninguna tabla. Solo 3pacientes tenían un GFRe por debajo de 90ml/min/1,73m2 al final del seguimiento; dos de ellos mostraron una capacidad de concentración disminuida y el cociente albúmina/creatinina incrementado.
DiscusiónMuchos de los pacientes estudiados fueron tratados en una época en que el abordaje terapéutico era diferente al actual. Los niños con RVU a los que se les habían realizado las pruebas de función renal eran aparentemente los que tenían un peor pronóstico. Por esta razón, la incidencia de niños tratados quirúrgicamente (cirugía endoscópica o abierta) fue mayor de lo que se observa habitualmente en nuestros hospitales y la frecuencia de cicatrices al final del periodo de seguimiento, superior a lo descrito en estudios longitudinales sobre el tema18,19. En estos, la frecuencia de nuevas cicatrices fue de alrededor del 10%18,19.
Como se indicó en la Introducción, el término pielonefritis crónica fue el primero que se utilizó para describir las lesiones residuales ocurridas después de padecer una o más ITU febriles1. Es difícil entender hoy en día que las lesiones renales observadas en las autopsias de niños fallecidos de pielonefritis aguda pudieran mostrar bacterias junto a áreas de fibrosis y de pérdida nefronal; estos mismos hallazgos se encontraron en estudios experimentales en animales a los que se les inducia una ITU, y esto puede deberse a la falta de antibióticos efectivos al inicio y a que no eran capaces de penetrar en el tejido cicatricial20. Esta persistencia de bacterias apuntaría a la existencia de una población bacteriana remanente en el parénquima y pelvis renales, que permanecería algún tiempo después de una ITU febril y que podría ser la causa de recurrencias en algunos pacientes.
Como se ha indicado, la aparente asociación entre pielonefritis crónica y RVU se denominó nefropatía de reflujo3. Se trata de un término radiológico que traduce una pérdida de parénquima y que es confuso por varias razones. Por un lado, las anomalías del desarrollo renal caracterizadas por pérdida de parénquima renal (displasia e hipoplasia) son coincidentes con el RVU; la displasia renal se asocia generalmente a RVU masivo, más frecuentemente unilateral y en varones8,9. El RVU no es por sí mismo la causa de la displasia renal, sino que se trata de una asociación de dos anomalías congénitas del riñón y tracto urinario (Congenital Anomalies of the Kidney and Urinary Tract [CAKUT]), lo que es relativamente frecuente en humanos. En uno de los mejores comentarios editoriales publicados sobre el tema, Fernández Menéndez y Málaga Guerrero21 escribieron que el término nefropatía de reflujo es equívoco y que «todavía hoy, demasiadas veces, se utiliza esa inadecuada y confundidora expresión. Erradicar por completo su uso será posible cuando dejemos de estar confundidos». Por otro lado, como se ha indicado en la Introducción, el requisito para desarrollar una cicatriz renal después de una ITU febril es la inflamación en sí misma y no la presencia de RVU4. A finales de la década de los cincuenta del siglo pasado Shapiro et al.6 demostraron experimentalmente en ratas que no tenían RVU que, al inducir en ellas experimentalmente el desarrollo de una pielonefritis, se producía una reacción inflamatoria que terminaba produciendo una cicatriz20. En este sentido, una cicatriz es una pérdida de parénquima cortical renal con fibrosis secundaria como respuesta del sistema inmunológico a la invasión bacteriana, independientemente de la existencia o no de hiperpresión en la vía urinaria22. Por tanto, se sabe que el RVU no es la causa última de las cicatrices4-7,20,23. Sin embargo, se ha descrito un mayor riesgo de cicatrización renal en pacientes con RVU y dilatación del tracto urinario24. Sabiendo que el RVU no es una condición necesaria para la formación de cicatrices, es comprensible indagar en la razón por la que la intensidad del RVU puede asociarse con un mayor riesgo de aparición de cicatrices. Quizá la explicación resida en que las pielonefritis que ocurren en pacientes con RVU y dilatación de las vías urinarias son causadas, por razones desconocidas, por bacterias más virulentas25,26.
Con respecto a las pruebas funcionales renales básicas, durante la década de los sesenta se publicó un estudio experimental en perros en el que se observó una disminución de la capacidad de concentración renal tras la producción de una obstrucción ureteral27. Más tarde, la disponibilidad de desmopresina permitió a los investigadores medir la UOsm máxima, con lo que se demostró que se reducía en pacientes tanto adultos como en niños con obstrucción pieloureteral28. Posteriormente, la asociación entre RVU y capacidad de concentración reducida ha sido descrita en algunos trabajos10,11,29.
En los últimos años se han estudiado los mecanismos renales que explican la alteración en el manejo renal del agua en pacientes con aumento de la presión en el tracto urinario. Así, se ha publicado la existencia de una disminución en la actividad de algunos transportadores tubulares de sodio30, una disminución en la expresión de transportadores de urea31 y una reducción en la actividad de las acuaporinas del túbulo colector30. Específicamente, en el RVU experimental se ha descrito una reducción de la expresión de las acuaporinas1 y232. Todos estos cambios funcionales favorecen la aparición de poliuria y pérdida salina.
En este sentido, en nuestra muestra la disminución en la capacidad de concentración fue la alteración funcional más frecuente en pacientes con RVU activo (tablas 1-3; fig. 1) y fue más importante en los que padecían un RVU grave (tabla 2). Por tanto, una UOsm máxima reducida fue la alteración funcional más frecuente en pacientes afectos de lo que podríamos denominar como la auténtica nefropatía de reflujo. Sin embargo, una vez curado el RVU, la capacidad de concentración (UOsm máxima) mejoró (tabla 2) y el número de niños con defecto de concentración se redujo desde el 46 al 9% (tabla 3; fig. 1). De los 8niños con defecto de concentración persistente, 7 tenían asociado algún daño demostrable en el parénquima renal (tabla 3).
Se ha publicado que un aumento de la excreción de albúmina es un signo temprano de daño glomerular tanto en enfermedades sin pérdida nefronal (nefropatía diabética, obesidad) como cuando existe reducción de nefronas, así como un buen predictor del desarrollo de enfermedad cardiovascular. En pacientes con RVU se ha descrito previamente un aumento de la excreción de albúmina12, aunque sin aclarar si está en relación con la pérdida de parénquima o con un aumento de presión en la vía urinaria.
En nuestra serie, el aumento de la albuminuria fue la alteración más frecuentemente observada en niños con pérdida parenquimatosa, una vez curado el RVU (tabla 3). Aún más, los pacientes que habían tenido un RVU más severo al principio presentaban una mayor excreción de albúmina al final del seguimiento (tablas 1 y 2) que estaba relacionada con la pérdida concomitante de parénquima.
En relación con la NAG, desde los años sesenta del pasado siglo se sabe que procede del tejido renal33, ya que se encuentra en los lisosomas de las células del túbulo proximal; cuando estas células se dañan, se libera a la luz tubular y se produce un aumento de su excreción34. En un principio se utilizó para evaluar la nefrotoxicidad de los antibióticos aminoglucósidos, pero los niveles de NAG también pueden elevarse en pacientes con incremento de la presión intratubular, como sucede en las obstrucciones del tracto urinario35 y en el RVU13. Se ha discutido si este aumento de la excreción urinaria de NAG se debe a las altas presiones o a una disminución de la tasa de filtración glomerular12. En nuestra muestra se observó un aumento en la eliminación urinaria de NAG en el 20% de los casos de RVU activo que debe estar en relación con el incremento de presión, ya que se normalizó en todos los pacientes una vez que se había curado el RVU, lo que se tradujo en una especificidad del 100% (tablas 1-3, fig. 1).
En resumen, desde el punto de vista funcional, la nefropatía de reflujo es real y concurre cuando el RVU es activo y se traduce, fundamentalmente, en una disminución de la capacidad de concentración renal. Por otra parte, un aumento de la excreción de albúmina es la alteración más frecuente en la nefropatía cicatricial (una vez que el RVU se ha curado) que se relaciona con el daño residual parenquimatoso. Aunque estas dos nefropatías son muy próximas, no deberían circunscribirse en un solo término porque producen alteraciones funcionales diferentes en circunstancias morfológicas distintas, es decir, con RVU activo y con RVU curado. Finalmente, el término nefropatía displásico-cicatricial es, seguramente, más apropiado que el de nefropatía cicatricial en los pacientes con RVU curado, pérdida de parénquima y alteración de la función renal.
Además del diseño retrospectivo, las limitaciones de este estudio son la ausencia de la realización de estudios morfológicos y/o funcionales a algunos de los pacientes en ambos periodos evolutivos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.