Introducción
Las posibilidades actuales de nutrir artificialmente a los pacientes pediátricos han disminuido la tasa de morbimortalidad en todos los ámbitos de la Pediatría, pero quizás este efecto es más evidente en las unidades de cuidados intensivos pediátricos (UCIP)1-4. La decisión de indicar nutrición enteral (NE) o parenteral (NP) está condicionada por el estado nutricional, las necesidades del paciente, el grado de funcionalidad del tracto gastrointestinal y el tipo de patología. En el momento actual, las fórmulas, las indicaciones y los sistemas de administración de la nutrición artificial (NA) son bien conocidos en las UCIP. No obstante, no existe unanimidad de criterios ni protocolos universalmente aceptados sobre el uso de NE y NP. Además, la incidencia real de complicaciones atribuibles a la NA no está bien establecida.
Por ello, el Grupo de Trabajo de Nutrición de la Sociedad Española de Cuidados Intensivos Pediátricos ha realizado un estudio que indique la situación actual y facilite datos para elaborar, en un futuro, los protocolos de actuación más adecuados. Los objetivos han sido estudiar las indicaciones actuales de la NE y de la NP en las UCIP, valorar las vías y las pautas de administración del aporte nutricional empleado, analizar las complicaciones más frecuentes de la NA teniendo en cuenta la patología, la disfunción de órganos, la puntuación de riesgo de mortalidad pediátrica, las técnicas y las pautas de administración de las fórmulas nutricionales.
Material y métodos
Estudio prospectivo, descriptivo, multicéntrico y abierto, en el que han participado las UCIP y las UCI mixtas (pediátricas/neonatales) de 23 hospitales de España. Durante el mes de abril de 2003 se recogieron los datos de todos los pacientes ingresados que precisaron durante su estancia en cuidados intensivos alguna forma de NA. Se excluyeron los pacientes con estancias inferiores a 24 h (incluyendo los que fallecieron en las primeras 24 h), y los que ingresaron para monitorización o técnicas diagnósticas y/o terapéuticas.
Cada paciente podía recibir diferentes tipos de nutrición durante el mes del estudio y cada UCIP fue libre de elegir tanto la forma de nutrición como la fórmula comercial empleada, incluyendo la posibilidad de añadir suplementos proteicocalóricos o electrolitos.
En cada caso se recogieron los datos de filiación y antropometría, diagnóstico al ingreso y problemas en UCIP, tipo de nutrición artificial y vías de administración, evaluación de gravedad (mediante la escala pediátrica de riesgo de mortalidad [PRISM-III] y escala de disfunción de órganos), medicación administrada y técnicas de soporte aplicadas durante el máximo aporte calórico, y aporte nutricional y complicaciones atribuibles a cada forma de NA.
El estudio finalizó cuando terminó la NA, el paciente fue dado de alta de UCIP o al mes de la inclusión en protocolo.
Resultados
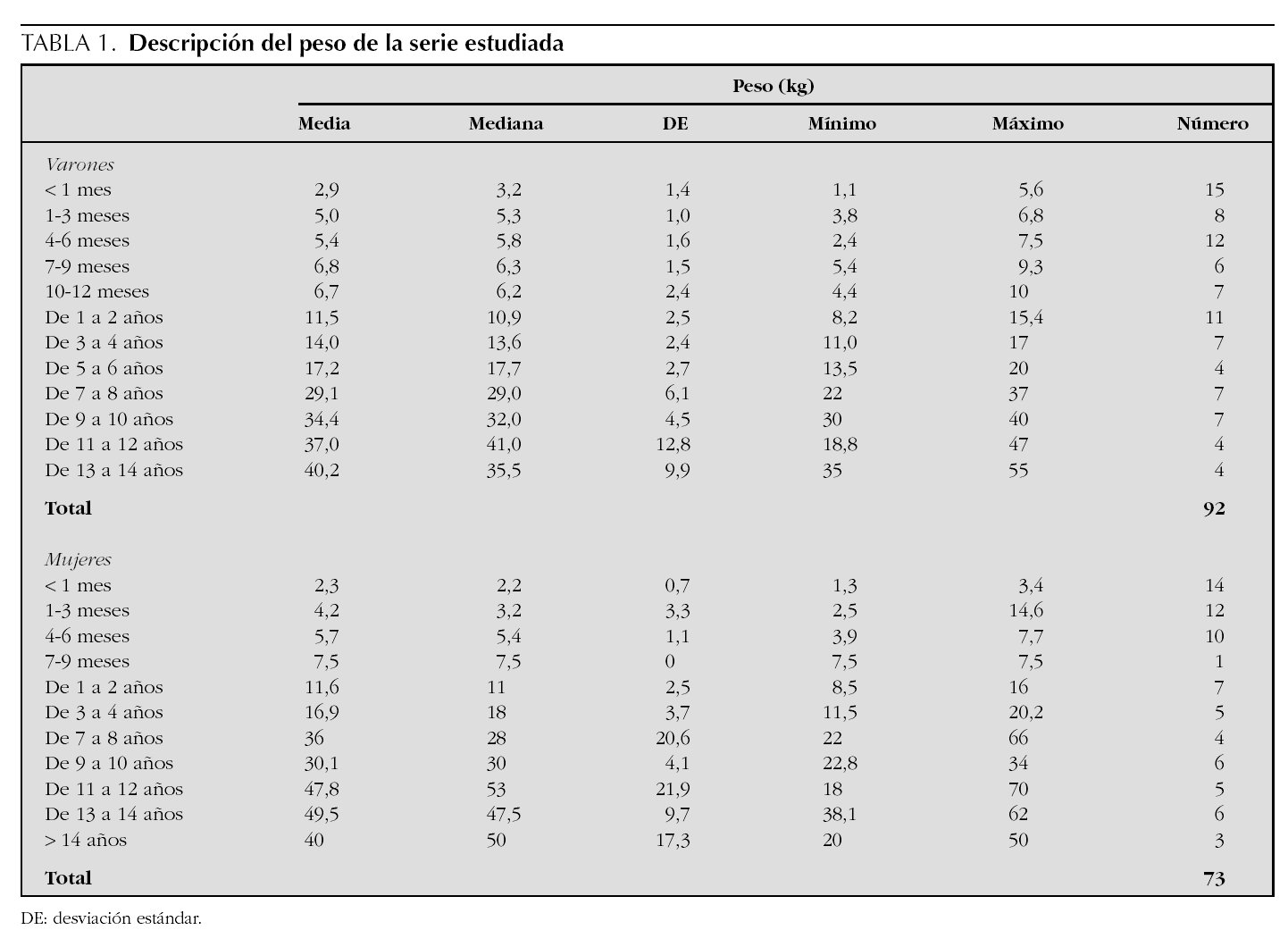
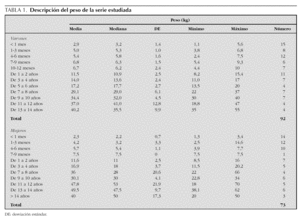
Durante el período comprendido entre el 1 y el 30 de abril de 2003 ingresaron 769 niños críticos en las UCIP participantes. De éstos, se seleccionaron para el estudio 165 pacientes (21,4 %), de los cuales 106 recibieron NE y 80 NP en algún momento de su estancia en UCIP. La estancia media fue de 11 días y tuvieron la siguiente distribución por edades: 85 niños (51,4 %) menores de un año (de ellos, el 37,5 % < 1 mes); 32 (19,4 %), entre 1 y 5 años; 26 (15,7 %), de 5 a 10 años, y 22 (13,4 %), más de 10 años. Respecto al sexo, 92 fueron varones (55,2 %) y 73 (44,8 %), mujeres. En la tabla 1 se describe el peso de los pacientes del estudio estratificado por edad y sexo.
De acuerdo con la novena edición de la Clasificación Internacional de Enfermedades (CIE-9), los diagnósticos principales al ingreso en UCIP fueron las siguientes patologías: respiratoria, 18,6 %; infecciosa, 14 %; hemodinámica y cardiopatías, 12,7 %; neurológica, 11,9 %; digestiva, 11 %; hemopatías, 5,2 %; anomalías congénitas no cardíacas, 5 %; politraumatismos, 3,6 %; neoplasias, 3,3 %; y otras patologías, 14,7 %.
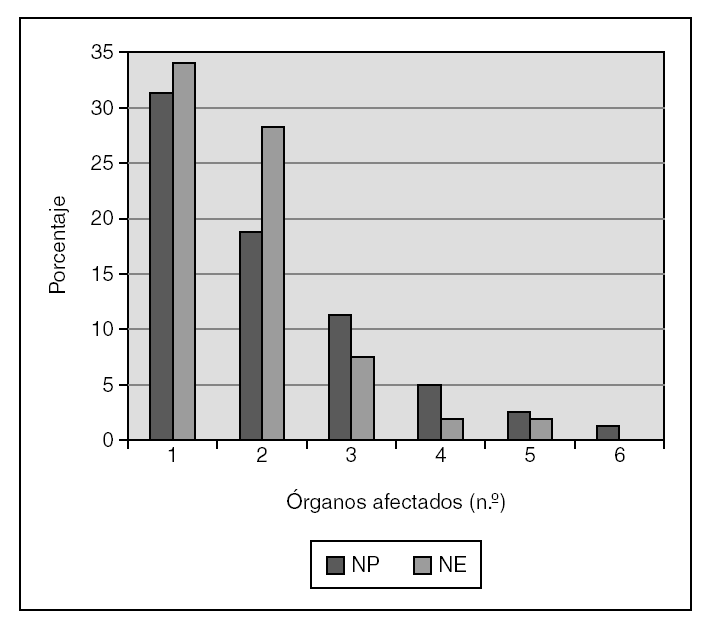
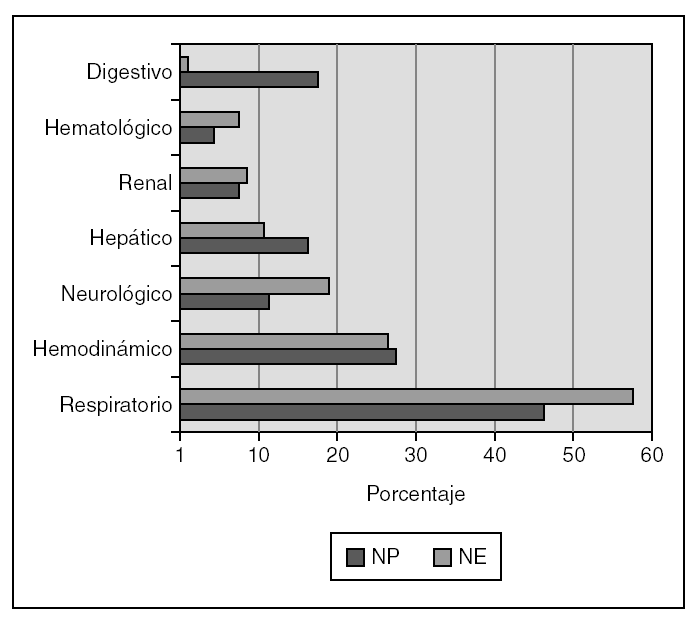
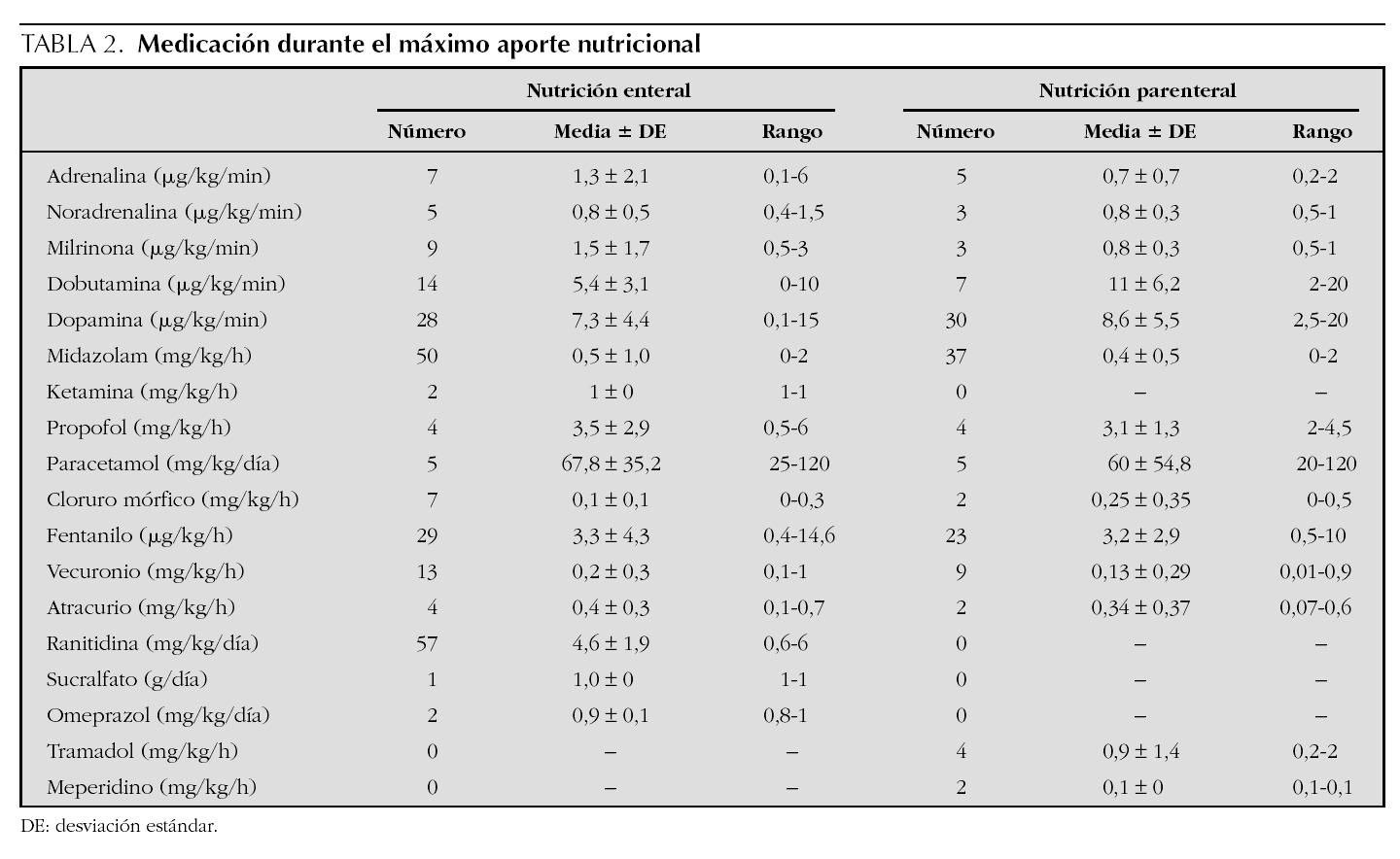
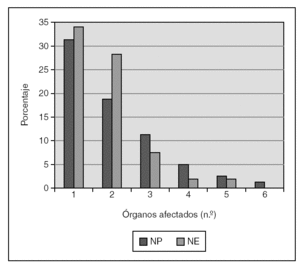
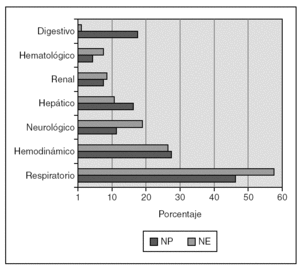
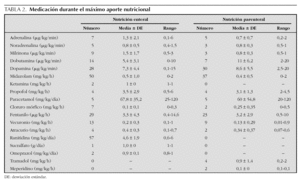
Respecto a los parámetros utilizados para evaluar la situación clínica de cada paciente y su gravedad en el momento del máximo aporte calórico, la puntuación media de PRIMS-III fue 7,1 en NP (mediana, 5; máximo, 30) y de 6,3 en los pacientes en NE (mediana, 5; máximo, 31). La figura 1 recoge el número de órganos afectados en el momento del máximo aporte calórico. En la figura 2 se detallan los órganos o sistemas afectados en cada caso. En la tabla 2 se resumen los tratamientos farmacológicos más relevantes en cada grupo. En lo que se refiere a las técnicas de soporte en UCIP, durante el máximo aporte nutricional recibían ventilación mecánica 58 pacientes con NE (54,7 %) frente a 33 con NP (41,3 %) y hemofiltración cuatro con NE (3,8 %) frente a 7 con NP (8,8 %).
Figura 1. Número de órganos afectados en el momento de máximo aporte calórico durante nutrición parenteral (NP) y enteral (NE).
Figura 2. Órganos y sistemas afectados en el momento de máximo aporte calórico durante nutrición parenteral (NP) y enteral (NE).
Dado que cada paciente pudo recibir varias formas de NA durante su estancia en UCIP, el análisis final engloba un total de 219 protocolos de nutrición. En los 106 pacientes en los que se usó la NE, la forma más común de administración fue la nasogástrica continua, utilizada en 72 pacientes (67,9 %), seguida de la nasogástrica intermitente en 29 casos (27,4 %); el 16 % recibió NE vía nasoyeyunal (17 pacientes) y sólo 3 casos por gastrostomía (2,8 %). Las técnicas de perfusión más utilizadas fueron mediante bomba volumétrica (68,9 %), bomba peristáltica (13,2 %), administración por gravedad (7,5 %) y en 11 pacientes no constaba el sistema de administración. En cuanto a la sonda nasogástrica/nasoyeyunal fue lastrada en 15 casos y con fiador en 24, con un calibre menor o igual de 8 Fr en el 61 % de los casos. Como suplementos de la fórmulas comerciales se utilizaron dextrinomaltosa en 6 casos, MCT en 5 casos, dextrinomaltosa + MCT en 2 casos, LCT en un caso, oligopéptidos en 2 casos y cloruro potásico en un paciente.
Respecto a los pacientes que precisaron NP, en la mayor parte de los casos se administró, al menos en algún momento de su estancia en UCIP, por vía central (69 pacientes, que corresponden al 86,4 % de los casos). La vía más comúnmente utilizada fue la vena femoral (27,5 %), seguida de la yugular interna (21,3 %), la basílica (13,8 %), la subclavia (8,8 %) y la umbilical (7,5 %). La NP fue periférica en el 12,6 % de los casos (10 pacientes) y epicutánea en el 3,8 % (3 casos), no constando la vía en dos. El tipo de catéter utilizado fue de tres vías en 14 casos (17,5 %), dos en 36 casos (45,5 %) y uno en 20 casos (25 %); y no constaba en 10 casos. Finalmente, en 51 pacientes se utilizó bolsa única de NP, en 26 bolsas independientes para lípidos, en 3 casos no constaba.
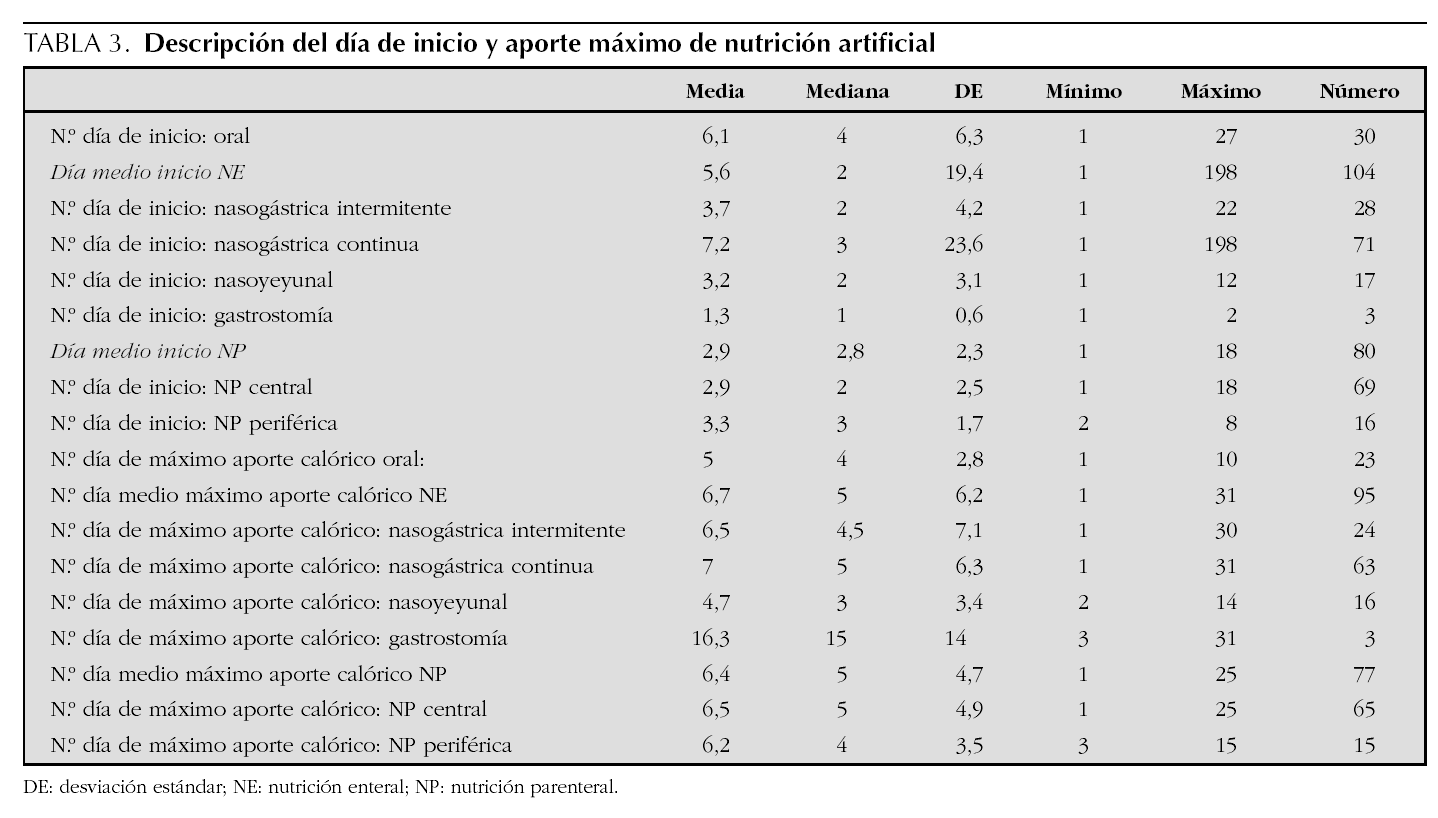
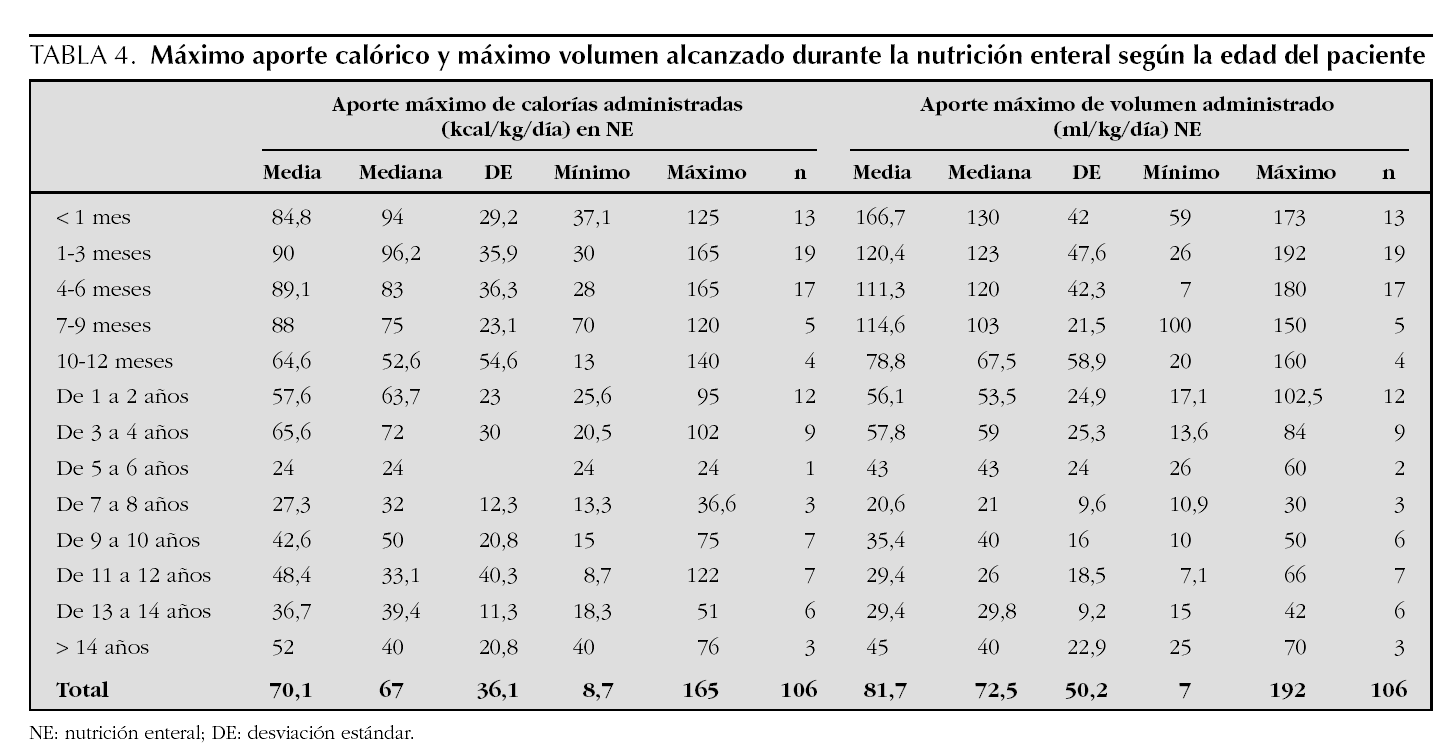
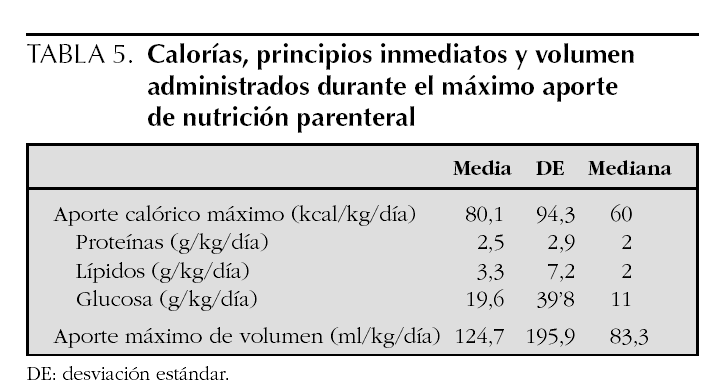
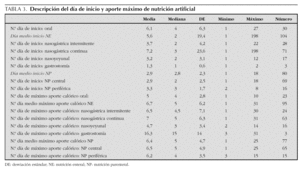
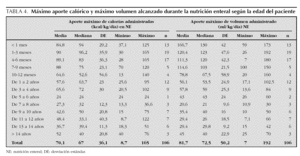
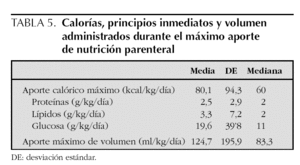
En la tabla 3 se reseña el día de inicio de las diferentes modalidades de nutrición artificial y el día en que se alcanzó el máximo aporte calórico en cada una de ellas. Las tablas 4 y 5 resumen el máximo aporte de calorías y líquidos en cada forma de nutrición. En el caso de la NE (tabla 4), los resultados están desglosados en función de la edad, para disminuir la dispersión de los datos, mientras que para la NP (tabla 5) se detalla la proporción entre los diferentes principios inmediatos.
La duración media de cada tipo de nutrición en UCIP fue 8,8 ± 9,3 días en NE y 7,3 ± 6,6 días en NP. Dentro de la NE, la duración media fue superior en los pacientes con gastrostomía (21 días), seguida por la NE nasogástrica continua (8,5 días) y nasoyeyunal (7,9 días), siendo menor en los que recibían NE nasogástrica intermitente (7 días). Finalmente, la duración media de la NP central fue de 7,4 días frente a 6,3 días en los que recibían NP periférica.
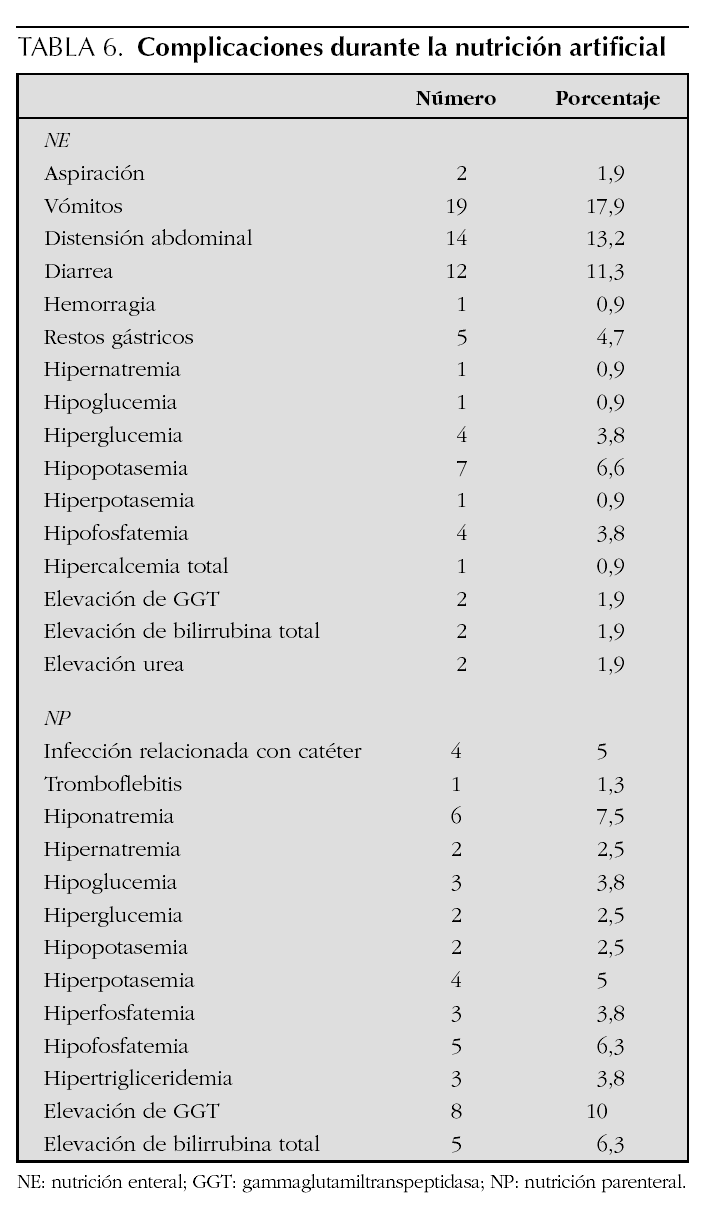
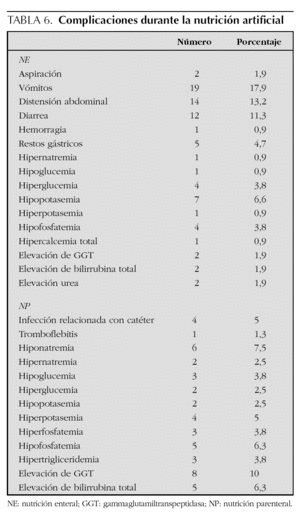
En la tabla 6 se reseña la incidencia de complicaciones durante la NA. Independientemente de ello, 20 pacientes precisaron interrumpir la NE durante más de 6 h por vómitos (9,4 %), distensión abdominal (8,5 %), diarrea (3,8 %) o restos gástricos (3,8 %). Las complicaciones asociadas a la NP fueron menos frecuentes pero más graves.
Los motivos de finalización del estudio fueron en 105 (63,6 %) alta en UCIP; finalización de la NA 24 casos (14,5 %); estancia de más de un mes 18 (10,9 %), mientras que no constaba en cinco (3 %). Trece pacientes (7,9 %) murieron dentro de los límites del estudio, sin relación con el tipo de NA. Las causas fueron: complicaciones en el postoperatorio de neurocirugía, fibrilación ventricular, shock cardiogénico, reagudización de fallo hepático en cirrosis hepática, encefalopatía terminal en enfermedad de Leigh, muerte encefálica (hipertensión intracraneal).
En el caso de la NE, el motivo de finalización fue el alta de UCIP en el 50 % de los casos, en el 24,5 % el paso a nutrición oral, y en el 2,8 % por necesidad de pasar a NP; un 7,5 % murieron; en el 6,6 % no se completaron los datos del estudio. El motivo de la retirada de la NP fue en el 32,5 % alta de UCIP, paso a NE en el 22,5 %, paso a nutrición oral en el 31,3 % y muerte del paciente en el 10 %.
Discusión
El incremento de la supervivencia en el paciente crítico ha sido posible en parte por el desarrollo de las técnicas de nutrición. La frecuente infranutrición o malnutrición condicionada por un estado hipermetabólico, con necesidades nutricionales elevadas y disminución de la capacidad de utilización del sustrato energético, se asocia a un incremento de la morbimortalidad. Se ha demostrado que el soporte nutricional y metabólico precoz evitan esta situación; no obstante, también la sobrenutrición conlleva mayor riesgo de mortalidad1,5, ya que el exceso nutricional durante el estrés metabólico puede producir alteraciones en la fisiopatología pulmonar y hepática y, por tanto, debe ser evitada.
Al analizar los resultados de este estudio multicéntrico, prospectivo, de un mes de duración, llama la atención que sólo el 21,4 % de los pacientes ingresados precisara algún tipo de NA. Se trataba de enfermos con una media de estancia prolongada (11 días), la mayoría menores de un año de vida y con un peso medio igual o inferior a P25 (tabla 1). Es posible que esta baja tasa de NA corresponda a la rápida capacidad de recuperación de la población pediátrica frente a cualquier agresión, que permite reiniciar la alimentación normal precozmente, pero también puede indicar una infrautilización de la NA. En cualquier caso, consideramos que debe ser un fiel reflejo de la práctica asistencial de nuestro medio, ya que las 23 UCIP incluidas en el estudio son una muestra bastante representativa de la asistencia intensiva en nuestro país.
Al plantearse la NA en las UCI hay una gran variabilidad en la indicación de un tipo u otro de soporte nutricional6-9, si bien las guías de práctica clínica recomiendan el uso precoz de la NE más que el de la NP10. Esto se debe a que la ruta enteral es más fisiológica: ejerce una importante acción trófica sobre la mucosa intestinal, que mantiene así su papel barrera reduciendo la translocación bacteriana y la entrada de patógenos en la cavidad peritoneal y la circulación2,3,11,12. Mantener un aporte de al menos el 10-15 % de las necesidades calóricas por vía enteral, además de preservar la función intestinal, simplifica el manejo de fluidos y electrolitos y estimula la actividad neuronal no luminal2,4,13. Sin embargo, la interrupción frecuente de la NE por complicaciones gastrointestinales u otros problemas puede originar una nutrición subóptima que incida de forma negativa en la evolución6-8,14.
En el momento actual en las UCIP hay un incremento de la indicación precoz de NE en el niño crítico con disminución significativa de la NP, y con esta metodología se han observado menos complicaciones y menor coste económico15-20. La NP queda cada vez más reservada para pacientes con lesiones intestinales isquémicas, íleo obstructivo, para los que no toleran o bien tienen complicaciones con la nutrición transpilórica y en los que tampoco es posible la nutrición mixta (NP + NE). Nuestros resultados, con 106 pacientes que recibieron NE frente a 80 que recibieron NP, demuestran aún una alta tasa de utilización de NP en nuestro medio. Esto no puede explicarse por las características de los pacientes, dado que la tasa de patología digestiva como causa de ingreso o el desarrollo de problemas digestivos en la evolución no fue muy significativa; tampoco la gravedad de los pacientes, estimada a través de la PRIMS-III, difirió mucho entre ambos grupos de nutrición al igual que distribución de los diagnósticos al ingreso.
En lo que respecta al perfil de seguridad, los resultados de nuestra serie coinciden con los descritos en otras series21-24 (tabla 6). En la serie de NE las principales complicaciones fueron locales (vómitos, distensión abdominal, diarrea, restos gástricos) y aunque el 18,8 % requirieron interrupción frecuente de la NE durante más de 6 h, en general estos riesgos no contraindican la NE, sino que aconsejan tener una vigilancia cuidadosa para evitar los efectos secundarios. Con respecto a la NP, las complicaciones fueron menos frecuentes pero potencialmente mucho más graves, destacando las infecciones relacionadas con el catéter central, tromboflebitis, la presencia de alteraciones bioquímicas agudas y una elevada incidencia de colestasis.
Parece pues que el uso de una técnica u otra de NA depende más de la rutina de cada unidad que de las limitaciones de cada técnica o de sus posibles riesgos. En ese sentido, es destacable como durante el máximo aporte calórico, los pacientes con NE precisaban dosis más elevadas de adrenalina, noradrenalina y milrinona, como signo de una importante inestabilidad hemodinámica. Ello indica que los pacientes en situación de shock pueden tolerar la NE, incluso hasta su fallecimiento, a pesar de que la hipoperfusión intestinal generada por la situación hemodinámica puede teóricamente disminuir la tolerancia digestiva. Tampoco hubo diferencias en las dosis de sedoanalgesia y miorrelajantes entre los dos grupos, o en el uso de ventilación mecánica. De hecho, tan sólo en el 2,8 % de los pacientes fue preciso interrumpir la NE por intolerancia digestiva. Existió una cierta tendencia a retrasar el inicio de la NE respecto a la NP, salvo en los pacientes con gastrostomía previa, a pesar que con la NE se alcanzó más rápidamente el máximo aporte calórico.
En un estudio multicéntrico comparando la eficacia y las complicaciones de la nutrición nasoyeyunal precoz con la nasogástrica precoz en adultos, se ha demostrado cómo la primera tiene una menor tasa de complicaciones gastrointestinales, con una menor incidencia de restos gástricos, permitiendo administrar un mayor aporte de volumen, todo ello con una incidencia similar de neumonía nosocomial25,26. Sin embargo, la nutrición enteral nasogástrica continua fue la más frecuente utilizada en nuestra serie, indicándose la vía transpilórica tan sólo en el 16 % de los pacientes. La mayoría de éstos recibieron NE por bomba volumétrica, lo que permite una dosificación más exacta.
Con respecto a la NP, se administró por vía central en la mayor parte de los casos, lo que si bien permite mayores aportes de nutrientes en un volumen más reducido, aumenta la posibilidad de complicaciones graves relacionadas con la vía de perfusión, si bien el tiempo que se mantuvo no fue excesivamente prolongado (alrededor de una semana) y algo inferior al tiempo de NE. No existió unanimidad de criterios a la hora de emplear bolsa única de NP o bolsas separadas con aporte de lípidos independiente. En contra de lo esperable, se alcanzó un mayor aporte calórico en NP frente a NE, si bien a expensas de un aporte hídrico mucho más elevado en el primer grupo. Hay que tener en cuenta que el cálculo de las necesidades energéticas en el niño crítico es complicado y controvertido. Algunos autores han intentado adecuar el aporte calórico al consumo mediante la calorimetría indirecta. Sin embargo, la complejidad de esta técnica y el hecho de que la mayoría de unidades de UCIP no disponen de ella, condicionan que no se utilice de forma sistemática para ajustar los aportes energéticos en todos los pacientes.
Las diferentes fórmulas teóricas no han demostrado suficiente fiabilidad cuando se han comparado con la calorimetría indirecta: en nuestro medio, el cálculo teórico más frecuentemente utilizado fue la fórmula de Holliday, que permite estimar a partir del peso del paciente el aporte calórico normal desde el recién nacido hasta el adulto. Este método, aunque no se ha validado con la calorimetría puede ser eficaz modificándolo según el grado de intensidad y las técnicas de soporte del paciente, ya que es bien tolerado y no produce sobrecarga metabólica27.
En conclusión, al menos hasta una quinta parte de los pacientes pediátricos ingresados en las UCIP precisarán en algún momento algún método de NA, sobre todo si son menores de un año. Aunque el uso de la NE empieza a ser mayoritario, es precisa una concienciación del personal que atiende a estos pacientes para fomentar, no sólo su uso frente a la NP, sino también su implantación más precoz, siendo posible conseguir aportes calóricos adecuados con NE, incluso en pacientes con disfunción hemodinámica o en aquellos que precisan grandes dosis de sedoanalgesia. Las complicaciones se producen en pocos casos y son en general poco importantes, por lo que la NE debe ser en principio el sistema de elección de alimentación artificial en cuidados intensivos pediátricos.
El mayor conocimiento de las enfermedades de los pacientes ingresados en UCIP y sus necesidades nutricionales son de gran utilidad para tratar de elaborar en el futuro protocolos de actuación y diseñar fórmulas específicas para las patologías más graves.
Grupo de Trabajo de Nutrición. Sociedad Española de Cuidados Intensivos Pediátricos
Unidades de UCIP participantes: Hospital 12 de Octubre (I. Sánchez); Hospital Carlos Haya (C. Calvo Macías); Hospital Central Asturias (C. Rey); Hospital de Cruces (M.ªT. Hermana); Hospital Donostia (J. Landa); Hospital General de Alicante (R. Rey Sáez); Hospital Gregorio Marañón (J. López-Herce); Hospital Infanta Cristina (J.M. Espinosa Ruiz); Hospital La Paz (P. Dorao); Hospital Parc Taulí (T. Gili); Hospital Puerta del Mar (A. Hernández); Hospital Ramón y Cajal (I. De Martos); Hospital Reina Sofía (J.L. Pérez Navero); Hospital San Cecilio (A. Ruiz Extremera); Hospital Sant Joan de Déu (M. Pons); Hospital Santa Creu i Sant Pau (J. Nadal); Hospital Santiago de Compostela (L. Redondo); Hospital Torrecárdenas (M. González-Ripoll); Hospital Vall d'Hebron (M. Pujol); Hospital Virgen de la Arrixaca (P. Torres); Hospital Virgen de la Salud (J.A. Alonso Martín); Hospital Virgen de las Nieves (J. Gualda Cantó); Hospital Virgen del Rocío (M.ªC. Mercader Carranza); Hospital Xeral Cíes (A. Reparaz Romero).