la determinación de la enzima tiopurina metiltransferasa (TPMT) nos permite pautar la dosis inicial individualizada de azatioprina (AZA). Las determinaciones de los metabolitos tiopurínicos de la AZA, la 6-tioguanina (6-TGN) y la 6-metilmercaptopurina (6-MMP) se han descrito como nuevos marcadores de la actividad del fármaco.
Objetivosdescribir el fenotipo de TPMT en nuestra población y relacionar los valores de los metabolitos tiopurínicos con la actividad terapéutica y los efectos adversos.
Material y métodosse recogieron retrospectivamente los valores de TPMT de 107 pacientes y de 6-TGN y 6-MMP de 18 pacientes en tratamiento con AZA (8 con enfermedad de Crohn, 5 con colitis ulcerosa y 5 con hepatitis autoinmune).
Resultadosla media de determinación de TPMT fue 20,19U/ml. Ninguno presentó actividad de TPMT menor que 5U/ml. De los 18 pacientes, 13 mostraron concentraciones subterapéuticas de 6-TGN (<235pmol/8×108 hematíes). El 45% de los pacientes mantuvieron remisión clínica. La media de concentración de 6-TGN en los pacientes en remisión fue 259pmol/8×108 hematíes frente a 209pmol/8×108 hematíes en los no respondedores (p=0,37). Hay una relación inversa (r=−0,28) entre los valores de TPMT y los de 6-TGN. En 6/18 pacientes encontramos toxicidad: 5 con leucocitopenia y uno con hiperamilasemia.
Conclusionesla determinación de TPMT y la monitorización de los metabolitos tiopurínicos nos permite optimizar tratamiento con AZA, aunque son necesarios nuevos estudios que permitan el correcto conocimiento de los intervalos de efectividad terapéutica y toxicidad.
Individualised doses of azathioprine (AZA) may be prescribed by monitoring the levels of the enzyme thiopurine methyltransferase (TPMT). The measurements of thiopurine metabolites of AZA, 6-thioguanine (6-TGN) and 6-methylmercaptopurine (6-MMP), have also been reported as new markers of AZA activity.
ObjectivesTo describe TPMT phenotype in our population and to establish a relationship between thiopurine metabolites,and therapeutic activity and adverse effects.
Material and methodsData on TPMT were retrospectively collected from 107 patients, and 6-TGN and 6-MMP levels in 18 patients currently on treatment with AZA (Crohn's disease 5, ulcerative colitis 5, autoimmune hepatitis 5).
ResultsMean value of TPMT was 20.19U/ml. None of the patients had a TPMT activity<5U/ml. Of the 18 patients on treatment, 13 showed sub-therapeutic levels of 6-TGN (<235pmol/8×108 red blood cells). Clinical remission was maintained in 45% of patients. Mean levels of 6-TGN in patients with clinical remission were 259pmol/8×108 red blood cells versus 209pmol/8×108 red blood cells in non-responders (p=0.37). There was an inverse relationship (r=−0.28) between TPMT and 6-TGN levels. Toxic effects occurred in 6 of 18 patients, with leukopenia in 5 and hyperamylasemia in 1.
ConclusionsDetermination of TPMT and monitoring of thiopurine metabolites allows AZA treatment to be optimised, although further studies are necessary to establish therapeutic effectiveness and toxicity ranges.
La azatioprina (AZA) y su derivado la 6-mercaptopurina (6-MP) son análogos de las purinas con actividad inmunomoduladora, empleadas en el tratamiento de la enfermedad inflamatoria intestinal y en otras entidades como la hepatitis autoinmunitaria.
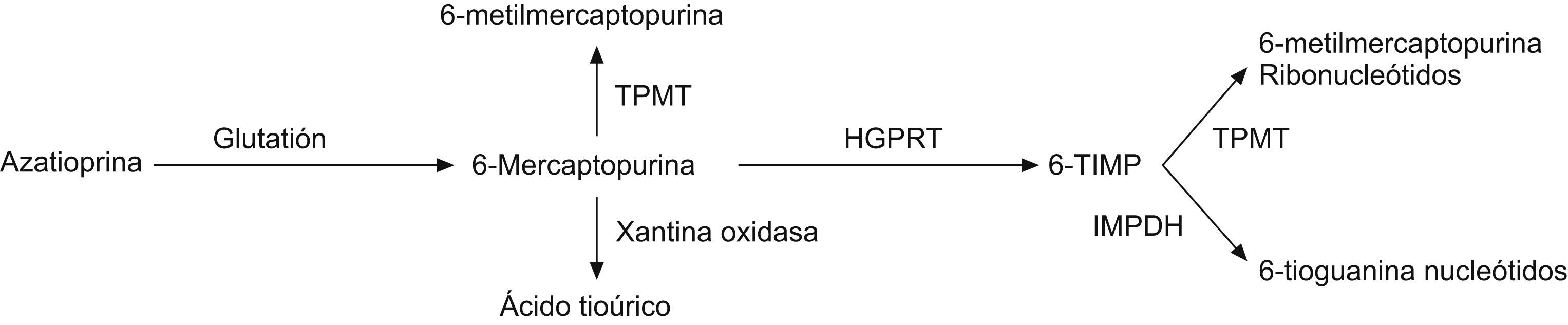
La AZA se metaboliza inicialmente a 6-MP, y mediante la enzima tiopurina metiltransferasa (TPMT) se transforma en sus metabolitos inactivos, la 6-metilmercaptopurina (6-MMP) y sus derivados ribonucleótidos, o a través de la vía de la hipoxantina-guanina fosforibosiltransferasa, en su metabolito activo, la 6-tioguanina (6-TGN) (fig. 1). Históricamente, la dosificación de estos fármacos se realizaba en función del peso del paciente; la AZA, entre 2 o 3mg/kg/día, y la 6-MP, a 1,5mg/kg/día, y el ajuste final lo determinaba la aparición de algún efecto secundario, principalmente leucocitopenia. La determinación de la actividad de la enzima TPMT permitió ajustar la dosis de AZA según el fenotipo enzimático del paciente. La posibilidad de medir las concentraciones de los metabolitos 6-TGN y 6-MMP se ha convertido en un nuevo escalón para una correcta monitorización de la dosis óptima del fármaco, con lo que se evitan efectos secundarios indeseables1.
Los objetivos del estudio son, en primer lugar, describir el fenotipo de la TPMT en nuestra población y correlacionar la dosis de AZA administrada (ajustada a la actividad de la TPMT) con los valores circulantes de su metabolito activo, la 6-TGN, y en segundo lugar, relacionar los valores circulantes de 6-TGN con la respuesta terapéutica, y los de metabolitos, con el riesgo de toxicidad.
Material y métodosSe incluyeron los valores de actividad enzimática de la TPMT de 107 pacientes (menores de 18 años) susceptibles de tratamiento con AZA y diagnosticados, en su mayoría, de enfermedad inflamatoria intestinal o hepatitis autoinmune. Las cifras de los metabolitos 6-TGN y 6-MMP se determinaron en 18 pacientes (10 niñas y 8 niños) que recibían AZA de forma estable (un mínimo de 2 meses con la misma dosis) y ajustada a las concentraciones de la enzima TPMT. El diagnóstico de estos enfermos fue: 8/18, enfermedad de Crohn (EC); 5/18, colitis ulcerosa (CU), y 5/18, hepatitis autoinmune. La determinación de la actividad de TPMT y de los metabolitos tiopurínicos se realizó en 10ml de sangre total con heparina litio para cada determinación o como alternativa en 10ml de sangre total con EDTA tripotásico. Se mantuvo la muestra refrigerada (temperatura mínima de 4°C) y se procesó antes de 24h de su extracción.
El análisis de TPMT se realiza mediante reacción enzimática; se incuba con la 6-mercaptopurina y S-adenosil-L-metionina y se obtiene la 6-MMP que se mide mediante análisis cromatográfico de alta eficacia (HPLC) con una columna C-18 de 3μm. El análisis de los metabolitos se realiza mediante HPLC con una columna C-18 en fase reversa de 250×4mm con un tamaño de partícula de 5μm y elución mediante gradiente.
Se consideró efectividad terapéutica o remisión clínica cuando no hubo necesidad de corticoides o de modificación de la medicación inmunitaria de base. La leucopenia se definió como toda cifra de leucocitos totales<4.000 leucocitos/μl y la hipertransaminemia o hiperamilasemia como toda elevación de valores×2 la normalidad.
El análisis estadístico se realizó mediante el programa SPSS 11. Significación estadística entre las medias de los diferentes grupos establecida mediante la U de Mann-Whitney. La correlación entre variables cuantitativas se estableció mediante coeficiente de correlación de Pearson previa confirmación de la normalidad de la muestra.
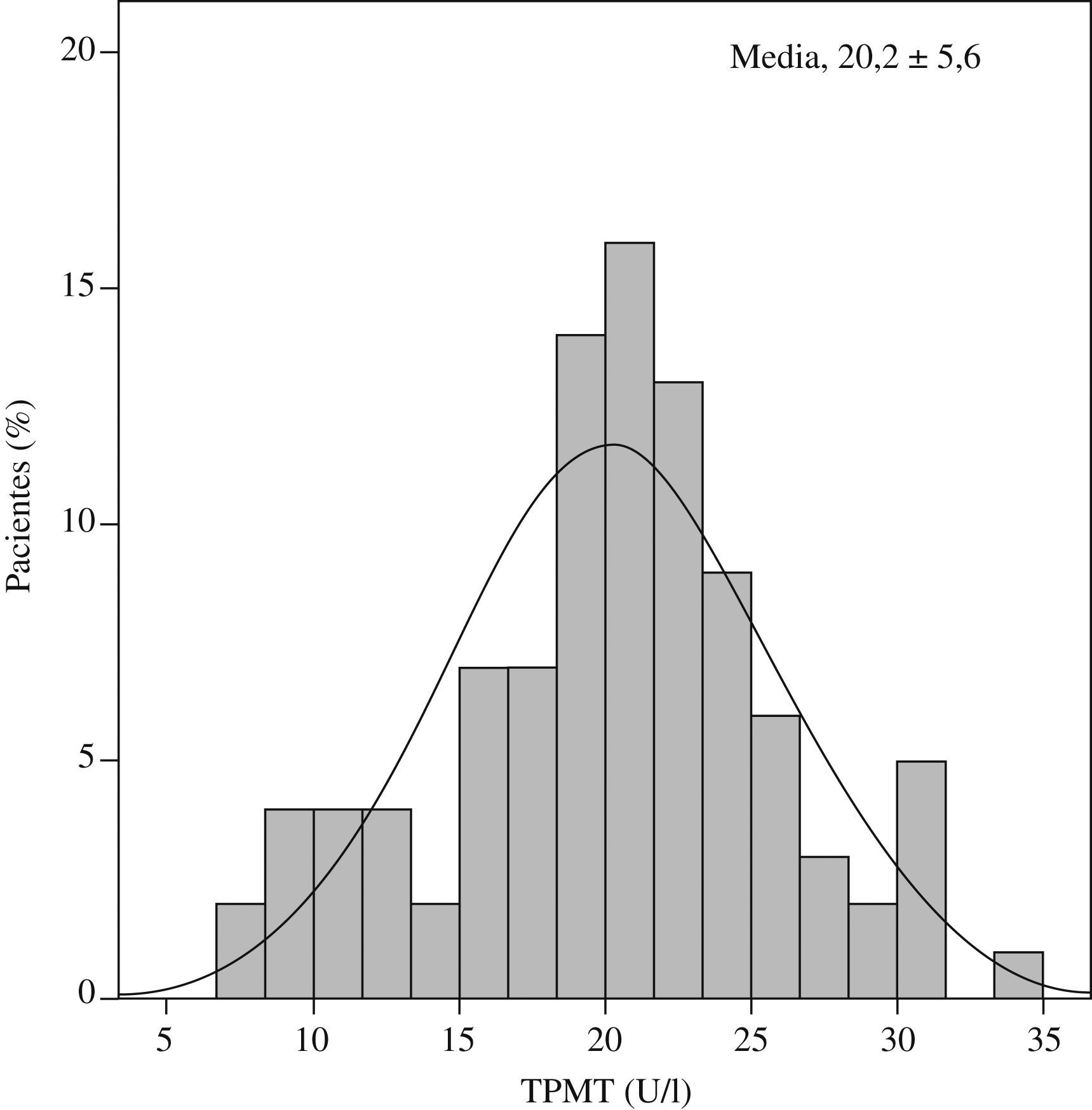
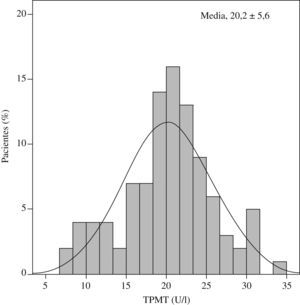
ResultadosLa actividad de TPMT en nuestra población siguió una distribución normal (Kolmogorov-Smirnov, Z=0,5) con una curva similar a la de Gauss (fig. 2). La determinación media de TPMT fue de 20,19 (intervalo, 7,39–34,38)U/ml. Las dosis de AZA se establecieron en función de dicha actividad (tabla 1). Ninguno de nuestros pacientes presentó actividad de TPMT menor de 5U/ml, umbral mínimo en el que la recomendación actual sería no administrar el fármaco ante el alto riesgo de leucocitopenia.
Actividad de la tiopurina metiltransferasa (TMPT)
| Actividad TPMT (U/ml) | Dosis de AZA recomendada | Población (%) |
| <5 | No administrar | 0 |
| 5,1–13,7 | 0,5mg/kg/día | 14,2 |
| 13,8–18 | 1,5mg/kg/día | 14,2 |
| 18,1–26 | 2,5mg/kg/día | 58,5 |
| 26,1–40 | 3mg/kg/día | 13,1 |
AZA: azatioprina.
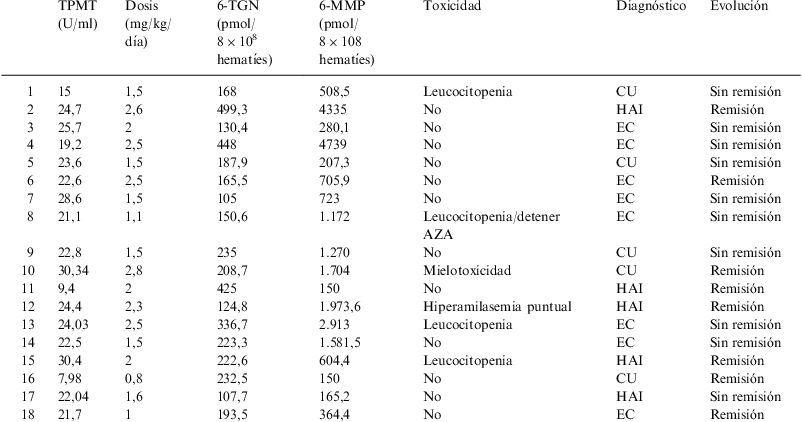
La tabla 2 muestra la totalidad de pacientes y la actividad de TPMT, la dosis de AZA administrada, los valores de metabolitos tiopurínicos y los efectos secundarios hallados.
Descripción general de los casos
| TPMT (U/ml) | Dosis (mg/kg/día) | 6-TGN (pmol/8×108 hematíes) | 6-MMP (pmol/8×108 hematíes) | Toxicidad | Diagnóstico | Evolución | |
| 1 | 15 | 1,5 | 168 | 508,5 | Leucocitopenia | CU | Sin remisión |
| 2 | 24,7 | 2,6 | 499,3 | 4335 | No | HAI | Remisión |
| 3 | 25,7 | 2 | 130,4 | 280,1 | No | EC | Sin remisión |
| 4 | 19,2 | 2,5 | 448 | 4739 | No | EC | Sin remisión |
| 5 | 23,6 | 1,5 | 187,9 | 207,3 | No | CU | Sin remisión |
| 6 | 22,6 | 2,5 | 165,5 | 705,9 | No | EC | Remisión |
| 7 | 28,6 | 1,5 | 105 | 723 | No | EC | Sin remisión |
| 8 | 21,1 | 1,1 | 150,6 | 1.172 | Leucocitopenia/detener AZA | EC | Sin remisión |
| 9 | 22,8 | 1,5 | 235 | 1.270 | No | CU | Sin remisión |
| 10 | 30,34 | 2,8 | 208,7 | 1.704 | Mielotoxicidad | CU | Remisión |
| 11 | 9,4 | 2 | 425 | 150 | No | HAI | Remisión |
| 12 | 24,4 | 2,3 | 124,8 | 1.973,6 | Hiperamilasemia puntual | HAI | Remisión |
| 13 | 24,03 | 2,5 | 336,7 | 2.913 | Leucocitopenia | EC | Sin remisión |
| 14 | 22,5 | 1,5 | 223,3 | 1.581,5 | No | EC | Sin remisión |
| 15 | 30,4 | 2 | 222,6 | 604,4 | Leucocitopenia | HAI | Remisión |
| 16 | 7,98 | 0,8 | 232,5 | 150 | No | CU | Remisión |
| 17 | 22,04 | 1,6 | 107,7 | 165,2 | No | HAI | Sin remisión |
| 18 | 21,7 | 1 | 193,5 | 364,4 | No | EC | Remisión |
6-TGN: 6-tioguanina; 6-MMP: 6-metilmercaptopurina; AZA: azatioprina; CU: colitis ulcerosa; EC: enfermedad de Crohn; TMPT: tiopurina metiltransferasa.
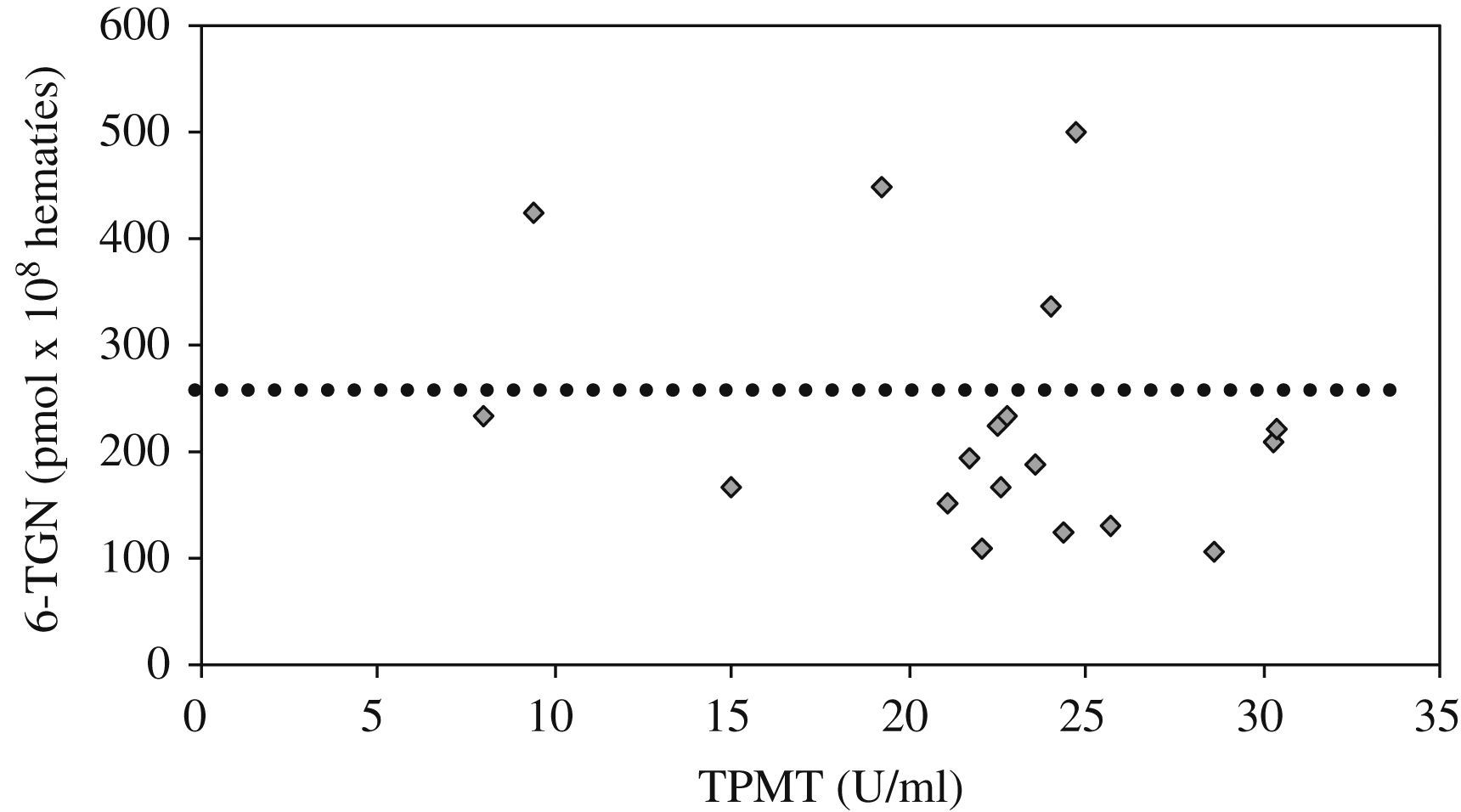
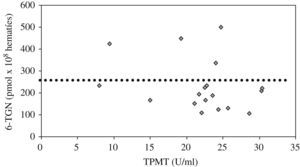
En los 18 pacientes en quienes se midieron metabolitos la dosis media de AZA administrada y ajustada según la actividad de la TPMT fue 1,84±0,59 (intervalo, 0,8–2,8)mg/kg/día y la determinación media de 6-TGN fue 231 (intervalo, 105–499,3)pmol/8×108 hematíes (valores de normalidad de referencia, 235–450pmol/8×108 hematíes). De los 18 pacientes, 13 mostraron concentraciones subterapéuticas de 6-TGN, con una media de 168pmol/8×108 hematíes. La correlación entre los valores de TPMT y los de 6-TGN mostró una relación inversa (r=−0,28) (fig. 3).
El 45% (8/18) de los pacientes mantuvo remisión clínica, este grupo estaba recibiendo mayores dosis de AZA (media, 2mg/kg/día), respecto al que no lo consiguió (media, 1,7mg/kg/día), aunque sin diferencia significativa (p=0,28). No se hallaron diferencias significativas (p=0,37) entre los valores medios de 6-TGN en pacientes en remisión (259pmol/8×108 hematíes) y aquellos sin remisión (209pmol/8×108 hematíes). De los 8 pacientes en remisión mantenida, sólo 2 (pacientes número 2 y 11; tabla 2) presentaban cifras de 6-TGN >235pmol/8×108 hematíes.
El valor medio de la 6-MMP fue 1.308 (intervalo, 150-4.739)pmol/8×108 hematíes (valores de normalidad de referencia<5.700pmol/8×108 hematíes). No se hallaron diferencias significativas (p=0,72) entre los valores medios de 6-MMP (1.248pmol/8×108 hematíes) en pacientes en remisión y aquellos sin remisión (1.355,9pmol/8×108 hematíes). No se encontró relación entre 6-MMP y TPMT (r=0,19).
Encontramos efectos secundarios en 6/18 pacientes: 5 presentaron leucocitopenia, 1 presentó hiperamilasemia sin pancreatitis clínica. Ninguno presentó hipertransaminemia significativa. Todos los pacientes recuperaron la cifra de leucocitos, tras modificar la dosis de medicación sin ninguna infección durante el periodo de leucocitopenia. En todos los pacientes con leucocitopenia se disminuyó la dosis prescrita inicialmente acorde a la actividad TPMT y en 2 casos hubo que suspender el tratamiento. En los pacientes con leucocitopenia se encontró una cifra de 6-TGN media de 217pmol/8×108 hematíes, cifra inferior a la de los pacientes que no la presentaron (236,68pmol/8×108 hematíes), sin diferencia significativa (p=0,96).
DiscusiónClásicamente se describe la determinación de TPMT de forma trimodal con tres genotipos diferenciados: el homocigoto (TPMTHH) con alta actividad enzimática, el heterocigoto (TPMTHL) con actividad intermedia y el homocigoto (TPMTLL) con baja actividad enzimática. La determinación de la actividad de la enzima TPMT nos permite iniciar una dosificación individual del fármaco y así evitar el riesgo de toxicidad, principalmente leucocitopenia1,2. En nuestro estudio, se describe el fenotipo de TPMT que coincide con el descrito previamente en la literatura; no hay ningún paciente con actividad de TPMT<5U/ml1. Tras analizar nuestros datos y los publicados previamente, consideramos necesaria la determinación enzimática de la TPMT antes de iniciar todo tratamiento con AZA o derivados para poder detectar y excluir a los pacientes con TPMTLL debido a su alto riesgo de mielotoxicidad. Basándonos solamente en la actividad de TPMT estamos obviando el resto de las enzimas que intervienen en la cadena metabólica y otros factores intrínsecos que pueden intervenir en la biodisponibilidad final del fármaco, así como las interacciones farmacológicas. La determinación de metabolitos tiopurínicos nos podría permitir obviar estos factores farmacocinéticos y farmacodinámicos al medir la cantidad final de metabolito activo circulante.
Los estudios iniciales efectuados en adultos con enfermedad inflamatoria intestinal mostraron una buena correlación entre 6-TGN y respuesta terapéutica. Posteriormente Dubinsky et al1 establecieron un valor de corte para la 6-TGN >235pmol/8×108 hematíes a partir del cual, y en comparación con cifras inferiores, se establecía una mejor efectividad terapéutica, con una odds ratio de 51. La cifra subterapéutica de 6-TGN se estableció como la causa más frecuente de falta de respuesta a los tiopurínicos y en algunos casos su efectividad mejoraba al incrementar la dosis de AZA y conseguir valores de 6-TGN>235pmol/8×108 hematíes3–5. Estas valoraciones iniciales fueron rebatidas en estudios posteriores por Gupta et al, que presentaron estudios con un 58% de los pacientes en remisión clínica con valores de 6-TGN<235pmol/8×108 hematíes, con esto se iniciaron las dudas sobre el umbral establecido en el año 2000 por Dubinsky y otros autores6–8. Por otro lado, dichas conclusiones no cuestionaban la utilidad del estudio de metabolitos, ya que se aconseja su determinación para mejorar el control clínico, asegurar el cumplimiento del tratamiento y minimizar los riesgos potenciales de toxicidad.
Ante la falta de literatura pediátrica extensa y la controversia sobre la manera de optimizar a los pacientes en tratamiento con AZA, nos decidimos a iniciar nuestro propio estudio piloto para correlacionar el fenotipo de la TPMT en nuestros pacientes y sus concentraciones de metabolitos tiopurínicos, con el objetivo de encontrar una dosis personalizada y, si fuera posible, un umbral de metabolitos eficaz y seguro9. Evidenciamos unos mayores valores de 6-TGN para actividades menores de TPMT, como se comunica en las publicaciones, pero sin hallar correlación firme entre ambas variables (fig. 3). La controvertida relación entre efectividad clínica y 6-TGN resultó positiva, aunque no estadísticamente significativa. Los valores medios de 6-TGN fueron 259pmol/8×108 hematíes, en el grupo con remisión mantenida, frente a 209pmol/8×108 hematíes, en el grupo con enfermedad activa (diferencia sin significación, p=0,37). El umbral de 6-TGN establecido como objetivo terapéutico en estudios previos (>235pmol/8×108 hematíes) no fue superado por el 75% de nuestros pacientes en remisión, lo que corrobora la necesidad de reestablecer unos nuevos umbrales mínimos de eficacia.
Clásicamente, uno de los métodos usados anteriormente para ajustar la dosis de AZA era el aumento de VCM del eritrocito o la aparición de toxicidad hematológica, principalmente leucocitopenia. Actualmente, nuestro objetivo es establecer una correcta monitorización sin tener que inducir toxicidad en nuestros pacientes. Podemos clasificar los efectos tóxicos de AZA y derivados en: independiente de la dosis (fiebre, artralgias, eritema, pancreatitis y algunos casos de disfunción hepática, principalmente colestasis) o en dependiente de la dosis: náuseas, mielosupresión u otras disfunciones hepáticas, principalmente elevación de transaminasas1,10. Los estudios clásicos establecieron un 39% de toxicidad al administrar AZA o 6-MP; la leucocitopenia (14%) y la elevación de transaminasas (15%) son los efectos adversos más importantes1. Actualmente, el riesgo de toxicidad hepática se ha reducido a un 3%, aproximadamente, como reflejan distintos autores11–14. Si el riesgo de hepatotoxicidad se relaciona con valores de 6-MMP >5.700pmol/8×108 hematíes, la leucocitopenia se relaciona con las concentraciones de 6-TGN, sin haber sido posible establecer un intervalo claro de toxicidad, aunque se postula que más de 450pmol/8×108 hematíes incrementaría su riesgo. No se ha encontrado relación entre hiperamilasemia o pancreatitis y los metabolitos conocidos, y se teoriza sobre un posible mecanismo de tipo idiosincrásico o alérgico causal1. Una actividad de TPMT baja o un tratamiento combinado con alopurinol o mesalazina (inhibidores de la xantina oxidasa o TPMT, respectivamente) debería obligar a una monitorización estrecha de los metabolitos para evitar el alto riesgo de toxicidad2.
En nuestro estudio un 33% de los pacientes presentaron efectos secundarios; 5 pacientes, leucocitopenia, y uno, hiperamilasemia. Ningún paciente presentó hepatotoxicidad. La administración de una dosis correcta de AZA según los valores de TPMT no excluyó, en absoluto, el desarrollo de leucocitopenia15. Los casos de leucocitopenia en nuestros pacientes tampoco se pudo relacionarlos con los valores de 6-TGN ni con los de 6-MMP3.
En conclusión, a pesar de la evidencia científica y del mismo modo que la TPMT, los metabolitos tiopurínicos no se han instaurado aún en el control sistemático de los pacientes en tratamiento con AZA o 6-MP. Podrían ser de gran utilidad en la práctica clínica diaria para facilitar la toma de decisiones ante diversas situaciones: una sospecha de falta de cumplimiento terapéutico en que se encuentran los dos metabolitos indetectables; una falta de efectividad terapéutica con cifras de 6-TGN bajas a pesar de aumentar las dosis de AZA (metabolización preferencial hacia la 6-MMP) o con 6-TGN elevados, pero sin correcta respuesta terapéutica; en estos últimos dos casos debería plantearse un cambio en el tratamiento inmunomodulador de base16–20.
En el futuro la monitorización de los metabolitos tiopurínicos deberá tener un importante papel en la optimización del tratamiento con AZA, aunque son necesarios más estudios que permitan el correcto conocimiento de los intervalos de efectividad terapéutica y toxicidad.