Los avances del tratamiento antineoplásico han llevado a un significativo aumento de las tasas de supervivencia, que en la actualidad y para la población pediátrica son superiores al 70%. Entre los posibles efectos tardíos secundarios al tratamiento oncológico, las alteraciones en la capacidad reproductiva pueden tener un especial impacto en la calidad de vida de los supervivientes. En los últimos años el desarrollo de nuevas técnicas de reproducción asistida, entre las que se incluye la criopreservación de corteza ovárica, ha abierto un camino esperanzador en algunos subgrupos de población, que hasta la fecha contaban con escasas posibilidades para preservar su fertilidad ante la administración de un tratamiento gonadotóxico. Sin embargo, la aplicación de estos avances en el campo de la Pediatría y de los adolescentes tiene todavía un largo camino por delante y algunas consideraciones prácticas y éticas merecen revisarse antes de recomendar su utilización en la práctica médica diaria.
Advances in antineoplastic therapy have considerably increased survival rates, and currently in the setting of paediatric population are higher than 70%. Among the potential long-term late effects due to oncological treatment, reproductive dysfunction may have a particularly deep impact on the survivors’ quality of life. Until recently, limited fertility preservation options were available before gonadotoxic therapies. In the last few years the development of new assisted reproduction techniques, including ovarian cryopreservation, may be promising in selected groups of patients. Although, the feasibility of these advances in the paediatric and adolescent field have a long way to go, several practical and ethical issues deserve a special review before recommending them for routine medical practice.
En España anualmente se diagnostican 850 pacientes menores de 15 años afectados de cáncer y más de 400 casos en adolescentes, con edades comprendidas entre los 15 y los 19 años1,2. Los avances del tratamiento antineoplásico han llevado a un significativo aumento de los índices de supervivencia en las últimas décadas; actualmente el índice medio de curación del cáncer infantil es del 70%3. El objetivo en este momento es ofrecer una recuperación completa y segura, con aceptable calidad de vida y una reintegración plena en la sociedad.
A pesar de que los niños toleran la toxicidad aguda del tratamiento mejor que los adultos, son más vulnerables a las secuelas tardías del tratamiento oncológico. Un estudio retrospectivo reciente en Estados Unidos analiza la morbilidad en más de 10.000 supervivientes de un cáncer infantil, y muestra que el 62% presentaba secuelas crónicas y en un 30% secuelas graves o amenazantes para la vida4. Entre los posibles efectos secundarios, los problemas renales, cardíacos, pulmonares y neurológicos, así como las alteraciones hormonales y del crecimiento, han sido habitualmente los más descritos en la literatura médica.
Desde el punto de vista endocrino-gonadal, sabemos que algunos de los tratamientos utilizados en el cáncer infantil pueden ocasionar fallo ovárico prematuro en las mujeres así como infertilidad o subfertilidad en la época adulta en ambos sexos5,6. Este hecho, se encuentra cada vez más presente entre los profesionales que trabajan el campo de la Oncología así como entre los nuevos pacientes diagnosticados y sus familias. La capacidad de reproducción en el ser humano no se considera un valor trivial y se relaciona de forma clara con las sensaciones de bienestar y de autonomía personal, según numerosos estudios7,8; su pérdida, por tanto, puede impactar profundamente en los supervivientes, con importantes problemas para asumir la imposibilidad de descendencia a consecuencia de tratamientos recibidos y de forma más llamativa cuando su administración se ha producido durante los primeros años de sus vidas9.
En las últimas décadas, las técnicas de reproducción asistida han conseguido verdaderos progresos y hoy en día el diseño de alternativas para preservar la fertilidad en pacientes diagnosticados de cáncer se ha convertido en una prioridad para muchos profesionales. Las publicaciones al respecto han aumentado espectacularmente y un “efecto dominó” es previsible en un futuro cercano. Ahora bien, la aplicabilidad y disponibilidad de estos procedimientos en la población pediátrica y adolescente todavía tiene un largo camino por delante5. Se debe superar un gran número de cuestiones prácticas, éticas y legales antes de que estas técnicas puedan aconsejarse en la práctica médica diaria10.
Exponemos a continuación una revisión sistemática y actualizada de las principales opciones de preservación de fertilidad (PF) en la población pediátrica y adolescente, así como de algunas de las múltiples cuestiones que de ellas se derivan, con el objetivo de optimizar el tratamiento y el seguimiento de los cada vez más numerosos supervivientes de cáncer.
¿Sabemos realmente cuál es la población que presenta riesgo de infertilidad? En estos momentos, ¿qué podemos ofrecerles?A pesar lo mucho publicado, estas 2 preguntas siguen siendo de absoluta actualidad y de difícil respuesta. Por un lado, la administración de radioterapia pélvica, el uso de irradiación corporal total, la quimioterapia utilizada en acondicionamiento de trasplante de precursores hematopoyéticos y el empleo de agentes alquilantes han sido clásicamente los factores asociados a mayor riesgo de gonadotoxicidad5.
Sin embargo, la naturaleza diversa de las agresiones sobre las gónadas tras quimioterapia y radioterapia dificulta con frecuencia la predicción individualizada del riesgo de infertilidad o subfertilidad en la edad adulta11. El consejo a la población pediátrica-adolescente y a sus familias en este tema puede resultar muy complejo si se tienen en cuenta, además, los casos descritos de recuperación de espermatogénesis y función ovárica en pacientes que habían recibido tratamientos con demostrado potencial esterilizador11.
Un estudio muy reciente de casos y controles realiza un análisis de la prevalencia de infertilidad y fallo ovárico prematuro en más de 5.000 supervivientes de cáncer infantil en Estados Unidos; sus resultados muestran cifras significativamente incrementadas en general en el grupo de los casos y de forma muy llamativa en aquellos pacientes que recibieron radioterapia en región hipotalámica, radioterapia en región pélvica, en los que se administró ciclofosfamida o CCNU y en aquéllos con una suma de dosis de agentes alquilantes fue elevada12. A pesar de estos datos, es llamativo que la mayoría de estudios publicados están basados en personas adultas, y se encuentran en general muy pocas referencias de seguimiento a largo plazo a nivel reproductivo en la población pediátrica y aun menos si nos limitamos a datos concretos publicados en España.
Desde la perspectiva de la Oncología Pediátrica, merece la pena un esfuerzo coordinado en la realización de estudios prospectivos multicéntricos bien diseñados que ayuden a clarificar más todavía los interrogantes expuestos y que mejoren las indicaciones de las novedosas técnicas de preservación de la fertilidad, prestando especial atención a los protocolos pediátricos utilizados en la actualidad en nuestro país y a los nuevos agentes antineoplásicos incorporados.
En la población pediátrica y adolescente, el impacto del diagnóstico de cáncer y la preocupación por el inicio del tratamiento lo más precozmente posible han contribuido a que pacientes, padres y facultativos no hayan considerado habitualmente el uso de técnicas de preservación de la fertilidad13. Aun así, el escollo más importante en este terreno para los pediatras oncólogos es que hasta la fecha no existían técnicas disponibles plenamente desarrolladas con este objetivo en el caso de pacientes prepuberales, y éstos suponen la mayor población diana en el cáncer infantil. Algunas cosas han cambiado y es importante “una puesta al día” con vistas a proporcionar una información actualizada pero realista a las familias afectadas.
Resumimos las diferentes opciones existentes desde la perspectiva pediátrica y remarcamos el carácter experimental o bien establecido de éstas (tabla 1).
Resumen de las principales modalidades de preservación de fertilidad disponibles en la actualidad para pacientes diagnosticados de cáncer
| Técnicas establecidas | Técnicas experimentales | |
| Hombres | Criopreservación de semen: | Administración de análogos de las hormonas gonadotropinas. Criopreservación del tejido testicular y maduración in vitro |
| ||
| Mujeres | Criopreservación de embriones | Administración de análogos de las hormonas gonadotropinas |
| Criopreservación de los ovocitos tras estimulación hormonal | CCO | |
| Translocación ovárica | Maduración in vitro de folículos ováricos |
CCO: criopreservación de corteza ovárica.
La técnica más habitual en varones adolescentes maduros es la criopreservación de espermatozoides obtenidos por masturbación. Se han descrito otros métodos de aislamiento de semen que podrían tener una particular utilidad en aquellos casos de adolescentes que por motivos psicológicos no pudieran emitir esta muestra, entre ellos destacan la electroestimulación vibratoria del pene, la electroestimulación rectal bajo anestesia14,13, así como la realización de biopsia testicular y el aspirado del epidídimo. Todas ellas suponen alternativas viables, pero la realidad es que muy pocos centros hospitalarios las ofrecen y se dispone de escasa información en cuanto a sus resultados en este subgrupo de población. Por otra parte, es destacable el desarrollo de nuevas técnicas de reproducción asistida, como la microinyección de espermatozoides (ICSI), que ha permitido en los últimos años la realización de tratamientos eficaces con un número muy bajo de espermatozoides, y que resulta especialmente útil en aquellos pacientes que por su enfermedad basal o su edad cuenten con un recuento anormalmente bajo15.
Los varones prepuberales no cuentan en la actualidad con ninguna opción disponible para preservar sus células germinales. La criopreservación del tejido testicular inmaduro con posterior maduración in vivo/in vitro es una estrategia puramente experimental que ha obtenido buenos resultados en modelos animales, pero que todavía no tiene aplicación práctica fuera de este ámbito. Por otra parte, la administración de hormonas análogas de las gonadotropinas como mecanismo protector del eje hipotálamo-hipofisario gonadal no ha mostrado ninguna efectividad en la población humana masculina14,16. La individualización de los tratamientos y el esfuerzo de los grupos internacionales por reducir la carga gonadotóxica de los protocolos utilizados en la actualidad cobran vital interés en este grupo concreto de pacientes dada la ausencia hasta la fecha de alternativas.
MujeresLa situación de las mujeres diagnosticadas de novo de cáncer y las opciones de PF existentes para éstas suponen hoy en día un tema de máxima actualidad. Son muchos los trabajos publicados al respecto recientemente, y se prevé que los avances tecnológicos en este campo sean muy numerosos en los próximos años17.
En este momento, la criopreservación de embriones es la única opción considerada fuera del ámbito experimental para las mujeres, pero obviamente el requerimiento de pareja o donante masculino, así como de tiempo para la estimulación hormonal la hace inviable en la población pediátrica. Este mismo tiempo resulta necesario para la vitrificación de ovocitos, que en los últimos meses está adquiriendo una particular relevancia en la población adulta18, pero que de momento casi ningún centro se ha planteado para pacientes menores.
La criopreservación de corteza ovárica (CCO) merece un apartado especial y detallado. Actualmente es la única opción viable para pacientes prepuberales y puberales, pero es importante resaltar desde el principio su carácter experimental y la necesidad de aclarar algunos conceptos sobre su aplicación en pacientes menores19,10.
Para entender la estrategia, debemos recordar que al nacimiento se dispone de un “pool” fijo de ovocitos, estimado en 1–2 millones, detenidos en la profase diplotene de la primera división meiótica. A partir de la menstruación y en cada uno de los períodos, uno de estos ovocitos madura definitivamente y se convierte en candidato para ser fecundado. El resto de ovocitos permanece en la corteza ovárica a modo de “reserva”, y disminuyen progresivamente con la edad hasta la menopausia a una edad media descrita de 51 años; cabe destacar, por otro lado, que estas células son especialmente vulnerables a la acción de agentes citotóxicos, tanto quimioterapia como radioterapia20.
La CCO implica la extracción de la corteza previamente a la administración del tratamiento oncológico, su congelación durante un período indefinido de tiempo y su posterior “autotrasplante” ortotópico o heterotópico, siempre que la paciente se encuentre libre de enfermedad y experimente una situación de fallo ovárico prematuro o de infertilidad.
El equipo de Gosden describió la primera experiencia con éxito en este ámbito en una oveja hace aproximadamente 15 años21 y desde entonces su aplicación en humanos ha crecido de forma exponencial. La restauración de la función hormonal se ha demostrado en varias publicaciones17 y en el campo de la fertilidad son 5 los recién nacidos vivos publicados hasta la fecha tras su aplicación22–25.
Los potenciales avances científicos y sociales que podría suponer la CCO son importantes y numerosos, pero debemos ser cautos con los datos expuestos ya que se desconoce en la actualidad cuántas cortezas ováricas se encuentran almacenadas y qué cifra total de autotrasplantes se ha realizado, lo que puede, por tanto, generar falsas expectativas.
La maduración in vitro de algunos de los folículos primordiales extraídos con el procedimiento anteriormente descrito y su posterior fecundación cuando la paciente alcance la edad adulta mediante técnicas de reproducción asistida abren un nuevo frente experimental muy prometedor. Su aplicación en modelos animales se ha conseguido en la actualidad y es previsible su utilización en la especie humana en los próximos años. La reducción al mínimo del riesgo de reintroducción de células malignas con el autotrasplante sería su principal ventaja respecto a las demás opciones26.
La manipulación hormonal en mujeres con análogos de las gonadotropinas como práctica alternativa supone un tema controvertido en la actualidad. No hay evidencia suficiente para su recomendación en estos momentos para la población adulta y aun menos para la población infantil, pero están en marcha varios ensayos clínicos prospectivos aleatorizados que podrían despejar algunas de las incógnitas en los próximos años16,27.
La transposición ovárica previa a la radioterapia pélvica ha sido también una técnica clásicamente descrita y potencialmente utilizable en la edad pediátrica para preservar la fertilidad, pero la realidad es que hasta la fecha no se ha empleado habitualmente bajo las premisas de requerir un procedimiento quirúrgico adicional, tener pocas posibilidades de éxito y no evitar la gonadotoxicidad provocada por quimioterapia, que con frecuencia se ha de utilizar conjuntamente. En cualquier caso, algunos trabajos recientes presentan buenos resultados en pequeñas series y animan a los profesionales a su consideración cuando el principal factor limitante es la radioterapia pélvica28,29.
Aspectos prácticosComentamos a continuación algunos detalles prácticos de los procedimientos que cuentan hoy en día con mayor aceptación por parte de la comunidad científica.
La criopreservación de semen es una técnica hoy por hoy bien establecida y a priori menos compleja que las ofertadas para la población femenina, pero cuando hablamos de población adolescente se han de tener en cuenta algunas consideraciones. Según estudios recientes esta técnica es ofrecida solamente a un 50% de los nuevos pacientes en el momento del diagnóstico30 y estos números podrían ser menores si consideramos a la población más joven. La dificultad para definir con certeza a qué edad una persona es capaz de emitir una muestra de semen, así como la tendencia a no considerar esta opción en aquellos pacientes con diagnóstico de mal pronostico inicial se han apuntado como las principales causas de estas cifras5,31. No hay reglas claramente establecidas, pero parece razonable que todo paciente masculino sexualmente maduro (con un volumen testicular superior a 10ml) y psicológicamente preparado al que se le vaya a realizar un tratamiento potencialmente gonadotóxico debería ser un candidato al ofrecimiento de esta técnica, dadas sus potenciales ventajas y los mínimos efectos secundarios32.
Tras la elección de los pacientes, decidir el momento de la realización de la técnica resulta crucial. La integridad del ADN de los espermatozoides puede dañarse con una simple sesión de quimioterapia, por lo que es imprescindible consultar a estos pacientes antes del inicio de cualquier tratamiento gonadotóxico5. No hay publicaciones que demuestren mayor número de malformaciones en los hijos espontáneos de pacientes que han recibido un tratamiento oncológico6, pero los pacientes deberían conocer que no hay datos suficientes de seguridad al respecto del uso de técnicas de reproducción asistida (ICSI) con semen recogido tras la administración reciente de quimioterapia33.
El término “facilidades para los adolescentes” en el contexto de la criopreservación de semen se ha utilizado en varias publicaciones y es claramente recomendable según los autores de esta revisión11,14,32. Personal entrenado y cómodo en este tipo de conversaciones debería ser el encargado de dirigir la información y las propuestas de una manera sensible y abierta, y debería valorar en cada caso la conveniencia o inconveniencia de la presencia de los padres en el momento de la charla y en el momento de acompañar a los pacientes a la unidad de reproducción. La posibilidad de recoger la muestra en un lugar diferente a la unidad de fertilidad de adultos (domicilio, algún lugar habilitado de la unidad de oncología pediátrica, etc.) puede mejorar el rendimiento de ésta34.
La CCO, como hemos señalado, supone la única opción disponible en mujeres prepuberales y pospuberales, pero dada su especificidad y su carácter experimental, actualmente sólo se encuentra disponible en muy pocos centros de nuestro país y son menos todavía los que tienen protocolos específicamente diseñados para la población pediátrica. Dada la necesidad de una intervención quirúrgica bajo anestesia, junto con los interrogantes que todavía plantea este procedimiento, su ofrecimiento debería restringirse a una población muy concreta19. Se ha indicado un riesgo de fallo ovárico mayor del 50% así como una razonable esperanza de vida entre otros criterios en el momento de plantearse la derivación de estas pacientes (tabla 2), pero no siempre es fácil disponer de estos datos en un tema, por otra parte, tan poco estudiado en la población infantil11,19. La edad máxima para su proposición es un punto muy controvertido, especialmente entre los especialistas de reproducción; sin embargo, poco se ha publicado sobre un punto de corte inferior. Dada la fisiología del ovario, es una técnica potencialmente utilizable desde el nacimiento, pero actualmente se cuenta con muy pocos datos en pacientes por debajo de los 5 años, por lo que la individualización de su indicación es, si cabe, todavía más importante en estos casos.
Resumen de los principales criterios indicados en la selección de pacientes para la realización de criopreservación de corteza ovárica
| Criterios indicados para ofrecer CCO |
| Menores de 30–35 años (discutido) |
| Sin hijos previos |
| Riesgo gonadotóxico intermedio-alto |
| Probabilidad de supervivencia razonable (discutido) |
| Sin quimioterapia previa (discutido) |
| Sin positividad de VIH/VHB (discutido) |
CCO: criopreservación de corteza ovárica; VHB: virus de la hepatitis B; VIH: virus de la inmunodeficiencia humana.
La técnica se lleva a cabo habitualmente por vía laparoscópica (múltiples biopsias, ooforectomía parcial u ooforectomía completa) y sería deseable que su ejecución coincidiera con otros procedimientos que precisen de anestesia general (inserción acceso venoso central, intervención del tumor, etc.).
Idealmente, las pacientes no deberían haber recibido ninguna quimioterapia previa, pero en el caso de las hemopatías malignas, se podrían considerar otras opciones35. Esta posibilidad es especialmente aplicable en aquellas pacientes que tras haber recibido un tratamiento considerado de bajo riesgo gonadotóxico vayan a recibir un trasplante de precursores hematopoyéticos19.
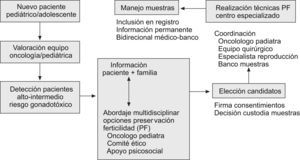
Aspectos éticosEl campo de la Oncología Pediátrica no debe quedar al margen de los avances experimentados por otras especialidades cuando de ellos se deriven potenciales beneficios para los pacientes. Ahora bien, cuando se trata de técnicas enmarcadas por el momento en el terreno experimental, se deben tomar algunas consideraciones adicionales por tratarse de una población especialmente vulnerable. A pesar de lo novedoso y prometedor de lo anteriormente expuesto, es imprescindible que centros especializados con experiencia y con una clara estrategia definida, aprobada por los respectivos comités éticos7 realicen el ofrecimiento de algunas de estas opciones. Las decisiones en el campo de la preservación de la fertilidad se deben tomar, como en otras muchas ocasiones, en el contexto de equipos multidisciplinarios, que además incluyan personal de apoyo psicológico para el paciente y sus familias10,19 (fig. 1).
La posibilidad descrita de reintroducir células malignas en el momento del autotrasplante es un apartado que necesita una mención especial. Actualmente se dispone de diversas técnicas altamente sensibles que podrían detectar macrometástasis o micrometástasis en el ovario (inmunohistoquímica, amplificación de reacción en cadena de la polimerasa (PCR) o PCR a tiempo real), además de las tradicionalmente utilizadas pruebas de imagen preoperatorias y de la histología convencional17,36. La maduración folicular in vitro tras CCO podría en un futuro no muy lejano minimizar este riesgo, tal y como se ha expuesto previamente. Sin embargo, a pesar de todas estas alternativas, consideramos imprescindible una información completa a las familias con relación a este tema por parte de los médicos implicados.
La aplicación de estas técnicas ha de tener presente el marco legal de cada país o comunidad autónoma. En este caso no sólo está implicada la normativa sobre recogida y uso de células germinales, sino que además se ha de plantear en el contexto de pacientes menores de edad.
Las decisiones tomadas de acuerdo con los mejores intereses para el niño respaldan a padres y a profesionales cuando los menores no tienen madurez suficiente para decidir11. Cuando hablamos del caso concreto de ensayos clínicos en menores de edad, debemos tener en cuenta además que éstos sólo pueden realizarse si ellos son los beneficiarios directos del ensayo. Si además son pacientes mayores de 12 años, la ley vigente determina que deberían ser consultados y dar su aprobación en el caso de entender y asimilar adecuadamente la información recibida.
La propuesta de un consentimiento informado en 2 etapas (la primera para permitir la recolección de células germinales en el momento del diagnóstico y la segunda para decidir su uso cuando el paciente alcance la edad adulta) está cobrando cada vez mayor importancia en los centros con más experiencia7,11,37 y podría aliviar algunas de estas cuestiones mencionadas. Por otra parte, se debe recordar que la custodia de las muestras en el caso de fallecimiento de los pacientes también debería quedar recogida en estos documentos37,38.
Consideraciones finalesAsumir un diagnóstico de cáncer no es fácil para ningún paciente. El escenario que además se plantea cuando al mismo tiempo hay que tomar decisiones sobre cuestiones tan vitales como el deseo de tener descendencia es muy complejo desde el punto de vista clínico y emocional, y más aún en el campo de la Pediatría. Los profesionales deben reconocer la importancia de este tema para los supervivientes e informar de forma actualizada y realista a las familias; deben a su vez estar abiertos a las nuevas opciones que la tecnología ofrece y enmarcarlas siempre en el contexto de estudios protocolizados, de forma que se consigan superar progresivamente todos los retos prácticos y éticos que este tema nos plantea.