La enfermedad inflamatoria intestinal (EII) está constituida por 3 entidades clínicas: la colitis ulcerosa (CU), la enfermedad de Crohn (EC) y la colitis indeterminada (CI), cuyo denominador común es la inflamación a nivel intestinal, asociada a una alteración de la respuesta inmunitaria. Todas ellas suelen presentar evolución crónica recidivante, alternando fases de actividad con otras de latencia. La etiopatogenia es desconocida, sin embargo, desempeñan un papel importante la predisposición genética, la disfunción inmunológica, los factores ambientales y las alteraciones de la permeabilidad intestinal. Entre el 20 y el 25% de los pacientes con EII comienzan en la infancia, habitualmente en la adolescencia, produciendo una importante repercusión en el crecimiento y desarrollo puberal1.
El infliximab es un anticuerpo monoclonal quimérico de clase IgG1 que bloquea la actividad del factor de necrosis tumoral alfa (TNF-α), citocina que desempeña un papel importante en el mecanismo de inflamación tisular de la EII. La llegada de los anti-TNF ha constituido un avance en el tratamiento de estas patologías; los pacientes con CU refractaria al tratamiento médico (mesalazina, corticoide y análogos de purinas) se benefician del uso de infliximab (recomendación 1A)2. Actualmente, el infliximab se emplea también en el tratamiento de otras patologías, como la artritis reumatoide, la espondilitis anquilosante, la psoriasis y la artropatía psoriásica. De forma paradójica, el infliximab puede inducir o desencadenar psoriasis en algunos pacientes.
Mujer de 17 años, con antecedentes familiares de psoriasis, diagnosticada de CU a los 12 años y 9 meses por dolor abdominal, deposiciones líquidas con sangre, tenesmo, pérdida ponderal, elevación de reactantes de fase aguda y escintigrafía compatible con pancolitis. Inicialmente tratada con mesalazina, corticoides y hierro, demostró corticorresistencia, que requirió ciclosporina con buena evolución posterior, permitiendo la retirada de corticoides con introducción de mercaptopurina.
Dos años después, presentó nuevo aumento de reactantes de fase aguda y anemización. Tras realización de una colonoscopia, se objetivó CU en brote moderado-grave, que requirió inicio de ciclo de corticoides. Debido a la mala respuesta clínica y analítica, se inició la administración de terapia biológica con infliximab a 5mg/kg cada 8 semanas. Asintomática desde ese momento, con buena ganancia ponderal y controles analíticos dentro de la normalidad, se retiró la mercaptopurina un año después.
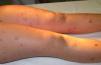
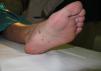
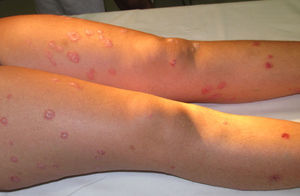
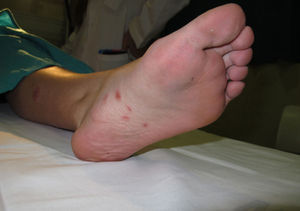
A los seis meses, es remitida a la consulta de dermatología por la aparición de placas eritematosas con descamación blanco grisácea, de predominio en los miembros inferiores, con afectación plantar de forma bilateral y simétrica (figs. 1 y 2), sin afectación ungueal ni sintomatología sistémica. La biopsia de una de las lesiones confirma el diagnóstico de psoriasis en placas. Se pautó una aplicación diaria con calcipotriol 50μg asociado a dipropionato de betametasona 0,5mg en gel, con clara mejoría de las lesiones cutáneas, sin necesidad de suspender el tratamiento con infliximab.
La psoriasis es una de las enfermedades dermatológicas más frecuentes, afectando al 1-2% de la población general. Es un trastorno cutáneo inflamatorio crónico, de herencia poligénica y asociado a factores desencadenantes, como traumatismos, infecciones como la estreptocócica, el estrés y fármacos, entre los que destacan glucocorticoides sistémicos, el litio oral, los betabloqueantes, las tetraciclinas y los antipalúdicos3.
El infliximab está asociado a reacciones adversas cutáneas como rash, urticaria, prurito, erupciones lupus-like, eccemas, vasculitis leucocitoclástica e infecciones cutáneas4. En los últimos años se han descrito casos de psoriasis inducida por anti-TNF-α, generalmente tras varias dosis, en un intervalo que oscila desde semanas a varios años tras la introducción del tratamiento5,6, en nuestro caso, las lesiones aparecieron transcurridos 2 años del inicio del mismo. Respecto de la variante clínica de psoriasis inducida por infliximab, se han descrito fundamentalmente casos de psoriasis pustulosa palmo-plantar y con menor frecuencia, como en nuestra paciente, psoriasis en placas7.
Los mecanismos patogénicos responsables del desarrollo de este evento adverso son complejos. Estudios sugieren que los anti-TNF-α tienden a estimular la producción de interferón 1 (α/β) por parte de la célula dendrítica. El interferón α incrementa la expresión de receptores de quimocinas, como el CXCR3 en célula T activada. Esto promueve la infiltración de células T autorreactivas en la piel, características de las lesiones psoriásicas4–6,8. El manejo de la mayoría de los pacientes que desarrollan psoriasis se basa en el uso de tratamiento tópico, continuando con el infliximab para el control de la EII; este fue también el caso de nuestra paciente. Sin embargo, en series de casos publicados ha sido necesario el cambio a otro anti-TNF o la suspensión de la terapia biológica5,9.
Este caso pone de manifiesto la importancia de un minucioso examen dermatológico en los pacientes con infliximab, que permita una detección y un tratamiento temprano.