La pubertad precoz central (PPC) es una enfermedad rara, de claro predominio femenino y con mayor incidencia entre individuos adoptados. De etiología idiopática en la mayoría de ocasiones, en los últimos 2 años se han descrito las primeras mutaciones causantes de PPC. La prevalencia de patología orgánica es notablemente inferior entre las niñas con PPC; sin embargo, no se han descrito variables predictoras lo suficientemente seguras como para seleccionar a qué tipo de niñas se les debe realizar una prueba de imagen. Aunque con las nuevas técnicas disponibles se ha conseguido mejorar la sensibilidad de la determinación de LH basal como marcador de PPC, a día de hoy la prueba más relevante sigue siendo el pico de LH tras test de estimulación con LHRH. Finalmente, la utilización de los análogos de GnRH se ha mostrado principalmente eficaz en el tratamiento de PPC de menores de 6 años.
Central precocious puberty (CPP) is a rare disease with female predominance and a higher incidence among adopted children. Of idiopathic aetiology in most cases, in the past few years the first mutations in patients with CPP have been described.
The prevalence of organic disease is notably lower among girls with CPP. However, no predictors have been described to select which kind of girls should undergo an imaging tests. Although the sensitivity of the determination of basal LH as a marker of CPP has improved with the new techniques, to date, the LH peak after LHRH stimulation test remains the gold standard for the diagnosis of CPP. Finally, the use of GnRH analogues has shown to be particularly effective in the treatment of CPP patients less than 6 years-old.
La pubertad es un fenómeno biológico complejo a través del cual se desarrollan los caracteres sexuales secundarios, se obtiene la maduración sexual completa y se alcanza la talla adulta1, 2. Desde hace varias décadas, se ha propuesto que el fenómeno final que pone en marcha la pubertad es el aumento en la secreción y la pulsatilidad de hormona liberadora de gonadotropinas (GnRH) por parte de las neuronas hipotalámicas productoras de GnRH3. Ahora bien, ¿qué regula este aumento de la secreción y pulsatilidad de la GnRH?
Ojeda et al4, 5 postulan que la neurorregulación de la pubertad depende de redes de genes cuyas acciones se solapan e interaccionan, tanto de una forma jerárquica como independiente. De esta manera, existirían unos ejes centrales que regulan una primera red periférica de genes, que, a su vez, interaccionan con una segunda y tercera red nodal de genes. Lógicamente, la interrelación entre el eje central y la primera red de genes vecinos es muy superior. De este modo, el desarrollo puberal quedaría regulado por un mecanismo complejo de genes interrelacionados que actúan a distintos niveles: a) cambios transinápticos: incremento de estímulos excitatorios de las neuronas secretoras de GnRH (vía glutamato, kisspeptina, neurokinina, disminución de los estímulos inhibitorios, disminución del estímulo de neuronas gabaérgicas y de neuronas productoras de sustancias opioides); b) cambios en células gliales: las células gliales contribuyen a la activación de la secreción de GnRH por dos mecanismos relacionados: uno a través de la liberación factores de crecimiento que actúan sobre receptores de las neuronas GnRH (factor de crecimiento transformador tipo β [TGFβ], factor de crecimiento epidérmico, factor de crecimiento similar a la insulina tipo 1), y otro merced a cambios en la adhesividad de las células gliales sobre las neuronas GnRH a través de la molécula de adhesión celular tipo 1 y del receptor tipo de la proteína tirosinfosfatasa β.
Cualquier anomalía en los mecanismos anteriormente descritos puede condicionar alteraciones en el desarrollo puberal, ya sea por adelanto, ya sea por excesivo retraso. Mención especial merece el sistema kisspeptina y su receptor (GPR54), elementos indispensables para explicar la fisiología de la pubertad y la reproducción. De esta forma, se han descrito mutaciones en este sistema causantes tanto de pubertad precoz central como de hipogonadismo6.
Definición de pubertad precozAparición progresiva de caracteres sexuales antes de los 8 años en niñas y 9 años en niños, que se acompaña de adelanto de la edad ósea y aceleración de la velocidad de crecimiento2, 7. Esta es una definición basada en criterios estadísticos que consideran normal alcanzar el estadio puberal Tanner II a partir de los 8 años en niñas y de los 9 años en niños (± 2,5 desviaciones estándar respecto a la edad media)8, 9.
Los límites de edad para definir pubertad precoz fueron cuestionados en la última década10 tras la aparición de un estudio transversal americano que alarmó a la comunidad científica internacional11; sin embargo, es necesario reseñar que este estudio presentaba importantes errores metodológicos: el principal de ellos fue que la estimación del estadio puberal a través de la evaluación del grado de telarquia se realizó por inspección y no por palpación. En consecuencia, a día de hoy, los límites anteriormente citados para el diagnóstico de pubertad precoz siguen vigentes en la comunidad científica internacional2, 7.
Clásicamente, se han definido dos subtipos de pubertad precoz en función de la activación de la liberación de gonadotropinas: a) pubertad precoz central (PPC) o dependiente de gonadotropina: existe una activación precoz de la liberación de hormona liberadora de gonadotropinas y, por ende, de FSH y LH; b) pubertad precoz periférica (PPP) o independiente de gonadotropina: producida por aumento de esteroides sexuales sin objetivar elevación de gonadotropinas. Por otra parte, de manera excepcional, se han descrito pacientes con pubertad precoz mixta: generalmente son niños/as con una PPP de largo tiempo de evolución que al recibir terapia frenan bruscamente la retroalimentación negativa de los esteroides sexuales y, de esta forma, se activa el eje gonadotropo. En menor medida, puede observarse un fenómeno de up-regulation consistente en que la retroalimentación continua del eje gonadal producida por grandes cantidades de esteroides produce una activación hipotálamo-hipofisaria que conlleva un aumento en la secreción de las gonadotropinas y, por ende, una activación central de la pubertad7, 13.
Epidemiología de pubertad precoz centralEn 1995 aparece publicado un estudio epidemiológico de la prevalencia e incidencia de pubertad precoz utilizando el registro nacional danés, siguiendo los criterios diagnósticos del ICD-1014. En este trabajo se incluyeron los diagnósticos registrados como pubertad precoz en niñas de 0 a 9 años y en niños de 0 a 10 años, obteniendo los siguientes resultados: prevalencia en torno al 0,2% para niñas y menos del 0,05% para niños. Por otra parte, la incidencia en niñas de 0 a 9 años oscilaba entre 0,5-8 casos por 10.000/año, mientras que en los niños de 0 a 10 años entre < 1 a 2 por 10.000/año. Al analizar la metodología utilizada por este grupo14, se puede comprobar que el diagnóstico de pubertad precoz englobaba varios trastornos: verdadera PPC, PPP, adrenarquia prematura, telarquia prematura y pubertad adelantada.
En el año 2008 se constituyó el Registro Español de Pubertad Precoz y se diseñó y configuró el programa informático PUBERE (www.seep.es/pubere) al amparo de la Sociedad Española de Endocrinología Pediátrica (SEEP) con el objetivo de conocer los primeros datos epidemiológicos sobre PPC en nuestro país. Dos años después, se publicaron los primeros resultados15: prevalencia global de 0,00019 (niñas: 0,00037; niños: 0.000046), incidencia anual que oscilaba entre 0,02 y 1,07 nuevos casos por 100.000 (niñas: 0,13-2,17; niños: 0-0,23) y una tasa de incidencia de 1997 a 2009 de 5,66 casos por millón de personas a riesgo/año (niñas: 11,23; niños: 0,96). Por tanto, estamos hablando de una enfermedad rara de claro predominio femenino (aproximadamente 10:1).
Por otra parte, es preciso destacar dos hallazgos muy importantes de este estudio español: a) la adopción presenta un riesgo de desarrollar PPC 25 veces superior a la población nacida en España, y b) la inmigración no asocia mayor riesgo de PPC que la población autóctona española.
Estos hallazgos coinciden con datos previamente comunicados por el grupo danés16, con una novedad: la adopción nacional también parece constituir un factor de riesgo para el desarrollo de PPC15.
EtiopatogeniaLa causa más frecuente de pubertad precoz es la activación temprana de la pulsatilidad de GnRH, es decir, la PPC. En la mayoría de ocasiones, la etiología de la PPC es desconocida (idiopática), aunque es obligado descartar patología endocraneal, especialmente en varones (Tabla 1).
Tabla 1. Clasificación etiológica de la pubertad precoz
| PPC | PPP | PP mixta |
| Genética: mutaciónKISS1/KISS1RIdiopáticaSecundaria Hamartoma hipotalámico Tumores: gliomas, ependimomas, astrocitomas, tumor pineal Malformaciones SNC (quistes, hidrocefalia) Post-infección Postraumática Posradioterapia Encefalopatía epiléptica | NiñoCongénita Mutación gen LHR (testotoxicosis) Hiperplasia suprarrenal congénita Mutación gen DAX1Adquirida Tumor testicular/adrenal Tumores productores de β-HCG Esteroides sexuales exógenos NiñaCongénita Síndrome de McCune-Albright (muy raro en niños) Adquirida Quiste ovárico Tumor ovárico/suprarrenal Esteroides sexuales exógenos Niño/niña Hipotiroidismo primario (excepcional) | Tumores productores de esteroides sexuales diagnosticados tardíamente Hiperplasia suprarrenal congénita de larga evolución, no tratada o inadecuadamente tratada Testotoxicosis no tratada o tratada con inhibidores de la aromatasa Síndrome de McCune Albright (con o sin tratamiento, la mayoría acaban presentando una activación central de la pubertad) |
Los distintos neuropéptidos y factores locales implicados en la regulación de la síntesis y liberación de GnRH deberían considerarse como candidatos para la investigación genética en los distintos trastornos de la pubertad, especialmente ante la presencia de varios casos en la misma familia. No obstante, en contraste con los hallazgos genéticos descritos en los últimos años en los hipogonadismos hipogonadotropos, la PPC idiopática es un campo de investigación aún en ciernes6.
Se conoce que la prevalencia de PPC es más elevada en algunas razas y que se han descrito algunos casos familiares. Así, De Vries et al17 estudiaron los casos familiares de PPC entre todos los diagnosticados de causa idiopática (n=156), observando una frecuencia del 27,5%. Además, estos casos familiares mostraron un cociente de segregación que oscilaba entre 0,38 y 0,58 en función del grado de penetrancia asumido, lo que sugiere un patrón de herencia autosómica dominante con penetrancia incompleta, especialmente en varones.
Más recientemente, 4 estudios independientes de asociación de genoma completo (GWAS) han identificado 2 loci asociados a la variación en la edad de la menarquia: 6q21 (en o cerca del gen LIN28B) y en 9q31.2. Sin embargo, estos 2 loci explican sólo una pequeña fracción de la contribución genética a la variación de la edad de la menarquia (0,6%), lo que sugiere la necesidad de seguir examinando otros loci y otros tipos de variantes18, 19, 20, 21. Por tanto, el estudio y el descubrimiento de distintos determinantes genéticos del tiempo de la pubertad pueden tener, en un futuro próximo, una importante utilidad práctica para el conocimiento de la PPC idiopática.
A pesar del avance espectacular en la genética de la pubertad, a día de hoy, únicamente el sistema KISS1/KISS1R se ha demostrado implicado en la patogénesis de la PPC. En efecto, gracias al cribado de mutaciones en los genes KISS1 y KISS1R en una cohorte de 67 niños brasileños afectados de PPC idiopática22, 23 se han descrito las siguientes mutaciones:
– Mutación activante en heterocigosis en el gen KISS1R (R386P): descrita en una niña adoptada diagnosticada a los 7 años de PPC idiopática, con el antecedente de aparición de telarquia en la época de lactante, que permaneció estable hasta la edad de los 7 años, cuando se objetivó un aumento progresivo de la misma junto con aceleración del crecimiento y adelanto de la edad ósea. Estudios in vitro han mostrado que esta mutación permite prolongar la activación de las vías de señalización intracelular en respuesta al estímulo de kisspeptina. Este mecanismo contribuiría a provocar un aumento en la amplitud de secreción de GnRH ante el estímulo de kisspeptina. No obstante, no queda claro cómo una estimulación continua del receptor causante de una secreción continua de GnRH no produzca una desensibilización del receptor y, en consecuencia, retraso puberal.
– Mutación del gen KISS1 (P47S) en heterocigosis: en un niño diagnosticado de PPC idiopática al año de vida. Su madre y abuela materna presentaban la misma mutación, sin tener antecedentes de adelanto puberal, lo que sugiere penetrancia incompleta dependiente del sexo.
– Mutación del gen KISS1 (H90D) en homocigosis: en una niña diagnosticada de PPC a los 6 años. Su madre, portadora de la mutación en heterocigosis, tuvo la menarquia a los 10 años.
La presencia de PPC obliga a descartar patología endocraneal (Tabla 1), aunque con diferencias notables entre niños y niñas. Así, en el sexo masculino, la prevalencia de patología endocraneal oscila entre un 33% a un 90%, mientras que en el sexo femenino la frecuencia varía entre un 8 a un 30%, dependiendo de las series15, 24, 25, 26, 27, 28. Estas diferencias existentes entre los distintos trabajos publicados pueden deberse a diferencias entre los criterios clínicos y bioquímicos de selección de pacientes, así como a la influencia de factores geográficos y raciales, y a la inclusión de mayor/menor número de pacientes adoptados. No obstante, queda plasmada la elevada prevalencia de patología orgánica entre los varones afectados de PPC.
El mecanismo íntimo por el cual un insulto endocraneal produce una activación precoz de la pubertad se desconoce, aunque se especula en que, por un lado, pueda existir un factor mecánico que altere la inhibición de las neuronas liberadoras de GnRH y, por otro, en función del tipo de lesión, pueda predominar uno u otro tipo celular capaz de secretar sustancias que activen la secreción de gonadotropinas29, 30. En este sentido, el hamartoma hipotalámico, malformación congénita no neoplásica compuesta por tejido hipotalámico heterotópico, ha sido un modelo de estudio para intentar aclarar la posible asociación entre lesión endocraneal y PPC (80% de hamartomas presentan PPC), por lo que surgen varias teorías: a) dentro del hamartoma existen neuronas capaces de secretar GnRH; b) en el interior de esta malformación puede encontrarse neuronas productoras de TGFα, que a su vez pudieran contribuir al inicio de la pubertad; c) esta lesión altera la vía de inhibición de las neuronas liberadoras de GnRH. Además, sabemos que la posición y la forma del hamartoma pueden condicionar su expresividad clínica, así el parahipotalámico y de forma pedunculada se asocia con mayor frecuencia a pubertad precoz, mientras que los hamartomas de localización intrahipotalámica y mayores de 10mm tienen mayor riesgo de desarrollar patología epiléptica y, más típicamente, las crisis gelásticas (risa incontrolable)30.
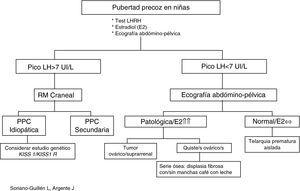
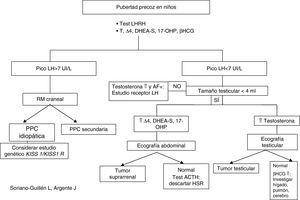
Evaluación diagnósticaLa aparición de caracteres sexuales secundarios antes de los 8 años en niñas y de los 9 años en niños junto con aceleración de la velocidad de crecimiento debe plantear la sospecha de un cuadro clínico de pubertad precoz y sentar las bases del diagnóstico diferencial con otras patologías que pueden compartir signos clínicos. Para ello, es preciso realizar una anamnesis meticulosa, junto a un examen físico detallado (Tabla 2) para solicitar, con posterioridad, las pruebas complementarias que nos puedan orientar el diagnóstico (Tabla 2; Figura 1, Figura 2)7, 31, 32, 33, 34.
Tabla 2. Anamnesis, examen físico y pruebas complementarias en el diagnóstico de PPC
| Anamnesis | Examen físico | Pruebas complementarias |
| Historia previa ¿Desde cuándo botón mamario o aumento tamaño testicular? ¿Desde cuándo pubarquia o axilarquia? ¿Sangrado vaginal? Características y periodicidad Gráfica de crecimiento Síntomas de hipertensión intracraneal Antecedentes personales Embarazo Parto PRN, LRN Período neonatal Enfermedades/terapias crónicas Antecedentes familiares Talla madre, edad menarquia Talla padre, desarrollo puberal Antecedentes de pubertad precoz Diagnóstico diferencialTelarquia prematura aislada Botón mamario antes de 8 años Sin aceleración del crecimiento Talla acorde con talla diana EO acorde con EC Muy frecuente en < 2 años Test LHRH prepuberal | Datos antropométricos Peso (kg y SDS) Talla (kg y SDS) IMC (kg/m2 y SDS) Velocidad de crecimiento (cm/año y SDS) Lesiones cutáneas (manchas café con leche, estrías, acantosis)Focalidad neurológica y fondo de ojoPalpación abdominal (masas abdominales)Estadio puberal de Tanner Tamaño testicular según orquidómetro de Prader Grado de telarquia Grado pubarquia/axilarquia Adrenarquia prematura Antes de los 8 años en niñas Antes de los 9 años en niños Vello púbico y/o axilar Aumento del olor corporal Sin botón mamario en niñas Tamaño testicular prepuberal en niños | Primer escalón Edad ósea Ecografía pélvica en niñas Test LHRH 17-B-estradiol/testosterona DHEA-S, Δ4, 17-OH-progesterona* Segundo escalón RM craneal Tercer escalón Estudio genético en PPC idiopática cuando varios casos familiares Pubertad adelantada Aparición de caracteres sexuales secundarios junto con aceleración del crecimiento y adelanto de la edad ósea > 8 años en niñas > 9 años en niños |
Figura 1. Algoritmo diagnóstico de pubertad precoz en niñas.
Figura 2. Algoritmo diagnóstico de pubertad precoz en niños.
Gonadotropinas basales y tras estímuloAnte un paciente con sospecha nítida de pubertad precoz, dispondremos de una serie de pruebas complementarias que pueden ser de utilidad para el diagnóstico diferencial entre PPC y PPP, así como entre PPC y otras variantes de la normalidad, como la telarquia prematura aislada. De esta forma, la determinación de gonadotropinas basales y tras estímulo con LHRH (100μg/m2 intravenoso), son las herramientas primordiales para el diagnóstico de PPC7, 31, 32, 33, 34.
El test de LHRH, a día de hoy, sigue siendo la prueba de oro para el diagnóstico de PPC, aunque plantea el problema del punto de corte del pico de LH a partir del cual considerar la existencia de una activación central de la pubertad precoz.
Así, distintos trabajos han mostrado unos umbrales de pico de LH para considerar PPC que oscilan entre 3,3 y 15 U/l35, 36, 37, 38. Esta variabilidad entre los distintos estudios puede estar mediada por factores raciales, diferencias en el tamaño muestral, así como, por el método utilizado.
Cambios en el punto de corte del pico de LH condicionan cambios en la sensibilidad y especificidad de la prueba. Por ello, se admite internacionalmente como punto de corte unos valores que se sitúen entre 5 y 10 U/l, según el método utilizado y para niños por encima de 2 años (en nuestro caso situamos el punto de corte en 7 U/l); sin embargo, en niños menores de 2 años debemos aumentar dicho punto de corte a 10 U/l por la activación transitoria del eje gonadal en esa época de la vida7, 34.
De no poder obtener LHRH, puede sustituirse por un test con acetato de leuprolida (análogo de GnRH). Así, se administrará acetato de leuprolida de forma subcutánea a la dosis de 20μg/kg (máximo: 500μg), realizando una extracción sanguínea para LH a las 2h de su administración: un pico de LH superior a 9,7 U/l es indicativo de activación central de la pubertad39.
En los últimos años, en parte gracias al avance en las técnicas que cuantifican las gonadotropinas basales (ensayos de tercera generación), ha surgido el debate de la utilidad de LH basal como método de cribado de PPC. Estos métodos novedosos disponen de mayor sensibilidad para la detección de valores muy bajos y son capaces de diferenciar cambios tan sutiles como 0,1 U/l. Sin embargo, se ha comprobado que sigue siendo muy difícil diferenciar niños prepuberales de los que presentan activación de la pubertad, especialmente en estadios iniciales (Tanner II), por la existencia de gran solapamiento entre los datos hormonales obtenidos. Por tanto, se trata de una prueba con poca sensibilidad (el 72 frente al 92% del test de LHRH) y elevada especificidad, ya que valores muy altos (p. ej., > 1 U/l) sugieren activación central de la pubertad, pero valores inferiores se solapan con los obtenidos en niños/as sin PPC. Además, esos datos deben interpretarse todavía con más cautela en menores de 2 años, donde puede existir una elevación fisiológica de gonadotropinas7, 37, 38.
En un estudio de niños sin patología puberal38, los niveles de basales de LH distinguían los varones prepuberales (LH < 0,2 U/l) de los puberales con una sensibilidad y especificidad del 100%; sin embargo, únicamente el 50% de niñas en estadio puberal Tanner II presentaban valores basales de LH en el rango prepuberal.
Más recientemente, Houk et al40 emplean dos ensayos de tercera generación para la cuantificación de gonadotropinas, mostrando que en más del 90% de las situaciones la determinación de LH basal es capaz de diferenciar una paciente prepuberal de una que tenga pubertad precoz. Así, los autores de este trabajo proponen un punto de corte de LH de 1 U/l para el diagnóstico de PPC, mientras que valores inferiores precisan la realización de un test de estimulación para la confirmación del diagnóstico. No obstante, hay que ser cuidadosos con la interpretación de estos resultados, dado el escaso tamaño muestral (n=51, 21 con PPC y 34 sin PPC), así como por la utilización de un protocolo de prueba de estimulación con hormona liberadora de gonadotropinas escasamente utilizado en países europeos.
Debido a la controversia suscitada sobre la utilidad de LH basal como medio diagnóstico principal en la PPC, es menester efectuar algunas reflexiones:
1. Si el objetivo de la cuantificación de gonadotropinas basales es evitar la realización de un test de LHRH (más molesto para el paciente y más costoso económicamente), un porcentaje no desdeñable de sujetos con sospecha de pubertad precoz serán sometidos a 2 pruebas, una extracción basal y un posterior test de LHRH (aquéllos con alta sospecha de PPC cuya cifra de LH sea inferior a 1 U/l, por ejemplo).
2. No hay los suficientes datos en la literatura científica, probablemente por diferencias entre las poblaciones incluidas y los métodos utilizados, para comparar la sensibilidad y especificidad de las gonadotropinas basales con el test de LHRH mediante una curva ROC. Por ello, aunque sea una prueba con mayor especificidad que sensibilidad, al menos a nuestro entender, sigue sin alcanzar la especificidad de un test de LHRH y esto conduce a un mayor porcentaje de falsos positivos que el test de LHRH. Este hecho, además, conlleva una mayor tasa de diagnósticos no adecuados de PPC y, por ende, un incremento no desdeñable del gasto sanitario (realización de pruebas de imagen y tratamiento crónico con análogos de GnRH), además de la indudable preocupación familiar que condiciona el diagnóstico de una patología crónica.
Por otra parte, en la actualidad, la mayoría de los autores no considera de utilidad para el diagnóstico diferencial de PPC la determinación basal ni tras estímulo de FSH ni el cociente LH/FSH37, 38, 40.
Otras determinaciones hormonalesTestosteronaLos niveles de testosterona son de utilidad para el diagnóstico de pubertad precoz en el niño. Así, valores superiores a 0,5 ng/ml se consideran en rango puberal7, 31.
17-β-estradiolHormona de escasa sensibilidad, ya que valores normales, no descartan una pubertad precoz; sin embargo, se encuentra muy elevada en tumores ováricos y suprarrenales productores de estrógenos, así como en quistes ováricos asociados aislados o asociados a síndrome de McCune-Albright7, 13, 31.
DHEA-S, androstendiona (Δ4) y 17-OH-progesteronaÚtiles en el niño con sospecha de pubertad precoz. Si encontramos cifras de DHEA-S por encima de 700μg/dl en un niño en edad prepuberal, es altamente indicativo de tumor suprarrenal. Por otro lado, estas hormonas, también se determinarán en aquellas niñas en las que la aparición de vello púbico y/o axilar haya sido muy anterior a la de botón mamario, junto con aceleración del crecimiento y de la edad ósea (puede tratarse de una hiperplasia suprarrenal no tratada, que secundariamente ha producido una activación central de la pubertad)13, 31.
Pruebas de imagenCálculo de la edad ósea mediante radiografía de mano-muñeca izquierdasEn los casos de pubertad precoz, hay paralelamente aceleración de la edad ósea, en comparación con las variantes de la normalidad7, 31. También puede utilizarse la edad ósea para predicciones de talla mediante el método de Bayley y Pinneau utilizando el atlas de Greulich y Pyle, aunque la precisión es baja: con un intervalo de confianza del 95%, alrededor de ± 6cm sobre la predicción de talla41.
Ecografía pélvicaSe realizará en todos los casos de pubertad precoz. Por un lado, descartaremos patología causante de PPP (tumores ováricos, quistes ováricos)13, 31 y, por otro, valoraremos signos de impregnación estrogénica. Así, en los últimos años, se ha constatado la existencia de cambios en las dimensiones de útero y ovario desde la infancia a la adolescencia. De esta forma, se ha investigado la utilidad de la ecografía pélvica como método para diferenciar entre niñas con pubertad precoz y niñas con telarquia prematura aislada u otras variantes de la normalidad. Para ello, se han utilizado diferentes variables con distintos puntos de corte para el diagnóstico de pubertad precoz y se han obtenido gran variabilidad de resultados en lo que se refiere a sensibilidad y especificidad de una prueba diagnóstica, por varios motivos: diferentes criterios de selección y diagnóstico, tamaños muestrales dispares y distinta metodología utilizada42, 43, 44.
No obstante, a día de hoy, parece existir cierto consenso en cuanto a las variables de mayor utilidad en el diagnóstico de pubertad precoz: tamaño y volumen uterino, relación fundus/cérvix, tamaño y volumen ovárico. Ahora bien, todavía no hay unanimidad en cuanto a la variable y el punto de corte de la misma (cut-off) que ofrezca mayores ventajas diagnósticas sobre el resto45, 46. Quizás, si hubiera que elegir uno de ellos, de especial mención es el trabajo realizado por Badouraki et al46, en el que muestran que un tamaño uterino superior a 3,1cm en niñas menores de 6 años y mayor de 3,8cm en niñas de 6 a 8 años es el parámetro más útil en el diagnóstico diferencial entre niñas con pubertad precoz y niñas con telarquia prematura aislada.
Ecografía mamariaEs de utilidad en el diagnóstico diferencial entre adipomastia y verdadera telarquia. Esta situación se nos puede plantear en niñas obesas, en las que suele existir cierto adelanto en la edad ósea y por palpación es muy difícil distinguir entre verdadero botón mamario y adipomastia47.
Resonancia magnética cranealSu prescripción en varones está fuera de toda duda teniendo en cuenta la elevada prevalencia de patología endocraneal existente entre ellos. Sin embargo, dada la menor frecuencia de patología craneal asociada a PPC entre las niñas, se ha tratado de validar un algoritmo de decisión en función de la edad (niñas<6 años) y los niveles de estradiol (por encima del percentil 45) para seleccionar a niñas a las que se les debe realizar RM craneal y disminuir un tercio de RM innecesarias, logrando con este árbol de decisión diagnóstica una sensibilidad del 100% y una especificidad del 39%26.
No obstante, esta idea no se ha generalizado, ya que aunque a mayor edad parece disminuir el número de casos de patología endocraneal asociados a PPC entre las niñas, el grupo español de pubertad precoz15 ha mostrado que el 60% de los casos de PPC son diagnosticados por encima de los 6 años. Este mismo grupo ha identificado unas variables que explican en un 16% la varianza de un modelo de regresión logística que incluye la presencia de patología endocraneal como variable dependiente: varones de corta edad no inmigrantes con peor pronóstico de talla. En definitiva, mientras no se encuentren variables predictoras más fiables para el diagnóstico de PPC de causa orgánica, es recomendable realizar RM craneal a todos los casos diagnosticados de PPC15, 48.
Consecuencias asociadas a la pubertad precoz centralLa consecuencia más evidente asociada a la PPC es la pérdida de potencial de talla. Este hecho se ha podido constatar gracias a la existencia de diferentes series históricas de pacientes sin tratamiento. Así, la talla final de varones oscilaba entre 151 y 156cm, y la de niñas entre 150 y 154cm49.
El proceso biológico dinámico iniciado en la pubertad se relaciona con el desarrollo social y emocional que acontece en esta época de la vida. Asimismo, la pubertad coincide con un tiempo de gran plasticidad neuronal y se ha demostrado una influencia clara de los esteroides sexuales sobre el desarrollo del sistema nervioso central.
Todos estos hechos convierten a la pubertad en un periodo de mayor riesgo de problemas de salud; muy en especial, si se produce un adelanto brusco de la misma50, 51. Por ello, la aparición de caracteres sexuales secundarios de manera precoz en sujetos con mentalidad infantil; es decir, que presentan cierto grado de inmadurez, acarrea problemas emocionales y de comportamiento.
Además, se ha descrito el incremento de la frecuencia de otras situaciones de suma importancia: adelanto en la actividad sexual, riesgo de abuso sexual, consumo de sustancias tóxicas, trastornos de la conducta alimentaria, depresión50, 51. No obstante, carecemos de estudios prospectivos referentes al impacto psicológico de niñas con PPC que no han recibido tratamiento con análogos de GnRH frente a las que sí lo han recibido.
En definitiva, no existen evidencias de que los posibles trastornos del comportamiento asociados a un adelanto puberal en la población general50, 51, 52 puedan extrapolarse a las pacientes con PPC53. Pese a ello, sí que parece clara la necesidad de frenar la pubertad en pacientes con retraso cognitivo considerable, dado el riesgo existente de empeorar notablemente el comportamiento de estos niños53.
A largo plazo, la mayor exposición a esteroides sexuales observada entre los individuos con importante adelanto puberal parece tener un riesgo aumentado de cáncer de mama y testicular50, 51. Por un lado, parece evidente que el cáncer testicular comienza en la vida fetal cuando las células germinales pasan al estadio de carcinoma in situ. Posteriormente, estas células permanecen quiescentes hasta que son estimuladas por las gonadotropinas, que parecen tener un efecto permisivo, no directo, sobre la génesis tumoral. Por tanto, a mayor adelanto puberal, mayor tiempo de estímulo sobre estas células cancerígenas. De igual forma, se ha demostrado que el cáncer de mama es más frecuente en mujeres con pubertades precoces y menopausias tardías, por su mayor tiempo de exposición a estrógenos.
Asimismo, también se ha comunicado, aunque con menor claridad que en las situaciones previas, una posible asociación entre adelanto puberal y cáncer ovárico y de próstata50, 51. Frente a estas posibles asociaciones entre adelanto puberal y cáncer surgidas de análisis retrospectivos (casos-control), debemos informar y actuar con suma cautela y, a la par, fomentar el diseño de estudios prospectivos que traten de aclarar esta posible relación causal.
Finalmente, hay que reseñar que mujeres con adelanto notable en la edad de la menarquia presentan en la vida adulta mayor índice de masa corporal (IMC), diámetro de cintura (relacionado con obesidad abdominal), cifras de tensión arterial, valor de hemoglobina glucosilada y peor perfil lipídico. Todos estos hechos conducen a un mayor riesgo de hipertensión, diabetes y enfermedad cardiovascular y, por tanto, de morbimortalidad54. Al igual que con el cáncer, este hallazgo deberá confirmarse con el diseño de cohortes de pacientes con PPC, con y sin tratamiento, a largo plazo.
TratamientoPara los casos de PPC secundarios a una lesión central (tumor o malformación, entre otras), el tratamiento causal no tendrá efecto alguno sobre el curso del desarrollo puberal. Además, la lesión orgánica más frecuentemente asociada a PPC, el hamartoma hipotalámico, es de muy difícil acceso y, por tanto, en la mayoría de las ocasiones, no se realiza tratamiento quirúrgico, intentando únicamente, tratar de frenar la pubertad con terapia médica53.
La terapia médica utilizada para frenar la activación central de la pubertad consiste en el empleo de análogos de hormona hipotalámica liberadora de gonadotropinas (análogos de GnRH) y busca mejorar el pronóstico de talla adulta por un lado y, por otro, evitar las posibles consecuencias psicológicas derivadas de un marcado adelanto puberal.
Estos fármacos producen una estimulación continua de las células gonadotropas hipofisarias, que conlleva a una desensibilización de las mismas (down-regulation) y, por ende, a una disminución en la secreción de hormona luteinizante y, en menor medida, de hormona foliculoestimulante55. De esta manera, desde el inicio de su utilización a principios de los años ochenta56, 57 hasta la actualidad, se han mostrado eficaces en frenar la pubertad, variando a lo largo del tiempo la forma de presentación, así como la vía y el intervalo de administración (Tabla 3)53.
Tabla 3. Características de los diferentes análogos de hormona liberadora de gonadotropinas
| Actuación rápida | Forma depot mensual | Forma depot trimestral | Implante para 12 meses | |
| Frecuencia administración | 2-4 veces/día (intranasal) 1 vez/día (subcutánea) | Cada 28 días | Cada 90 días | Una vez al año |
| Pico de concentraciones séricas | 10-45 min | 4 h | 4-8 h | 1 mes |
| Inicio de acción | 2-4 semanas | 1 mes | 1 mes | 1 mes |
| Ventajas | Rapidez de acción | Dosis y eficacia muy estudiadas | Menos inyecciones y mayor cumplimiento | No necesita inyecciones |
| Desventajas | Múltiples inyecciones diarias que complican el cumplimiento | Inyección dolorosa Problemas de cumplimiento | Inyección muy dolorosa | Requiere un procedimiento quirúrgico para la instalación y retirada del dispositivo |
| Tipos y dosis | Nafarelina nasal (800μg/12 h) Buserelina nasal (40μg /kg/día) Buserelina sc (1200-1800μg/día) Leuprolida sc (50μg/kg/día) Deslorelina sc (4-8μg/kg/día) Histrelina sc (8-10μg/kg/día) Triptorelina sc (20-40μg/kg/día) | Goserelina im 3,6mg Leuprolida im 3,75mg Triptorelina im 3-3,75 mg | Leuprolida im 11,25mg Triptorelina im 11,25 mg | Histerelina en implante anual de 50 mg |
Adaptado de Carel et al 53 .
En la actualidad, el fármaco más utilizado con diferencia es la triptorelina en su forma depot mensual. Probablemente, en los próximos años puedan instaurarse las formas depot trimestrales, cuya eficacia y seguridad se ha mostrado similar a la forma mensual. Claramente, existe menos experiencia con el implante de histerelina53.
Eficacia del tratamiento con análogos de hormona liberadora de gonadotropinasA pesar de no existir ensayos clínicos aleatorizados con análogos en el tratamiento de la PPC, la existencia de diferentes series históricas de pacientes sin tratamiento49 nos ha permitido comparar esos datos con resultados de talla adulta en pacientes afectados de PPC tratados con análogos de GnRH. Además, revisiones recientes que agrupan a un gran número de pacientes nos ha permitido conocer algo más sobre la eficacia de los análogos:
– Carel et al49 analizan los resultados de varios estudios descriptivos y muestran que la talla media alcanzada en aproximadamente 400 niñas tratadas hasta una edad media de 11 años con análogos de GnRH fue de 160cm.
– En la misma dirección apunta un metaanálisis58 que analiza los resultados de talla final de 637 niñas con PPC tratadas con análogos de GnRH. En este trabajo se muestra que el 75% de las niñas tratadas alcanza su talla genética. Además, resaltan que los mejores resultados al comparar la talla adulta y la predicción de talla al inicio del tratamiento se consiguen en las que comenzaron terapia a edades más tempranas.
– Por otra parte, en 26 niños tratados hasta una edad cronológica media de 12 años, la talla final media alcanzada fue de 172,9cm59.
En consecuencia, parece innegable el efecto beneficioso de los análogos de GnRH sobre la talla adulta en niñas con PPC; sin embargo, se ha demostrado que este beneficio es mayor en niñas menores de 6 años (ganancia media de 9 a 10cm sobre predicción de talla antes del tratamiento) frente al grupo de 6 a 8 años (ganancia media de 4 a 5cm). Este hecho no es extrapolable a varones, ya que existen pocos datos de talla adulta53.
Aunque el tema que nos ocupa es la PPC y no una variante de la normalidad como la pubertad adelantada, es preciso reseñar que el tratamiento con análogos de GnRH en el grupo entre 8 a 10 años no ha mostrado eficacia alguna sobre la mejoría de la talla final58, 60.
A día de hoy, podemos afirmar que no hay una evidencia científica grado I para aconsejar tratamiento con análogos de GnRH en pacientes afectados de PPC en lo que se refiere a mejoría de talla final (evidencia científica grado II: series de cohortes amplias, metaanálisis de estudios descriptivos) ni para la prevención de trastornos del comportamiento (los estudios mayoritarios provienen de estudios descriptivos en adelantos puberales: evidencia grado III). Por todo ello y, aunque tradicionalmente la tendencia era tratar a todas las niñas diagnosticadas de PPC independientemente de la edad, deberíamos plantearnos una serie de reflexiones sobre el coste-beneficio, coste-eficacia y riesgo-beneficio del tratamiento con análogos y tratar de establecer criterios comunes teniendo en cuenta una serie de variables (Tabla 4):
– Edad de inicio de tratamiento: claramente existe mayor beneficio del pronóstico de talla adulta en menores de 6 años.
– Evaluación psicopedagógica: sería imprescindible una evaluación psicológica y, si fuera preciso, un test psicométrico, para conocer el estado emocional de la niña y de su familia. También sería recomendable un seguimiento periódico a largo plazo.
– Pronóstico de talla: aquellos que presenten peor pronóstico de talla con respecto a talla diana al diagnóstico se beneficiarán en mejor medida del tratamiento.
– Adopción: si bien se necesitan más estudios, en nuestra opinión, estas niñas a su llegada tienen ciertos problemas de adaptación social (familiar y escolar) que sin duda pueden deteriorarse con un marcado adelanto puberal.
Tabla 4. Variables a tener en cuenta ante un posible tratamiento con análogos de GnRH en niñas con PPC idiopática. Algoritmo propuesto por los autores para inicio de terapia con análogos de GnRH
| Opciones | Puntuación | |
| Edad | < 6 años | 5 puntos |
| 6-8 años | 3 puntos | |
| 8-8,5 años | 1 punto | |
| Pronóstico de talla (método Bayley y Pinneau, average girls) | < 2 SDS de talla diana o < 145cm en paciente adoptado | 2 puntos |
| De –2 SDS a –1 SDS con talla diana o < 150cm en paciente adoptado | 1 punto | |
| De –1 SDS a 0 SDS de talla diana | 0,5 puntos | |
| Acorde/superior a talla diana o > 150cm en paciente adoptado | 0 puntos | |
| Evaluación psicológica | Cociente intelectual < 80 | 2 puntos |
| Alteraciones del comportamiento (colegio/domicilio) | 1 punto | |
| Importante ansiedad familiar | 0,5 puntos | |
| Exploración normal | 0 puntos | |
| Inmigración | Sí | 0,5 puntos |
| No | 0 puntos |
Puntuación final.
Máximo: 9,5 puntos.
Mínimo: 1 punto.
Indicación absoluta de tratamiento: ≥ 5 puntos (grado de recomendación B) 74 .
Recomendable tratar: 3-5 puntos (grado de recomendación C) 74 .
Seguimiento clínico sin tratamiento: < 3 puntos (grado de recomendación D) 74 .
Es otro motivo de controversia. Para ello, tendremos en cuenta que, cuando se suspenda el tratamiento, el niño/a tenga una edad adecuada para desarrollar la pubertad y en la que el pronóstico de talla no sea peor que al principio del tratamiento53. Carel et al49 mostraron que el 66% de la variabilidad de la talla adulta en niñas tratadas con análogos estaba influida por tres factores: edad ósea antes del tratamiento, talla al final del tratamiento y ganancia de talla después de interrumpir la terapia. Estos datos indican la importancia del crecimiento residual tras suspender el tratamiento y, por ello, no habrá que mantenerlo en exceso. Por lo tanto, aunque algunos autores31 abogan por una retirada entre los 12 y 12,5 años de edad ósea en niñas y entre 13 y 13,5 años de edad ósea en niños, parece razonable no continuar con el tratamiento más allá de los 11 años de edad cronológica en las niñas y 12 en los niños7, 49, pudiendo coincidir o no con la edad ósea antes referida.
Con el objetivo de mejorar la talla adulta en pacientes con PPC, se ha especulado con que la adición de otros fármacos (oxandrolona y hormona de crecimiento) mejoraría el resultado final. No obstante, teniendo en cuenta el riesgo-beneficio y los costes económicos derivados de la asociación de estos fármacos, a día de hoy, no existe indicación formal de tratamiento concomitante con estos fármacos en este tipo de patología53.
Seguridad del tratamiento con análogos de la hormona liberadora de gonadotropinasLos efectos secundarios asociados al tratamiento con análogos son escasos e incluyen: reacciones locales (eritema, infección, abscesos), reacciones urticariales, sangrado vaginal en el primer mes de tratamiento, síntomas menopáusicos (calor, rubor, cambios del humor)53.
Una preocupación extendida entre la comunidad científica es la posible ganancia ponderal asociada al uso de triptorelina. Sobre este particular, existen datos discrepantes en la literatura médica. La mayoría de los trabajos reflejan un mayor IMC en las pacientes con PPC al diagnóstico con respecto a la población normal; sin embargo, en el curso del tratamiento con análogos de GnRH, algunos autores no observan cambios del IMC61, 62, mientras que otras investigaciones han objetivado aumento del IMC en el curso de dicha terapia28, 63, 64. Por el contrario, en nuestro conocimiento, existe un único trabajo en la literatura que muestra un descenso del IMC durante el tratamiento con triptorelina65. Estas discrepancias existentes entre los diferentes estudios pueden deberse a varios factores: la mayoría son estudios retrospectivos, grupos heterogéneos (se incluyen pubertades centrales orgánicas e idiopáticas), distintos modelos estadísticos para interpretar dichos resultados, disparidad en la duración del estudio. De lo anterior se deduce que es necesario desarrollar un estudio prospectivo en el que se evalúen con rigor los posibles cambios de IMC y de la composición corporal durante la terapia con análogos de GnRH.
Por otra parte, se temía que la terapia con análogos de GnRH pudiera acarrear la presencia de osteoporosis al disminuir la síntesis de esteroides sexuales, factores primordiales para la adquisición del pico de masa ósea. A día de hoy, se ha podido comprobar que durante el tratamiento aparece una osteoporosis u osteopenia transitorias, que son reversibles, de tal forma que la adquisición final del pico de masa ósea no se ve afectada61, 66.
Otro motivo de preocupación entre la comunidad científica era las consecuencias sobre la capacidad reproductora. Afortunadamente, los datos de los que disponemos en la actualidad muestran que la función reproductiva está conservada tanto en varones como mujeres67, 68, 69. En el caso de las mujeres, el tiempo medio en aparecer la menstruación tras la retirada de los análogos oscila entre 2 a 61 meses, sin objetivar diferencias con respecto a la población normal en cuanto al porcentaje de ciclos ováricos regulares69, 70, 71, 72.
Finalmente, existen datos dispares en cuanto a la prevalencia de síndrome de ovario poliquístico tras la retirada del tratamiento con análogos de hormona de crecimiento. En una revisión muy reciente, se recogían los datos de varios estudios previos mostrando una frecuencia que oscilaba entre 0-12%, similar a la población general53. Sin embargo, un grupo italiano73 ha encontrado una prevalencia de hasta un 30%, aunque hay que reseñar que el tamaño muestral de este trabajo es muy reducido (46 niñas con antecedentes de PPC idiopática tratadas con análogos) para poder extraer conclusiones.
Áreas de controversia y perspectivas futurasEtiología de la pubertad precoz central idiopáticaUn elevado porcentaje de casos de PPC son idiopáticos. El conocimiento más detallado de la neurorregulación de la pubertad contribuirá a aclarar en los próximos años, al menos en parte, con muchos de los casos considerados idiopáticos.
Prevalencia e incidencia de pubertad precoz centralAún siendo una enfermedad rara, se intuye un aumento de los casos en los últimos años. Para explicar el cambio en esta tendencia existen varias teorías: factores nutricionales (epidemia de obesidad), ambientales (disruptores endocrinológicos) y psicosociales (adopción). En definitiva, es necesario fomentar estudios epidemiológicos prospectivos y multicéntricos que determinen la incidencia y prevalencia real de PPC y que traten de demostrar las distintas hipótesis planteadas.
Adopción y pubertad precoz centralAunque es evidente el riesgo de desarrollo de PPC entre los adoptados, el mecanismo íntimo que explica esta asociación no se ha aclarado. Por ello, se plantea la necesidad de diseñar protocolos de seguimiento de estos niños desde su llegada al país de acogida hasta la pubertad, evaluando periódicamente datos antropométricos y psicológicos.
Utilidad de gonadotropinas basalesEl avance técnico en la cuantificación de gonadotropinas basales en los últimos años ha sido notable; sin embargo, no hay datos claros de sensibilidad y especificidad en comparación con la prueba de oro que es el test de LHRH (realización de curva ROC). En consecuencia, para la implantación de esta técnica como cribado de PPC serán necesarios estudios multicéntricos que cumplan criterios comunes de selección de pacientes y, por supuesto, que utilicen la misma técnica. (Nivel de recomendación y evidencia científica BII).
Resonancia magnética craneal en niñas con pubertad precoz centralDesde hace tiempo, se han buscado variables predictoras de patología endocraneal y, paralelamente, se han tratado de establecer algoritmos diagnósticos para seleccionar a qué niñas realizar RM craneal. Lamentablemente, no hay variables capaces de predecir en un 100% la presencia o ausencia de patología endocraneal. Por ello, a la espera de nuevos estudios colaborativos, es recomendable la realización de una prueba de imagen a toda niña diagnosticada de PPC. (Nivel de recomendación y evidencia científica BII).
Comorbilidad asociada a pubertad precoz centralEs evidente que los niños/as con PPC sin tratamiento presentan mal pronóstico de talla (BII). Sin embargo, no hay estudios sólidos que relacionen PPC con cáncer (BII-CIII) ni con trastornos psicológicos/del comportamiento (CIII). La mayoría de los datos provienen de estudios casos-control y de estudios descriptivos y lo relacionan, más bien, con adelanto puberal. Precisamente por estos hechos, se plantea la necesidad de informar con cautela sobre la posibilidad de patología asociada a la PPC. Por este motivo, sería de enorme interés la planificación de estudios de evaluación psicológica al diagnóstico y durante el tratamiento con análogos, comparándolos con un grupo control de niñas prepuberales. Por otra parte, deberían crearse bases de datos de PPC con recogida de datos hasta la etapa adulta para estudiar la posible interacción con cáncer.
¿Es necesario tratar a todas las niñas con pubertad precoz central?Tradicionalmente, se frenaba la pubertad para mejorar el pronóstico de talla adulta y para evitar trastornos psicológicos derivados de un adelanto puberal. Pues bien, el conocimiento de diferentes series de talla adulta nos ha permitido saber que el tratamiento es mucho más eficaz en niñas < de 6 años (BII). A este hecho tenemos que sumar nuestro desconocimiento real sobre el impacto psicológico que acontece a niñas con PPC (CIII). Por todo ello, aún debe reflexionarse sobre el beneficio real de frenar la pubertad a todas las niñas diagnosticadas de PPC. Así, parece de interés analizar distintas variables (edad al diagnóstico, pronóstico de talla, perfil psicopedagógico, adoptada) antes de plantear algún tratamiento.
¿Cuándo finalizar la terapia con análogos de la hormona liberadora de gonadotropinas?No existe un consenso internacional nítido en la literatura científica. A día de hoy, puede afirmarse que hay que individualizar a cada paciente valorando la maduración psicológica y el pronóstico de talla final. (Nivel de recomendación y evidencia científica CIII).
Seguridad del tratamiento con análogos de la hormona liberadora de gonadotropinasDespués de 30 años de experiencia, puede afirmarse que es un tratamiento seguro y se ha demostrado que no plantea complicaciones de osteoporosis ni de infertilidad. Quizás sea preciso aclarar, a través de estudios prospectivos, su influencia real sobre el IMC y la composición corporal. (Nivel de recomendación y evidencia científica BII).
Mejor forma de tratamientoEn nuestro país estamos habituados al uso de triptorelina mensual; sin embargo, hay datos de eficacia y seguridad contrastada en las formas trimestrales (BII). Entendemos que debería instaurarse progresivamente esta terapia, al menos inicialmente, en aquellos pacientes en los que haya pocas dudas de un seguimiento terapéutico correcto, ya que reduce el número de inyecciones y, paralelamente, se consumen menos recursos sanitarios. Las perspectivas futuras se centran en la terapia con histerelina, si los resultados a largo plazo son similares o mejores.
Los grados de recomendación y niveles de evidencia científica se han tomado de la agencia americana para la investigación sanitaria de calidad74.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Recibido 7 Noviembre 2010
Aceptado 8 Noviembre 2010
Autor para correspondencia. argentefen@terra.es