Sr. Editor:
En la bibliografía se ha recogido diferentes tipos de quilotórax tratados con octreotida, pero ninguno tras la reparación quirúrgica de una atresia de esófago, por lo que nos parece interesante su publicación.
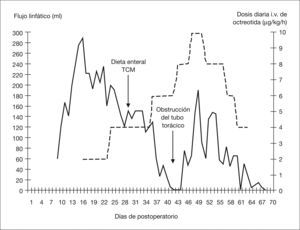
Presentamos el caso clínico de una niña con diagnóstico de atresia de esófago, trasladada a nuestro hospital para su tratamiento quirúrgico. Antecedentes de crecimiento intrauterino retardado e hidramnios, cesárea a la semana 35 de gestación y peso al nacer de 1.423g. Fue intervenida a las 48h de vida de atresia de esófago tipo 3, mediante abordaje extrapleural. Al día 7 del postoperatorio desarrolló un derrame pleural que requirió la colocación de un tubo de drenaje torácico. El análisis del líquido pleural fue diagnóstico de quilotórax. El flujo linfático se incrementó rápidamente, alcanzando 288ml/día en el día 16 del postoperatorio. En este momento se inició tratamiento con octreotida intravenosa en dosis de 2μg/kg/h. La respuesta fue lenta, por lo que se incrementó progresivamente la dosis hasta 10μg/kg/h el día 47 del postoperatorio. Se inició alimentación enteral con triglicéridos de cadena media el día 29 del postoperatorio y se redujo progresivamente la nutrición parenteral. Dada la favorable respuesta al tratamiento, disminuimos la dosis de la octreotida a partir del día 51 del postoperatorio, y suspendimos su administración el día 64 (fig. 1). El resto de la evolución se desarrolló sin incidencias.
El quilotórax es la causa más frecuente de derrame pleural neonatal1,2, con una incidencia del 1 %3, que aumenta tras procedimientos quirúrgicos torácicos; es del 3,8 % tras cirugía cardíaca4 y hasta del 27 % tras reparación de una hernia diafragmática5. Su incidencia tras la reparación de una atresia de esófago es desconocida, con muy pocos casos descritos en la bibliografía1,2,6.
El quilotórax neonatal posquirúrgico es generalmente secundario a la lesión del conducto torácico y/o canales linfáticos3. El intervalo entre el traumatismo quirúrgico y la aparición del quilotórax varía entre 1 y 25 días, con un período medio de 7 días2,4,6. La eficacia del tratamiento conservador del quilotórax es alta, logrando su resolución en el 80 % de los casos1. Este tratamiento incluye medidas nutricionales destinadas a disminuir el flujo linfático a nivel torácico, como la alimentación enteral con triglicéridos de cadena media, la nutrición parenteral total1,3,7 o la combinación de ambas1,5,8, que evitan la pérdida de peso y mantienen un aceptable equilibrio calórico y proteico8. No obstante, el tratamiento conservador puede causar una larga estancia hospitalaria e incrementar la morbilidad3,9, con importantes complicaciones de tipo infeccioso y nutricional1,7. Actualmente, no existe consenso en la bibliografía con respecto al período de espera antes de indicar un procedimiento quirúrgico. Algunos autores establecen un tiempo límite de 4 semanas, porque la mayoría de los pacientes responden antes1,6; otros recomiendan períodos mayores7. Las principales indicaciones de cirugía, establecidas en la bibliografía, son la malnutrición, la inestabilidad metabólica y el derrame pleural persistente más de 4 semanas, aunque existe una amplia variación de criterios entre los diferentes equipos1,6–8. Se han utilizado múltiples procedimientos quirúrgicos1–3,5,7. La toracotomía y la ligadura del conducto torácico representan una importante cirugía que no siempre es resolutiva4,6. La pleurodesis tiene buenos resultados6, pero incrementa la posibilidad de linfedema y fibrosis pulmonar2. Los procedimientos toracoscópicos todavía son limitados en estos pacientes7. La derivación pleuroperitoneal parece una opción efectiva, y actualmente se recomienda como el procedimiento quirúrgico de elección, aunque no está exenta de complicaciones y largos períodos de hospitalización7.
La octreotida ha sido efectiva en el tratamiento del quilotórax neonatal espontáneo y posquirúrgico tras la cirugía cardíaca y la reparación de la hernia diafragmática1,4,9. La dosis recomendada en pacientes pediátricos es de 20–70μg/kg/día, dividida en tres dosis subcutáneas, o mediante infusión intravenosa continua entre 1 y 10μg/kg/h10 Nosotros hemos utilizado la infusión intravenosa continua durante 48 días con dosis de 2–10μg/kg/h, con buena tolerancia y sin efectos adversos.
Creemos que los actuales cuidados neonatales y nutricionales, asociados a la administración de octreotida, hacen posible el manejo conservador del quilotórax neonatal posquirúrgico durante un largo período de tiempo, evitando un procedimiento quirúrgico no siempre efectivo y nunca exento de importantes riesgos.