Avances en el diagnóstico molecular han hecho posible la detección de agentes virales desconocidos en infecciones de las vías respiratorias inferiores (IVRI). Sin embargo, sigue habiendo dudas relativamente a su frecuencia y relevancia.
ObjetivoComparar la clínica y la gravedad entre la infección por virus único y la coinfección en niños admitidos por IVRI.
MétodosSe realizó un estudio durante 3 años consecutivos (2012-2015) que incluyó a niños menores de 2 años ingresados por IVRI. La identificación viral se realizó mediante la técnica de PCR para 16 virus. Los datos clínicos y el uso de los recursos hospitalarios se recogieron de forma estándar durante la estancia hospitalaria y se compararon la infección única con coinfecciones virales.
ResultadosFueron analizadas 524 muestras (451 pacientes); 448 (85,5%) tuvieron al menos un virus identificado. Coinfecciones virales se encontraron en 159 (35,5%). RSV y HRV fueron los virus más frecuentes; bronquiolitis y neumonía, los diagnósticos principales. Los pacientes con coinfecciones virales eran mayores, iban a la guardería, tenían sibilancias recurrentes con más frecuencia y eran más sintomáticos al ingreso. No fueron sometidos a más exámenes, pero les fueron prescritos medicamentos con más frecuencia. El grupo de la coinfección viral no mostró una mayor duración de la estancia hospitalaria, de la necesidad de oxígeno, de UCI o soporte ventilatorio.
DiscusiónNuestro estudio mostró una proporción significativa de coinfecciones virales en los niños pequeños ingresados con IVRI y confirma dados previos que muestran que la prescripción es más frecuente en las coinfecciones virales, sin asociación con peor resultado clínico.
Advances in molecular diagnosis have made it possible to detect previously unknown viral agents as causative agents of lower respiratory tract infections (LRTI). The frequency and relevance of viral coinfections is still debatable.
Objectivecompare clinical presentation and severity between single virus infection and viral coinfection in children admitted for LRTI.
MethodsA 3-year period observational study (2012-2015) included children younger than two years admitted for LRTI. Viral identification was performed using PCR technique for 16 viruses. Clinical data and use of health resources was gathered during hospital stay using a standard collection form and we compared single virus infection and viral coinfections.
ResultsThe study included 524 samples (451 patients); 448 (85,5%) had at least one virus identified. Viral coinfections were found in 159 (35,5%). RSV and HRV were the most commonly identified virus; bronchiolitis and pneumonia the most frequent diagnosis. Patients with viral coinfections were older, attended day-care centers, had previous recurrent wheezing more frequently and were more symptomatic at admission. These patients did not have more complementary exams performed but were prescribed medications more often. Viral coinfection group did not show longer length of hospital stay and oxygen need, more need for ICU nor ventilatory support.
DiscussionOur study showed a significant proportion of viral coinfections in young infants admitted with LRTI and confirmed previous data showing that prescription was more frequent in inpatients with viral coinfections, without an association with worst clinical outcome.
Las infecciones de las vías respiratorias inferiores (IVRI) son una causa común de hospitalización en pacientes pediátricos1-3, especialmente en menores de 2 años4-6. Se han identificado distintos virus como agentes etiológicos de IVRI, entre ellos el virus sincitial respiratorio (VSR), adenovirus (ADV), virus de la gripe tipo A (VGA) y tipo B (VGB), rinovirus humano (RVH) y los virus parainfluenza de tipo 1 (PIV1), 2 (PIV2) y 3 (PIV3)7-10. El VSR continua siendo el patógeno viral más importante en la infancia, tanto en infecciones por virus único como en coinfecciones virales4,6.
En los últimos veinte años la emergencia de las tecnologías basadas en la reacción en cadena de la polimerasa (PCR) ha llevado a un aumento considerable en la sensibilidad del diagnóstico de infecciones virales, pudiéndose detectar un gran número de virus, así como más de un virus en cada muestra de secreciones respiratorias2,11,12. Estas pruebas permiten detectar virus imposibles de cultivar mediante técnicas convencionales2 y han ayudado a identificar al menos 4 virus adicionales asociados a IVRI: metapneumovirus (MPV)13, coronavirus (CoV)14-16, bocavirus (hBoV)17 y parainfluenza 4 (PIV4)18,19.
La prevalencia de coinfección viral detectada por PCR en niños hospitalizados con IVRI grave oscila entre el 14 y el 44%20. No ha podido determinarse aún si la coinfección viral tiene o no un impacto clínico significativo6,11,21-24. Un metaanálisis reciente encontró resultados que divergían fundamentalmente sobre la base de la edad (incluyendo a pacientes adultos), comorbilidades, estacionalidad, área geográfica y método de detección empleado25.
El objetivo principal del estudio era comparar la gravedad de la clínica y la evolución clínica a corto plazo de infecciones por virus único y coinfecciones virales en niños ingresados por IVRI. También se compararon los recursos sanitarios utilizados en cada grupo.
El estudio partía de la hipótesis de que los pacientes con coinfección viral presentarían cuadros más graves y requerirían más pruebas complementarias y recursos sanitarios para su tratamiento.
MétodosEstudio prospectivo observacional unicéntrico en el que se incluyó a pacientes ingresados por IVRI consecutivamente entre octubre del 2012 y septiembre del 2015 en el servicio de pediatría de un hospital universitario de tercer nivel. El servicio atiende a niños previamente sanos que acuden a los servicios de urgencias (SU) comprendidos en el área de referencia del hospital y a niños con enfermedades crónicas o graves provenientes de otros hospitales de la zona. Durante el período de estudio acudieron un total de 119.682 niños a los SU, de los que fueron ingresados el 3,3%.
Se incluyó en el estudio a los niños menores de 2 años con diagnóstico de IVRI. El diagnóstico al alta de cada paciente fue establecido por el médico a su cargo, que también recogió los datos clínicos al ingreso y al alta en un formulario estandarizado creado ex profeso para el estudio. Se analizaron datos demográficos de los pacientes (sexo, edad), comorbilidades o enfermedades crónicas asociadas (prematuridad, muy bajo peso al nacer, enfermedades respiratorias, cardiovasculares, neurológicas o genéticas), datos clínicos y del entorno (lactancia materna, exposición al humo de tabaco, asistencia a guardería), duración de signos y síntomas asociados a la infección respiratoria aguda, y hallazgos del examen físico al ingreso. También se comparó la cantidad de recursos sanitarios utilizados, en concreto las pruebas complementarias realizadas (incluyendo análisis de sangre, cultivos bacterianos de muestras respiratorias, radiografía [RX] torácica), tratamientos indicados (broncodilatadores, antibióticos, administración de oxígeno y soporte ventilatorio), duración de la estancia hospitalaria e ingreso en la unidad de cuidados intensivos (UCI).
En las primeras 72 h del ingreso se recogieron secreciones respiratorias mediante aspirado nasofaríngeo (ANF) o frotis. Las muestras se enviaron al Laboratorio de Microbiología, donde se llevaron a cabo los pertinentes estudios bacteriológicos y virales. La identificación viral se realizó mediante interpretación cualitativa de PCR en tiempo real (Anyplex™ II RV16 [Seegene Inc., Seoul, Korea] hasta principios de diciembre de 2015, y Allplex Respiratory Panel I, II y III [Seegene Inc., Seoul, Korea] posteriormente). Ambos kits permitían la identificación simultánea de 16 virus: ADV, VGA, VGB, PIV1, 2, 3 y 4, RVH, VSRA y VSRB, hBoV, CoV 229E, NL63 y OC43, MPV y enterovirus (EV). El segundo permitía también diferenciar entre influenza A (H1N1) pdm09 y A(H3).
La coinfección viral se definió como la detección simultánea de múltiples patógenos virales en una misma muestra respiratoria y la coinfección bacteriana o infección pulmonar bacteriana secundaria sobre la base de cultivos bacterianos positivos. Las pruebas bacteriológicas se realizaron exclusivamente a petición del doctor a cargo del paciente. Las cepas aisladas de muestras de secreciones respiratorias (expectoración, secreciones bronquiales) obtenidas por frotis se identificaron sobre la base de la presencia de células epiteliales y neutrófilos, y la morfología de la bacteria predominante. En todas las muestras, independientemente del método de obtención, se aislaron las colonias con morfología macroscópica distintiva en cultivo puro26. La coinfección se definió sobre la base de criterios microbiológicos debido a la superposición de la clínica de distintos diagnósticos, en particular bronquiolitis y neumonía27.
La gravedad se determinó sobre la base de los días de estancia hospitalaria, el ingreso en la UCI y la necesidad de ventilación mecánica, tanto invasiva como no invasiva.
Análisis estadísticoPara facilitar la comunicación de nuestros datos, nos referiremos a ellos como casos o muestras. Los datos se codificaron antes de su análisis, para el que se utilizó el Statistical Package for the Social Sciences® versión 20.0 (International Business Machines Corp. Armonk, New York). Se generaron estadísticos descriptivos, expresando los valores de variables discretas como frecuencias absolutas y porcentajes, y los de variables continuas mediante la mediana y el rango intercuartílico (RIQ) o la media y la desviación estándar (DE), según fuera apropiado. Las variables continuas se compararon por medio de la prueba no paramétrica de suma de rangos de Wilcoxon o, si los datos seguían una distribución normal (sobre la base de la prueba de Shapiro-Wilk), mediante la prueba t de Student, realizándose ambas pruebas para 2 colas. En cuanto a las variables discretas, las comparaciones entre grupos se realizaron mediante análisis de tablas de contingencia y la prueba de la chi al cuadrado o el test exacto de Fisher, según correspondiera. Todos los p-valores se calcularon para pruebas a 2 colas y se estableció el nivel de significación estadística en p<0,05.
Se ajustó un modelo de regresión logística para identificar variables clínicas y virológicas asociadas a la estancia hospitalaria. Las variables asociadas al ingreso en la UCI se identificaron mediante regresión logística univariante y multivariante. Los factores que se incluyeron en el modelo fueron aquellos que mostraron una asociación con la variable de respuesta en los análisis crudos (p<0,05) o que podían ser relevantes a nivel clínico. Los resultados de los modelos de regresión logística se expresaron mediante odds ratios (OR) e intervalos de confianza (IC) del 95%.
Declaración de principios éticosEl estudio se realizó en conformidad con los principios establecidos en la Declaración de Helsinki y fue aprobado por el comité ético institucional. Se obtuvo el consentimiento informado oral de los padres o tutores legales de todos los pacientes.
ResultadosCaracterísticas demográficas y clínicasDurante el período de estudio se obtuvo un total de 524 muestras de niños menores de 24 meses ingresados por IVRI.
Las muestras correspondieron a un total de 451 niños, predominantemente varones (n=253; 56,1%), de los que 105 (23,3%) eran prematuros, 112 (24,8%) pesaron menos de 2.500g al nacer y 83 (18,4%) tenían enfermedad crónica de base. Cincuenta y un pacientes fueron hospitalizados más de una vez por episodios de IVRI durante los 3 años del estudio, de los que 19 (37%) presentaban alguna enfermedad crónica.
La edad mediana de la muestra fue de 3,9 meses (RIQ, 1,2-10,0), y aproximadamente la mitad de los pacientes (50,6%) tenían menos de 4 meses de edad; 112/442 (25,3%) acudían a la guardería y 214/487 (43,9%) habían estado expuestos a humo de tabaco.
En los 524 casos, el tiempo de evolución medio de los síntomas previos al ingreso fue de 5,4 días (DE 5,7). La tos (466; 88,9%) y la rinorrea (458; 87,4%) fueron los principales síntomas al ingreso, mientras que el distrés respiratorio fue el signo más frecuente (458; 87,4%), con hipoxemia en 171 (32,6%) episodios.
Se recogieron y analizaron muestras de sangre para hemograma y niveles de proteína C reactiva en 364 casos (69,5%); se hizo cultivo bacteriológico de secreciones respiratorias en 260 (49,6%) y RX de pecho en 343 (65,5%).
Durante la estancia hospitalaria se indicó el uso de oxígeno suplementario según fuera necesario en 472 casos (90,1%), con una duración mediana de la oxigenoterapia (O2) de 96 h (RIQ 48-144). Se utilizó nutrición enteral por sonda nasogástrica en 332 casos (63,4%). En 320 casos (61,1%) se prescribió antibioterapia por vía intravenosa, en su mayoría (300; 93,8%) por sospecha o confirmación de infección bacteriana, incluyendo otitis media aguda y/o bronquitis o neumonía. La estancia hospitalaria mediana fue de 6 días (RIQ 4-9).
Ciento dieciséis pacientes (22,1%) ingresaron en la UCI, con una estancia mediana en la unidad de 4 días (RIQ 3-7). Noventa y ocho casos (84,5%) requirieron ventilación mecánica: invasiva en 34 casos, no invasiva en 49 y de ambos tipos en 15. La duración mediana del soporte ventilatorio fue de 4 días (RIQ 2-6).
El diagnóstico al alta más frecuente fue bronquiolitis aguda con o sin sobreinfección bacteriana (328; 62,6%), seguido de neumonía adquirida en la comunidad (109; 20,8%).
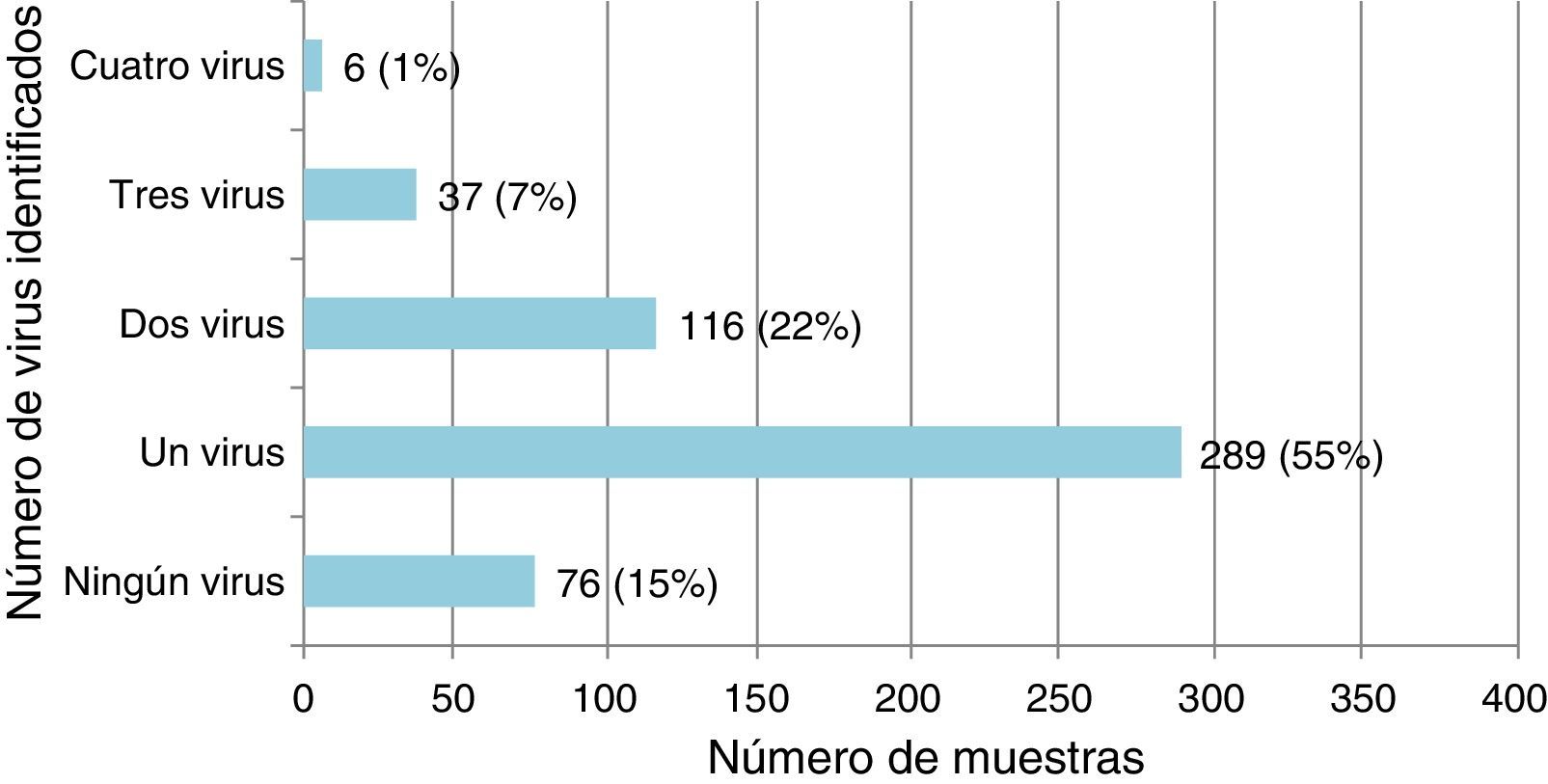
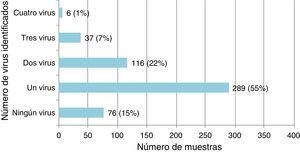
Infección por virus único y coinfección viral en niños con infecciones de las vías respiratorias inferioresDe los 524 especímenes respiratorios recogidos, 448 (85,5%) fueron positivos a uno o más virus (fig. 1). El VSR fue el virus detectado más frecuentemente, seguido del RVH (tabla 1).
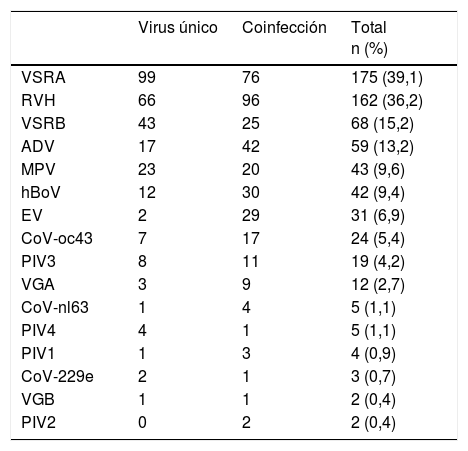
Virus identificado en infección por virus único o de coinfección viral en las 448 muestras de secreciones respiratorias positivas en pacientes menores de 2 años ingresados por IVRI
| Virus único | Coinfección | Total n (%) | |
|---|---|---|---|
| VSRA | 99 | 76 | 175 (39,1) |
| RVH | 66 | 96 | 162 (36,2) |
| VSRB | 43 | 25 | 68 (15,2) |
| ADV | 17 | 42 | 59 (13,2) |
| MPV | 23 | 20 | 43 (9,6) |
| hBoV | 12 | 30 | 42 (9,4) |
| EV | 2 | 29 | 31 (6,9) |
| CoV-oc43 | 7 | 17 | 24 (5,4) |
| PIV3 | 8 | 11 | 19 (4,2) |
| VGA | 3 | 9 | 12 (2,7) |
| CoV-nl63 | 1 | 4 | 5 (1,1) |
| PIV4 | 4 | 1 | 5 (1,1) |
| PIV1 | 1 | 3 | 4 (0,9) |
| CoV-229e | 2 | 1 | 3 (0,7) |
| VGB | 1 | 1 | 2 (0,4) |
| PIV2 | 0 | 2 | 2 (0,4) |
Se detectó infección por virus único en 289/448 (64,5%) de los casos positivos, en los que el VSR fue el virus detectado más frecuentemente (142 casos; 49,1%). Hubo coinfección viral en 159/448 casos (35,5%), en su mayoría implicando al VSR (101; 63,5%) y el RVH (96; 60,4%) (tabla 1). El VSR se detectó con mayor frecuencia en infecciones por un único virus (p=0,018) y el RVH en coinfecciones virales (p=0,05).
La coinfección viral no fue más frecuente en los meses invernales (diciembre-febrero) en comparación con la infección por virus único (103 [64,8%] vs. 178 [61,6%]; p=0,5).
Se detectó coinfección viral o bacteriana en 125/448 casos (27,9%). Las bacterias involucradas con mayor frecuencia en coinfecciones fueron Haemophilus influenzae no tipificable (79/125 casos; 63%) y Streptococcus pneumoniae (27/125 casos; 21%).
La bronquiolitis fue el diagnóstico al alta más frecuente asociado a infecciones por virus único y coinfecciones virales (194 [78,9%] vs. 85 [66,4%]), mientras que la neumonía fue más frecuente en coinfecciones virales (43 [33,6%] vs. 52 [21,1%]; p=0,012).
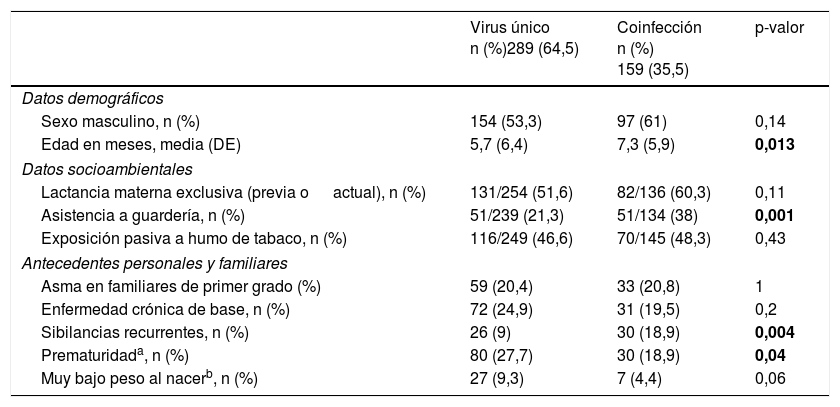
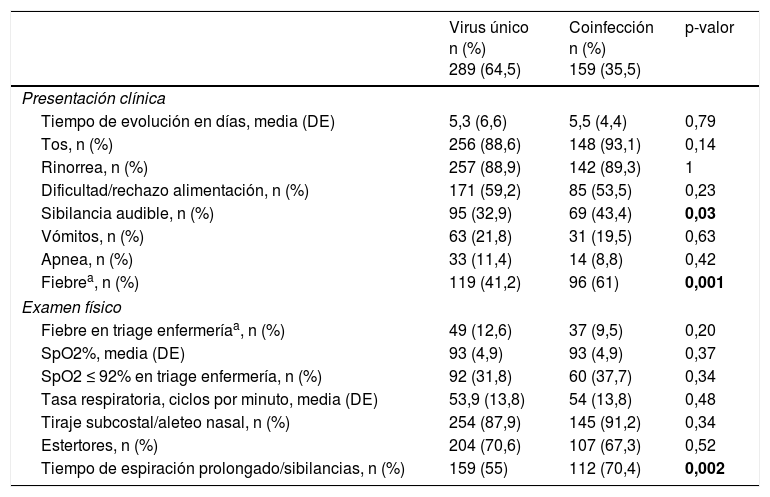
Características demográficas, socioambientales y clínicas de la infección por virus único y la coinfección viralLas tablas 2 y 3 muestran los datos demográficos y socioambientales, los antecedentes personales y las características clínicas asociadas a las infecciones por virus único y las coinfecciones virales en pacientes con IVRI. La edad media al ingreso fue significativamente mayor en casos con coinfección viral. Los antecedentes de sibilancias recurrentes y de asistencia a guardería, y las sibilancias audibles, la fiebre y el broncoespasmo al ingreso se asociaron con mayor frecuencia a la coinfección viral. La prematuridad se asoció con mayor frecuencia a la infección por virus único. Todos los pacientes fueron dados de alta al domicilio o transferidos a otro hospital; no hubo fallecimientos.
Características demográficas y socioambientales y antecedentes personales asociadas a la infección por virus único y la coinfección viral
| Virus único n (%)289 (64,5) | Coinfección n (%) 159 (35,5) | p-valor | |
|---|---|---|---|
| Datos demográficos | |||
| Sexo masculino, n (%) | 154 (53,3) | 97 (61) | 0,14 |
| Edad en meses, media (DE) | 5,7 (6,4) | 7,3 (5,9) | 0,013 |
| Datos socioambientales | |||
| Lactancia materna exclusiva (previa o actual), n (%) | 131/254 (51,6) | 82/136 (60,3) | 0,11 |
| Asistencia a guardería, n (%) | 51/239 (21,3) | 51/134 (38) | 0,001 |
| Exposición pasiva a humo de tabaco, n (%) | 116/249 (46,6) | 70/145 (48,3) | 0,43 |
| Antecedentes personales y familiares | |||
| Asma en familiares de primer grado (%) | 59 (20,4) | 33 (20,8) | 1 |
| Enfermedad crónica de base, n (%) | 72 (24,9) | 31 (19,5) | 0,2 |
| Sibilancias recurrentes, n (%) | 26 (9) | 30 (18,9) | 0,004 |
| Prematuridada, n (%) | 80 (27,7) | 30 (18,9) | 0,04 |
| Muy bajo peso al nacerb, n (%) | 27 (9,3) | 7 (4,4) | 0,06 |
Manifestaciones clínicas y hallazgos del examen físico asociados a infección por virus único y coinfección viral
| Virus único n (%) 289 (64,5) | Coinfección n (%) 159 (35,5) | p-valor | |
|---|---|---|---|
| Presentación clínica | |||
| Tiempo de evolución en días, media (DE) | 5,3 (6,6) | 5,5 (4,4) | 0,79 |
| Tos, n (%) | 256 (88,6) | 148 (93,1) | 0,14 |
| Rinorrea, n (%) | 257 (88,9) | 142 (89,3) | 1 |
| Dificultad/rechazo alimentación, n (%) | 171 (59,2) | 85 (53,5) | 0,23 |
| Sibilancia audible, n (%) | 95 (32,9) | 69 (43,4) | 0,03 |
| Vómitos, n (%) | 63 (21,8) | 31 (19,5) | 0,63 |
| Apnea, n (%) | 33 (11,4) | 14 (8,8) | 0,42 |
| Fiebrea, n (%) | 119 (41,2) | 96 (61) | 0,001 |
| Examen físico | |||
| Fiebre en triage enfermeríaa, n (%) | 49 (12,6) | 37 (9,5) | 0,20 |
| SpO2%, media (DE) | 93 (4,9) | 93 (4,9) | 0,37 |
| SpO2 ≤ 92% en triage enfermería, n (%) | 92 (31,8) | 60 (37,7) | 0,34 |
| Tasa respiratoria, ciclos por minuto, media (DE) | 53,9 (13,8) | 54 (13,8) | 0,48 |
| Tiraje subcostal/aleteo nasal, n (%) | 254 (87,9) | 145 (91,2) | 0,34 |
| Estertores, n (%) | 204 (70,6) | 107 (67,3) | 0,52 |
| Tiempo de espiración prolongado/sibilancias, n (%) | 159 (55) | 112 (70,4) | 0,002 |
DE: desviación estándar; SpO2: δsaturación de oxígeno capilar periférica.
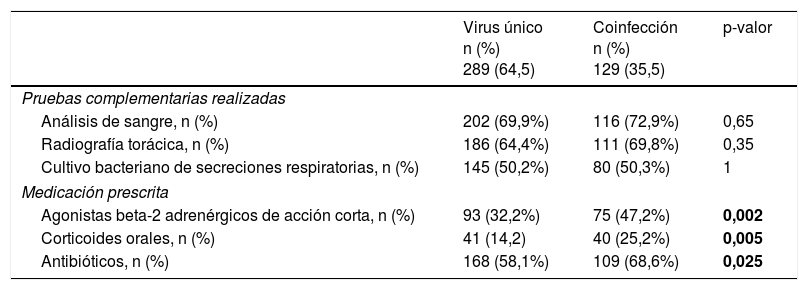
No se observaron diferencias significativas entre el grupo con infección por virus único y el grupo con coinfección viral en cuanto a las pruebas complementarias, aunque la prescripción de medicamentos fue más frecuente en el grupo con coinfección viral (tabla 4). La amoxicilina/ácido clavulánico fue el antibiótico prescrito con mayor frecuencia en ambos grupos (59/109 de casos con coinfección y 112/168 de casos con infección por virus único).
Comparación de utilización de recursos hospitalarios en infecciones por virus único y coinfecciones virales
| Virus único n (%) 289 (64,5) | Coinfección n (%) 129 (35,5) | p-valor | |
|---|---|---|---|
| Pruebas complementarias realizadas | |||
| Análisis de sangre, n (%) | 202 (69,9%) | 116 (72,9%) | 0,65 |
| Radiografía torácica, n (%) | 186 (64,4%) | 111 (69,8%) | 0,35 |
| Cultivo bacteriano de secreciones respiratorias, n (%) | 145 (50,2%) | 80 (50,3%) | 1 |
| Medicación prescrita | |||
| Agonistas beta-2 adrenérgicos de acción corta, n (%) | 93 (32,2%) | 75 (47,2%) | 0,002 |
| Corticoides orales, n (%) | 41 (14,2) | 40 (25,2%) | 0,005 |
| Antibióticos, n (%) | 168 (58,1%) | 109 (68,6%) | 0,025 |
Asimismo, en casos con diagnóstico al alta de neumonía, en los que fue más frecuente la coinfección viral, se prescribieron más agonistas beta-2 adrenérgicos de acción corta (53 [48,6%] vs. 76 [23,4%]; p<0,001), corticoides orales (23 [21,1%] vs. 17 [5,2%]; p<0,001) y antibióticos (105 [96,3%] vs. 165 [50,6%]; p<0,001) en comparación con los pacientes con bronquiolitis.
Al comparar las coinfecciones virales/bacterianas con aquellas en las que no hubo aislado bacteriano, observamos que en las primeras se realizaron más frecuentemente análisis de sangre (104 [84,6%] vs. 215 [67,6%]; p<0,001) y RX de pecho (100 [80,6%] vs. 197 [61,4%], p<0,001). La antibioterapia por vía intravenosa se prescribió con mayor frecuencia en casos de coinfección viral/bacteriana (116 [92,8%] vs. 161 [50%]; p<0,001). No se observaron diferencias entre estos grupos en el uso de broncodilatadores (40 [32%] vs. 128 [39,6%]; p=0,15) o de corticoides (19 [15,2%] vs. 62 [19,3%]; p=0,34).
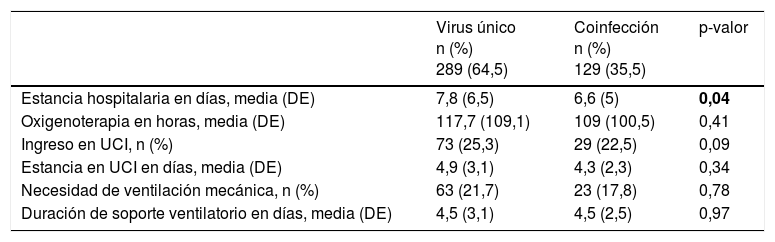
La estancia hospitalaria media fue algo más prolongada en el grupo con infección por virus único en comparación con el grupo con coinfección. No se observaron diferencias significativas entre estos grupos en los demás parámetros de gravedad (tabla 5).
Comparación de evolución clínica y gravedad en infecciones por virus único y coinfecciones virales
| Virus único n (%) 289 (64,5) | Coinfección n (%) 129 (35,5) | p-valor | |
|---|---|---|---|
| Estancia hospitalaria en días, media (DE) | 7,8 (6,5) | 6,6 (5) | 0,04 |
| Oxigenoterapia en horas, media (DE) | 117,7 (109,1) | 109 (100,5) | 0,41 |
| Ingreso en UCI, n (%) | 73 (25,3) | 29 (22,5) | 0,09 |
| Estancia en UCI en días, media (DE) | 4,9 (3,1) | 4,3 (2,3) | 0,34 |
| Necesidad de ventilación mecánica, n (%) | 63 (21,7) | 23 (17,8) | 0,78 |
| Duración de soporte ventilatorio en días, media (DE) | 4,5 (3,1) | 4,5 (2,5) | 0,97 |
DE: desviación estándar; UCI: unidad de cuidados intensivos.
Tras el ajuste, el modelo de regresión múltiple mostró que las variables principales asociadas con una estancia más prolongada fueron la prematuridad (con un aumento de 2,2 días [IC del 95%: 1,0-3,5]) y la prescripción de antibioterapia (con un aumento de 2,7 días [IC del 95%: 1,5-3,8]). El modelo de regresión logística multivariante ajustado mostró que las variables principales asociadas al ingreso en la UCI fueron la presencia de fallo respiratorio agudo/hipercapnia con requerimiento de ventilación mecánica y antibioterapia (OR 46,6 [IC del 95%: 20,7-104,9] y 7,4 [IC del 95%: 2,4-22,3], respectivamente). En este análisis no se mantuvo la asociación entre la coinfección y la estancia hospitalaria o el ingreso en la UCI.
DiscusiónNuestro estudio unicéntrico encontró una prevalencia alta de virus respiratorios (detección>85%). Los virus VSR A y B fueron los detectados con mayor frecuencia, seguidos del RVH, en infección única o coinfección; conjuntamente, ambos virus ascendían a más de la mitad de las detecciones de virus único.
La prevalencia de coinfección viral (35,5%) se aproximó a la descrita por otros autores que emplearon técnicas de detección viral similares11,23. Los virus implicados con mayor frecuencia fueron el RVH (60,4%) y el VSR A (47,8%), patógenos que también predominaron en las infecciones por virus único, como se observó en estudios anteriores11. El ADV fue el tercer virus más identificado en los casos de coinfección viral (26,4%). Su prevalencia superó la descrita en otros estudios28,29. Virus tales como el ADV, hBoV, EV, CoV OC43, CoV NL63, PIV1, 2 y 3 y VGA se detectaron con mayor frecuencia en casos de coinfección que en infecciones por agente único5,28. Nascimento et al. obtuvieron resultados similares en in 201023.
No obstante, existe una gran variabilidad en la prevalencia de coinfección viral, habiéndose descrito tasas tan bajas como el 11-17,5%6,30,31 y otras que ascienden hasta el 50-60%29,32,33. Un estudio nacional multicéntrico7 en el que la detección viral se realizó mediante técnicas de inmunofluorescencia y PCR encontró una prevalencia significativamente menor de coinfección en niños con bronquiolitis aguda (13,3%). Las diferencias en las tasas de coinfección viral observadas pueden deberse a las poblaciones estudiadas (lactantes o niños de mayor edad, o diferentes proporciones y tipos de enfermedades de base) o a los métodos empleados para la detección viral. En nuestro estudio, la coinfección viral se detectó más frecuentemente en niños de mayor edad, que asistían a la guardería o con factores de riesgo individual tales como sibilancias recurrentes, y en niños con diagnóstico de alta de neumonía. Otros autores han publicado resultados similares5,6.
Aunque los resultados publicados al respecto son discrepantes, en nuestro estudio no se observó asociación entre la coinfección viral y la gravedad5,6. Aunque en nuestro estudio no empleamos escalas de gravedad para su evaluación, otros autores que sí las han empleado tampoco han encontrado diferencias6.
En un metaanálisis reciente, Asner et al.25 no encontraron evidencia convincente de un mayor riesgo de desarrollar enfermedad grave en pacientes ingresados con coinfección viral en comparación con pacientes con infección por virus único. No obstante, cabe mencionar que, por lo general, la calidad de la evidencia de los estudios incluidos, evaluada mediante el sistema GRADE, era de baja a moderada. Los estudios de Suryadevara et al.1, Marguet et al., Nascimento et al.23 y de Paulis et al.11 corroboraron que no parece que la coinfección viral se asocie a la gravedad. Por otro lado, Martínez-Roig et al.32 han descrito una relación inversa entre el número de virus detectados en ANF, el requerimiento de oxígeno y la estancia hospitalaria. El estudio ya citado de Calvo et al.6 sugería que la coinfección viral se asociaba a un incremento en la estancia hospitalaria, al contrario de lo observado en nuestro estudio.
La prescripción de broncodilatadores de acción corta, antibióticos y corticoides sistémicos fue más frecuente en el grupo con coinfección viral. Hemos de interpretar estos resultados con cautela, ya que la diferencia se habría debido probablemente a la mayor edad y mayor intensidad de los síntomas al ingreso en este grupo más que a la presencia de coinfección viral. Algunas de estas manifestaciones clínicas, como la fiebre, también se observaron con mayor frecuencia en pacientes con infecciones virales múltiples en otros estudios6.
Aunque no se evaluó de manera sistemática, se detectó coinfección viral/bacteriana en el 27,9% de los casos y, como se ha descrito anteriormente, se asoció a una mayor frecuencia de obtención de muestras de sangre, radiografía torácica y uso de antibióticos5,27,34,35.
Entre las fortalezas de nuestro estudio señalamos la recogida prospectiva de datos, la cantidad considerable de muestras respiratorias analizadas, el uso de un ensayo molecular de amplio espectro para la detección de 16 virus respiratorios distintos y la alta tasa de positividad. Además, la muestra resultó ser homogénea en cuanto a la edad (81,7% menores de 12 meses y mediana de 4 meses). También se evaluó el impacto de las comorbilidades de base y los factores de riesgo. Destacamos, por último, la fortaleza derivada de su duración, pues se incluyeron casos en todas las estaciones del año. Algunos estudios previos realizaron análisis estacionales, lo que impidió la caracterización de algunos virus asociados a IVRI durante el resto del año7,36.
Nuestro estudio presenta tiene limitaciones dignas de mención. En primer lugar, su diseño se centró en la epidemiología de las IVRI virales en pacientes pediátricos hospitalizados. Por tanto, solo incluyó a pacientes ingresados en un hospital universitario, y es posible que sus resultados no se puedan generalizar a la asistencia médica comunitaria, además de no ser extrapolables a niños con enfermedad menos grave. En segundo lugar, la identificación viral por PCR en tiempo real de secreciones respiratorias no indica exclusivamente infección aguda. Es bien sabido que esta técnica es capaz de detectar virus en hasta un 5% de pacientes asintomáticos36,37. Además, hay que tener presente que la detección de más de un virus puede deberse a la presencia de fragmentos virales que persisten de 5a 6 semanas tras el inicio de los síntomas38. Por tanto, el término «codetección» sería, de hecho, más preciso que el término «coinfección», especialmente cuando se utilizan técnicas de diagnóstico molecular. No obstante, esta es una limitación de difícil solución, pues el aislamiento de la mayoría de estos virus en cultivo celular es complicado, por lo que la interpretación clínica de la detección viral en las secreciones respiratorias de un niño con IVRI supone un reto considerable21,36–38. Puede que este sea otro de los factores que contribuyen a que no se observen diferencias en cuanto a la evolución clínica entre las infecciones por virus único y las coinfecciones. Es posible que la PCR cuantitativa y su correlación con las manifestaciones clínicas lleguen a ser de utilidad para establecer el papel real de las infecciones múltiples. Por último, otra limitación importante es el que no se realizaran pruebas bacteriológicas sistemáticas en los especímenes respiratorios. La posible influencia de una infección bacteriana concomitante podría ser un factor relevante contribuyente a las discrepancias existentes en los resultados de los estudios que han analizado el papel de la coinfección viral en la gravedad clínica. En el futuro, estudios prospectivos longitudinales que incluyesen la obtención seriada de muestras para la detección viral y bacteriana podrían contribuir a clarificar la relevancia clínica de la IVRI polimicrobiana aguda.
En resumen, sobre la base de los datos obtenidos en este estudio prospectivo unicéntrico de varios años de duración, uno de cada 3 niños ingresados por IVRI está infectado por más de un virus. Los resultados indican que la coinfección viral está asociada a datos demográficos y ambientales y a las características clínicas al ingreso. Y lo que es más importante, estos resultados cuestionan planteamientos actuales, ya que observamos que este hecho no incidía en la evolución a corto plazo ni en la gravedad en pacientes con coinfección sobre la base de la identificación de un solo virus por métodos menos sensibles39,40.
Dada la carga de enfermedad de las IVRI en la infancia, consideramos necesarios más estudios prospectivos longitudinales con variables de respuesta a corto plazo bien definidas y búsqueda sistemática de virus y bacterias en muestras de secreciones respiratorias para definir mejor la importancia clínica de las infecciones respiratorias polimicrobianas en la edad pediátrica y ajustar los factores de riesgo de gravedad y el uso de recursos hospitalarios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentaciones previas: Congreso Extraordinario de la AEP y II Congreso Extraordinario Latinoamericano de Pediatría, Madrid, 5 a 7 de junio del 2014.