La diabetes tipo 1 (DT1) es una enfermedad autoinmune cuyo diagnóstico tardío puede conllevar complicaciones graves como la cetoacidosis diabética (CAD), especialmente en niños. La presencia de autoanticuerpos específicos permite identificar una fase presintomática, abriendo la puerta a estrategias de cribado dirigidas a poblaciones de riesgo genético elevado, como los familiares de primer grado (FPG). Este documento presenta las recomendaciones consensuadas de la Sociedad Española de Diabetes (SED), la Sociedad Española de Endocrinología y Nutrición (SEEN) y la Sociedad Española de Endocrinología Pediátrica (SEEP) sobre el cribado, la estadificación y el seguimiento de la DT1 en fases preclínicas. La identificación temprana de la enfermedad permitirá establecer un abordaje personalizado, promover la educación en salud y, eventualmente, considerar intervenciones terapéuticas que puedan retrasar la progresión hacia la fase sintomática. Este consenso busca establecer un marco común de actuación clínica basado en la evidencia disponible, con recomendaciones claras para su adecuada implementación.
Type 1 diabetes (T1D) is an autoimmune disease whose late diagnosis can lead to serious complications such as diabetic ketoacidosis, especially in children. The presence of specific autoantibodies allows for the identification of a presymptomatic phase, opening the door to screening strategies targeting populations at high genetic risk, such as first-degree relatives. This document presents the consensus recommendations of the Spanish Diabetes Society (SED), the Spanish Society of Endocrinology and Nutrition (SEEN) and the Spanish Society of Paediatric Endocrinology (SEEP) on the screening, staging and monitoring of T1D in preclinical stages. Early identification of the disease will enable a personalised approach to be established, promote health education and, eventually, consider therapeutic interventions that may delay progression to the symptomatic phase. This consensus seeks to establish a common framework for clinical action based on the available evidence, with clear recommendations for its proper implementation.
La diabetes tipo 1 (DT1) es una enfermedad autoinmune crónica que se caracteriza por la destrucción progresiva de las células beta del páncreas, lo que culmina en una deficiencia virtualmente absoluta de insulina1.
La detección precoz de este proceso autoinmune se ha convertido en una prioridad2,3, ya que no solo facilita la detección temprana de la DT1, también posibilita la implementación de estrategias preventivas orientadas a reducir complicaciones agudas en el momento del diagnóstico y a preservar la función residual de las células beta4,5.
Con el objetivo de facilitar y estandarizar el manejo de las fases presintomáticas de la enfermedad, el presente documento recoge el posicionamiento consensuado de la Sociedad Española de Diabetes (SED), la Sociedad Española de Endocrinología y Nutrición (SEEN), y la Sociedad Española de Endocrinología Pediátrica (SEEP) sobre el cribado, la estadificación y el seguimiento de la DT1 en estadios preclínicos. El documento completo puede consultarse en el Anexo. Material adicional.
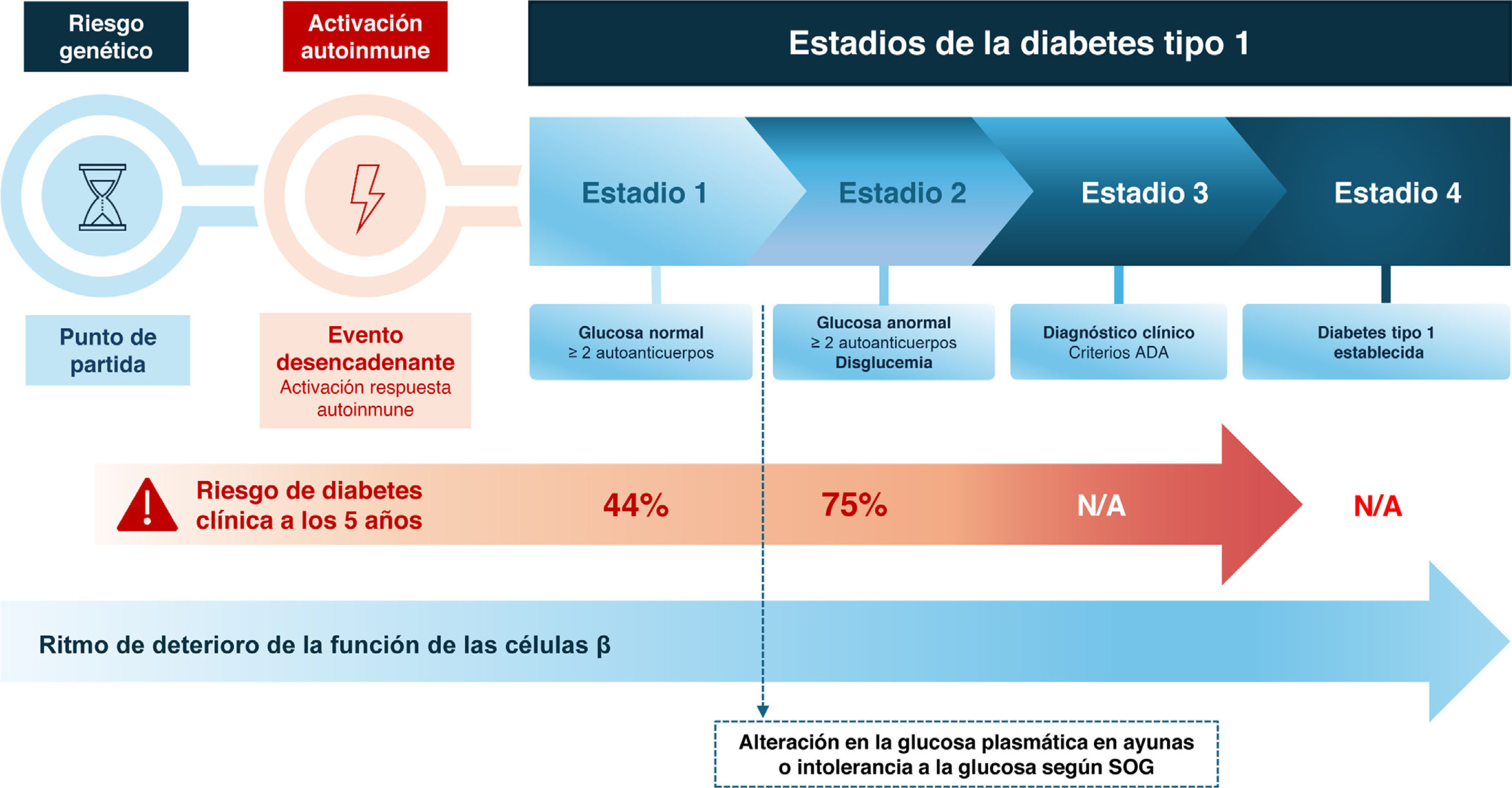
Estadios de la diabetes tipo 1 y riesgo de progresiónLa DT1 progresa a través de varias etapas, desde la activación autoinmune en personas genéticamente predispuestas hasta la aparición de síntomas clínicos evidentes6. La estadificación actual de la DT1 se muestra en la figura 1. Una vez que se detectan 2 o más autoanticuerpos frente a antígenos de célula beta (estadio 1), la probabilidad de progresión a diabetes clínica es elevada durante la vida de la persona, aunque en esta fase todavía no hay alteraciones en la glucemia y las personas están asintomáticas. El estadio 1 suele ir seguido del desarrollo de alteración de la glucosa en ayunas o de la tolerancia a la glucosa (disglucemia) que define el estadio 2, aunque es posible que esta etapa no se detecte cuando la progresión hacia el estadio 3 es rápida.
Los criterios de la Asociación Americana de Diabetes (ADA)7 para definir la normoglucemia, la disglucemia y la hiperglucemia se basan en las medidas de glucosa plasmática en ayunas (GPA), la glucosa plasmática a las 2h durante la sobrecarga oral de glucosa de 75g (SOG) y la HbA1c (tabla 1). Como alternativa para establecer el diagnóstico de estadio 2 (disglucemia), se pueden utilizar puntos temporales intermedios durante la SOG, en caso de valores de glucemia ≥200mg/dL (≥11,1mmol/L) a los 30, 60 o 90 minutos También se puede medir la glucosa plasmática aleatoria para diagnosticar la hiperglucemia cuando hay síntomas (tabla 1).
Criterios de la ADA para normoglucemia, disglucemia e hiperglucemia
| Normoglucemia (estadio 1) | Disglucemia(estadio 2) | Hiperglucemia(estadio 3) | |
|---|---|---|---|
| GPA | <100mg/dL (<5,6 mmol/L) | 100-125mg/dL (5,6-6,9mmol/L) | ≥126mg/dL (≥7,0mmol/L) |
| HbA1c | <5,7% (<39mmol/mol) | a) 5,7-6,4% (39-47mmol/mol)b) Incremento ≥10% desde la última visita | ≥6,5% (≥48mmol/mol) |
| SOG | 2h GP<140mg/dL (<7,8mmol/L) | a) GP 140-199mg/dL (7,8-11,0mmol/l) a los 120minb) GP ≥200mg/dL (≥11,1mmol/l) a los 30, 60 o 90min | 2h GP ≥200mg/dL (≥11,1mmol/L) |
| GP aleatoria | Síntomas+GP ≥200mg/dL (≥11,1mmol/L) |
GP: glucosa plasmática; GPA: glucosa plasmática en ayunas; SOG: sobrecarga oral de glucosa.
American Diabetes Association7.
El riesgo y la tasa de desarrollo de la DT1 en estadio 3 varía en función del tipo, número y título de los autoanticuerpos frente a células beta, y de la edad en el momento de la seroconversión, estimados principalmente a partir de estudios de cohortes de población pediátrica8–10.
Cribado de la diabetes tipo 1: aspectos a considerar y recomendacionesEstrategias de cribadoDesde un punto de vista metodológico, se podrían plantear dos modalidades principales de cribado que permitirían identificar a individuos en las fases presintomáticas de DT1. Por un lado, una estrategia basada exclusivamente en la detección de autoanticuerpos, y por otro lado, otra que combina la evaluación del riesgo genético, seguida del cribado con autoanticuerpos solamente de aquellas personas con alto riesgo genético11.
Cribado basado exclusivamente en determinación de autoanticuerposPara el cribado de autoanticuerpos, se emplean cuatro tipos de anticuerpos (anti-GAD o GADA, antiinsulina (IAA), anti-IA2 o IA-2A, y anti-ZnT8 o ZnT8A) según las recomendaciones de la ADA7. Existen diferentes técnicas de detección: radioinmunoensayo o RIA (considerado el gold estándar), el método luciferase immunoprecipitation system (LIPS), la detección por electroquimioluminiscencia (ECL), o por quimioluminiscencia, el método ELISA, el método Antibody-Detection-by-Agglutination-PCR (ADAP) etc. Es importante que los métodos cumplan los estándares de la Islet Autoantibody Standardization Program (IASP); no obstante, los métodos disponibles están validados y permiten un cribado relativamente sencillo desde el punto de vista técnico y logístico, aunque su sensibilidad y especificidad varía de unos métodos a otros12.
En la interpretación de un resultado positivo para anticuerpos y, consiguientemente, considerar autoinmunidad activada, según las recomendaciones de las guías internacionales, se debe seguir la regla del 2×2×2 (al menos dos autoanticuerpos positivos, si es posible determinados con dos técnicas diferentes, y en dos muestras de sangre diferentes)13.
Población diana del cribado de la DT1Las dos estrategias que se utilizan actualmente para el cribado de la DT1 se basan en: a) la detección de autoanticuerpos en personas con riesgo genético/antecedentes familiares, y b) la detección de autoanticuerpos en la población general. La primera estrategia se ha enfocado especialmente en familiares de primer grado (FPG) de pacientes con DT1, dado que tienen un riesgo genético considerablemente mayor que la población general. De hecho, la probabilidad de desarrollar DT1 en FPG es del orden de 10 veces más alta en comparación con aquellas personas sin ese antecedente y, aunque en menor magnitud, ello incluye a FPG adultos (padres y hermanos). Diversos estudios han demostrado que, incluso en adultos, la presencia de múltiples autoanticuerpos conlleva un riesgo elevado de desarrollar DT1 en los años siguientes13–15. Además, se estima que más de la mitad de los nuevos casos de DT1 se diagnostican en edad adulta. Estos datos refuerzan la necesidad de incluir a esta población en los programas de cribado16–19. No obstante, dado que alrededor del 90% de los nuevos casos de DT1 ocurren en personas sin antecedentes familiares20, existen múltiples estudios pilotos en países de nuestro entorno que están evaluando actualmente la viabilidad, aceptación y resultados en sus sistemas sanitarios del cribado en población general (particularmente en la edad pediátrica) para detectar a esos individuos de riesgo no aparente. La ADA recomienda el cribado en personas con antecedentes familiares de DT1 o con un riesgo genético elevado conocido, mientras que de momento no plantea el cribado masivo de la población general fuera de protocolos de investigación7. Posicionamiento: El cribado en FPG o personas con riesgo genético elevado conocido es una estrategia respaldada por la evidencia clínica y las recomendaciones de sociedades especializadas, como ISPAD y ADA. El desarrollo de programas piloto de cribado en la población general pediátrica permitirá determinar su rendimiento predictivo, limitaciones y relación coste-efectividad en la población española y en última instancia, la viabilidad para una implementación a gran escala en nuestro medio.
- •
Se recomienda realizar el cribado en niños con un FPG (padres, hermanos) afectado de DT1, ya que entre los menores de 20 años la prevalencia de DT1 en familiares (hermanos: 6-7%, madre: 1,3-4%, padre: 6-9%) es 15 veces mayor en comparación con la de la población general15,21.
- •
La toma de muestras en dos ocasiones durante la infancia parece la estrategia más rentable, con una primera determinación a los dos o tres años. Si esta es negativa, se aconseja repetirla entre los seis a ocho años, o a los cuatro años del primer cribado independientemente de la edad de partida.
- •
El momento óptimo para identificar la autoinmunidad en la adolescencia (10-18 años) es una única prueba a los 10 años o hacer dos pruebas a los 10 y 14 años. A partir de los 14 años, no se recomienda repetir el cribado.
- •
Entre los 18 y los 45 años, se aconseja una determinación de autoanticuerpos. Si el resultado es negativo, no se recomienda repetir.
- •
El resultado negativo indica un escaso riesgo inmediato de progresión a DT1, pero no descarta que pueda desarrollarse más adelante.
La información sobre el cribado debe seguir unos principios básicos22: el derecho a no saber, el respeto a la autonomía (las personas deben tomar sus propias decisiones) y la igualdad de acceso a la asistencia sanitaria.
Seguimiento y monitorización de las personas que presentan marcadores de autoinmunidad positivosUn resultado positivo en el cribado de autoanticuerpos debe ir acompañado de un seguimiento regular que vigile la progresión de la enfermedad y permita una intervención temprana2. Es fundamental disponer de métodos de monitorización que permitan determinar de forma precoz y precisa cuándo el paciente ha evolucionado hacia el estadio 3. Idealmente, dichos métodos de monitorización deberían ser poco invasivos, fáciles de usar y rápidos, ya que, según algunos estudios, la adherencia a algunos de los métodos actuales de seguimiento no es óptima23.
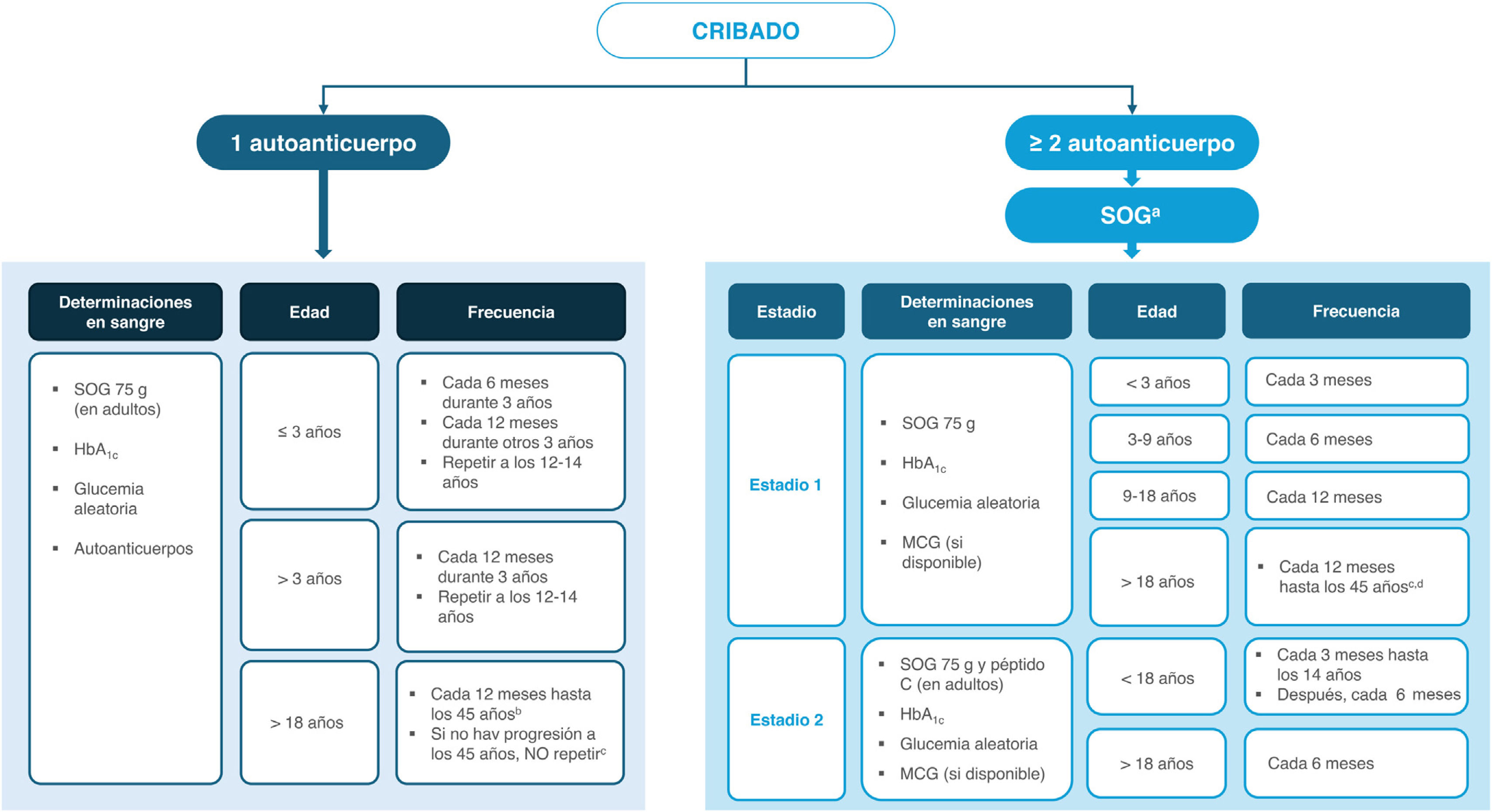
Recomendaciones para el seguimiento de personas con autoinmunidadLas estrategias de seguimiento y monitorización dependerán de la edad y el número de autoanticuerpos frente a células beta. Tales estrategias han sido descritas detalladamente en la guía consensuada en 2024 por las sociedades científicas más importantes2, la cual se considera adecuada en nuestro contexto (fig. 2). Se recomienda ofrecer pruebas de valoración de la glucemia y un seguimiento continuo a las personas que den positivo para uno o más autoanticuerpos frente a células beta2,3.
Recomendaciones de seguimiento y monitorización de personas con riesgo genético elevado (FPG) con autoinmunidad positiva contra célula beta.
a HbA1c, la glucosa capilar/venosa y la MCG (monitorización continua de glucosa) pueden ser alternativas (fundamentalmente en los niños) cuando la sobrecarga oral de glucosa (SOG) no es factible. La sobrecarga de glucosa en niños se realiza con 1,75g de glucosa por kg de peso corporal, hasta un máximo de 75g.
b Si no es FPG/no hay factores de riesgo adicionales, cada tres años.
c A partir de los 45 años, el seguimiento metabólico puede continuarse de acuerdo con la detección de DT2 establecida en atención primaria.
d Si no es FPG/no hay factores de riesgo adicionales y no hay progresión a los cinco años, cada dos años.
Las mujeres embarazadas con autoanticuerpos positivos deben realizarse una SOG y HbA1c (y si disponible, valorar monitorización continua de glucosa [MCG]) en el momento de la confirmación de la gestación y en la semana 24-28, acorde con los protocolos estandarizados de cribado de la diabetes gestacional. Aquellas diagnosticadas de DT1 deben ser evaluadas en el posparto inmediato y previamente al alta hospitalaria por un endocrinólogo para determinar la continuidad de la terapia insulínica. Haya o no diagnóstico clínico de DT1, las mujeres gestantes con anticuerpos deben ser monitorizadas en el posparto por un periodo de seis a 12 meses para valorar la necesidad de insulina2. Posteriormente, si no hay progresión al estadio 3, el seguimiento será el de sujetos adultos con anticuerpos positivos.
Recomendaciones para la educación de los pacientes/familiaresTras la confirmación de la DT1 en estadio 1 o 2, los pacientes/cuidadores necesitarán educación sobre la progresión de la enfermedad y recibir el soporte adecuado. Se recomienda la derivación a un centro/facultativo especializado (Unidades de Endocrinología Pediátrica o Servicios de Endocrinología y Nutrición). Los profesionales sanitarios deben explicar las probabilidades de progresión a estadio 3 en función del número y tipo de autoanticuerpos presentes, y del estado glucémico para dar soporte a los pacientes/cuidadores a comprender y aceptar el riesgo de progresión a la DT1 clínica. Se proporcionarán instrucciones escritas que incluyan información de contacto y dispositivos de atención urgente disponibles en su medio en caso de síntomas de DT1 y/o hiperglucemia.
Cuando los pacientes (eventualmente) progresen al estadio 3 de la DT1, se deben transmitir los pilares básicos para un buen manejo de la enfermedad: alimentación sana, vida activa, tratamiento con insulina y monitorización periódica de la glucosa24.
Evaluación del impacto de un programa de cribado y seguimiento de la diabetes tipo 1Una de las maneras más habituales de analizar el seguimiento y evaluar el impacto de los programas de cribado y monitorización consiste en valorar si el diagnóstico precoz reduce la frecuencia de cetoacidosis diabética (CAD) al diagnóstico. Varios estudios, fundamentalmente centrados en población pediátrica, han demostrado que la participación en un programa de seguimiento preclínico reduce la frecuencia de CAD al diagnóstico25, e implica periodos más breves de hospitalización, probablemente como consecuencia de un diagnóstico más precoz de la enfermedad y menos deterioro general en el momento del diagnóstico26. Se ha demostrado que la CAD no solo es un riesgo grave por sí misma, sino que es un factor de riesgo potencial para el desarrollo de complicaciones diabéticas, ya que está relacionada con dificultades para alcanzar los objetivos de control glucémico a largo plazo27.
En cuanto a los costes de tales programas, en España todavía no hay datos al respecto, por lo que son necesarios análisis de coste-efectividad tanto en los estudios piloto ya en marcha con familiares13 como en la población general.
Propuesta de indicadores del impactoComo indicadores específicos del impacto de la puesta en marcha del programa de cribado en familiares y monitorización sistemática, se plantean los siguientes (su análisis se llevaría a cabo de forma desagregada para población pediátrica y adulta):
- -
Proporción de personas en riesgo (un único autoanticuerpo positivo) sobre el total de FPG sometidos a cribado.
- -
Proporción de personas diagnosticadas como DT1 estadio 1 sobre el total de FPG sometidos a cribado.
- -
Proporción de personas diagnosticadas como DT1 estadio 2 sobre el total de FPG sometidos a cribado.
- -
Proporción de personas diagnosticadas como DT1 clínica (estadio 3) sobre el total de FPG sometidos a cribado.
- -
Proporción de personas diagnosticadas como DT1 clínica (estadio 3) en forma de CAD sobre el total de personas diagnosticadas como DT1 estadios 1 y 2 a través del programa de cribado en FPG.
- -
Tasa de incidencia anual de CAD en el área de puesta en marcha del programa de cribado (en comparación con una población no sometida a cribado).
Tasa de incidencia anual de CAD grave en el área de puesta en marcha del programa de cribado (en comparación con una población no sometida a cribado).
Controversias de un programa de cribado y seguimiento de la diabetes tipo 1 en estadios tempranosEl cribado de la DT1 puede generar controversias, ya que el resultado positivo no permite predecir cuándo aparecerá la enfermedad con exactitud: en niños, donde hay más evidencia clínica, se sabe que el 53% de los que tienen dos anticuerpos (estadio 1 o 2) a los cinco años están en insulinodependencia (estadio 3), subiendo al 82% a los 10 años13. En adultos la progresión entre estadios es más lenta e incierta, lo que dificulta definir los programas de intervención educativa y terapéutica. Por otra parte, ensayos clínicos recientes en pacientes con DT1 en estadios presintomáticos han demostrado beneficios prometedores28, si bien no consiguen prevenir de forma definitiva la progresión entre estadios y los hallazgos publicados hasta el momento no son aún aplicables a todos los estadios y poblaciones en los que se está estudiando el cribado. Como la mayoría de los casos de DT1 surgen sin antecedentes familiares, una reducción significativa de la CAD requeriría un cribado poblacional, lo que implica evaluar previamente su viabilidad y beneficio-riesgo mediante estudios piloto. Por último, es esencial formar a los profesionales sanitarios y agentes implicados para garantizar un adecuado seguimiento y educación del paciente.
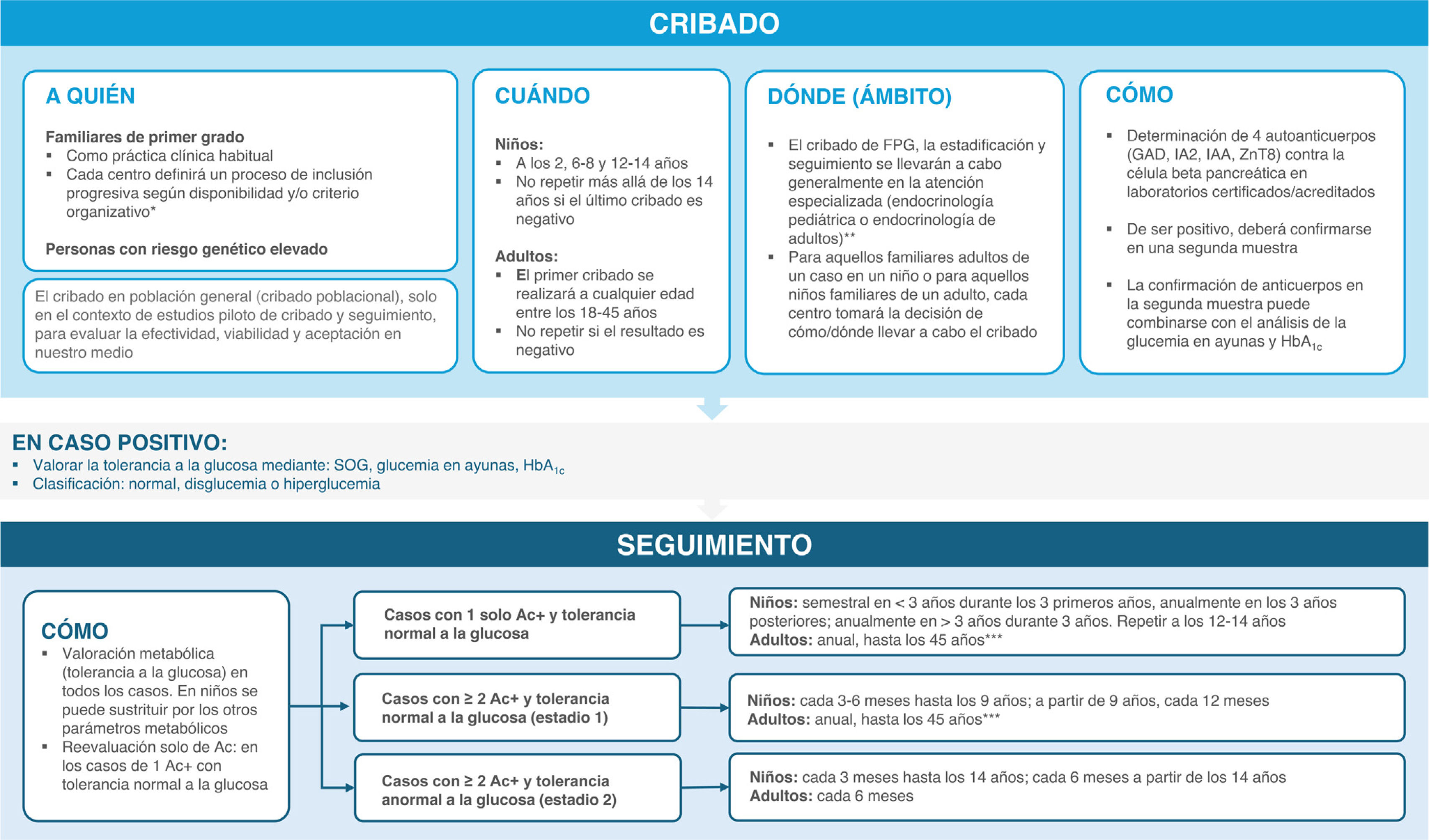
Resumen de recomendaciones y conclusionesLas recomendaciones para el cribado y el seguimiento de los estadios tempranos de la DT1 se resumen en la figura 3.
Recomendaciones para el cribado y el seguimiento de los estadios presintomáticos de la DT1.
* Se recomienda que la estrategia de cribado y seguimiento DT1 en fases presintomáticas garantice unos estándares mínimos homogéneos en todo el territorio español adaptando su implementación a las características y necesidades específicas de cada región y servicio sanitario para asegurar la equidad.
** En los programas piloto de población general, el cribado se puede hacer en los equipos de pediatría de familia; sin embargo, el seguimiento y estadificación se realizará en los equipos especializados.
*** Si no es FPG/no hay factores de riesgo adicionales y no hay progresión a los cinco años, cada dos años. A partir de los 45 años, el seguimiento metabólico puede continuarse de acuerdo con la detección de DT2 establecida en atención primaria.
El protocolo aquí presentado deberá adaptarse a los recursos disponibles y a las particularidades de cada centro o región, manteniéndose actualizado conforme surjan nuevos hallazgos científicos y recomendaciones internacionales.
FinanciaciónLa Sociedad Española de Endocrinología y Nutrición, la Sociedad Española de Diabetes y la Sociedad Española de Endocrinología Pediátrica han financiado los servicios de redacción médica proporcionados por Springer. Los autores no han recibido compensación económica directa ni indirecta por la elaboración de este trabajo, que ha contado con el apoyo de las mencionadas sociedades científicas.
Conflicto de interesesMaría Asunción Martínez-Brocca es investigadora principal en estudios promovidos por Diamyd Medical AB y Sanofi, y ha participado en actividades remuneradas por Novo Nordisk y Sanofi.
Virginia Bellido ha recibido honorarios profesionales (consultoría, investigación o conferencias) de Abbott, AstraZeneca, Boehringer Ingelheim, Eli Lilly, Esteve, MSD, Novo Nordisk, y Sanofi.
Roque Cardona-Hernandez es investigador principal en estudios promovidos por Diamyd Medical AB, Novartis, y Sanofi, y ha recibido honorarios por ponencias o asesoramiento científico de Abbott, Dexcom, Medtronic, Novo-Nordisk, y Sanofi.
Luis Castaño ha colaborado participando en actividades científicas financiadas por NovoNordisk, Astra Zeneca y Sanofi.
Ignacio Conget ha colaborado con Abbot, Medtronic, Dexcom, Lilly, Sanofi, NovoNordisk, Bayer, Ascensia.
Alberto Fernández he participado en sesiones formativas y foros de discusión organizados por Novo-Nordisk, Lilly, Astra-Zeneca, Abbott y Boehringer.
Ana Lucía Gómez Gila ha recibido honorarios profesionales de Novo Nordisk Pharma, Sandoz Farmacéutica y Sanofi Aventis.
Isabel Leiva-Gea es investigadora principal en estudios promovidos por Diamyd Medical AB y ha participado en actividades remuneradas por Abbott, Dexcom, Medtronic, Novo-Nordisk, Eli Lilly, Sanofi y Biomarine.
Dídac Mauricio ha recibido honorarios por consultoría y por impartir conferencias de AB-Biotics, Abbott, Almirall, Amarna, Amgen, AstraZeneca, Ferrer, Gilead, Lilly, Medtronic, Menarini, MSD, NovoNordisk y Sanofi.
AgradecimientosLos autores agradecen a Anabel Herrero en nombre de Springer Healthcare la asistencia en la elaboración del manuscrito, así como el apoyo de las sociedades científicas a las que los autores representan.
Este artículo ha sido elaborado conjuntamente por Endocrinología, Diabetes y Nutrición, Endocrinología, Diabetes y Nutrición (English Edition), Anales de Pediatría, Anales de Pediatría (English Edition) y publicado conjuntamente por Elsevier España S.L.U. Los artículos son idénticos salvo pequeñas diferencias estilísticas y ortográficas acordes con el estilo de cada revista. Cualquiera de las dos citas puede ser utilizada al citar este artículo.